| страница | 12/26 |
| Дата | 18.05.2018 |
| Размер | 0,98 Mb. |
| Тип | Протокол |
- Навигация по данной странице:
- Макроскопический анализ материалов позволяет определить
- 6. Прочность – это способность материала
| От чего зависят свойства металлов, с точки зрения их внутреннего строения? а) от химического состава б) от типа кристаллической решетки. в) от количества компонентов.
б) механические свойства б) Восстанавливать первоначальную форму после снятия нагрузки в) Сопротивляться проникновению более твердого материала Точки зрения внутреннего строения, все металлы и сплавы представляют собой 1. тела кристаллические 2. тела аморфные 3. твердые растворы Металлическим сплавом называют 1. химическое соединение компонентов сплава 2. механическую смесь компонентов сплава 3. сложное вещество, полученное сплавлением или спеканием нескольких металлов или металлов с неметаллами 3. Железо с углеродом образуют сплавы с тремя типами структурных компонентов: жидкие и твердые растворы, химические соединения и … 1. механические смеси Аллотропией или полиморфизмом называют 1. способность металла в твердом состоянии иметь различные кристаллические формы (например, ?-Fe, ?-Fe, …) 2. процесс перехода из одной кристаллической формы в другую 3. изменение свойств металла при введении легирующих элементов 5. Выявление структуры металла или сплава по отполированному микрошлифу производится методом [ К физическим свойствам металлов относится 1. обрабатываемость резанием 2. плотность – масса, заключенная в единице объема 3. прочность – способность материала сопротивляться разрушению под действием нагрузок Механические свойства металлов включают 1. пластичность – способность материала принимать новую форму и размеры под действием внешних сил, не разрушаясь 2. тепловое расширение — способность металлов увеличиваться в размерах при нагревании и уменьшаться при охлаждении 3. ковкость – способность металла обрабатываться давлением в холодном или горячем состоянии без признаков разрушения В группу технологических свойств материалов входит 1. температура плавления, при которой материал переходит из жидкого в твердое состояние 2. твердость – способность материала сопротивляться проникновению в него другого более твердого тела 3. свариваемость и литейные свойства При холодной пластической деформации происходит упрочнение металла (наклеп) и понижение пластичности вследствие 1. изменения микроструктуры металла 2. искажения кристаллической решетки металла 3. уплотнения металла Причиной возникновения внутренних напряжений в отливке является 1. усадка и фазовые превращения при охлаждении металла 2. недостаточная податливость материала формы 3. наличие примесей кремния, марганца, фосфора и серы 11. Диаграммы состояния сплавов представляют собой [ 1. графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов 2. кривые охлаждения сплавов 2-х компонентной системы 3. теоретические диаграммы для определения линий «ликвидус» и «солидус» Основными компонентами, от которых зависят структура и свойства железоуглеродистых сплавов, являются 1. цементит Ц + перлит П 2. феррит Ф + графит Г 3. железо Fe + углерод С 13. Пересыщенный твердый раствор углерода в ?-Fe представляет собой структурную составляющую железоуглеродистого сплава, называемую 14. Механическая смесь кристаллитов феррита и цементита – это одна из структурных составляющих железоуглеродистого сплава, называемая 15. Железоуглеродистый сплав, содержащий более 2,3 % углерода, называют Урок 8. Общие свойства металловИзвестно, что все простые вещества условно можно разделить на простые вещества-металлы и простые вещества-неметаллы. МЕТАЛЛЫ, по определению М. В. Ломоносова — это «светлые тела, которые ковать можно». Обычно это ковкие блестящие материалы, обладающие высокой тепло- и электропроводностью. Эти физические и многие химические свойства металлов связаны со способностью их атомов ОТДАВАТЬ электроны. НЕМЕТАЛЛЫ, напротив, способны ПРИСОЕДИНЯТЬ электроны в химических процессах. Большинство неметаллов проявляют противоположные металлам свойства: не блестят, не проводят электрический ток, не куются. Являясь противоположными по свойствам, металлы и неметаллы легко реагируют друг с другом. Эта часть Самоучителя посвящена краткому освещению свойств металлов и неметаллов. Описывая свойства элементов, желательно придерживаться следующей логической схемы: 1. Вначале описать строение атома (указать распределение валентных электронов), сделать вывод о принадлежности данного элемента к металлам или неметаллам, определить его валентные состояния (степени окисления) — см. урок 3; 2. Затем описать свойства простого вещества, составив уравнения реакций
3. Затем нужно описать свойства важнейших соединений (водородных соединений, оксидов, гидроксидов, солей). При этом вначале следует определить характер (кислотный или основной) данного соединения, а затем, вспомнив свойства соединений этого класса, составить необходимые уравнения реакций; 4. И наконец нужно описать качественные реакции на катионы (анионы), содержащие этот элемент, способы получения простого вещества и важнейших соединений этого химического элемента, указать практическое применение изучаемых веществ этого элемента. Так, если вы определите, что оксид кислотный, то он будет реагировать с водой, основными оксидами, основаниями (см. урок 2.1) и ему будет соответствовать кислотный гидроксид (кислота). При описании свойств этой кислоты также полезно заглядывать в соответствующий раздел: урок 2.2. Внутреннее строение и физические свойства металловМеталлы — это простые вещества, атомы которых могут только отдавать электроны. Такая особенность металлов связана с тем, что на внешнем уровне этих атомов мало электронов (чаще всего от 1 до 3) или внешние электроны расположены далеко от ядра. Чем меньше электронов на внешнем уровне атома и чем дальше они расположены от ядра, — тем активнее металл (ярче выражены его металлические свойства). Задание 8.1. Какой металл активнее: Назовите химические элементы А, Б, В, Г. Металлы и неметаллы в Периодической системе химических элементов Менделеева (ПСМ) разделяет линия, проведённая от бора к астату. Выше этой линии в главных подгруппах находятся неметаллы (см. урок 3). Остальные химические элементы — металлы. Задание 8.2. Какие из следующих элементов относятся к металлам: кремний, свинец, сурьма, мышьяк, селен, хром, полоний? Вопрос. Как можно объяснить тот факт, что кремний — неметалл, а свинец — металл, хотя число внешних электронов у них одинаково? Существенной особенностью атомов металлов является их большой радиус и наличие слабо связанных с ядром валентных электронов. Для таких атомов величина энергии ионизации* невелика.
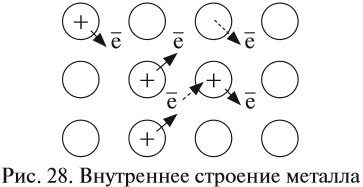
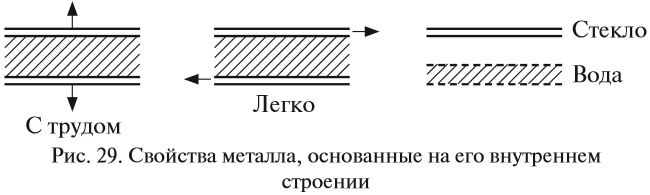
Часть валентных электронов металлов, отрываясь от атомов, становятся «свободными». «Свободные» электроны легко перемещаются между атомами и ионами металлов в кристалле, образуя «электронный газ» (рис. 28). В последующий момент времени любой из «свободных» электронов может притянуться любым катионом, а любой атом металла может отдать электрон и превратиться в ион (эти процессы показаны на рис. 28 пунктирами). Таким образом, внутреннее строение металла похоже на слоёный пирог, где положительно заряженные «слои» атомов и ионов металла чередуются с электронными «прослойками» и притягиваются к ним. Наилучшей моделью внутреннего строения металла является стопка стеклянных пластинок, смоченных водой: оторвать одну пластинку от другой очень трудно (металлы прочные), а сдвинуть одну пластинку относительно другой очень легко (металлы пластичные) (рис. 29). Задание 8.3. Сделайте такую «модель» металла и убедитесь в этих свойствах. Химическая связь, осуществляемая за счёт «свободных» электронов, называется металлической связью. «Свободные» электроны обеспечивают также такие физические свойства металлов, как электро- и теплопроводность, пластичность (ковкость), а также металлический блеск. Задание 8.4. Найдите дома металлические предметы. Выполняя это задание, вы легко найдёте на кухне металлическую посуду: кастрюли, сковородки, вилки, ложки. Из металлов и их сплавов делают станки, самолёты, автомобили, тепловозы, инструменты. Без металлов невозможна современная цивилизация, так как электрические провода также делают из металлов — Cu и Al. Только металлы годятся для получения антенн для радио- и телеприёмников, из металлов делают и лучшие зеркала. При этом чаще используют не чистые металлы, а их смеси (твёрдые растворы) — СПЛАВЫ. Металлы легко образуют сплавы — материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов (простых веществ), из которых хотя бы один является металлом. Многие металлические сплавы имеют один металл в качестве основы с малыми добавками других компонентов. В принципе, чёткую границу между металлами и сплавами трудно провести, так как даже в самых чистых металлах имеются «следовые» примеси других химических элементов. Все перечисленные выше предметы — станки, самолёты, автомобили, сковородки, вилки, ложки, ювелирные изделия — делают из сплавов. Металлы-примеси (легирующие компоненты) очень часто изменяют свойства основного металла в лучшую, с точки зрения человека, сторону. Например, и железо и алюминий — довольно мягкие металлы. Но, соединяясь друг с другом или с другими компонентами, они превращаются в сталь, дуралюмин и другие прочные конструкционные материалы. Рассмотрим свойства самых распространённых сплавов. Сталь — это сплавы железа с углеродом, содержащие последнего до 2 %. В состав легированных сталей входят и другие химические элементы — хром, ванадий, никель. Сталей производится гораздо больше, чем каких-либо других металлов и сплавов, и все виды их возможных применений трудно перечислить. Малоуглеродистая сталь (менее 0,25 % углерода) в больших количествах потребляется в качестве конструкционного материала, а сталь с более высоким содержанием углерода (более 0,55 %) идет на изготовление режущих инструментов: бритвенные лезвия, сверла и др. Железо составляет основу чугуна. Чугуном называется сплав железа с 2–4 % углерода. Важным компонентом чугуна является также кремний. Из чугуна можно отливать самые разнообразные и очень полезные изделия, например крышки для люков, трубопроводную арматуру, блоки цилиндров двигателей и др. Бронза — сплав меди, обычно с оловом как основным легирующим компонентом, а также с алюминием, кремнием, бериллием, свинцом и другими элементами, за исключением цинка. Оловянные бронзы знали и широко использовали ещё в древности. Большинство античных изделий из бронзы содержат 75–90 % меди и 25–10 % олова, что делает их внешне похожими на золотые, однако они более тугоплавкие. Это очень прочный сплав. Из него делали оружие до тех пор, пока не научились получать железные сплавы. С применением бронзы связана целая эпоха в истории человечества: Бронзовый век. Латунь — это сплавы меди с Zn, Al, Mg. Это цветные сплавы с невысокой температурой плавления, их легко обрабатывать: резать, сваривать и паять. Мельхиор — является сплавом меди с никелем, иногда с добавками железа и марганца. По внешним характеристикам мельхиор похож на серебро, но обладает большей механической прочностью. Сплав широко применяют для изготовления посуды и недорогих ювелирных изделий. Большинство современных монет серебристого цвета изготавливают из мельхиора (обычно 75 % меди и 25 % никеля с незначительными добавками марганца). Дюралюминий, или дюраль — это сплав на основе алюминия с добавлением легирующих элементов — медь, марганец, магний и железо. Он характеризуется своей стальной прочностью и устойчивостью к возможным перегрузкам. Это основной конструкционный материал в авиации и космонавтике. Химические свойства металловМеталлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления. Рассмотрим пример. Пусть алюминий реагирует с серой: Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов? Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона: Поскольку атом алюминия отдает электроны, атом серы принимает их. Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему? У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона: Таким образом, полученное соединение имеет состав: В результате получаем уравнение реакции: Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций: Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми. Названия полученных в таких реакциях соединений всегда содержат суффикс ИД: Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4). Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов: Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот: Задание 8.6. Составьте уравнения возможных реакций:
Все эти металлы в полученных соединениях двухвалентны. Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата: Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется: Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций. Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме: где х — валентность металла. Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом? Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl – . А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты! Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот? Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме: Металлы, менее активные, чем железо, с водой не реагируют! Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли: Задание 8.9. Какие из следующих реакций возможны и почему:
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны. Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью: А затем полученная щёлочь реагирует с солью: Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла: Коррозия металловКоррозия — самопроизвольный процесс окисления металла под действием факторов окружающей среды. В природе практически не встречается металлов в свободном виде. Исключение составляют только «благородные», самые неактивные металлы, например золото, платина. Все остальные активно окисляются под действием кислорода, воды, кислот и др. Например, ржавчина образуется на любом незащищённом железном изделии именно в присутствии кислорода или воды. При этом окисляется железо: а восстанавливаются компоненты атмосферной влаги: В результате образуется гидроксид железа (II), который, окисляясь, превращается в ржавчину: Подвергаться коррозии могут и другие металлы, правда, ржавчина на их поверхности не образуется. Так, нет на Земле металла алюминия — самого распространённого металла на планете. Но зато основу многих горных пород и почвы составляет глинозём Al2O3. Дело в том, что алюминий мгновенно окисляется на воздухе. Коррозия металлов наносит колоссальный ущерб, разрушая различные металлические конструкции. Чтобы уменьшить потери от коррозии, следует устранить причины, которые её вызывают. В первую очередь, металлические предметы следует изолировать от влаги. Это можно сделать разными способами, например, хранить изделие в сухом месте, что далеко не всегда возможно. Кроме того, можно поверхность предмета покрасить, смазать водоотталкивающим составом, создать искусственную оксидную плёнку. В последнем случае в состав сплава вводят хром, который «любезно» распространяет собственную оксидную плёнку на поверхность всего металла. Сталь становится нержавеющей. Изделия из нержавеющей стали дороги. Поэтому для защиты от коррозии используют тот факт, что менее активный металл не изменяется, т. е. не участвует в процессе. Поэтому если к сохраняемому изделию приварить более активный металл, то, пока он не разрушится, изделие корродировать не будет. Этот способ защиты называется протекторной защитой. Металлы — это простые вещества, которые всегда являются восстановителями. Восстановительная активность металла убывает в ряду напряжений от лития к золоту. По положению металла в ряду напряжений можно определить, как металл реагирует с растворами кислот, с водой, с растворами солей. Металл, все о металле, свойства металлов
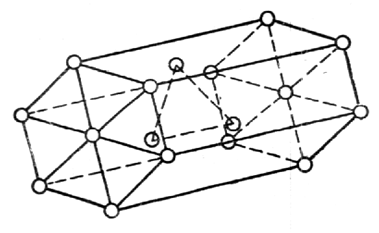
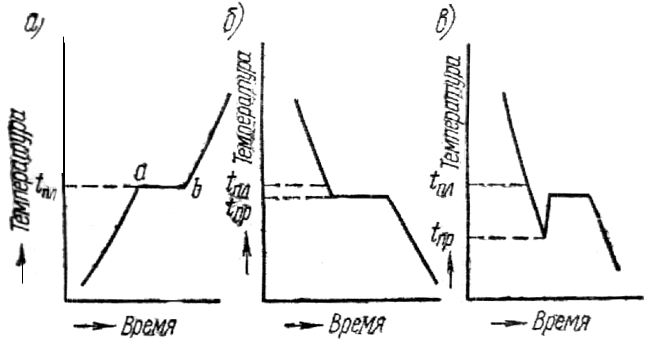
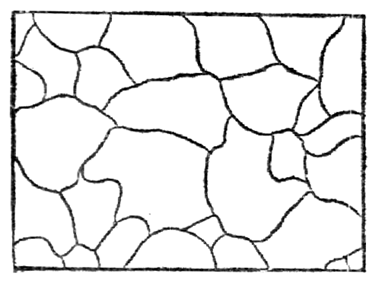
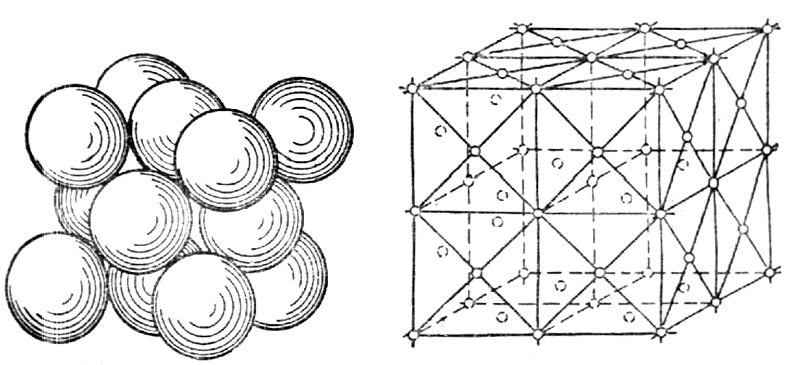
Многие физические свойства металлов зависят от их внутреннего строения. Атомы имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся электроны. Атомы очень малы – их размеры порядка 10 –10 –10 –9 м, а размеры ядра еще примерно в 100 000 раз меньше (10 –15 –10 –14 м). Валентные электроны (на внешних орбитах) слабо связаны с ядром. Основная практическая задача металловедения – изыскание оптимального состава и обработки металлов и сплавов для получения заданных свойств. Свойства материалов, металлов свойства, которые предопределяют сферы их применения. Физические свойства металлов – это плотность, электро- и теплопроводность, температуры плавления, кипения, испарения, магнитность, температурные коэффициенты линейного и объемного расширения и др. Физические свойства металлов обусловлены составом и структурой материалов. К химическим свойствам относят способность металлов к химическому взаимодействию с агрессивными средами. Технологические свойства характеризуют способность материалов подвергаться различным видам горячей и холодной обработки и важны для выбора способов формообразования и получения заготовок деталей машин. Свариваемость – способность материалов образовывать качественные неразъемные сварные соединения без дефектов и с высокой прочностью. Деформируемость – способность материала принимать требуемую форму без разрушения в результате пластической деформации. Прокаливаемость – способность металла воспринимать закалку на некоторую глубину от поверхности. Эксплуатационные свойства – это свойства материала непосредственно влияющие на показатели, характеризующие служебное назначение машины. Коррозионная стойкость – сопротивляемость материала воздействию агрессивных сред (кислотных, щелочных, солевых и др.) Жаропрочность – способность материала сохранять требуемые механические свойства при высоких рабочих температурах. Жаростойкость – способность материала сопротивляться окислению в газовой среде при высоких температурах. Хладостойкость – способность материала сохранять требуемую пластичность и ударную вязкость при низких рабочих температурах. Антифрикционность – способность материала прирабатываться по трущимся поверхностям к другому материалу. Механические свойства характеризуют способности материалов противостоять механическим нагрузкам и играют определяющую роль при выборе материалов для изготовления деталей машин в машиностроении. К ним относят прочность, упругость, пластичность, ударную вязкость, твердость и выносливость. По этим свойствам можно провести сравнительную оценку различных материалов, а также контроль их качества на производстве при изготовлении изделий. Механические свойства определяются в процессе механических испытаний. Так, например, сварные соединения испытывают на растяжения, ударную вязкость, изгиб или сплющивание. По характеру изменения во времени нагрузки могут быть статическими, динамическими и повторно-переменными. Статическая нагрузка – это однократно приложенная нагрузка, плавно и относительно медленно возрастающая от нуля до своей максимальной величины. Статические нагрузки подразделяют на постоянные и временные, последние могут быть подвижными и неподвижными (например, масса стеллажей и бункеров в складских помещениях). Динамическая (ударная) нагрузка — это однократно приложенная нагрузка, действующая на материал резко и с большой скоростью возрастающая от нуля до своей максимальной величины. Повторно-переменная нагрузка — это нагрузка, многократно прикладываемая к материалу, причем скорости возрастания и убывания нагрузки могут быть различные. По направлению действия различаются растягивающие, сжимающие, изгибающие, скручивающие и срезывающие нагрузки (рисунок 32). Растягивающими являются равные по величине нагрузки, приложенные к центрам тяжести концевых сечений прямолинейного бруса и направленные в противоположные друг от друга стороны вдоль главной оси бруса (а). При прямо противоположном направлении сил Р нагрузки являются сжимающими (б). Изгибающие нагрузки действуют перпендикулярно оси в плоскости симметрии прямолинейного бруса (в). Срезывающие — это нагрузки, вызывающие скольжение (сдвиг) одних частей материала относительно других в плоскости сечения (г). Скручивающие нагрузки — пара сил, т.е. две равные по абсолютному значению и противоположные по направлению параллельные силы, действующие в плоскостях поперечных сечений стержня (д). Рисунок 32 – Механические испытания образцов При эксплуатации материалов возможна реализация нескольких схем одновременно. При приложении нагрузки в твердом теле возникают напряжения и деформации. Напряжение – это величина нагрузки Р [Н], отнесенная к единице площади сечения F [мм 2 ] испытываемого образца: , МПа (7) Напряжения могут быть нормальными и касательными. Действительными (рабочими) напряжениями считаются те, которые фактически будут существовать. Предельно-опасные напряжения возникают тогда, когда внутренние силы (силы молекулярного противодействия) достигли такого значения, при котором нарушается работоспособность детали в силу появления необратимых пластических деформаций (для пластичных металлов) либо разрушения (для хрупких металлов). Допускаемые напряжения — это напряжения, обеспечивающие нормальную и безопасную работу изделий и конструкций, они в несколько раз меньше предельно опасных напряжений и характеризуются нормативным коэффициентом запаса прочности. Таким образом, прочность любой детали обеспечена, если действительные напряжения меньше или равны допускаемым напряжениям. Внутренние напряжения подразделяют на напряжения I рода, уравновешивающиеся в объеме всего тела (макронапряжения); II рода, уравновешивающиеся в объеме одного зерна (кристаллита) или нескольких блоков (микронапряжения); III рода, уравновешивающиеся в объемах порядка размеров кристаллической ячейки (субмикроскопические). Приложенные к телу внешние силы вызывают деформацию. Деформация – изменение формы и размеров материалов под действием нагрузки. В твердых телах различают два основных вида деформаций – упругую и пластическую, физическая сущность которых различна. Дата добавления: 2014-01-13 ; Просмотров: 201 ; Нарушение авторских прав? ; Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет Внутреннее строение металлов и сплавов Кристаллическое строение металловУ веществ в твердом состоянии строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно. У всех металлов и их сплавов строение кристаллическое. На рис.12показана структура чистого железа. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы — многогранники, поэтому их называюткристаллитами, зернамиили гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов. Рис.12.Микроструктура чистого железа (х — 150) Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемыекристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (— и— железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (— железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк,— титан,— кобальт). Элементарная ячейкаповторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла. Элементарная ячейка центрированного куба (рис.13) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре. Рис.13. Элементарная ячейкаРис.14. Часть пространственной решет- центрированного куба ки центрированного куба Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств. Рис.15. Элементарная ячейка кубаРис.16. Часть пространственной ре- с центрированными гранями шетки куба с центрированными На рис.14приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.15) состоит из 14 атомов, из них 8 атомов расположены по вершинам — куба и 6 атомов — по граням. На рис.16приведена часть пространственной решетки куба с центрированными гранями ( гранецентрированного куба). На схеме имеется восемь элементарных ячеек; узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка (рис.17) состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре оснований и 3 атома — внутри призмы. Для измерения расстояния между атомами кристаллических решеток пользуются специальной единицей, называемойангстремом Рис.17. Гексагональная ячейка Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д. Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называютсясвободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами. Таким образом, в узлах решеток, обозначенных кружками рис.14и16, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается. Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов. Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 — 50 %, а предел прочности—от 14 до 35 кГ/мм 2 для различных образцов. Это свойство кристаллов называютанизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве. Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называютсяплоскостями спайности. Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность. Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью(кажущейся изотропностью). Аллотропия металлов(или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см.рис.14), а выше — решетку гранецентрированного куба (см.рис.16). Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами , , и т. д., причем буквойобозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии. Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале. Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец). Температура, соответствующая какому-либо превращению в металле, называется критической точкой. На рис.18, априведена кривая нагрева металла. Здесь точка а— начало плавления, точкаb — окончание плавления. Рис.18. Кривые нагревания (а) и охлаждения (б— без петли, в — с петлей) металла Участок аbуказывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления). Переход из жидкого состояния в твердое при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладитьнесколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.19,6) находится несколько нижеtпл при температуре переохлажденияtпр. У некоторых металлов переохлаждение (tпл— tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлажденияtпр(рис. 18, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти доtпл. В этом случае на графике вычерчивается петля теплового гистерезиса. При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку. Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов. У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен). Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа. Рис.19. Кривые охлаждения и нагревания железа На рис.19приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 1539 0 С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе. Критические точки обозначаются буквой А, при нагревании обозначаютАcи при охлажденииAr индексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состоянияFe — Fe3C. При температурах ниже 768 0 С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют-железо ; при нагревании она в точкеАс2переходит в немагнитную модификацию-железо. Кристаллическая структура при этом не меняется. В точке Ас3при температуре 910 0 С-железо переходит в-железо с кристаллической решеткой гранецентрированного куба. В точке Ас4при температуре 1401 0 С-железо переходит в-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб. При охлаждении происходят те же переходы, только в обратной последовательности. Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3). Превращение в точке А3сопровождается изменением объема, так как плотность кристаллической решетки-железа больше плотности решетки-железа, в точкеАс3 объем уменьшается, в точкеAr3 — увеличивается. | ||||||||||||||||||||||||||||||||||
Понравилась статья? Поделись с друзьями!
- http://sdamzavas.net/1-70494.html
- http://himi4ka.ru/samouchitel-po-himii/urok-8-obshhie-svojstva-metallov.html
- http://acrossteel.ru/sprav_steel_10.html
- http://chemlib.ru/books/item/f00/s00/z0000037/st065.shtml
- http://studopedia.su/10_80057_obshchie-svedeniya.html
- http://studfiles.net/preview/3624164/



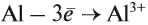
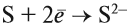
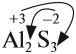

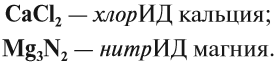
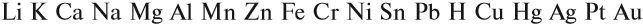
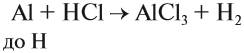
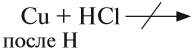
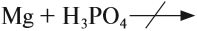
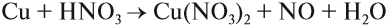
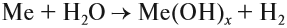
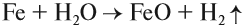

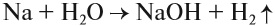
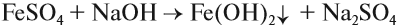
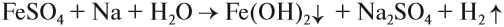

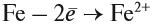
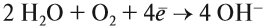
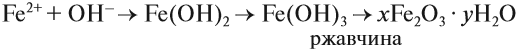


 см.
см.