Парообразование, которое происходит только со свободной поверхности жидкости, граничрщей с газообразной средой или с вакуумом, называется испарением.
Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории. Как известно, потенциальная энергия молекул жидкости при увеличении расстояния между ними должна возрастать. Следовательно, чтобы покинуть жидкость, молекула должна выполнить работу за счет уменьшения своей кинетической энергии. Среди хаотически движущихся молекул жидкости в ее поверхностном слое всегда найдутся такие молекулы, которые стремятся еылететь из жидкости. Когда такая молекула выходит за поверхностный слой, то возникает сила, втягивающая молекулу обратно в жидкость (рис. 7.1). Поэтому вылетают из жидкости только те молекулы, у которых кинетическая энергия больше работы, необходимой для преодоления противодействия молекулярных сил в слое толщиной где — радиус молекулярного действия.
Покинувшие жидкость молекулы совместно составляют пар над ее поверхностью. Так как из жидкости вылетают молекулы с достаточно большой кинетической энергией, а остаются в ней
молекулы с меньшей кинетической энергией, то среднее значение энергии для молекул, остающихся в жидкости, в процессе испарения уменьшается, т. е. жидкость при испарении охлаждается. Этим объясняется ощущение холода при выходе из воды после купанья, охлаждение руки, смоченной эфиром, и т. п.
Некоторые молекулы пара при хаотическое движении над поверхностью жидкости залетают обратно в жидкость. Это означает, что наряду с испарением жидкости всегда происходит и конденсация ее паров. Так как молекулы пара, залетающие в жидкость, частично передают свою кинетическую энергию молекулам жидкости, то при этом происходит возрастание Еаост у молекул жидкости, т. е. увеличение внутренней энергии жидкости (нагревание жидкости).
Итак, на поверхности жидкости одновременно происходит испарение и конденсация. Когда преобладает процесс испарения, жидкость охлаждается, а когда преобладает конденсация, жидкость нагревается.
Поскольку силы молекулярного взаимодействия зависят от природы молекул, скорость испарения зависит от рода жидкости. Эту зависимость легко обнаружить на опыте. Если в одинаковые открытые сосуды налить равные объемы разных жидкостей, то через некоторое время будет видно, что быстрота испарения этих жидкостей разная. Оказывается, что эфир испаряется быстрее спирта, а спирт — быстрее воды.
Опыт показывает, что скорость испарения жидкости зависит от площади ее свободной поверхности. Чем больше эта площадь, тем быстрее испаряется жидкость. (Приведите примеры, подтверждающие эту зависимость, и объясните ее.)
Испарение происходит при любой температуре. Поэтому над свободной поверхностью жидкости всегда находится пар этой жидкости.
Легко заметить, что с повышением температуры скорость испарения жидкости возрастает. Например, горячая вода испаряется быстрее холодной. Объясняется это тем, что при повышении температуры увеличивается средняя кинетическая энергия молекул жидкости и становится больше таких молекул, которые могут преодолеть противодействие поверхностного слоя жидкости и вылететь за его пределы.
Как было отмечено выше, наряду с испарением жидкости всегда происходит и конденсация ее паров, которая уменьшает скорость испарения. При увеличении плотности молекул пара над поверхностью жидкости конденсация пара возрастает и испарение замедляется. Следовательно, чем меньше плотность пара жидкости над ее поверхностью, тем больше скорость испарения. Поэтому откачка паров с поверхности ускоряет ее испарение.
Отметим еще, что охлаждение жидкости в процессе ее испарения не всегда заметно. Объясняется это тем, что между жидкостью и окружающими телами существует теплообмен, который компенсирует потери ее энергии, уменьшая охлаждение жидкости. Однако при большой скорости испарения температура жидкости может заметно понизиться.
Испарение и конденсация. Объяснение явления испарения на основе представлений о молекулярном строении вещества. Удельная теплота парообразования. Ее единицы.
Явление превращения жидкости в пар называется парообразованием.
Испарение-процесс парообразования, происходящий с открытой поверхности.
Молекулы жидкости движутся с разными скоростями. Если какая-нибудь молекула окажется у поверхности жидкости, она может преодолеть притяжение соседних молекул и вылететь из жидкости. Вылетевшие молекулы образуют пар. У оставшихся молекул жидкости при соударении меняются скорости. Некоторые молекулы при этом приобретают скорость, достаточную для того, чтобы вылететь из жидкости. Этот процесс продолжается, поэтому жидкости испаряются медленно.
*Скорость испарения зависит от рода жидкости. Быстрее испаряются те жидкости, у которых молекул притягиваются с меньшей силой..
*Испарение может происходить при любой температуре. Но при высоких температурах испарение происходит быстрее.
*Скорость испарения зависит от площади ее поверхности.
*При ветре (потоке воздуха) испарение происходит быстрее.
При испарении внутренняя энергия уменьшается, т.к. при испарении жидкость покидают быстрые молекулы, следовательно, средняя скорость остальных молекул уменьшается. Значит, что если нет притока энергии из вне, то температура жидкости уменьшается.
Явление превращения пара в жидкость называется конденсацией. Она сопровождается выделением энергии.
Конденсацией пара объясняется образование облаков. Пары воды, поднимающиеся над землей, образуют в верхних холодных слоях воздуха облака, которые состоят из мельчайших капель воды.
Удельная теплота парообразования – физ. величина, показывающая какое кол-во теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Уд. теплоту парообразования обозначают буквой L и измеряется в Дж/кг
Уд. теплоту парообразования воды:L=2,3×10 6 Дж/кг, спирт L=0,9×10 6
Кол-во теплоты, необходимое для превращения жидкости в пар: Q = Lm
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Учись учиться, не учась! 9403 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Молекулярная физика. Испарение и конденсация.
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Сублимацию, или возгонку, т.е. переход вещества из твердого состояния в газообразное, также называют испарением.
Из повседневных наблюдений известно, что количество любой жидкости (бензина, эфира, воды), находящейся в открытом сосуде, постепенно уменьшается. Жидкость не исчезает бесследно — она превращается в пар. Испарение — это один из видов парообразования. Другой вид — это кипение.
Механизм испарения.
Как происходит испарение? Молекулы любой жидкости находятся в непрерывном и беспорядочном движении, причем, чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии имеет определенную величину. Но у каждой молекулы кинетическая энергия может быть как больше, так и меньше средней. Если вблизи поверхности окажется молекула с кинетической энергией, достаточной для преодоления сил межмолекулярного притяжения, она вылетит из жидкости. То же самое повторится с другой быстрой молекулой, со второй, третьей и т. д. Вылетая наружу, эти молекулы образуют над жидкостью пар. Образование этого пара и есть испарение.
Поглощение энергии при испарении.
Поскольку при испарении из жидкости вылетают более быстрые молекулы, средняя кинетическая энергия оставшихся в жидкости молекул становится все меньше и меньше. Это значит, что внутренняя энергия испаряющейся жидкости уменьшается. Поэтому если нет притока энергии к жидкости извне, температура испаряющейся жидкости понижается, жидкость охлаждается (именно поэтому, в частности, человеку в мокрой одежде холоднее, чем в сухой, особенно при ветре).
Однако при испарении воды, налитой в стакан, мы не замечаем понижения ее температуры. Чем это объяснить? Дело в том, что испарение в данном случае происходит медленно, и температура воды поддерживается постоянной за счет теплообмена с окружающим воздухом, из которого в жидкость поступает необходимое количество теплоты. Значит, чтобы испарение жидкости про исходило без изменения ее температуры, жидкости необходимо сообщать энергию.
Количество теплоты, которое необходимо сообщить жидкости для образования единицы массы пара при постоянной температуре, называется теплотой парообразования.
Скорость испарения жидкости.
В отличие от кипения, испарение происходит при любой температуре, однако с повышением температуры жидкости скорость испарения возрастает. Чем выше температура жидкости, тем больше быстро движущихся молекул имеет достаточную кинетическую энергию, чтобы преодолеть силы притяжения соседних частиц и вылететь за пределы жидкости, и тем быстрее идет испарение.
Скорость испарения зависит от рода жидкости. Быстро испаряются летучие жидкости, у которых силы межмолекулярного взаимодействия малы (например, эфир, спирт, бензин). Если капнуть такой жидкостью на руку, мы ощутим холод. Испаряясь с поверхности руки, такая жидкость будет охлаждаться и отбирать у нее некоторое количество теплоты.
Скорость испарения жидкости зависит от площади ее свободной поверхности. Это объясняется тем, что жидкость испаряется с поверхности, и чем больше площадь свободной поверхности жидкости, тем большее количество молекул одновременно вылетает в воздух.
В открытом сосуде масса жидкости вследствие испарения постепенно уменьшается. Это связано с тем, что большинство молекул пара рассеивается в воздухе, не возвращаясь в жидкость (в отличие от того, что происходит в закрытом сосуде). Но небольшая часть их возвращается в жидкость, замедляя тем самым испарение. Поэтому при ветре, который уносит молекулы пара, испарение жидкости происходит быстрее.
Применение испарения в технике.
Испарение играет важную роль в энергетике, холодильной технике, в процессах сушки, испарительного охлаждения. Например, в космической технике быстроиспаряющимися веществами покрывают спускаемые аппараты. При прохождении через атмосферу планеты корпус аппарата в результате трения нагревается, и покрывающее его вещество начинает испаряться. Испаряясь, оно охлаждает космический аппарат, спасая его тем самым от перегрева.
Конденсация.
Конденсация (от лат. condensatio — уплотнение, сгущение) — переход вещества из газообразного состояния (пара) в жидкое или твердое состояние.
Известно, что при наличии ветра жидкость испаряется быстрее. Почему? Дело в том, что одновременно с испарением с поверхности жидкости идет и конденсация. Конденсация происходит из-за того, что часть молекул пара, беспорядочно перемещаясь над жидкостью, снова возвращается в нее. Ветер же выносит вылетевшие из жидкости молекулы и не дает им возвращаться.
Конденсация может происходить и тогда, когда пар не соприкасается с жидкостью. Именно конденсацией объясняется, например, образование облаков: молекулы водяного пара, поднимающиеся над землей, в более холодных слоях атмосферы группируются в мельчайшие капельки воды, скопления которых и представляют собой облака. Следствием конденсации водяного пара в атмосфере являются также дождь и роса.
При испарении жидкость охлаждается и, став более холодной, чем окружающая среда, начинает поглощать ее энергию. При конденсации же, наоборот, происходит выделение некоторого количества теплоты в окружающую среду, и ее температура несколько повышается. Количество теплоты, выделяющееся при конденсации единицы массы, равно теплоте испарения.
объяснить процесс испарения с молекулярной точки зрения
Наиболее быстрые молекулы вблизи поверхностного слоя сверху не окружены молекулами воды. И их кинетической энергии в какой то момент достаточно, чтобы преодолеть силы молекулярного притяжения, и выйти из жидкости.
Другие вопросы из категории
по горизонтальной поверхности льда если коэффициент трения 0.05 ?
Выразите скорость в м/с
Читайте также
2. Какие недостатки имеет кипятильник? ( Объясните почему с точки зрения физики)
3. Почему в Москве снег тает быстрее, чем за городом, даже на открытых участках.( Объясните почему с точки зрения физики)
Я занялся вопросом времени, и для очередного раздела нужна информация от том, что такое «время» с точки зрения квантовой физики.
базе одного центра цивилизации, согласно другой- на базе нескольких центров культур.Какую точку зрения вы считаете правильной?Каковы ваши доводы
плавления и отвердевания с молекулярной точки зрения.
Урок по физике «Испарение и конденсация» (8-й класс)
Разделы: Физика
Задачи урока:
- Ввести понятия об испарении и конденсации, с привлечением молекулярных.
- Представлений о строении вещества. Раскрыть проявлением статистических.
- Закономерностей в процессах испарения и конденсации, расширить.
- Представления учащихся об объектах природы и средствах описания.
- Формировать мыслительную деятельность по плану: факты – модель – следствия – эксперимент, формировать умения конспектировать.
Тип урока: комбинированный урок.
Демонстрации:
- Зависимость скорости испарения от площади свободной поверхности, температуры, движения воздуха.
- Охлаждение жидкости при испарении.
План урока
Этапы урока.
- Введение. Повторение: основные положения МКТ, внутренняя энергия. Постановка учебных проблем урока (5мин.).
- Изучение нового материала. Объяснение явлений испарения и конденсации с точки зрения МКТ (30 мин).
- Подведение итогов урока, выделение главного (9мин.).
- Домашнее задание (1 мин.).
Вопросы для повторения:
Три гипотезы лежащие в основе МКТ?
- Все тела состоят из огромного числа частиц, между которыми есть промежутки.
- Частицы вещества участвуют в тепловом движении.
- Частицы вещества взаимодействуют друг с другом.
Из чего складывается внутренняя энергия?
- Любое тело обладает внутренней энергией, потому что оно состоит из частиц.
- Внутренняя энергия представляет собой сумму кинетической энергии движения всех её частиц и потенциальной энергии их взаимодействия.
Изучение нового материала.
Давайте представим себе теплый летний день, мы искупались, наше тело и волосы стали мокрыми, но мы не расстраиваемся, достаточно несколько минут побыть на солнце и волосы станут сухими, влага с поверхности тела исчезнет. А куда же она подевалась?
Итак, испарение – агрегатное превращение, которое мы будем изучать. На основе знаний о молекулярной природе тепловых явлений построим модели явлений испарения и конденсации, с помощью которых объясним наблюдения в природе и в быту, связанные с испарением и конденсацией. Мы знаем много примеров, когда происходит испарение воды: лужи высыхают, приготовление сушеной рыбы, сухофруктов, целебных трав…
Но, не только вода испаряется, так же испаряется спирт, керосин, ртуть. Сначала проведем наблюдение за процессом испарения воды
Запишем свойства жидкости и пара
Жидкости испаряются при любых температурах. (Лужи испаряются и летом, и осенью, и весной.)
Рис 1
Рис. 2
А возможен ли обратный процесс – переход из газообразного состояния в жидкое? Наблюдения за водяными парами позволяют ответить на этот вопрос утвердительно. Рис. 2, Рис. 3 Агрегатное превращение, при котором вещество из газообразного состояния переходит в жидкое , называется конденсацией.
Опыт 1.
Опыт показывает, что конденсации тоже может проходить при любых температурах, только для этого нужно, чтобы имелась свободная поверхность этой жидкости или пар жидкости в атмосфере (либо в помещении) находился в особом состоянии. Такой пар называется насыщенным. А пока мне бы хотелось обратить ваше внимание на следующий факт. Приходилось ли вам наблюдать, что шарики нафталина, которые используют для уничтожения моли, со временем тоже испаряются? Подобное превращение из твердого состояния сразу в газообразное называется сублимацией или возгонкой. Посмотрим опыт по возгонке йода.
Опыт 2.
Если в пробирку насыпать кристалликов йода, закрыть ее пробкой и нагревать в пламени спиртовки, то можно наблюдать, как вся пробирка заполняется парами фиолетового цвета.
При охлаждении паров в пробирке наблюдается выпадение кристалликов йода на стенках пробирки. Этот процесс называется конденсацией. Другие закономерности можно обнаружить, проделав следующие опыты:
Опыт 3. С помощью пипетки нанесем на стеклянную пластину две капли воды. Одну каплю размажем на возможно большую площадь, другую оставим так. Вывод: испарение жидкости происходит тем быстрее, чем больше площадь её свободной поверхности.
Опыт 4. Нанесем на две стеклянные пластины по капле воды. Одну пластину поместим под лампу, а другую оставим при комнатной температуре. Вывод: испарение происходит быстрее при более высокой температуре жидкости.
Опыт 5. Нанесем на две стеклянные пластины по капле воды и распределим их на большей площади. Одну пластину поместим под вентилятор, а другую оставим. Вывод: жидкость испаряется быстрее, если образовавшийся над ней пар удаляется от поверхности жидкости.
Опыт 6. Нанесем на пластину три разных жидкостей: подсолнечного масла, воды и спирта. Распределим жидкости на одинаковые площади, проведем наблюдение. Вывод: интенсивность испарения разных жидкостей при одинаковых условиях различна.
Для объяснения этих опытов воспользуемся моделью процесса испарения. Согласно МКТ молекулы жидкости совершают непрерывное хаотическое движение. Скорости молекул неодинаковы. Среди множества молекул есть такие, скорости которых малы и скорости которых велики по сравнению со скоростью большинства молекул. Если такая быстрая молекула находится вблизи свободной поверхности жидкости и ее скорость направлена в сторону свободной поверхности, то она может преодолеть молекулярное притяжение со стороны соседей и вылететь за пределы жидкости. Так как из жидкости улетают наиболее быстрые молекулы, то средняя скорость (как и средняя кинетическая энергия) оставшихся молекул жидкости уменьшается.
Поэтому, когда нет притока энергии к жидкости из вне, испарение ведет к уменьшению внутренней энергии жидкости, вследствие чего жидкость охлаждается. Рассмотрим конкретную ситуацию:
Что будет происходить, если смазать, например, спиртом, руку?
Да, она охлаждается, поскольку, испаряясь, жидкость отнимет часть внутренней энергии руки, вследствие чего, её температура понизится.
Мы изучили явления испарения, используя цикл естественнонаучного познания. Представим его в виде схемы.
Конденсация – это процесс, обратный испарению.
Чем будет сопровождаться конденсация?
Правильно: при конденсации происходит выделении энергии.
Итак, подведем итоги:
- При одинаковых условиях скорость испарения зависит от рода жидкости (температура – мера средней кинетической энергии теплового движения частиц).
- От площади свободной поверхности.
- От наличия ветра.
Вопросы для закрепления:
- Почему скошенная трава быстрее высохнет в ветреную погоду?
Ответ: ветер относит молекулы воды, которые испаряются с поверхности травы. - В двух одинаковых тарелках поровну налиты жирные и постные щи. Какие щи остынут быстрее?
Ответ: быстрее остынут постные щи, так как жирная пленка препятствует испарению воды. - Сырые дрова горят хуже, чем сухие. Почему?
Ответ: часть энергии расходуется на испарение воды в сырых дровах.
Литература
- Г.Н. Степанов. Физика – 8. Учебник. Санкт-Петербург “Валерий СПД”, 200 год.
- Л.А. Кирик. Физика – 8. Методические материалы. М.: “Илекса”, 2004 год.
- М.Е. Тульчинский. Качественные задачи по физике в 6-7 классах. М.: Просвещение, 1976 год.
Изложения нового материала. Объяснение явления испарения с точки зрения мкт
| Название | Изложения нового материала. Объяснение явления испарения с точки зрения мкт |
| Дата конвертации | 30.03.2013 |
| Размер | 36.83 Kb. |
| Тип | Рассказ |
учитель физики МОУ «Гимназия №5»Урок в 8 классе по теме «Испарение и конденсация»Цели урока:
Тип урока: комбинированный. 1. Зависимость скорости испарении от температуры, движения воздуха. План изложения нового материала.
Ход урока 2. Подготовка к усвоению нового материала На столах у вас лежат предметные стеклышки. Подышите на стеклышко. Что вы наблюдается? Как называется наблюдаемое явление? Как и почему можно изменить «картину» на стеклышке? Объявление темы урока: «Испарение и конденсация». Постановка целей и задач урока. 3. Объяснение нового материала. Рассказ о явлении испарения с точки зрения МКТ. Нарисуйте в тетради сосуд, который наполненный жидкостью. Изобразим молекулы этой жидкости в виде шариков, которые расположены довольно плотно друг к другу. Это молекулярная модель жидкости. Изобразите стрелками направления движения некоторых молекул. Каким молекулам легче всего покинуть жидкость? Вывод: поверхностный слой жидкости могут покинуть молекулы находящиеся вблизи поверхности, и которые имеют большую кинетическую энергию равную работе, которую необходимо совершить против сил сцепления, удерживая их внутри жидкости. Признаки явления испарения с помощью видеофильма «Молекулярная физика» Демонстрация — уменьшение количеств вещества при испарении, которое сопровождается понижением температуры испаряющейся жидкости. Вывод: При испарении происходит понижение температуры, т.к. внутренняя энергия испаряющейся жидкости уменьшается. От каких факторов зависит скорость испарения? Демонстрация – зависимость скорости испарения от температуры, движения воздуха с помощью видеофильма «Молекулярная физика» Вывод: Испарение зависит от: а) температуры; Испарение происходит с любой поверхности, в том числе и с поверхности твердого тела. Пример: бельё высыхает и на морозе. Испаряется и нафталин, поэтому мы чувствуем его запах. Этот процесс называют сублимацией. Конденсация — процесс перехода молекул из пара в жидкость. Этот процесс происходит на поверхности жидкости или твердого тела. Конденсация сопровождается выделением энергии. Пример: образование облаков, выпадение росы. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Испарение в природе, технике. а) В естественных условиях испарение является единственным способом передачи влаги с океанов в атмосферу и основной составляющей круговорота воды на земном шаре. Пример: С поверхности земли, ежегодно испаряется 577 000 куб. км воды. С поверхности Мирового океана — 505 000 куб. км; с поверхности рек, озер ….- 74 000 куб. км. Огромное количество воды испаряется растениями. За вегетационный период 1 га пшеницы испаряется около 2 000 куб. м воды. 1 га взрослых лиственных деревьев за лето испаряет до 15 000 куб. м б) в технике применяется испарение как средство для очистки веществ или разделения жидких смесей перегонкой (получение бензина, керосина и т.д.). Процесс испарения лежит в основе двигателей внутреннего сгорания, холодильных установок, а так же для разбрызгивания воды в горячем цеху для охлаждения воздуха, а также в основе всех процессов сушки в сушильных камерах. а) фронтальная беседа по вопросам. 1. Что называют испарением? б) работа в группах 1 группа: В каких случаях понижение температуры при испарении жидкости полезно и что следует сделать, чтобы его ускорить? 2 группа: Когда быстрое испарение вредно, и каким образом его можно замедлить? 3 группа: Почему учителя физкультуры настаивают, чтобы ученики после урока обязательно переодевались? 1 группа: Выйдя в летний жаркий день из реки, вы ощущаете прохладу, это ощущение усиливается в ветреную погоду. Объясните, почему это происходит? 2 группа: Утром на траве появились капельки росы. Какой будет день, холодный или теплый? 3 группа: Какой суп остынет быстрее: жирный или постный? Школьная ЭнциклопедияNav view searchИспарение, кипение, конденсацияПодробности Категория: Молекулярно-кинетическая теория Опубликовано 09.11.2014 21:08 Просмотров: 12576 В жидком состоянии вещество может существовать в определённом интервале температур. При температуре, меньшей нижнего значения этого интервала, жидкость превращается в твёрдое вещество. А если значение температуры превысит верхнюю границу интервала, жидкость переходит в газообразное состояние. Всё это мы можем наблюдать на примере воды. В жидком состоянии мы видим её в реках, озёрах, морях, океанах, водопроводном кране. Твёрдое состояние воды — лёд. В него она превращается, когда при нормальном атмосферном давлении её температура снижается до 0 о С. А при повышении температуры до 100 о С вода закипает и превращается в пар, который является её газообразным состоянием. Процесс превращения вещества в пар называют парообразованием. Обратный процесс перехода из пара в жидкость — конденсация. Парообразование происходит в двух случаях: при испарении и при кипении. Испарением называют фазовый процесс перехода вещества из жидкого состояния в газообразное или парообразное, происходящий на поверхности жидкости. Как и при плавлении, при испарении веществом поглощается теплота. Она затрачивается на преодоление сил сцепления частиц (молекул или атомов) жидкости. Кинетическая энергия молекул, обладающих самой высокой скоростью, превышает их потенциальную энергию взаимодействия с другими молекулами жидкости. Благодаря этому они преодолевают притяжение соседних частиц и вылетают с поверхности жидкости. Средняя энергия оставшихся частиц становится меньше, и жидкость постепенно остывает, если её не подогревать извне. Так как частицы находятся в движении при любой температуре, то и испарение также происходит при любой температуре. Мы знаем, что лужи после дождя высыхают даже в холодную погоду. Но скорость испарения зависит от многих факторов. Один из важнейших — температура вещества. Чем она выше, тем больше скорость движения частиц и их энергия, и тем большее их количество покидает жидкость в единицу времени. Наполним одинаковым количеством воды 2 стакана. Один поставим на солнцепёк, а другой оставим в тени. Через некоторое время увидим, что воды в первом стакане стало меньше, чем во втором. Её нагрели солнечные лучи, и она испарилась быстрее. Лужи после дождя летом также высыхают гораздо быстрее, чем весной или осенью. В сильную жару происходит быстрое испарение воды с поверхностей водоёмов. Высыхают пруды, озёра, пересыхают русла неглубоких рек. Чем выше температура окружающей среды, тем выше скорость испарения. При одинаковом объёме жидкость, находящаяся в широкой тарелке, испарится гораздо быстрее жидкости, налитой в стакан. Это означает, что скорость испарения зависит от площади поверхности испарения. Чем больше эта площадь, тем большее количество молекул вылетает из жидкости в единицу времени. При одинаковых внешних условиях скорость испарения зависит от рода вещества. Заполним стеклянные колбы одинаковым объёмом воды и спирта. Через некоторое время увидим, что спирта осталось меньше, чем воды. Он испаряется с большей скоростью. Так происходит, потому что молекулы спирта слабее взаимодействуют друг с другом, чем молекулы воды. Влияет на скорость испарения и наличие ветра. Мы знаем, что вещи после стирки гораздо быстрее высыхают, когда их обдувает ветер. Струя горячего воздуха в фене способна быстро высушить наши волосы. Ветер уносит молекулы, вылетевшие из жидкости, и обратно они уже не возвращаются. Их место занимают новые молекулы, покидающие жидкость. Поэтому в самой жидкости их становится меньше. Следовательно, она испаряется быстрее. СублимацияИспарение происходит и в твёрдых телах. Мы видим, как постепенно высыхает на морозе замёрзшее, покрытое льдом бельё. Лёд превращается в пар. Мы ощущаем резкий запах, образующийся при испарении твёрдого вещества нафталина. Некоторые вещества вообще не имеют жидкой фазы. К примеру, элементарный иод I 2 — простое вещество, представляющее собой кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, при нормальных условиях сразу же превращается в газообразный иод — фиолетовые пары с резким запахом. Тот жидкий йод, который мы покупаем в аптеках, — это не жидкое его состояние, а раствор йода в спирте. Процесс перехода твёрдых тел в газообразное состояние, минуя жидкую стадию, называют сублимацией, или возгонкой. Кипение — это тоже процесс перехода жидкости в пар. Но парообразование при кипении происходит не только на поверхности жидкости, но и по всему её объёму. Причём процесс этот проходит гораздо интенсивнее, чем при испарении. Поставим на огонь чайник с водой. Так как в воде всегда есть растворённый в ней воздух, то при нагревании на дне чайника и на его стенках появляются пузырьки. Эти пузырьки содержат воздух и насыщенный водяной пар. Сначала они появляются на стенках чайника. Количество пара в них увеличивается, увеличиваются в размерах и они сами. Затем под воздействием выталкивающей силы Архимеда они будут отрываться от стенок, подниматься вверх и лопаться на поверхности воды. Когда температура воды достигнет 100 о С, пузырьки будут образовываться уже по всему объёму воды. Испарение происходит при любой температуре, а кипение — только при определённой температуре, которая называется температурой кипения. Каждое вещество имеет свою температуру кипения. Она зависит от величины давления. При нормальном атмосферном давлении вода закипает при температуре 100 о С, спирт — при 78 о С, железо — при 2750 о С. А температура кипения кислорода — минус 183 о С. При уменьшении давления температура кипения снижается. В горах, где атмосферное давление ниже, вода закипает при температуре менее 100 о С. И чем выше над уровнем моря, тем меньшей будет температура кипения. А в кастрюле-скороварке, где создаётся повышенное давление, вода закипает при температуре выше 100 о С. Насыщенный и ненасыщенный парЕсли вещество может одновременно существовать в жидкой (или твёрдой) фазе и газообразной, то его газообразное состояние называют паром. Пар образуют молекулы, вылетевшие при испарении из жидкости или твёрдого вещества. Нальём жидкость в сосуд и плотно закроем его крышкой. Через некоторое время количество жидкости уменьшится из-за её испарения. Молекулы, покидающие жидкость, будут концентрироваться над её поверхностью в виде пара. Но когда плотность пара станет довольно высокой, некоторые из них начнут снова возвращаться в жидкость. И таких молекул будет всё больше и больше. Наконец, настанет такой момент, когда число молекул, вылетающих из жидкости, и число молекул, возвращающихся в неё, сравняется. В этом случае говорят, что жидкость находится в динамическом равновесии со своим паром. А такой пар называется насыщенным. Если при парообразовании из жидкости вылетает больше молекул, чем возвращается, то такой пар будет ненасыщенным. Ненасыщенный пар образуется, когда испаряющаяся жидкость находится в открытом сосуде. Покидающие её молекулы рассеиваются в пространстве. Возвращаются в жидкость далеко не все из них. Конденсация параОбратный переход вещества из газообразного состояния в жидкое называют конденсацией. При конденсации часть молекул пара возвращается в жидкость. Пар начинает превращаться в жидкость (конденсироваться) при определённом сочетании температуры и давления. Такое сочетание называется критической точкой. Максимальная температура, ниже которой начинается конденсация, называется критической температурой. При температуре выше критической газ никогда не превратится в жидкость. В критической точке граница раздела фазовых состояний жидкость-пар размывается. Исчезает поверхностное натяжение жидкости, выравниваются плотности жидкости и её насыщенного пара. При динамическом равновесии, когда число молекул, покидающих жидкость и возвращающихся в неё равно, процессы испарения и конденсации уравновешены. При испарении воды её молекулы образуют водяной пар, который смешивается с воздухом или другим газом. Температура, при которой такой пар в воздухе становится насыщенным, начинает конденсироваться при охлаждении и превращается в капельки воды, называется точкой росы. Когда в воздухе находится большое количество водяного пара, говорят, что его влажность повышена. В природе испарение и конденсацию мы наблюдаем очень часто. Утренний туман, облака, дождь — всё это результат этих явлений. С земной поверхности при нагревании испаряется влага. Молекулы образовавшегося пара поднимаются вверх. Встречая на своём пути прохладные листики или травинки, пар конденсируется на них в виде капелек росы. Чуть выше, в приземных слоях, он становится туманом. А высоко в атмосфере при низкой температуре остывший пар превращается в облака, состоящие из капелек воды или кристалликов льда. Впоследствии из этих облаков на землю прольётся дождь или выпадет град. Но капельки воды при конденсации образуются лишь в том случае, когда в воздухе находятся мельчайшие твёрдые или жидкие частицы, которые называют ядрами конденсации. Ими могут быть продукты горения, распыления, частицы пыли, морской соли над океаном, частицы, образовавшиеся в результате химических реакций в атмосфере и др. ДесублимацияИногда вещество может перейти из газообразного состояния сразу в твёрдое, минуя жидкую стадию. Такой процесс называется десублимацией. Ледяные узоры, которые появляются на стёклах в мороз, и есть пример десублимации. При заморозках почва покрывается инеем — тонкими кристалликами льда, в которые превратились водяные пары из воздуха. Журнал «Квант»Испарение и конденсацияПереход вещества в газообразное состояние называется парообразованием. Совокупность молекул, вылетевших из вещества, называется паром это го вещества. При парообразовании увеличиваются средние расстояния между молекулами. В результате потенциальная энергия взаимодействия частиц увеличивается (численное значение ее уменьшается, но она отрицательна). Таким образом, процесс парообразования связан с увеличением внутренней энергии вещества. Парообразование может происходить непосредственно из твердого состояния — это возгонка (или сублимация). Переход из жидкого состояния в газообразное возможен двумя различными процессами: испарением и кипением. Испарение — это парообразование, происходящее только со свободной поверхности жидкости, граничащей с газообразной средой или с вакуумом. Экспериментально установлены следующие закономерности:
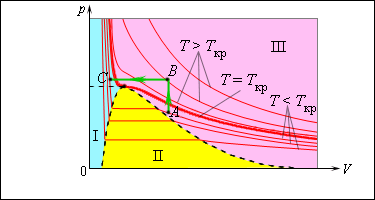
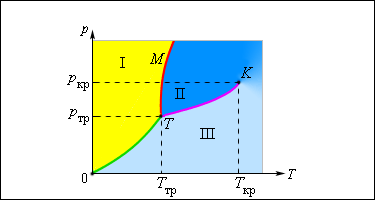
Механизм испарения можно объяснить с точки зрения MKT: молекулы, находящиеся на поверхности, удерживаются силами притяжения со стороны других молекул вещества. Молекула может вылететь за пределы жидкости лишь тогда, когда ее кинетическая энергия превышает значение той работы, которую необходимо совершить, чтобы преодолеть силы молекулярного притяжения (работа выхода). Поэтому покинуть вещество могут только быстрые молекулы. В результате средняя кинетическая энергия оставшихся молекул уменьшается, а температура жидкости понижается. Для поддержания температуры испаряющейся жидкости неизменной к ней необходимо подводить некоторое количество теплоты. Количество теплоты Q, необходимое для превращения жидкости в пар при постоянной температуре, называется теплотой парообразования. Экспериментально установлено, что Q = Lm, где m — масса испарившейся жидкости, L — удельная теплота парообразования. Удельная тепло га парообразования — величина, численно равная количеству теплоты, необходимому для превращения в пар жидкости единичной массы при неизменной температуре. Удельная теплота парообразования L зависит от рода жидкости и внешних условий. При увеличении температуры она уменьшается (рис. 1). Это объясняется тем, что все жидкости при нагревании расширяются. Расстояния между молекулами при этом увеличиваются и силы молекулярного взаимодействия уменьшаются. Кроме того, чем больше температура, тем больше средняя кинетическая энергия движения молекул и тем меньше энергии им нужно добавить, чтобы они могли вылететь за пределы поверхности жидкости. Молекулы пара хаотически движутся. Поэтому скорости некоторых из них будут направлены в сторону жидкости. Достигнув поверхности, они втягиваются в нее силами притяжения со стороны молекул, находящихся на поверхности жидкости, и снова становятся молекулами жидкости. Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией. Число возвратившихся в жидкость за определенный промежуток времени молекул тем больше, чем больше концентрация молекул пара, а следовательно, чем больше давление пара над жидкостью. Конденсация пара сопровождается нагреванием жидкости. При конденсации выделяется такое же количество теплоты, которое было затрачено при испарении. ЛитератураАксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 197-198. Объяснение испарения с молекулярной точки зренияЛюбое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом . Испарение и конденсация являются примерами фазовых переходов. Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры . Например, для воды критическая температура равна , для азота , для кислорода . При комнатной температуре () вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов. Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел). Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость. В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия , когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной . Пар, находящийся в равновесии со своей жидкостью, называют насыщенным . Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара данного вещества зависит только от его температуры и не зависит от объема . Поэтому изотермы реальных газов на плоскости () содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
|
- http://studopedia.ru/8_97003_bilet--.html
- http://www.calc.ru/Molekulyarnaya-Fizika-Ispareniye-I-Kondensatsiya.html
- http://fizika.neznaka.ru/answer/2188744_obasnit-process-isparenia-s-molekularnoj-tocki-zrenia/
- http://xn--i1abbnckbmcl9fb.xn--p1ai/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/524237/
- http://koledj.ru/docs/index-6711.html
- http://ency.info/materiya-i-dvigenie/molekulyarno-kineticheskaya-teoriya/357-isparenie
- http://www.physbook.ru/index.php/%D0%A2._%D0%98%D1%81%D0%BF%D0%B0%D1%80%D0%B5%D0%BD%D0%B8%D0%B5
- http://physics.ru/courses/op25part1/content/chapter3/section/paragraph4/theory.html