
задача №3
к главе «Тема VI. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Работа 2. Строение атома».
1. Что общего в строении атомов химических элементов, расположенных в одной А-группе?
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах углерода (массовое число 12), цинка (массовое число 64) и брома (массовое число 79).
3. Напишите электронные формулы атомов лития и хлора.
4. Напишите не менее трех символов химических элементов, у которых на внешнем энергетическом уровне находится пять электронов. Изобразите схему строения атома и электронную формулу одного из них.
1. Атомы элементов, расположенных в одной главной подгруппе имеют одинаковое строение валентной электронной оболочки.
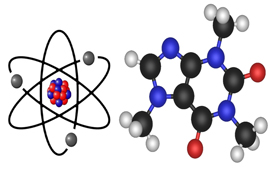
Молекула и атом: что это, что общего и в чем разница
Очень часто можно услышать мнение, что атом будучи составной частью молекулы, обладает теми же свойствами и имеет аналогичную структуру. Такая позиция лишь отчасти имеет право на существование, поскольку частицы имеют общие и отличительные признаки. Для начала достаточно рассмотреть свойства двух объектов, и на их основе делать дальнейшие выводы.
Атом можно рассматривать как элементарную частицу однородного вещества. Такое вещество, по определению, состоит только из одного химического элемента (С, N, O и другие с периодической таблицы Менделеева). Именно наименьшая часть таких элементов, которая может быть носителем их свойств, и называется атомом. Согласно последним современным представлениям, атом состоит из трех составляющих: протонов, нейтронов и электронов.
Первые две субчастицы вместе составляют базовое ядро, которое имеет положительный заряд. Двигающиеся вокруг ядра электроны привносят компенсационный заряд с противоположным знаком. Таким образом, делается первый вывод, что большинство атомов — электрически нейтральны. Что касается оставшейся части, то в силу различных физико-химических процессов, атомы могут либо присоединять, либо отпускать электроны, что приводит к появлению заряда. Атом имеет массу и размер (определяется размерами ядра) и определяет химические свойства вещества.
Молекула является минимальной структурной единицей вещества. Такое вещество может состоять из нескольких химических элементов. Однако, молекулой можно считать и одноатомное вещество одного химического элемента — инертный газ аргона. Как и атомы, является электрически нейтральной. Ионизировать молекулу можно, но уже значительно сложнее: атомы внутри молекулы связаны между собой ковалентной, либо ионной связью. Поэтому присоединить или забрать электрон становится значительно сложнее. Большинство молекул имеет сложную архитектурную постройку, где каждый атом заранее занимает отведенное ему место.
Строение молекулы воды
Атом и молекула: общие свойства
Строение. Обе частицы являются структурными единицами вещества. При этом под атомом подразумевается один определенный элемент, молекула же включает в себя уже несколько химически связанных атомов, но структура (положительное ядро с отрицательными электронами) остается той же.
Электрическая нейтральность. При отсутствии внешних факторов — взаимодействия с другим химическим веществом, направленного электрического поля и других раздражителей, — атомы и молекулы не имеют заряда.
Замещение. Атом может выступать как молекула в одном случае — при работе с инертными газами. Также молекулой может считаться одноатомная ртуть.
Наличие массы. Обе частицы имеют свою четкую массу. В случае атома масса зависит от химического элемента и определяется весом ядра (протон почти в 1500 раз тяжелее электрона, поэтому вес отрицательной частицы часто не берется во внимание). Масса молекулы определяется исходя из ее химической формулы — элементов, входящих в ее состав.
Атом и молекула: отличные свойства
Неделимость. Атом является мельчайшим элементом, из которого нельзя выделить еще меньшую частицу. (Получение иона влияет только на заряд, но не на вес). Молекулу, в свою очередь, можно разделить на более мелкие молекулы или можно разложить на атомы. Процесса распада легко добиться с использованием химических катализаторов. Иногда достаточно просто нагреть вещество.
Свободное существование. Молекула может свободно существовать в природе. Атом существует в вольной форме лишь в двух случаях:
- Как одноатомная ртуть или инертный газ.
- В условиях космоса — как отдельные атомы могут находиться любые химические элементы.
В остальных случаях атом всегда входит в состав молекулы.
Образование заряда. Взаимодействие между ядром и электроном в атоме можно легко преодолеть даже мельчайшим электрическим полем. Таким образом, — из атома легко получить положительный или отрицательный ион. Наличие химических связей между атомами внутри молекулы требует приложения гораздо большего электрического поля или взаимодействия с другим химически активным веществом.
Чем, с точки зрения строения атома,отличаются металлы главных и побочных подгрупп друг от друга?
Вместе с тем атомы элементов-металлов главных и побочных подгрупп имеют относительно невысокие энергии ионизации. Это связано с небольшим числом электронов на последнем энергетическом уровне и наличием свободных орбиталей.
отличие в том что у атамов металлов гдавных подгрупп заполняются внешние электронные уровни, а у металлов побочных подгрупп- предвнешние.. иногда даже третьи от внешнего..
Другие вопросы из категории
CH3-CHO > CH3COOH > СН3-СОО-CH2-CH3 > CH3COOK
3) При восстановлении водородом уксусного альдегида массой 90 г получили 82 г этилового спирта. Определите массовую долю выхода спирта. (Ответ: 87,1%)
H₂S+K₂Cr₂O₇+H₂SO₄⇒S+Cr₂(SO₄)₃+K₂SO4+H₂O
Читайте также
Объясните с точки зрения строения атомов этих элементов
и в чем различия в строении атомов химических элементов с порядковыми номерами 11 и 19?
2. ПО электронной формуле атома 1s2 2s2 2p6 3s2 3p6 3d5 4s2 определите, какой это элемент, его положение в периодической системе хим элементов ( группа, период, подгруппа). К какому семейству (s, p, d) относится этот элемент ?
3. Запишите значения квантовых чисел для электронов 2s2 2p3 подуровня.
4. Какой из двух элементов обладает более выраженными неметаллическими свойствами S, Cl ? Дайте объяснение с точки зрения электронной теории строения атома
5.Дайте характеристику элемента Кремний на основе его положения в периодической системе Минделеева
Основы строения атома. Просто о сложном
Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
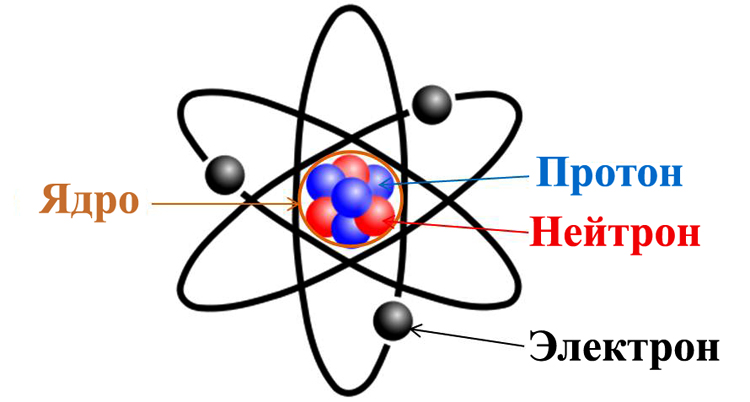
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.

Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц — кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.

Свойства атомов
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?

Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами — 126) элементов, не считая изотопов. Но так было далеко не всегда.
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.

Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.

Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Эволюция теоретических проблем химии
С точки зрения теории строения атома, элементы в периодической системе расположены в последовательности увеличения зарядов их ядер, Внутри каждого периода по мере возрастания зарядов ядер элементов последовательно изменяется структура внешних электронных уровней. С этим связан переход элементов от металлов к неметаллам. В периодах слева направо, с увеличением зарядов ядер элементов, усиливается притяжение электронов к ядру и происходит сжатие атома, т. е. уменьшение атомного радиуса элементов. Поэтому в начале каждого периода располагаются элементы, имеющие больший атомный радиус и меньшее число электронов на внешнем электронном слое. Чем больше атомный радиус, тем слабее притяжение электронов внешнего слоя и тем легче элементу отдавать электроны. Такая структура характерна для элементов — металлов, которые сравнительно легко отдают валентные электроны, но не могут принимать их дополнительно для достройки электронных оболочек внешнего уровня.
С увеличением атомного номера элементов увеличивается заряд ядра и число электронов во внешнем слое и уменьшается легкость отдачи электронов с этого слоя. Таким образом, внутри каждого периода с увеличением атомных номеров элементов наблюдается уменьшение металлических свойств элементов и возрастание неметаллических свойств (способность притягивать к себе электроны). Каждый период заканчивается инертным элементом, имеющим завершенную структуру внешнего электронного слоя (полный октет).
Устойчивость такого октета объясняет пассивность инертных элементов, что не позволяет причислить их к металлам или неметаллам. В группах расположены элементы, имеющие одинаковое строение внешнего электронного слоя, т. е. электронные аналоги. Номер группы указывает число электронов на внешней электронной оболочке атомов элементов данной группы. Элементы, находящиеся в одной группе проявляют близкие химические свойства. Однако и внутри группы свойства элементов изменяются. Это связано с тем, что внутри каждой группы сверху вниз у элементов увеличивается число электронных слоев, т. е. атомный радиус. Чем больше атомный радиус, тем дальше от ядра электроны внешнего слоя и тем слабее они удерживаются ядром.
Таким образом, в группах сверху вниз усиливаются металлические и уменьшаются неметаллические свойства. В периодической таблице группы делятся на два типа: 8 групп IA- VIIIA и 8 групп IB- VIIIB. Группа VIIIB состоит из триад. В группах IА и IIA находятся s-элементы, у них последним заполняется электронами s-подуровень внешнего уровня. Далее, согласно правилам Клечковского, для элементов с главным квантовым числом n= 2 и n= 3 (второй и третий период) происходит заполнение р- подуровня. Это р- элементы, они располагаются в группах IIIA- VIIIA. Для элементов IV и V периода после заполнения электронами s- подуровня энергетически более выгодно заполнение соответственно 3d- и 4d- поуровней, что и происходит у элементов групп IB- VIIIB.
Группы типа В расположены в порядке, указывающем число валентных электронов атомов элементов, так как у d- элементов валентными являются электроны не только внешнего уровня, но и заполняемого второго снаружи уровня. После полного заполнения d- электронами второго снаружи уровня, происходит заполнение р- подуровня последнего электронного уровня (группы IIIA- VIIIA).
У актиноидов и лантаноидов происходит заполнение электронами f- подуровня третьего снаружи энергетического уровня, что и обуславливает схожесть их химических свойств.
Как видно, с учетом заполнения электронами энергетических уровней, в периодической таблице с увеличением атомных номеров элементов наблюдается периодическое повторение строения внешних электронных слоев, что и обусловливает периодичность свойств химических элементов.
С электронной конфигурацией атома связаны такие его свойства, как энергия ионизации, сродство к электрону, электроотрицательность, степень окисления.
Смотрите также
Возникновение и развитие науки химии
С незапамятных времён человек,сталкиваясь с различными явлениями природы,накапливая сведения о нихи об окружающих его предметах,всё чаще использовал их себе на благо.Человек заметил,что под .
История развития представлений о строении атома
Все тела живой и неживой природы, несмотря на их разнообразие, состоят из мельчайших частиц — атомов. Первым, кто высказал предположение об этом, считается древнегреческий философ Демокрит. Именно он назвал атомом мельчайшую неделимую частицу образующую вещество (атом в переводе с др.греч «неделимый»). Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома, что атомы разлагаются на более мелкие элементарные частицы и таким образом «атомами» в Демокритовском смысле не являются. Тем не менее, термин используется и теперь в современной химии и физике, несмотря на несоответствие его этимологии современным представлениям о строении атома.
Первые представления об атоме
Демокрит считал, что если разделить, например, яблоко на две половины, затем одну из них еще на две части, и продолжать деление таким образом до тех пор пока результат деления перестанет быть яблоком, то мельчайшая частица которая все еще сохраняет свойство яблока является атомом яблока (т.е. неделимой частью яблока). Он утверждал, что атомы существуют вечно; они настолько малы, что их размеры не поддаются измерению; все атомы одинаковы, но они различаются внешне (атомы воды, например, гладкие, они способны перекатываться, и поэтому жидкости свойственна текучесть; атомы железа имеют зубчики, которыми они зацепляются друг за друга, что придает железу свойства твердого тела). Представления Демокрита были умозрительными.
Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Атоми́зм — натурфилософская теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов. (В современной физике вопрос об атомизме является открытым. Некоторые теоретики придерживаются атомизма, но под атомами подразумевают фундаментальные частицы, которые далее неделимы).
Основы атомной теории строения вещества
В 1808 г. физик Дальтон Джон (1766–1844) возродил атомизм, доказал реальность существования атомов. Он писал: «Атомы — химические элементы, которые нельзя создать заново, разделить на более мелкие частицы, уничтожить путем каких-либо химических превращений. Любая химическая реакция просто изменяет порядок группировки атомов». Джон Дальтон ввёл понятие «атомный вес», первым рассчитал атомные веса (массы) ряда элементов и составил первую таблицу их относительных атомных весов, заложив тем самым основу атомной теории строения вещества.
Дальтон был одним из самых знаменитых и уважаемых учёных своего времени, ставший широко известным благодаря своим новаторским работам в разных областях знания. Он впервые (1794) провёл исследования и описал дефект зрения, которым страдал сам, — цветовая слепота, позже названный в его честь дальтонизмом; открыл закон парциальных давлений (закон Дальтона) (1801), закон равномерного расширения газов при нагревании (1802), закон растворимости газов в жидкостях (закон Генри-Дальтона). Установил закон кратных отношений (1803), обнаружил явление полимеризации (на примере этилена и бутилена).
Однако вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
В 1897 г. английский физик Дж. Томсон изучая катодные лучи, пришел к выводу, что атомы любого вещества содержат отрицательно заряженные частицы, которые он назвал электронами. Огромной заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. Он предложил первую модель атома — «пудинг с изюмом» 1904 г.
По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью,в положительно заряженной сфере находится несколько электронов, так что атом подобен кексу, в котором роль изюминок играют электроны.
Ядерная модель атома (планетарная)
Резерфорд бомбардировал α-частицами атомы тяжелых элементов (золото, серебро, медь и др.). α-частицы – это полностью ионизированные атомы гелия. Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад.
Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома (планетарная):
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся электрон по законам электродинамики должен терять энергию и приближаться к ядру. Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожное время должен упасть на ядро. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к явлениям атомных масштабов законы классической физики неприемлемы.
Датским физик Нильс Бор (1885 — 1962) считал что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира — квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и «спасающих») атом Резерфорда. Его теория впоследствии привела к созданию стройной теории движения микрочастиц — квантовой механики.
Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия E. В стационарном состоянии атом не излучает.
Согласно второму постулату Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
Квантовая теория строения атома
Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv, где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности Гейзенберга служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Последнее положение было сформулировано после того, как в 1920 г. Э.Резерфорд открыл протон, а в 1932 г. Дж.Чедвик — нейтрон.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = А — N,
N = А — Z,
А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики (механику, применимую к движению обычных тел и описываемую законами Ньютона, стали называть классической механикой). Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В.Гейзенберг, австриец Э.Шредингер, англичанин П.Дирак. Впоследствии каждый из этих ученых был удостоен Нобелевской премии.
Квантовая механика — математически очень сложная теория. Но главная трудность не в этом. Процессы, которые описывает квантовая механика, — процессы микромира — недоступны не только восприятию нашими органами чувств, но и воображению. Люди лишены возможности представить их себе наглядно в полной мере, так как они совершенно отличны от тех макроскопических явлений, которые человечество наблюдало на протяжении миллионов лет. Человеческое воображение не создает новые, а лишь комбинирует известные, поэтому практически невозможно на нашем макроскопическом языке описать поведение фотонов и других частиц.
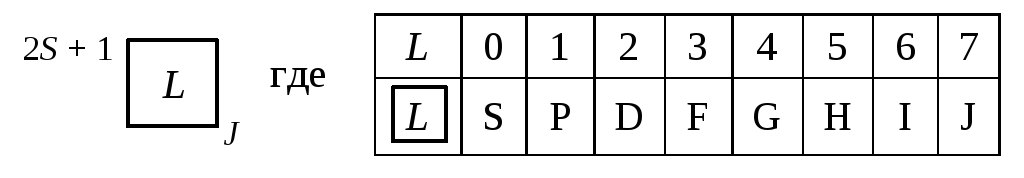
Характеристика элемента по его положению в Периодической системе Д. И. Менделеева с точки зрения строения атома
|
- http://vchemraznica.ru/molekula-i-atom-chto-eto-chto-obshhego-i-v-chem-raznica/
- http://russkij-yazyk.neznaka.ru/answer/3292946_cem-s-tocki-zrenia-stroenia-atomaotlicautsa-metally-glavnyh-i-pobocnyh-podgrupp-drug-ot-druga/
- http://zaochnik.ru/blog/osnovy-stroeniya-atoma-prosto-o-slozhnom/
- http://www.chemicalnow.ru/chemies-4372-2.html
- http://himege.ru/stroenie-atoma/
- http://uz.denemetr.com/docs/1267/index-4294.html
- http://vchemraznica.ru/molekula-i-atom-chto-eto-chto-obshhego-i-v-chem-raznica/
- http://studfiles.net/preview/3246904/page:2/
- http://studopedia.ru/4_177052_vopros--harakteristika-elementov-I-IV-periodov-ishodya-iz-ih-polozheniya-v-periodicheskoy-sisteme-s-tochki-zreniya-teorii-stroeniya-atoma.html



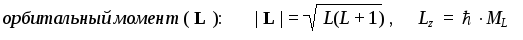
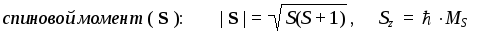
 | 7305 —
| 7305 —  или читать все.
или читать все.