О том, что все вещества состоят из частиц, знали еще древние греки. Около 420 г. до н. э. философ Демокрит выдвинул предположение, что материя состоит из крошечных, неделимых частиц, которые назвали атомами. Все вещества состоят из атомов и молекул. И атом, и молекулу считали вначале не делимыми, и только впоследствии было доказано, что это не так.
Атомы — это мельчайшие частицы, из которых состоит вещество.
Молекулы — это также элементарные частицы, из которых состоит любое вещество.
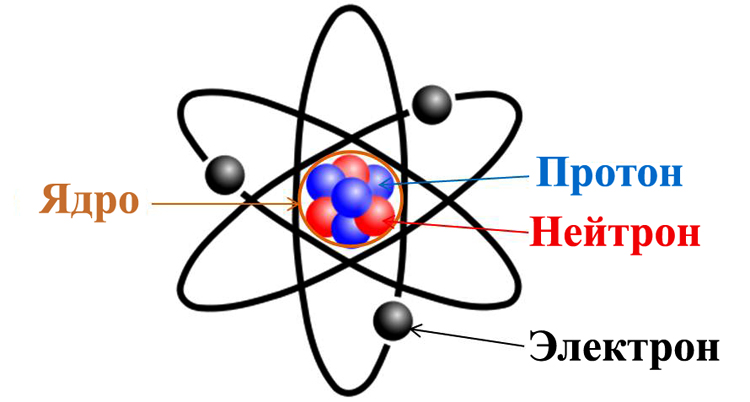
Атом является элементарной частицей вещества. Он имеет свою массу и размер и отвечает за свойства этого вещества, как химического элемента. Атом состоит из ядра и электронов, которые движутся по своим орбитам вокруг ядра. Именно строением атома обуславливаются химические свойства вещества. Атомы не встречаются в свободном состоянии. Они связываются друг с другом и образуют молекулы, благодаря электрическим зарядам частиц, из которых они состоят.
Молекула — это то, из чего состоит вещество. В состав молекул могут входить два и более атомов, которые между собой связаны межатомными связями. Более точно можно сказать так, что молекула состоит из атомных ядер и внутренних электронов, которые движутся по своим орбитам, а также внешних валентных электронов. В разных молекулах находится разное количество атомов определенного вида и разного количества. Молекула имеет сложную архитектурную постройку, где у каждого атома свое место и свои вполне определенные соседи. Свойства молекулы определяется тем, сколько в ней атомов. На эти свойства влияет порядок и конфигурация соединения атомов. Атомная постройка, которая образует молекулу, может быть жесткой, но не во всех случаях. Каждый атом находится в непрерывном движении, он колеблется около своего положения равновесия. При этом свободная молекула в процессе ее теплового движения имеет различные конфигурации. Молекула электрически является нейтральной частицей. Она является наименьшей частицей вещества, которая обладает его химическими свойствами. В случае одноатомных молекул таких, как инертные газы, свойства молекулы и атома совпадают. Атомы в молекуле объединены химическими связями. Такая связь может создаваться одной или несколькими парами электронов, которыми сообща владеют два атома. Молекула может существовать самостоятельно.
Разница между атомом и молекулой
Атомы и молекулы не являются синонимами. Хотя оба понятия относятся к химии и физике и описывают очень маленькую частицу, различия между ними очевидны:
Ключевые различия
Атом состоит из ядра, протонов и нейтронов. Атом — это самая маленькая и неделимая частица, известная человеку. Молекула же является соединением атомов. Примером этого может служить атом кислорода и водорода. Отдельно они не создают никаких молекул, но вместе являются молекулой. Два атома кислорода и один атом водорода дают нам молекулу воды — H2O. То же самое характерно для каждой молекулы. Молекула оксида кальция образована кислородом и кальцием, молекула оксида натрия — кислородом и натрием. Иногда для создания молекулы достаточно двух атомов, иногда требуется больше. Кроме того, атом сохраняет свойства данного элемента и участвует в химических реакциях. Молекула же приобретает новые свойства, характерные для самой себя. Они могут значительно отличаться от свойств атомов, которые её составляют.
Atom — наименьшая частица, известная науке
Молекула состоит из атомов
Atom сохраняет все свойства элемента
Молекула обладает новыми свойствами, являющимися результирующими свойствами компонентных частиц
Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
- Существуют вещества с молекулярным и немолекулярным строением.
- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
- Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
- Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
- Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
- Атомы одного вида отличаются от атомов другого вида массой и свойствами.
- При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
- У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
- У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Дайте ответы на следующие вопросы:
- Назовите имя древнегреческого философа, который высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов.
- Назовите имя великого русского учёного, основоположника учения о молекулах и атомах.
- Дайте определение молекуле.
- Дайте определение атому.
- Какие вещества относят к веществам молекулярного строения? Приведите примеры веществ.
- Какие вещества относят к веществам немолекулярного строения? Приведите примеры веществ.
- Какими свойствами характеризуются веществамолекулярного строения?
- Какими свойствами характеризуются веществанемолекулярного строения?
- Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
1.3.1. Определения понятий атом и молекула
По современным представлениям:
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Неправильно говорить, что «атом – наименьшая частица химического элемента, сохраняющая все его химические свойства», т. к. химический элемент – это вид частиц (атомов, ионов, ядер) с определенным зарядом ядра; поэтому элемент не состоит из атомов!
Кроме того, химические свойства – это энергетика и скорость химической реакции, а они зависят не только от состава реагирующей частицы, но и от ее энергетического состояния, геометрической формы и т. п., потому химическими свойствами обладают не атомы (и молекулы), а их совокупности – химические вещества.
Молекула – это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей, определяющая состав вещества.
Согласно современным представлениям из молекул состоят вещества в газо- и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру (большинство органических веществ; неметаллы, кроме бора, кремния, аллотропных модификаций углерода; углекислый газ СО2; вода Н2О).
Большинство же твердых неорганических веществ не имеет молекулярной структуры: их решетка состоит не из молекул, а из других частиц (ионов, атомов); они существуют в виде макротел (кристалл NaCl, друза кварца, кусок железа и др.). К веществам немолекулярного строения относятся соли, оксиды металлов, алмаз, кремний, металлы и др.
Химическая связь между молекулами у веществ с молекулярной структурой менее прочная, чем между атомами в молекуле, поэтому их температуры плавления и кипения сравнительно низкие. У веществ с немолекулярной структурой химическая связь между частицами весьма прочная, поэтому их температуры плавления и кипения высокие.
1.3.2. Массы атомов и молекул. Моль
Массы атомов и молекул чрезвычайно малы, поэтому для них используют специальную единицу измерения – атомную единицу массы (сокращенное обозначение «а. е. м.»):
1 а. е. м. = 1,66·10 –27 кг.
Например, абсолютная масса атома алюминия:
mo(Al) = 4,482·10 –26 кг = 27 а. е. м.
Чаще используют безразмерные величины – относительные атомные и молекулярные массы.
Относительная атомная масса Ar – число, показывающее, во сколько раз масса данного атома больше 1/12 массы атома углерода 12 С.
Ar(Al) = 
Относительная молекулярная масса Mr – число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода 12 С.
Mr(SO2) = 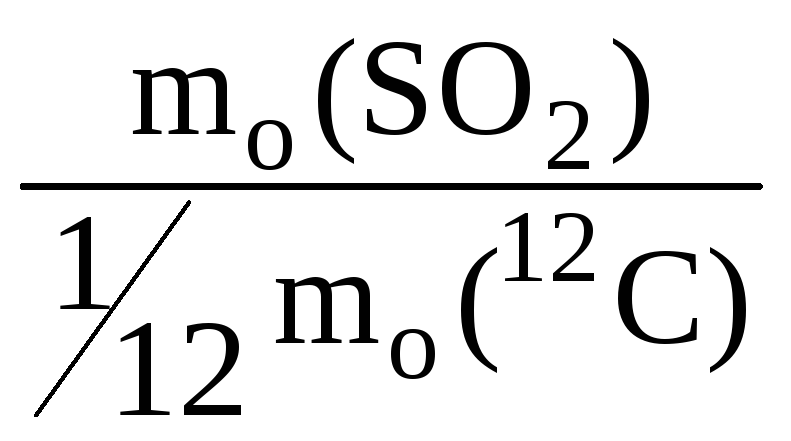
Наряду с единицами массы и объема, в химии пользуются также единицей количества вещества, называемой молем (сокращенное обозначение – «моль»).
Моль – это количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов, ядер, электронов, радикалов), сколько содержится атомов в 0,012 кг (12 г) углерода 12 C.
В одном моле любого вещества содержится число Авогадро структурных единиц, а именно
NA = 6,02·10 23 моль –1 .
Моль вещества имеет определенную массу (молярную массу) и определенный объем (молярный объем).
Молярная (мольная) масса М – это масса 1 моль вещества, выраженная в единицах массы:
Молярный (мольный) объем Vm – объем 1 моль вещества, выраженный в единицах объема:
Пример 1.1. Во время войны во Вьетнаме (1962–1971 гг.) американские войска широко использовали дефолианты в борьбе с партизанами. Дефолиант «agent orange» (оранжевый реактив) вызывает ускоренное опадание листьев деревьев. Всего над джунглями было распылено 57 тыс. т этого препарата, в котором в виде примеси содержалось до 170 кг диоксина. Сейчас этот дефолиант известен под названием 2,4-D (2,4-дихлорфеноуксусная кислота). Рассчитайте массу одной молекулы дефолианта (молекулярная формула С8Н6O3Cl2): а) в граммах; б) в атомных единицах массы.
а). Для расчета массы молекулы 2,4-дихлорфеноуксусной кислоты необходимо знать ее молярную массу:
М(С8Н6O3Cl2) = 8 · 12 + 6 · 1 + 3 · 16 + 2 · 35,5 = 221 (г/моль).
Рассчитываем количество вещества по следующим формулам:
ν = m / M; ν = N / NA,
где m – масса, M – молярная масса, N – число атомов или молекул, NA = 6,02·10 23 моль –1 – постоянная Авогадро.
Объединив эти формулы можно выразить массу через число молекул:
m = ν · M = 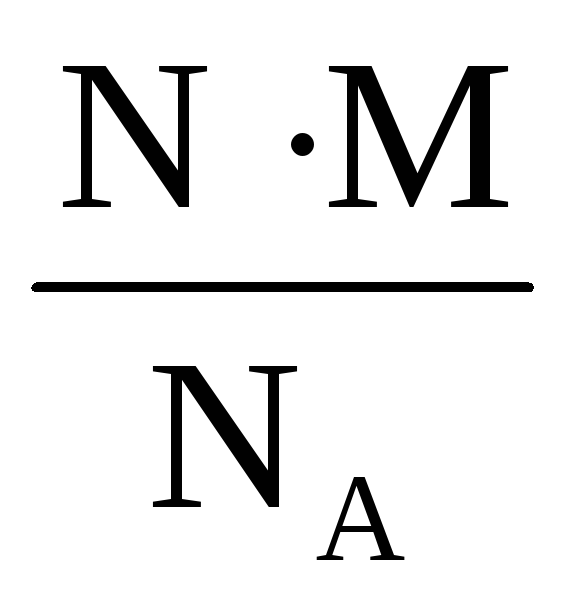
Подставляя в полученную формулу N = 1, M = 221 г/моль, NA, находим:
m(С8Н6O3Cl2) = 
б). Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а. е. м.
Относительная молекулярная масса численно равна молярной массе:
Пример 1.2. Сколько молекул содержится в 1 л воды?
Решение. 1. Массу 1 л воды можно вычислить, используя величину плотности (плотность воды при 4С равна 1 г/см 3 ):
V(H2O) = 1 л = 1 дм 3 = 1000 см 3 ;
m(H2O) = 1000 см 3 · 1 г/см 3 = 1000 г.
2. Дальнейшие рассуждения можно вести двумя способами.
1 способ: по количеству вещества.
Пользуясь формулами ν = m / M и ν = N / NA, находим:
N(H2O) = ν(Н2О) · NA; N(H2O) = 55,6 моль · 6,02·10 23 моль –1 = 334,7·10 23 = 3,35·10 25 .
2 способ: с помощью пропорции.
18 г (1 моль) H2O содержат 6,02·10 23 молекул;
1000 г Н2О содержат N молекул.
N(H2O) = 1000 · 6,02·10 23 / 18 = 3,35·10 25 .
Пример 1.3. Вычислите молярный объем алюминия, если его плотность составляет 2,7 г/см 3 .
Решение. Для вычисления молярного объема через плотность вещества необходимо знать его молярную массу:
ρ(Al) = 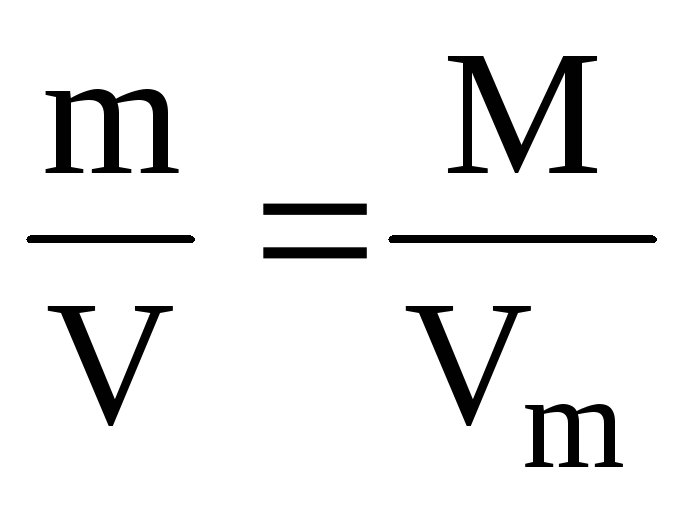
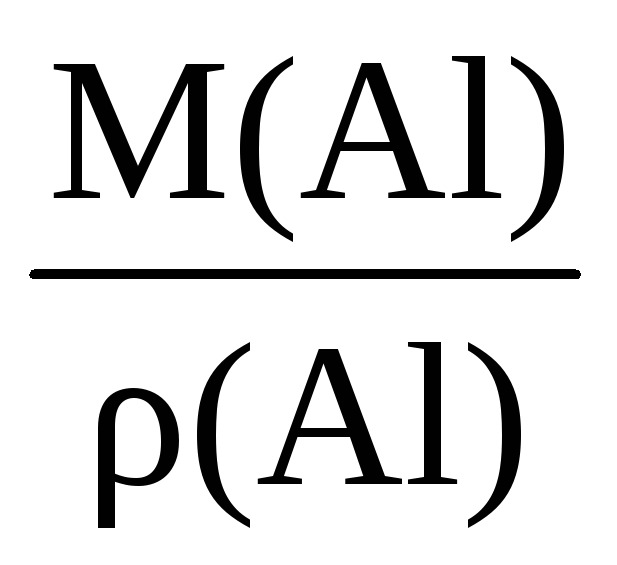
Vm(Al) = 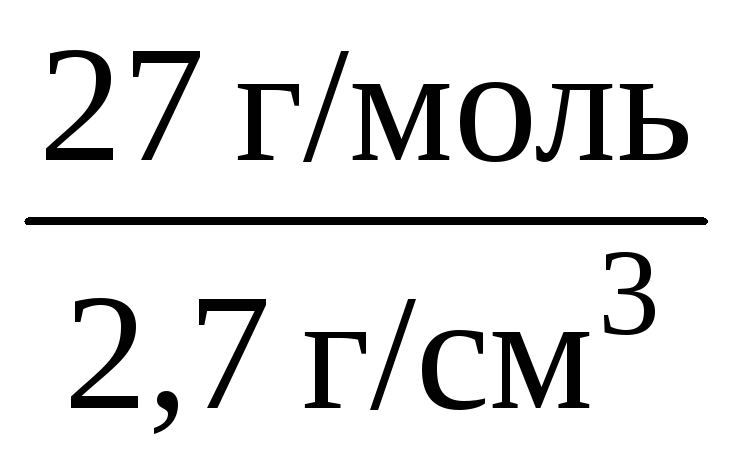
Молекула и атом: что это, что общего и в чем разница
Очень часто можно услышать мнение, что атом будучи составной частью молекулы, обладает теми же свойствами и имеет аналогичную структуру. Такая позиция лишь отчасти имеет право на существование, поскольку частицы имеют общие и отличительные признаки. Для начала достаточно рассмотреть свойства двух объектов, и на их основе делать дальнейшие выводы.
Атом можно рассматривать как элементарную частицу однородного вещества. Такое вещество, по определению, состоит только из одного химического элемента (С, N, O и другие с периодической таблицы Менделеева). Именно наименьшая часть таких элементов, которая может быть носителем их свойств, и называется атомом. Согласно последним современным представлениям, атом состоит из трех составляющих: протонов, нейтронов и электронов.
Первые две субчастицы вместе составляют базовое ядро, которое имеет положительный заряд. Двигающиеся вокруг ядра электроны привносят компенсационный заряд с противоположным знаком. Таким образом, делается первый вывод, что большинство атомов — электрически нейтральны. Что касается оставшейся части, то в силу различных физико-химических процессов, атомы могут либо присоединять, либо отпускать электроны, что приводит к появлению заряда. Атом имеет массу и размер (определяется размерами ядра) и определяет химические свойства вещества.
Молекула является минимальной структурной единицей вещества. Такое вещество может состоять из нескольких химических элементов. Однако, молекулой можно считать и одноатомное вещество одного химического элемента — инертный газ аргона. Как и атомы, является электрически нейтральной. Ионизировать молекулу можно, но уже значительно сложнее: атомы внутри молекулы связаны между собой ковалентной, либо ионной связью. Поэтому присоединить или забрать электрон становится значительно сложнее. Большинство молекул имеет сложную архитектурную постройку, где каждый атом заранее занимает отведенное ему место.
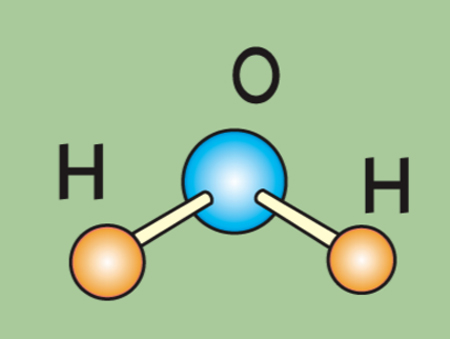
Строение молекулы воды
Атом и молекула: общие свойства
Строение. Обе частицы являются структурными единицами вещества. При этом под атомом подразумевается один определенный элемент, молекула же включает в себя уже несколько химически связанных атомов, но структура (положительное ядро с отрицательными электронами) остается той же.
Электрическая нейтральность. При отсутствии внешних факторов — взаимодействия с другим химическим веществом, направленного электрического поля и других раздражителей, — атомы и молекулы не имеют заряда.
Замещение. Атом может выступать как молекула в одном случае — при работе с инертными газами. Также молекулой может считаться одноатомная ртуть.
Наличие массы. Обе частицы имеют свою четкую массу. В случае атома масса зависит от химического элемента и определяется весом ядра (протон почти в 1500 раз тяжелее электрона, поэтому вес отрицательной частицы часто не берется во внимание). Масса молекулы определяется исходя из ее химической формулы — элементов, входящих в ее состав.
Атом и молекула: отличные свойства
Неделимость. Атом является мельчайшим элементом, из которого нельзя выделить еще меньшую частицу. (Получение иона влияет только на заряд, но не на вес). Молекулу, в свою очередь, можно разделить на более мелкие молекулы или можно разложить на атомы. Процесса распада легко добиться с использованием химических катализаторов. Иногда достаточно просто нагреть вещество.
Свободное существование. Молекула может свободно существовать в природе. Атом существует в вольной форме лишь в двух случаях:
- Как одноатомная ртуть или инертный газ.
- В условиях космоса — как отдельные атомы могут находиться любые химические элементы.
В остальных случаях атом всегда входит в состав молекулы.
Образование заряда. Взаимодействие между ядром и электроном в атоме можно легко преодолеть даже мельчайшим электрическим полем. Таким образом, — из атома легко получить положительный или отрицательный ион. Наличие химических связей между атомами внутри молекулы требует приложения гораздо большего электрического поля или взаимодействия с другим химически активным веществом.
Какие Атомы и молекулы-Definition[Разница между атомами и молекулами]
Возникает много раз вопроса, какие атомы и молекулы, Определение, В чем разница между атомами и молекулами, Молекула соединения и элемента. Давайте начнем обсуждать с примером.
Все дома выполнены из кирпича. Таким же образом, Атомы и молекулы являются строительными блоками материи. Атом является маленькой частицей, когда группа вместе образует молекулу. по аналогии, группа молекул одинакового или различного рода сочетает в себе, чтобы сформировать дело.
Все атомы настолько малы, что мы не можем видеть даже при очень мощном оптическом микроскопе. Электронный микроскоп может произвести чрезвычайно увеличенное изображение крошечного объекта. Самый продвинутый тип электронного микроскопа и его названия сканирующего туннельного микроскопа (STM). Этот микроскоп может производить компьютерные изображения, которые показывают в визуальных.
- Атом водорода является наименьшим из всех атомов.
Какие Атомы и молекулы-Definition
| Атомы наименьшая частица элемента, который может принимать участие в химической реакции. Это может или не может быть способно к самостоятельному существованию. |
Например, атомы водорода не способны к независимому существованию, а атомы неона газа способны к независимому существованию.
- Это очень и очень малы по размеру. Это идея о 35 рупий атом меди покрывают расстояние 1 см.
- Размер атома указывает на атомный радиус.
- Единицы атомного радиуса являются нанометра. Один нанометр является очень небольшой единицей измерения длины.
- Атом имеет свойство элемента.
- Его суб-частица Электроны протонах и нейтронах.
молекула
| Это наименьшая частица вещества (элемент или соединение,) которая способна к независимому существованию. |
Разница между атомами и молекулами
| атомы | Молекулы |
| Атом в наименьшей частицей элемента которые могут принимать участие в химических изменениях. | Молекула является наименьшим частица вещества (элемент или соединение,). |
| Это может или не может быть способен к независимому существованию. | Она способна к независимому существованию. |
| Он может быть разбит на еще более мелкие фрагменты, такие как электроны, протоны & нейтроны. Но атом является наименьшей единицей для химической реакции. | Молекула может содержать один, два или более атома. для одноатомных молекул, кроме(ЧАС2, Cl2), другие могут быть разделены на атомы составляющих. |
| Примеры – O (кислород), N (азот), S (сера) | Примеры – вода (ЧАС2 O ), Углекислый газ (Колорадо2), Сероводород (ЧАС2S) |
Как Атомы и молекулы, относящиеся?
Молекулы, как правило, состоит из двух или более атомов одинаковых или различных элементов. Таким образом, молекулы из двух типов: Молекула элемента, Молекула соединения.
Молекула Элемента
Молекула элемент содержит два или более атомов одного и того же элемента. Например, молекула водорода(ЧАС2) состоит из двух атомов водорода. Такие молекулы, как термин двухатомных молекул. Другие примеры двухатомных молекул Cl2, O 2, N2. С другой стороны, озон( O 3) содержит три кислорода и являются трехатомными молекулами.
Можно отметить, что молекулы благородные газы такие как гелий, неон, аргон, криптон, и ксенона одноатомные молекулы. Это происходит потому, что каждый из этих газов содержит только один атом.
- Число атомов в молекуле элемента называется его атомарность.
Молекула соединения
Молекула соединения содержит два или более атомов различных элементов. Например, молекула хлористого водорода (HCl) содержит один атом водорода и один атом хлора. Так как молекула хлористого водорода содержит два атома, он также называется двухатомной молекулы. С другой стороны, вода (ЧАС2 O ) содержит два атома водорода и один атом кислорода. Молекула, содержащая более трех атомов, называется многоатомной молекулой. Это может Следует отметить, что молекулы некоторых из натуральных продуктов являются довольно сложными и содержат очень большое число атомов. Например, молекула сахарного тростника (С12ЧАС22 O 11) содержит 45 атомы.
Это все об основах какие атомы и молекулы, Определение, Разница между атомами и молекулами, Молекула соединения и Molecule элемента.
Если вы хотите чувствовать себя свободно делиться с другими.
Современное изложение основных положений атомно-молекулярного учения:
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, при химических — разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Строение и свойства молекул
Все тела, которые нас окружают, состоят из атомов. Атомы, в свою очередь, собираются в молекулу. Именно благодаря различию в молекулярном строении, можно говорить об отличных друг от друга веществах, опираясь на их свойства и параметры. Молекулы и атомы всегда находятся в состоянии динамики. Двигаясь, они все же не разбегаются в разные стороны, а удерживаются в определенной структуре, чем мы обязаны существованию такого огромного разнообразия веществ во всем окружающем нас мире. Что же это за частички и каковы их свойства?
Общие понятия
Если отталкиваться от теории квантовой механики, то молекула состоит не из атомов, а их ядер и электронов, которые постоянно взаимодействуют между собой.
Для некоторых веществ молекула – это наименьшая частица, имеющая состав и химические свойства самой субстанции. Так, свойства молекул с точки зрения химии определяются ее химическим строением и составом. Но только для веществ с молекулярным строением работает правило: химические свойства веществ и молекул одинаковы. Для некоторых полимеров, например, этилена и полиэтилена, состав не соответствует молекулярному.
Известно, что свойства молекул определяются не только количеством атомов, их типом, но и конфигурацией, порядком соединения. Молекула – это сложная архитектурная постройка, где каждый элемент стоит на своем месте и имеет своих конкретных соседей. Атомная структура может быть более или менее жесткой. Каждый атом совершает колебание относительно своего равновесного положения.
Конфигурация и параметры
Бывает, что некоторые части молекулы совершают вращение по отношению к другим частям. Так, в процессе теплового движения свободная молекула обретает причудливые формы (конфигурации).
В основном свойства молекул определяются связью (ее типом) между атомами и архитектурой самой молекулы (структурой, формой). Таким образом, в первую очередь общая химическая теория рассматривает химические связи и основывается на свойствах атомов.
При сильно выраженной полярности свойства молекул трудно описать двух- или трехконстантными корреляциями, которые отлично подходят для неполярных молекул. Поэтому был введен дополнительный параметр с дипольным моментом. Но такой способ не всегда успешен, так как полярные молекулы имеют индивидуальные характеристики. Также были предложены параметры для учета квантовых эффектов, имеющие важность при низких температурах.
Что мы знаем о молекуле самого распространенного вещества на Земле?
Из всех веществ на нашей планете, самое распространенное – это вода. Она, в прямом смысле, обеспечивает жизнь всему сущему на Земле. Только вирусы могут без нее обойтись, остальные живые структуры в своем составе по большей части имеют воду. Какие свойства молекулы воды, характерные только ей, используются в хозяйственной жизни человека и живой природе Земли?
Ведь это поистине уникальная субстанция! Набором свойств, присущих воде, не может похвастаться больше ни одно вещество.
Вода — это основной растворитель в природе. Все реакции, протекающие в живых организмах, так или иначе происходят в водной среде. То есть вещества вступают в реакции, находясь в растворенном состоянии.
Вода обладает отличной теплоемкостью, но низкой теплопроводностью. Благодаря таким свойствам мы можем использовать ее в качестве транспортировки тепла. Этот принцип входит в механизм охлаждения большого числа организмов. В атомной энергетике свойства молекулы воды послужили поводом для использования этого вещества в качестве теплоносителя. Помимо возможности быть реактивной средой для других веществ, вода сама может вступать в реакции: фотолиз, гидратацию и другие.
Природная чистая вода – это жидкость, не имеющая запаха, цвета и вкуса. Но на толщине слоя, большем чем 2 метра, цвет становится голубоватым.
Вся молекула воды – это диполь (два разноименных полюса). Именно дипольная структура в основном определяет необычные свойства этого вещества. Молекула воды является диамагнетиком.
Еще одним интересным свойством обладает талая вода: ее молекула приобретает строение золотой пропорции, а структура вещества – пропорции золотого сечения. Многие свойства, которыми обладает молекула воды, установлены с помощью анализа поглощения и испускания полосатых спектров в газовой фазе.
Естествознание и молекулярные свойства
Все вещества, кроме химических, имеют физические свойства молекул, входящих в их структуру.
В физической науке понятие молекул используют для объяснения свойств твердых тел, жидкостей и газов. Способность всех веществ к диффузии, их вязкость, теплопроводность и другие свойства определяются подвижностью молекул. Когда французский ученый-физик Жан Перрен изучал броуновское движение, он экспериментально доказал существование молекул. Все живые организмы существуют благодаря тонко сбалансированному внутреннему взаимодействию в структуре. Все химические и физические свойства веществ имеют фундаментальное значение для естествознания. Развитие физики, химии, биологии и молекулярной физики послужило возникновению такой науки, как молекулярная биология, исследующая основные явления в жизни.
Используя статистическую термодинамику, физические свойства молекул, которые определяют методами молекулярной спектроскопии, в физической химии определяют термодинамические свойства веществ, необходимые для расчета химических равновесий и скоростей его установления.
Чем отличаются свойства атомов и молекул между собой?
Прежде всего, атомы не встречаются в свободном состоянии.
У молекул оптические спектры более богаты. Это связано с меньшей симметрией системы и с появлением возможности новых вращений и колебаний ядер. У молекулы суммарная энергия складывается из трех энергий, отличных по порядку величин составляющих:
- электронной оболочки (оптическое или ультрафиолетовое излучение);
- колебания ядер (инфракрасная часть спектра);
- вращения молекулы в целом (радиочастотный диапазон).
Атомы излучают характерные линейчатые спектры, а молекулы – полосатые, состоящие из множества близко расположенных линий.
Спектральный анализ
Оптические, электрические, магнитные и другие свойства молекулы определяются еще и связью с волновыми функциями. Данные о состояниях молекул и вероятном переходе между ними показывают молекулярные спектры.
Переходы (электронные) в молекулах показывают химические связи и структуру их электронных оболочек. Спектры, имеющие большее количество связей, имеют длинноволновые полосы поглощения, попадающие в видимую область. Если вещество построено из таких молекул, оно имеет характерную окраску. Это все органические красители.
Свойства молекул одной и той же субстанции являются одинаковыми во всех агрегатных состояниях. Это значит, что у одних и тех же веществ свойства молекул жидких, газообразных субстанций не отличаются от свойств твердого. Молекула одного вещества всегда имеет одинаковую структуру, независимо от агрегатного состояния самого вещества.
Электрические характеристики
То, как вещество ведет себя в электрическом поле, определяется электрическими характеристиками молекул: поляризуемостью и постоянным дипольным моментом.
Дипольный момент – это электрическая асимметрия молекулы. У молекул, которые имеют центр симметрии, как H2, нет постоянного дипольного момента. Способность электронной оболочки молекулы перемещаться под воздействием электрического поля, в результате которого в ней образуется наведенный дипольный момент, – это поляризуемость. Чтобы найти значение поляризуемости и дипольного момента, необходимо измерить диэлектрическую проницаемость.
Поведение в переменном электрическом поле световой волны характеризуют оптические свойства вещества, которые определяются поляризуемостью молекулы этой субстанции. Непосредственно с поляризуемостью связаны: рассеяние, преломление, оптическая активность и другие явления молекулярной оптики.
Часто можно услышать вопрос: «От чего, кроме молекул, зависят свойства вещества?» Ответ на него достаточно прост.
Свойства веществ, кроме изометрии и кристаллической структуры, определяются температурой окружающей среды, самой субстанции, давлением, наличием примесей.
Химия молекул
До формирования такой науки, как квантовая механика, природа химических связей в молекулах была нераскрытой тайной. Классическая физика объяснить направленность и насыщаемость валентных связей не могла. После создания базовых теоретических сведений о химической связи (1927 г.) на примере простейшей молекулы Н2, теория и методы расчёта стали постепенно совершенствоваться. К примеру, на основе широкого применения метода молекулярных орбиталей, квантовой химии, стало возможным вычислять межатомные расстояния, энергию молекул и химических связей, распределение электронной плотности и других данных, которые вполне совпадали с экспериментальными.
Вещества с одинаковым составом, но разным химическим строением и разными свойствами, называются структурными изомерами. У них разные структурные формулы, но одинаковые молекулярные.
Известны различные типы структурной изомерии. Различия заключаются в строении углеродного скелета, положении функциональной группы или положении кратной связи. Кроме того, еще существуют пространственные изомеры, у которых свойства молекулы вещества характеризуются одинаковым составом и химическим строением. Поэтому и структурные, и молекулярные формулы у них одинаковые. Отличия заключаются в пространственной форме молекулы. Для изображения разных пространственных изомеров используют специальные формулы.
Есть соединения, которые называются гомологами. Они похожи по строению и свойствам, но отличаются по составу на одну или несколько групп СН2. Все вещества, похожие по строению и свойствам, объединены в гомологические ряды. Изучив свойства одного гомолога, можно рассуждать о любом другом из них. Совокупность гомологов – это гомологический ряд.
При преобразованиях структур вещества химические свойства молекул резко меняются. Примером служат даже простейшие соединения: метан, соединяясь даже с одним атомом кислорода, становится ядовитой жидкостью с названием метанол (метиловый спирт – СН3ОН). Соответственно, его химическая комплементарность и действие на живые организмы становятся другими. Аналогичные, но более сложные изменения, происходят при модификации структур биомолекул.
Химические молекулярные свойства сильно зависят от строения и свойств молекул: от энергетических связей в ней и геометрии самой молекулы. Особенно это работает в биологически активных соединениях. Какая конкурирующая реакция окажется преобладающей, часто определяется только пространственными факторами, зависящими, в свою очередь, от исходных молекул (их конфигурации). Одна молекула, имеющая «неудобную» конфигурацию, вообще не вступит в реакцию, а другая, с таким же химическим составом, но другой геометрией, может среагировать на реакцию мгновенно.
Большое число биологических процессов, наблюдающихся при росте и размножении, связано с геометрическими соотношениями между продуктами реакции и исходными веществами. К сведению: действие немалого количества новых лекарств основывается на аналогичном строении молекул какого-либо соединения, вредного с биологической точки зрения для человеческого организма. Лекарство занимает место вредоносной молекулы и затрудняет ее действие.
С помощью химических формул выражают состав и свойства молекул разных веществ. На основании молекулярной массы, химического анализа устанавливается атомное соотношение и составляется эмпирическая формула.
Определение геометрической структуры молекулы производится с учетом равновесного расположения атомных ядер. От расстояния между ядрами атомов зависит энергия взаимодействия атомов. При очень больших расстояниях эта энергия нулевая. При сближении атомов начинает формироваться химическая связь. Тогда атомы сильно притягиваются друг к другу.
Если наблюдается слабое притяжение, то образование химической связи при этом не обязательно. Если атомы начинают сближаться на более близкие расстояния, между ядрами начинают действовать электростатические силы отталкивания. Препятствием для сильного сближения атомов является несовместимость их внутренних электронных оболочек.
Невооруженным глазом увидеть молекулы невозможно. Они так малы, что даже микроскоп с 1000-кратным увеличением нам не поможет их разглядеть. Биологи наблюдают бактерии размером 0,001 мм. Но молекулы в сотни и тысячи раз меньше их.
Сегодня строение молекул некой субстанции определяют дифракционными методами: дифракцией нейтронов, рентгеноструктурным анализом. Также существует колебательная спектроскопия и электронный парамагнитный метод. Выбор метода зависит от типа вещества и его состояния.
Размер молекулы — это условная величина, если учитывать электронную оболочку. Дело в расстояниях электронов от атомных ядер. Чем они больше, тем вероятность найти электроны молекулы меньше. На практике размер молекул можно определить, учитывая равновесное расстояние. Это тот промежуток, на который сами молекулы могут сблизиться при плотной упаковке в молекулярном кристалле и в жидкости.
Большие расстояния располагают молекулы к притяжению, а малые, наоборот, к отталкиванию. Поэтому рентгеноструктурный анализ молекулярных кристаллов помогает найти размеры молекулы. Используя коэффициент диффузии, теплопроводности и вязкости газов, а также плотности вещества в конденсированном состоянии, можно определить порядок величины молекулярных размеров.
Атомно-молекулярное учение. Химические элементы
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М.В.Ломоносов. Основные положения этого учения изложены в работе «Элементы математической химии» (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Через 67 лет после Ломоносова атомистическое учение в химии применил английский ученый Джон Дальтон. Он изложил основные положения атомистики в книге «Новая система химической философии» (1808). В своей основе учение Дальтона повторяет учение Ломоносова. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в. На международном съезде химиков г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям:
Атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.
Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Большинство же твердых неорганических веществ не имеет молекулярной структуры: их решетка состоит не из молекул, а из других частиц (ионов, атомов); они существуют в виде макротел (кристалл хлорида натрия, кусок меди и др.). Не имеют молекулярной структуры соли, оксиды металлов, алмаз, кремний, металлы.
Атомно-молекулярное учение позволило объяснить основные понятия и законы химии. С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов. Важнейшей характеристикой атома является положительный заряд его ядра, численно равный порядковому номеру элемента. Значение заряда ядра служит отличительным признаком для различных видов атомов, что позволяет дать более полное определение понятия элемента:
Химический элемент — это определенный вид атомов с одинаковым положительным зарядом ядра.
Известно 107 элементов. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы обычно делят на металлы и неметаллы . Однако это деление условно. Важной характеристикой элементов является их распространенность в земной коре, т.е. в верхней твердой оболочке Земли, толщина которой принята условно равной 16 км. Распределение элементов в земной коре изучает геохимия — наука о химии Земли. Геохимик А.П.Виноградов составил таблицу среднего химического состава земной коры. Согласно этим данным самым распространенным элементом является кислород — 47,2% массы земной коры, затем следует кремний — 27,6, алюминий — 8,80, железо -5,10, кальций — 3,6, натрий — 2,64, калий — 2,6, магний — 2,10, водород — 0,15%.
Атомно-молекулярное учение
Ведущей идеей атомно-молекулярного учения, составляющего фундамент современной физики, химии и естествознания, является идея дискретности (прерывности строения) вещества.
Первые представления о том, что вещество состоит из отдельных неделимых частиц, появились в глубокой древности и поначалу разрабатывались в русле общих философских представлений о мире. Например, некоторые философские школы Древней Индии (I тыс. до н. э.) признавали не только существование первичных неделимых частиц вещества (ану), но и их способность соединяться друг с другом, образуя новые частицы. Аналогичные учения существовали и в других странах древнего мира. Наибольшую известность и влияние на последующее развитие науки оказала древнегреческая атомистика, создателями которой были Левкипп (V в. до н. э.) и Демокрит (р. ок. 460 до н. э. — ум. ок. 370 до н. э.). «Причинами всех вещей,— писал древнегреческий философ и ученый Аристотель (384–322 до н. э.), излагая демокритовское учение,— являются определенные различия в атомах. А различий этих три: форма, порядок и положение». В работах самого Аристотеля встречается важное понятие о миксисе — однородном соединении, образованном из различных веществ. Позднее древнегреческий философ-материалист Эпикур (342–341 до н. э. — 271–270 до н. э.) ввел понятие о массе атомов и их способности к самопроизвольному отклонению во время движения.
Важно отметить, что, по мысли многих древнегреческих ученых, сложное тело — это не простая смесь атомов, а качественно новое целостное образование, наделенное новыми свойствами. Однако у греков еще не выработалось понятие об особых «многоатомных» частицах — молекулах, промежуточных между атомами и сложными телами, которые были бы мельчайшими носителями свойств тел.
В средние века наблюдалось резкое ослабление интереса к античному атомизму. Церковь обвиняла древнегреческие философские учения в утверждении того, что мир возник из случайных сочетаний атомов, а не по воле божьей, как того требовала христианская догма.
В XVI–XVII вв. в обстановке общекультурного и научного подъема начинается возрождение атомизма. В этот период передовые ученые разных стран: Г. Галилей (1564–1642) в Италии, П. Гассенди (1592–1655) во Франции, Р. Бойль (1627–1691) в Англии и другие — провозгласили принцип: не искать истину в Священном писании, а «непосредственно» читать книгу природы
П. Гассенди и Р. Бойлю принадлежит главная заслуга в дальнейшей разработке античной атомистики. Гассенди ввел понятие о молекуле, под которой он понимал качественно новое образование, составленное путем соединения нескольких атомов. Широкую программу создания корпускулярной философии природы предложил Р. Бойль. Мир корпускул, их движение и «сплетение», по мысли английского ученого, весьма сложны. Мир в целом и его мельчайшие частицы — это целесообразно устроенные механизмы. Корпускулы Бойля — это уже не первичные недробимые атомы античных философов, а сложное целое, способное менять свое строение путем движения.
«С тех пор, как я прочитал Бойля,— писал М. В. Ломоносов,— мною овладело страстное желание исследовать мельчайшие частицы». Великий русский ученый М. В. Ломоносов (1711–1765) развил и обосновал учение о материальных атомах и корпускулах. Он приписывал атомам не только неделимость, но и активное начало — способность к движению и взаимодействию. «Нечувствительные частицы должны различаться массою, фигурою, движением, силою инерции или расположением». Корпускулы однородных тел, по Ломоносову, «состоят из одинакового числа одних и тех же элементов, соединенных одинаковым образом… Корпускулы разнородны, когда элементы их различны или соединены различным образом или в различном числе». Лишь потому, что изучение массовых отношений в начале XVIII в. только начиналось, Ломоносов не смог создать количественное атомно-молекулярное учение.
Это сделал английский ученый Д. Дальтон (1766–1844). Он рассматривал атом как мельчайшую частицу химического элемента, отличающуюся от атомов других элементов прежде всего массой. Химическое соединение, по его учению, представляет собой совокупность «сложных» (или «составных») атомов, содержащих определенные, характерные лишь для данного сложного вещества количества атомов каждого элемента. Английский ученый составил первую таблицу атомных масс, но в силу того, что его представления о составе молекул зачастую опирались на произвольные допущения, основанные на принципе «наибольшей простоты» (например, для воды он принял формулу ОН), эта таблица оказалась неточной.
В 1808 г. французский ученый Ж. Л. Гей-Люссак (1778–1850) сформулировал закон, согласно которому объемы реагирующих газов относятся друг к другу как небольшие целые числа. Однако Дальтон полагал, что в реакциях между газообразными простыми веществами участвуют атомы этих веществ, и считал на том основании, что, например, из одного объема азота и одного объема кислорода должен образовываться только один объем оксида азота (NO): N + O → NO, а не два, как экспериментально установил Гей-Люссак.
В 1811 г. итальянский ученый А. Авогадро (1776–1856) дополнил атомно-молекулярное учение двумя гипотезами, впоследствии полностью подтвердившимися:
1) в равных объемах различных газов при одинаковых температуре и давлении находится одинаковое число молекул;
2) молекулы простых газов содержат четное число атомов, как правило, равное двум.
Открытие Авогадро давало в руки химиков простой и правильный метод определения молекулярных масс: отношение молекулярных масс двух газов равно отношению их плотностей. Но к сожалению, число атомов в молекулах простых газов и паров Авогадро не конкретизировал, да и не мог этого сделать, что почти на 40 лет задержало признание его идей химиками, хотя многие ученые, как, например, французский физик А. Ампер (1775–1836), высказывали уже аналогичные мысли. Только к началу 1840‑х гг. появились химические доказательства двухатомности молекул водорода, кислорода, азота, галогенов.
Кроме того, в первой половине XIX в. многие химики не верили в возможность определения истинных атомных масс и предпочитали пользоваться эквивалентами, которые можно было найти экспериментально. Поэтому одному и тому же соединению приписывались разные формулы, а это вело к установлению неправильных атомных и молекулярных масс.
Одними из первых, кто начал борьбу за реформу теоретической химии, были французские ученые Ш. Жерар (1816–1856) и О. Лоран (1807–1853), которые создали правильную систему атомных масс и химических формул. В 1856 г. русский ученый Д. И. Менделеев (1834–1907), а затем независимо от него итальянский химик С. Канниццаро (1826 — 1910) предложили метод вычисления молекулярной массы соединений по удвоенной плотности их паров относительно водорода. К 1860 г. этот метод определился в химии, что имело решающее значение для утверждения атомно-молекулярной теории. В своем выступлении на Международном конгрессе химиков в Карлсруэ (1860) Канниццаро убедительно доказал правильность идей Авогадро, Жерара и Лорана, необходимость их принятия для верного определения атомных и молекулярных масс и состава химических соединений. Благодаря работам Лорана и Канниццаро химики осознали различие между той формой, в которой элемент существует и вступает в реакции (например, для водорода это H2), и той формой, в которой он присутствует в соединении (HCl, H2O, NH3 и т. д.). В итоге конгрессом были приняты следующие определения атома и молекулы: молекула — «количество тела, вступающее в реакции и определяющее химические свойства»; атом — «наименьшее количество элемента, входящее в частицы (молекулы) соединений». Было также принято предложение считать понятие об «эквиваленте» эмпирическим, не совпадающим с понятиями «атом» и «молекула».
Установленные С. Канниццаро атомные массы послужили Д. И. Менделееву основой при открытии периодического закона химических элементов. Решения конгресса благотворно повлияли на развитие органической химии, ибо установление формул соединений открыло путь для создания структурной химии.
Таким образом, к началу 1860‑х гг. атомно-молекулярное учение сформировалось в виде следующих положений.
1. Вещества состоят из молекул. Молекулой называется наименьшая частица вещества, обладающая его химическими свойствами. Многие физические свойства вещества — температуры кипения и плавления, механическая прочность, твердость и т. д. — обусловлены поведением большого числа молекул и действием межмолекулярных сил.
2. Молекулы состоят из атомов, которые соединяются друг с другом в определенных отношениях (см. Молекула; Химическая связь; Стехиометрия).
3. Атомы и молекулы находятся в постоянном самопроизвольном движении.
4. Молекулы простых веществ состоят из одинаковых атомов (O2, O3, P4, N2 и т. д.); молекулы сложных веществ — из разных атомов (H2O, HCl).
5. В ходе химических реакций происходит изменение состава молекул и перегруппировка атомов, в результате чего образуются молекулы новых химических соединений.
6. Свойства молекул зависят не только от их состава, но и от способа, которым атомы связаны друг с другом (см. Теория химического строения; Изомерия).
Современная наука развила классическую атомно-молекулярную теорию, а некоторые её положения были пересмотрены.
Было установлено, что атом не является неделимым бесструктурным образованием. Об этом, впрочем, догадывались и многие ученые в прошлом веке.
Выяснилось, что далеко не во всех случаях частицы, образующие вещество, представляют собой молекулы. Многие химические соединения, особенно в твердом и жидком состоянии, имеют ионную структуру, например соли. Некоторые вещества, например инертные газы, состоят из отдельных атомов, слабо взаимодействующих между собой даже в жидком и твердом состояниях. Кроме того, вещество может состоять из частиц, образованных путем объединения (ассоциации) нескольких молекул. Так, химически чистая вода образована не только отдельными молекулами H2O, но и полимерными молекулами (H2O)n, где n = 2–16; одновременно в ней присутствуют гидратированные ионы H + и OH − . Особую группу соединений составляют коллоидные растворы. И наконец, при нагревании до температур порядка тысяч и миллионов градусов вещество переходит в особое состояние — плазму, которая представляет собой смесь атомов, положительных ионов, электронов и атомных ядер.
Оказалось, что количественный состав молекул при одинаковом качественном составе может меняться иногда в широких пределах (например, оксид азота может иметь формулу N2O, NO, N2O3, NO2, N2O4, N2O5, NO3), при этом, если рассматривать не только нейтральные молекулы, но и молекулярные ионы, то границы возможных составов расширяются. Так, молекула NO4 неизвестна, но недавно был открыт ион NO 3− 4 ; не существует молекулы CH5, но известен катион CH + 5 и т. д.
Были открыты так называемые соединения переменного состава, в которых на единицу массы данного элемента приходится различная масса другого элемента, например: Fe0,89–0,95O, TiO0,7–1,3 и т. д.
Было уточнено положение о том, что молекулы состоят из атомов. Согласно современным квантово-механическим представлениям (см. Квантовая химия), у атомов в молекуле более или менее неизменным остается только остов, т. е. ядро и внутренние электронные оболочки, тогда как характер движения внешних (валентных) электронов коренным образом изменяется так, что образуется новая, молекулярная электронная оболочка, охватывающая всю молекулу (см. Химическая связь). В этом смысле никаких неизменных атомов в молекулах нет.
Принимая во внимание эти уточнения и дополнения, следует иметь в виду, что современная наука сохранила рациональное зерно классического атомно-молекулярного учения: идеи о дискретном строении вещества, о способности атомов давать посредством соединения друг с другом в определенном порядке качественно новые и более сложные образования и о непрерывном движении частиц, составляющих вещество.
- http://v-chem-raznica.ru/raznica-mezhdu-atomom-i-molekuloy
- http://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no6-atomy-i-molekuly-atomno-molekularnoe-ucenie-vesestva-molekularnogo-i-nemolekularnogo-stroenia
- http://studfiles.net/preview/5797038/page:4/
- http://vchemraznica.ru/molekula-i-atom-chto-eto-chto-obshhego-i-v-chem-raznica/
- http://googlegalaxyscience.com/atom-and-molecules/?lang=ru
- http://examchemistry.com/content/lesson/osnovnyepon/amu.html
- http://fb.ru/article/353690/stroenie-i-svoystva-molekul
- http://www.himhelp.ru/section23/section1/section2cdty/
- http://yunc.org/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D0%BE-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B5_%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D0%B5