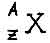С точки зрения теории строения атома, элементы в периодической системе расположены в последовательности увеличения зарядов их ядер, Внутри каждого периода по мере возрастания зарядов ядер элементов последовательно изменяется структура внешних электронных уровней. С этим связан переход элементов от металлов к неметаллам. В периодах слева направо, с увеличением зарядов ядер элементов, усиливается притяжение электронов к ядру и происходит сжатие атома, т. е. уменьшение атомного радиуса элементов. Поэтому в начале каждого периода располагаются элементы, имеющие больший атомный радиус и меньшее число электронов на внешнем электронном слое. Чем больше атомный радиус, тем слабее притяжение электронов внешнего слоя и тем легче элементу отдавать электроны. Такая структура характерна для элементов — металлов, которые сравнительно легко отдают валентные электроны, но не могут принимать их дополнительно для достройки электронных оболочек внешнего уровня.
С увеличением атомного номера элементов увеличивается заряд ядра и число электронов во внешнем слое и уменьшается легкость отдачи электронов с этого слоя. Таким образом, внутри каждого периода с увеличением атомных номеров элементов наблюдается уменьшение металлических свойств элементов и возрастание неметаллических свойств (способность притягивать к себе электроны). Каждый период заканчивается инертным элементом, имеющим завершенную структуру внешнего электронного слоя (полный октет).
Устойчивость такого октета объясняет пассивность инертных элементов, что не позволяет причислить их к металлам или неметаллам. В группах расположены элементы, имеющие одинаковое строение внешнего электронного слоя, т. е. электронные аналоги. Номер группы указывает число электронов на внешней электронной оболочке атомов элементов данной группы. Элементы, находящиеся в одной группе проявляют близкие химические свойства. Однако и внутри группы свойства элементов изменяются. Это связано с тем, что внутри каждой группы сверху вниз у элементов увеличивается число электронных слоев, т. е. атомный радиус. Чем больше атомный радиус, тем дальше от ядра электроны внешнего слоя и тем слабее они удерживаются ядром.
Таким образом, в группах сверху вниз усиливаются металлические и уменьшаются неметаллические свойства. В периодической таблице группы делятся на два типа: 8 групп IA- VIIIA и 8 групп IB- VIIIB. Группа VIIIB состоит из триад. В группах IА и IIA находятся s-элементы, у них последним заполняется электронами s-подуровень внешнего уровня. Далее, согласно правилам Клечковского, для элементов с главным квантовым числом n= 2 и n= 3 (второй и третий период) происходит заполнение р- подуровня. Это р- элементы, они располагаются в группах IIIA- VIIIA. Для элементов IV и V периода после заполнения электронами s- подуровня энергетически более выгодно заполнение соответственно 3d- и 4d- поуровней, что и происходит у элементов групп IB- VIIIB.
Группы типа В расположены в порядке, указывающем число валентных электронов атомов элементов, так как у d- элементов валентными являются электроны не только внешнего уровня, но и заполняемого второго снаружи уровня. После полного заполнения d- электронами второго снаружи уровня, происходит заполнение р- подуровня последнего электронного уровня (группы IIIA- VIIIA).
У актиноидов и лантаноидов происходит заполнение электронами f- подуровня третьего снаружи энергетического уровня, что и обуславливает схожесть их химических свойств.
Как видно, с учетом заполнения электронами энергетических уровней, в периодической таблице с увеличением атомных номеров элементов наблюдается периодическое повторение строения внешних электронных слоев, что и обусловливает периодичность свойств химических элементов.
С электронной конфигурацией атома связаны такие его свойства, как энергия ионизации, сродство к электрону, электроотрицательность, степень окисления.
Смотрите также
Железо и его роль
Железо — (лат. Ferrum), Fe (читается «феррум»), химический элемент, атомный номер 26, атомная масса 55,847. Происхождение как латинского, так и русского названий элемента однозначно не уста .
Строение атомов и элементарные частицы
Э.Резерфорд (1871 — 1937), исследуя законы рассеяния α-частиц, которыми он бомбардировал атомы различных элементов, обнаружил в атомах тяжелые ядра с диаметром порядка 10Ф (1Ф = 10 -13 см = 10-15 м = 1 фм (фемтометр)).Далее оказалось, что ядро по сравнению с самим атомом настолько мало, что вероятность попадания заряженной частицы в ядро составляет примерно 1:100 000. Это открытие позволило Резерфорду в 1911 году предложить планетарную модель атома, на основе которой в 1913 году Н.Бор (1885 — 1962) положил начало квантовой теории атома. Согласно Бору, самый легкий атом водорода состоит из тяжелого положительно заряженного ядра (протона), вокруг которого вращается легкий отрицательно заряженный электрон.
Четких границ ядра атомов не имеют. Диаметр ядра Н равен 1.45 Ф, диаметр же атома Н около 100 000 Ф. Диаметр ядра атома U равен 9 Ф. Таким образом, размеры ядра атомов в периодической системе элементов от H до U увеличиваются примерно в 6 раз.
В настоящее время, изучение микрообъектов и микрособытий стало возможным благодаря сочетанию теоретических успехов квантовой механики и тончайших физических экспериментов. Законы квантовой механики позволили выяснить строение атомов, понять устройство их ядер и свойства, составляющих атомы, элементарных частиц.
В настоящее время известно несколько сотен элементарных частиц. Они разделяются между собой по:
а) массе на тяжелые – барионы, средние – мезоны и легкие – лептоны с фотонами;
б) отношению к принципу Паули на подчиняющиеся – фермионы и частицы с целым или нулевым спином – бозоны;
в) участию в сильных взимодействиях – адроны и в слабых взаимодействиях – фотоны, электроны, мюоны, тау-лептоны, нейтрино.
Строение атомных ядер
Ядра атомов сложены элементарными частицами – протонами (+) и нейтронами (0). Масса протона mp = (1.672614±0.0000086)*10 -24 г, что в 1836 раз больше массы электрона. Число протонов в ядре, равное атомному номеру элемента Z, определяет его положение в периодической системе элементов. Нейтрон имеет массу, равную примерно 1,75*10-24 г, т.е. в 1840 раз большую, чем у электрона. Заряд нейтрона равен нулю. Нейтрон устойчив только в составе стабильных атомных ядер. Свободный нейтрон – нестабильная частица, распадающаяся по схеме n→p+e — +νe. В веществе, вследствие поглощения нейтронов ядрами атомов, свободные нейтроны существуют всего лишь единицы–сотни микросекунд.
Ядерное вещество имеет огромную плотность, оцененную Я.И.Френкелем в 10 14 г/см 3 , т.е. 1 см 3 ядерного вещества весит от 100 до 600 млн. тонн. Ядра атомов несут положительный заряд. Наивысшая плотность заряда у ядра атома H – протона, чем больше масса ядра, тем меньший заряд оно имеет.
Ядерные силы, связывающие нуклоны (протоны и нейтроны) в ядре остаются не до конца разгаданными, известно, что они в тысячи раз превышают силы электростатического взаимодействия протона и нейтрона. Особенностью ядерных сил является то, что они действуют на очень малых расстояниях, и на удалении 4 Ф их роль становится несущественной. Япоснкий физик Х. Юкава впервые объяснил природу ядерных сил особой формой излучения нуклонов, выражающейся в непрерывном обмене последних мезонами — частицами с массой примерно в 300 раз превышающей массу электронов. В 1947 году мезоны были установлены в составе космического излучения и в настоящее время экспериментально подтверждена важная роль мезонов в ядерном взаимодействии.
Структура атомных ядер остается одной из сложнейших проблем своременной физики. Существует несколько моделей атомных ядер (модель «жидкой капли», модель ферми-газа, оптическая, коллективная, оболочечная), однако все они используются как более или менее близкие к реальности гипотезы. Согласно широко распространенной оболочечной модели, каждый нуклон в ядре находится в определенном квантовом состоянии и располагается на отвечающем этому состоянию уровне, который может заполняться определенным числом нуклонов. Ядра, в которых полностью заполнены уровни с числом протонов или нейтронов 2, 8, 20, 28, 40, 50, 82, 126, называются магическими. Они отличаются от соседних ядер повышенной устойчивостью, большей распространенностью и другими свойствами.
По соотношению в ядрах числа протонов и нейтронов принято называть изотопами атомы с одним и тем же числом протонов, но с разным числом нейтронов. В изотопах Z постоянно, N и A — переменны.
Изобары – атомы с разным числом протонов, но с одинаковым массовыми числами. В изобарах А постоянно, Z и N — переменны.
Изотоны – атомы с разным числом протонов и разными значениями массового числа, но с одинаковым числом нейтронов. В изотонах N постоянно, Z и A – переменны.
Атомы с одинаковым составом ядра могут находиться в различных энергетических состояниях. Их называют изомерами. Изомеры имеют разные физические свойства, например период плураспада радиоактивных ядер и энергию связи нуклонов.
Основные свойства атомов и ионов
Орбитальные радиусы – радиусы максимумов радиальной плотности электронов внешней орбитали. Они отражают размеры атомов или ионов в свободном состоянии, т.е. вне химической связи. Эффективным ионным или атомным радиусом называют размер атома или иона в соединении. Они определяются через длину связи – расстояние между центрами атомов или ионов, определяемое рентгеновскими методами. Существующие системы эффективных ионных радиусов рассчитаны относительно величины радиуса иона кислорода, составляющей от 0,132 до 0,14 нм. Для элементарных ионов одного и того же элемента установлено, что радиус катиона меньше радиуса атома, а последний, в свою очередь меньше радиуса аниона.
В зависимости от положения в Периодической системе установлены основные закономерности изменения радиусов атомов:
1) радиусы увеличиваются в группах с ростом атомного номера в связи с увеличением числа электронных оболочек;
2) радиусы уменьшаются в периодах с увеличением заряда ядра;
3) наиболее близкие по радиусу элементы располагаются по диагонали друг от друга;
4) для лантаноидов и актиноидов радиусы уменьшаются с ростом порядкового номера в результате увеличения заряда ядра и заполнения электронами f-подуровня («лантаноидное сжатие»), вследствие этого, радиусы элементов, располагающихся в периодической системе после лантаноидов, Hf, Ta, W, практически не отличаются от аналогичных элементов предшествующего периода: Zr, Nb, Mo.
Валентность (степень окисления) – мера заряда иона или количество электронов отданных или присоединенных атомом при образовании иона.
Потенциал ионизации – энергия, необходимая для удаления электрона из атома. С ростом атомного номера потенциалы ионизации увеличиваются в периоде и уменьшаются в группе. Обратной величиной к потенциалу ионизации является сродство к электрону.
Электроотрицательность – способность атома или иона при вступлении в соединения притягивать электроны. Электроотрицательность является функцией от потенциала ионизации и сродства к электрону. Её величина зависит от заряда ядра атома, его валентности в данном соединении и строения электронных оболочек.
В периоде электроотрицательность минимальна для щелочных металлов и увеличивается к галогенам. Для литофильных катионов она уменьшается в группе с увеличением ионного радиуса. Для халькофильных элементов электроотрицательность выше, чем у литофильных из той же группы Периодической системы.
Элементы с резко различной электроотрицательностью образуют соединения с ионным типом связи. Близкие и высокие значения электроотрицательности приводят к образованию ковалентной связи, а близкие и малые – металлической.
Ионный потенциал Картледжа (Z), равный отношению валентности (W) к ионному радиусу (R): Z=W/R, отражает свойства катионогенности или анионогенности элементов. Минимальными значениями потенциала Картледжа обладают наиболее сильные катионы (щелочные, щелочноземельные металлы), максимальные значения Z характерны для галогенов и элементов, образующих кислородные анионы. Промежуточные значения этого параметра характерны для амфотерных элементов.
Величина ионного потенциала Картледжа позволяет судить о подвижности элементов – способности образовывать ионы и мигрировать в водных растворах. Элементы с низкими и высокими значениями Z являются наиболее подвижными, а с промежуточными – инертными.
Классификация элементов по типам строения их атомов
Если индивидуальность химического элемента определяется зарядом ядра его атомов, то его химические свойства определяются числом и расположением его внешних электронов. Электроны располагаются вокруг ядра на строго определенных расстояниях согласно их энергетическим уровням. Определенное число электронов образует серии, создающие вокруг ядра «электронные оболочки».
Число электронов в каждой серии, по Паули, 2n 2 , где n – номер серии.
Например, в серии n = 1, куда входят водород и гелий, может быть только 1 или 2 электрона, во второй серии 2 х 2 2 = 8 электронов, т.е. при последовательном заполнении серии электронами от 1 до 8 должны существовать 8 элементов, что наглядно подтверждается естественным рядом элементов от Li до Ne, в третьей серии 2 х 3 2 = 18 элементов и 2 х 4 2 = 32 — в четвертой (от Cs до Rn). Спектральные исследования указывают на различие в энергии связи электронов данной электронной серии (уровня), поэтому электроны распределяются на подгруппы, обозначаемые буквами s, p, d, f, причем в подгруппе s может быть не более 2, p — не более 6, d — не более 10 и f — 14 электронов.
В зависимости от своего электронного строения все химические элементы могут быть разделены на элементы-восстановители, отдающие электроны и образующие катионы, и элементы-окислители, приобретающие электроны и образующие анионы.
С точки зрения строения атомов элементы подразделяются таким образом.
1. Инертные газы, не участвующие в химических процессах, обладающих внешней 8-электронной оболочкой (у гелия 2-электронная).
II, Атомы, образующие ионы с 8-электронной оболочкой (К, Al, Sc, Mg, Ti, Ce, Th, U, F, O, Cl, S и др.).
III. Атомы, образующие ионы с 18-электронной оболочкой (Ag, Ga, Sn, Hg, Cd, In, Zn и др.).
IV. Атомы переходных элементов, занимающих промежуточное положение между двумя предыдущими группами (Mn, Fe, Co, Ni, Re, Pd, Pt и др.).
У гомологов, т.е. у элементов с одинаковым типом строения внешних электронных оболочек, но различными зарядами ядра, иначе говоря, у элементов одной и той же группы и подгруппы периодической системы, наблюдаются следующие закономерные изменения их химических свойств.
У элементов, образующих ионы, с 8-электронной внешней оболочкой, химическая активность возрастает, потенциалы ионизации уменьшаются, переход из металлического состояния в окисное сопровождается закономерным возрастанием выделяющейся при этом энергии, например, от лития к натрию, калию, рубидию и цезию.
Объясняется это тем, что у более тяжелых гомологов с более сложно построенной электронной оболочкой внешний электрон более удален от притягивающего его положительно заряженного ядра и промежуточные слои электронов играют экранирующую роль — чем больше электронов между ядром и валентным электроном, тем слабее его связь с ядром, тем легче он отрывается, тем больше энергия реакции окисления.
Совершенно иначе обстоит дело у элементов с 18-электронной оболочкой. Отдавая свои внешние валентные электроны при образовании химических соединений, они не достигают столь желательной 8-электронной оболочки; у этих элементов (Cu, Ag, Au, Zn, Cd, Hg и др.) химическая активность не возрастает, а понижается. (Нахождение в самородном состоянии в ряду Cu-Ag-Au возрастает с порядковым номером элемента).
У элементов, присоединяющих электроны с образованием анионов с 8-электронными оболочками (F, Cl, Br, J, S, Se, Te), химическая активность (в отличие от Li, Na, K, Rb, Cs) убывает с увеличением порядкового номера из-за экранирующего действия электронных слоев, располагающихся между ядром, притягивающим присоединяющийся электрон (хотя имеющиеся электроны и компенсируют полностью его заряд). Поэтому интенсивность реакции соединения с водородом убывает от фтора к йоду и от серы к теллуру.
Что же касается окислительных реакций в том же ряду, то фтор окислов практически не образует (F2O очень нестойкое соединение), кислородные кислоты хлора (HClO3 и HClO4 и др.) значительно менее стойки, чем соответствующие соединения иода. Кислородные соли хлора в минеральном мире неизвестны, а кислородные соединения йода представлены лаутаритом Ca(JO3)2, беллинджеритом 3Cu(JO3)2 2H2O, шварцем-бергитом Pb(JO 43 0)2×6PbO×PbCl2.
Устойчивость высших окислов в гомологических рядах V, Nb, Ta; Cr, Mo, W; Mn, Tc?, Re увеличивается с порядковым номером (или, что то же самое, с увеличением атомного веса). Так, ванадий в эндогенных минералах и горных породах присутствует только в виде трехвалентного соединения и только в зоне гипергенеза встречается в виде четырех- и пятивалентных соединений; хром обычно встречается только в виде трехвалентных соединений и очень редки в природе минералы шестивалентного хрома (крокоит PbCrO4).
Соединения шестивалентного молибдена типичны для зоны окисления, но и в эндогенных условиях он встречается, хотя и редко, в виде молибдошеелита Сa(Mo,W)O4 или даже повелита CaMoO4. Наконец, вольфрам и в эндогенных, и в экзогенных условиях встречается в виде шестивалентного (вольфрамит и шеелит) и очень редко в виде четырехвалентного (тунгстенит WS2). Если марганец в природе известен в виде двух-, трех- и четырехвалентных соединений, то рений, видимо, существует в виде четырех-шести- и семивалентных соединений.
Для некоторых гомологических рядов элементов, образующих ионы с 18-электронной оболочкой, наблюдается обратная зависимость: галлий встречается в виде трехвалентных соединений, а таллий почти исключительно в виде одновалентных; олово — в основном в виде четырехвалентных соединений, а свинец — в виде двухвалентных и только очень редко в зоне окисления в виде четырехвалентного свинца (платнерита). Устойчивость пятивалентных соединений убывает от мышьяка к сурьме и висмуту.
Необходимо коснуться и некоторых аномальных особенностей в химических свойствах элементов.
В ряду таллий-свинец-висмут валентности элементов (Tl + , Pb 2+ , Bi 3+ ) не отвечают номеру периодической системы на две единицы, иначе говоря, в валентностях этих элементов участвуют только электроны подгруппы р серии Р, а два электрона подгруппы s в реакциях не участвуют, образуя слои из двух электронов, как бы (в грубых чертах) имитируя гелиевую электронную оболочку. Однако эта имитация гелиевой оболочки все-таки сказывается на химических свойствах таллия, свинца и висмута. Она проявляется и в том, что одновалентный таллий сходен по своим свойствам со щелочными металлами (растворимая гидроокись) и в полевых шпатах, слюдах и карналлите таллий изоморфно замещает калий).
Свинец по многим своим свойствам сходен с кальцием. Трудная растворимость сульфата, изоморфизм свинца с барием, стронцием и кальцием — все это делает Pb 2+ сходным с Са 2+ .
Наконец, трехвалентный висмут по характеру своей гидроокиси и фосфата имеет очень отдаленное свойство с некоторыми свойствами скандия.
Вторая аномалия в химических свойствах элементов заключается в том, что некоторые свойства лития, бериллия, бора сходны с таковыми магния, алюминия и кремния, т.е. элементов, имеющих на единицу большую валентность. Это проявляется, например, в том, что литий подобно магнию, образует трудно растворимые фтористую, углекислую и фосфорнокислую соли.
Бериллий, подобно алюминию, образует студенистую гидроокись Ве(ОН)2, сходную с Al(ОН)3, и подобно последней растворяется в едких щелочах, образуя, например, К2ВеО2, сходный с алюминатом К3AlО3. Бериллий образует очень стойкие фторо-бериллаты типа Na2BeF4подобно алюминию Na3AlF6. В ряде силикатов бериллий играет роль, сходную с алюминием. Бор в отличие от всех остальных элементов своей группы периодической системы образует очень слабую борную кислоту, по ряду свойств сходную с кремниевой кислотой. Подобно кремневой кислоте, образующей поликремневые кислоты: авогардит KBF4 встречается, как и гиератит K2SiF6, в возгонах вулканов. Бороводород ВН3 очень напоминает собой кремневодород SiH4, а элементарный бор — элементарный кремний.
Такая кажущаяся «сдвинутость» элементов в периодической системе на одно место вправо обусловлена тем, что литий, бериллий и бор обладают сравнительно очень простым строением своего атома и два s-электрона серии К хотя и не участвуют в валентности, но влияют на свойства этих легких элементов как один дополнительно отданный электрон или же заряд ядра, скомпенсированный только двумя электронами, оказывает влияние на химические свойства ионов Li + , Be 2+ , B 3+ , как бы придавая им один дополнительный положительный заряд и тем самым делая их сходными с Mg 2+ , Al 3+ , Si 4+ . Наконец, что касается частных аномалий, то обращает на себя внимание нахождение молибдена в эндогенных рудах и горных породах в виде сульфида (молибденита), в то время как его ближайшие аналоги хром и вольфрам в этих же условиях представлены кислородными соединениями, в основном хромитом и вольфрамитом.
В противоположность молибдену олово имеет явно выраженную склонность к образованию кислородного соединения — касситерита SnО2, хотя свинец и стоящие справа и слева олова индий и сурьма являются типичными сульфидными элементами (для германия в более или менее равной степени характерна его форма нахождения в виде как сернистых, так и окисных соединений).
1867г – таблица Менделеева
Авторская формулировка(1869г): свойства элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов.
Современная формулировка: свойства простых веществ, а также форма и свойства элементов находятся в периодической зависимости от величин заряда числа атома.
Менделеев располагал элементы не только по принципу возрастания атомных масс, но и учитывал свойства элементов.
Каждому элементу присвоен порядковый (атомный) номер.
Порядковый номер совпадает с числом элементарных положительных электронных зарядов ядра атома этого элемента.
Порядковый номер частично равен положительному заряду ядра его атома.
Периодически повтор.след свойства элементов:
1.Металличность(легко отдают электроны)
2.Энергия ионизации атома – кол-во энергии, кот. Необходимо затратить отрыва электрона от атома.
3.Неметалличность(сильно притягивают электроны)
4.Сродство к электрону – кол-во энергии, которая выделяется при присоединении электрона к атому.
5.Электроотрицательность – способность атома притягивать электроны.
Причины: периодичное повторение св-в эл-ов объясняется периодическим повторением кол-во электронов по внешним электронам слое.
Вопрос. s-, p-, d-, f-элементы, положение в периодической системе. Основные химические свойства
Вопрос.Природа химической связи. Метод валентных связей.
(Хим. Связь имеет электронную природу, образ. за счет электронов)
Природа химической связи едина: взаимодействие атомов в молекуле (ионах, кристаллах) осуществляется под действием электрических сил между электронами и ядрами атомов.
(у S и P элементов за счет электронов внешнего слоя, у d элементов за счет электронов внешнего слоя и предвнешнего)
В формировании химической связи принимают участие валентные электроны. Это электроны внешних электронных слоев, которые наименее прочно связаны с ядром атома. Несмотря на единую электрическую природу связывания атомов существуют различные типы связей, формируемые по разным механизмам. К основным типам связи относятся ковалентная (полярная и неполярная) и ионная связи. Разновидностями этих типов являются донорно-акцепторная (координационная), водородная и другие. Между атомами металлов в конденсированной фазе действует металлическая связь. Метод базируется на двух положениях: 1 ) ковалентная химическая связь образуется парой электронов с антипараллельными спинами, пренадлежащей двум атомам; 2 ) ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Строение атома ванадия
Общие сведения о строении атома ванадия
Относится к элементам d — семейства. Металл. Обозначение – V. Порядковый номер – 23. Относительная атомная масса – 50,941 а.е.м.
Электронное строение атома ванадия
Атом ванадия состоит из положительно заряженного ядра (+23), внутри которого есть 23 протона и 28 нейтронов, а вокруг, по четырем орбитам движутся 23 электрона.
Рис.1. Схематическое строение атома ванадия.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома ванадия содержит 5 электронов, которые являются валентными. Степень окисления кальция равна +5. Энергетическая диаграмма основного состояния принимает следующий вид:
Исходя из диаграммы можно утверждать, что ванадий также имеет степень окисления +3.
Примеры решения задач
| Задание | Изобразите распределение электронов по энергетическим уровням и подуровням в атомах кремния и ванадия. К каким типам элементов с точки зрения строения атома они относятся? |
| Ответ | Кремний : |
Кремний относится к семейству p-, а ванадий d-элементов.
2) Строение атома. Ранние модели строения атома. Элементарные частицы атома. Состав атомного ядра. Изотопы.
Современные представления о состоянии электрона в атоме. Квантовые числа. Энергия и форма атомных орбиталей. Принцип запрета Паули. Правило Хунда. Правила Клечковского. Порядок заполнения атомных орбиталей.
Ранние модели строения атома
1.1. Модели строения атома
К концу XIX в. были накоплены сведения, подтверждающие сложное строение атома. В тот период был выдвинут целый ряд моделей строения атома. Одна из первых моделей была предложена Джозефом Томсоном в 1903 г. Томсоновская модель «сливового пудинга» (в русском литературном переводе – «булочка с изюмом») уподобляла атом положительно заряженному сферическому пудингу, в который вкраплены отрицательно заряженные шарики – электроны (рис. 1.1).
Модель атома в виде «булочки с изюмом»
(Дж.Томсон, 1903 г.)
В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест Резерфорд на основе данных подготовленного и проведенного им эксперимента сделал вывод, что в атоме положительный заряд сконцентрирован в малом объеме.
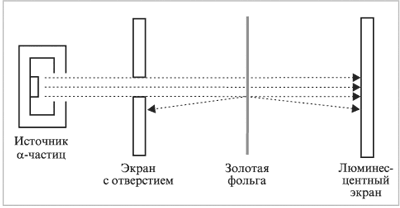
Ханс Гейгер и Эрнест Марсден были студентами Резерфорда. В 1910 г. они проводили эксперименты, в которых бомбардировали тонкие листы золотой фольги пучком -частиц (ядер атомов гелия) (рис. 1.2). Толщина золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе эксперимента было обнаружено, что подавляющее большинство -частиц совершенно свободно проходило через фольгу, причем некоторые из них лишь незначительно отклонялись от первоначального направления. Однако примерно одна из 10 000–100 000 частиц резко изменяла свое направление на противоположное.
Эксперимент Х.Гейгера и Э.Марсдена
Это наблюдение заставило Резерфорда выдвинуть новую модель атома, согласно которой положительно заряженное ядро окружено электронами (рис. 1.3).
Модель атома с положительно заряженным ядром
и вращающимися вокруг него электронами
(Э.Резерфорд, 1911 г.)
Рассчитанный на основе данных проведенного эксперимента размер ядра атома оказался примерно в 100 000 раз меньше размера самого атома. К примеру, если бы диаметр ядра составлял 1 см, то диаметр атома был бы 1 км. И в этой малой части пространства, занимаемого ядром, сосредоточено более 99,9% массы атома.
После этого Резерфорд предсказал существование протона и показал, что его масса более чем в 1800 раз должна превышать массу электрона. Существование нейтрона было предсказано Резерфордом в 1920 г. Экспериментально нейтрон был обнаружен в 1932 г.
Началом современной теории электронного строения атомов послужила его планетарная квантовая модель, которую в 1913 г. выдвинул Нильс Бор. Обоснованием этой и более поздних моделей атома служат главным образом три источника данных: атомные спектры, энергии ионизации атомов, сродство атомов к электрону.
Элементарные частицы атома
Электроныпредставляют собой стабильные отрицательно заряженные элементарные частицы массой около 9*10-31 кг каждая. Электроны участвуют в электромагнитном , слабом и гравитационном взаимодействиях и, следовательно, относятся к лептонам* . Электроны — один из основных структурных элементов вещества: электронные оболочки атомов определяют оптические, электрические, магнитные, химические свойства атомов и молекул, а также большинство свойств твердых тел.
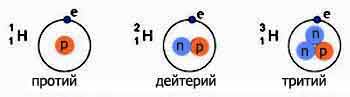
Протонытакже, как и электроны, относятся к стабильным элементарным частицам, масса каждого из них превышает массу электрона в 1836 раз. Протон относится к барионам и представляет собой ядро легкого изотопа атома водорода (протия).
Нейтроныявляются нейтральными элементарными частицами. Масса нейтрона немного превышает массу протона. Нейтроны относятся к барионам. В свободном состоянии они нестабильны и имеют время жизни около 16 минут. Вместе с протонами нейтроны образуют атомные ядра, причем, находясь в них, нейтроны стабильны.
СОСТАВ АТОМНОГО ЯДРА
Ядро атома состоит из нуклонов, которые подразделяются на протоны и нейтроны.
Символическое обозначение ядра атома:
А- число нуклонов, т.е. протонов + нейтронов ( или атомная масса )
Z- число протонов ( равно числу электронов )
N- число нейтронов ( или атомный номер )
— действуют между всеми нуклонами в ядре;
Нуклоны притягиваются друг к другу ядерными силами, которые совершенно непохожи ни на гравитационные, ни на электростатические. . Ядерные силы очень быстро спадают с расстоянием. Радиус их действия порядка 0,000 000 000 000 001 метра.
Для этой сверхмалой длины, характеризующей размеры атомных ядер, ввели специальное обозначение — 1 Фм ( в честь итальянского физика Э. Ферми, 1901-1954). Все ядра имеют размеры нескольких ферми. Радиус ядерных сил равен размеру нуклона, поэтому ядра — сгустки очень плотной материи. Возможно, самой плотной в земных условиях.
Ядерные силы — сильные взаимодействия. Они многократно превосходят кулоновскую силу (на одинаковом расстоянии). Короткодействие ограничивает действие ядерных сил. С ростом числа нуклонов ядра становятся неустойчивыми, и поэтому большинство тяжелых ядер радиоактивны, а совсем тяжелые вообще не могут существовать.
Конечное число элементов в природе — следствие короткодействия ядерных сил.
Атомы с одинаковыми атомными номерами называют изотопами: в таблице Менделеева
они расположены в одной клеточке (по-гречески изос — равный, топос — место).
Химические свойства изотопов почти тождественны.
Если элементов всего в природе — около 100, то изотопов — более 2000. Многие из них неустойчивы, то есть радиоактивны, и распадаются, испуская различные виды излучений.
Изотопы одного и того же элемента по составу отличаются лишь количеством нейтронов в ядре.
Изото́пы(от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его
массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон).
Современные представления о строении атома.
Подтверждённая экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила учёных к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определённую массу покоя), а с другой — его движение напоминает волну и может быть описано определённой амплитудой, длиной волны, частотой кол***ий и др. Поэтому нельзя говорить о какой-либо определённой траектории движения электрона — можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Cледовательно, под электронной орбитой следует понимать не определённую линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами, электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определённом расстоянии от ядра. В связи с этим электрон представляют не в виде материальной точки, а как бы «размазанным» по всему объёму атома в виде так называемого электронного облака, имеющего области сгущения и разрежения электрического заряда. Представление об электроне как о некотором облаке электрического заряда удобно; оно довольно точно передаёт особенности поведения электрона. Однако следует иметь в виду, что электронное облако не имеет резко очерченных границ, и даже на большом расстоянии от ядра существует вероятность пребывания электрона. Для характеристики формы электронного облака понятие орбиталь вместо понятия орбита было введено именно для того, чтобы не смешивать движение электрона с движением тела в классической физике. Однако при упрощённом рассмотрении строения атома иногда сохраняют термин орбита, помня тем не менее об особом характере движения электрона в атоме.
По современным представлениям состояние элетрона в атоме описывается четырьмя квантовыми числами. Главное квантовое число n характеризует величину энергии электрона и может принимать только положительные целочисленные значения: 1, 2, 3 и т. д. С увеличением главного квантового числа энергия электрона возрастает. Состояние электрона, отвечающее определённому значению главного квантового числа, называют энергетическим уровнем электрона в атоме. Помимо энергии электрона главное квантовое число определяет размеры электронного облака: чем выше значение главного квантового числа, тем больше электронное облако. Электроны, характеризующиеся одним и тем же квантовым числом, имеют электронные облака приблизительно одинаковых размеров. Поэтому говорят о существовании в атоме электронных слоёв. Электронные слои обозначают большими буквами латинского алфавита K, L, M, N, O, причём K-слой является первым от ядра атома, ему соответствует главное квантовое число n = 1, L-слой — вторым, M-слой — третьим и т. д. Электроны, образующие данный слой, могут обладать несколько отличающейся друг от друга энергией и иметь орбитали различных форм. Из квантовомеханической теории следует, что с увеличением главного квантового числа n изменяются число и характер электронных орбиталей в пределах данного электронного слоя. Количество орбиталей для каждого значения n равно квадрату главного квантового числа (n2).
Второе квантовое число l, описывающее форму электронного облака, называется орбитальным квантовым числом. При данном главном вантовом числе n орбитальное квантовое число l может принимать любые целочисленные значения от 0 до n–1. Соответствующие орбитали обозначаются строчными буквами латинского алфавита: s (l = 0), p (l = 1), d (l = 2), f (l = 3). Орбитальное квантовое число отображает энергию электрона на подуровне. Электроны с различными орбитальными квантовыми числами несколько отличаются друг от друга: их энергия тем выше, чем больше число l. Число возможных подуровней в каждом энергетическом уровне совпадает с порядковым номером электронного слоя, но фактически ни один энергетический уровень не содержит больше четырёх подуровней. Это справедливо для стационарного состояния атомов всех элементов. Так, первому энергетическому уровню соответствует s-подуровень; второму уровню — два подуровня: s и p; третьему уровню — три подуровня: s, p и d; четвёртому и следующим уровням —четыре подуровня: s, p, d и f.
Квантовые числа— энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3. n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями,
l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталями (5 типов),
l = 3 – f-орбиталями (7 типов).
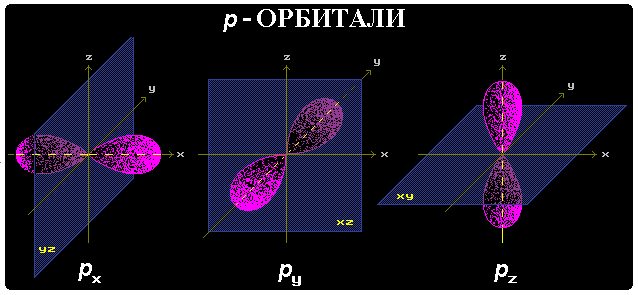
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: ↑и ↓.
Энергия и форма атомных орбиталей.
Атомные орбитали (АО) разных типов отличаются друг от друга формой и энергией и обозначаются символами: s, p, d, f и т.д.
Органические вещества состоят в основном из элементов 2-го и 3-го периодов, валентные электроны которых находятся на s- и р-АО.
Атомные орбитали s-типа имеют форму сферы:
р-АО имеют форму объемной восьмерки (гантели), направленной по оси x, y или z.
Энергия орбитали возрастает по мере удаления электрона от ядра атома (т.е. с увеличением номера электронного уровня).
Так, энергия s-АО увеличивается в ряду: 1s 1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %
Свойства ионной связи:
-В отличие от ковалентной связи ионная связь не обладает насыщаемостью.
-Прочность ионных связей.
-Вещества с ионными связями в молекулах, как правило, имеют более высокие температуры кипения и плавления.
Водородные связи влияют на физические (т.кип. и т.пл., летучесть, вязкость, спектральные характеристики) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при 24°С (молекулярная формула обоих веществ С2Н6О).
Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH3OH, С2Н5ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются. Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность.
Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа.
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа.
Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические:
Ионные кристаллические решетки
Виды частиц в узлах решетки: ионы
Для веществ с ионной химической связью будет характерна ионная решетка.
Ионы-это частицы, имеющие положительный или отрицательный заряд.
Напрмер NaCl , Соли, галогениды (IA,IIA),оксиды и гидроксиды типичных металлов.
Физ. свойства: Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток
Атомные кристаллические решетки
В узлах атомной кристаллической решетки находятся отдельные атомы.
Ковалентная химическая связь.
В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Простые по составу.
Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 35000С), прочны и тверды, нелетучи, практически нерастворимы в жидкостях.
Металлические кристаллические решетки
Металлическая связь. Связь в металлах между положительными ионами посредством обобществленных электронов.
общие физические свойства для металлов характерны: блеск, электропроводность, теплопроводность, пластичность.
Вещества с металлической связью имеют металлические кристаллические решетки
В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки.
Молекулярные кристаллические решетки
Эти вещества являются неметаллами. Простые по составу.Химическая связь внутри молекул ковалентная неполярная.Летучие, легкоплавкие, малорастворимые в воде.
в узлах решетки нах. молекулы.
молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, H2,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
5)Термодинамика и кинетика химических процессов.Скорость химической реакции. Влияние концентрации реагирующих веществ на скорость химических реакций. Молекулярность и порядок реакции. Механизмы реакций. Влияние температуры на скорость химических реакций (правило Вант-Гоффа, уравнение Аррениуса). Катализ и катализаторы, их значение. Ферментативный катализ. Химическое равновесие. Константа равновесия. Смещение химического равновесия (влияние концентрации веществ, внешнего давления, температуры).
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
-природа реагирующих веществ,
-температура (правило Вант-Гоффа),
-площадь поверхности реагирующих веществ.
Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
МОЛЕКУЛЯРНОСТЬ РЕАКЦИИ — число частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) р-ции и превращающихся в продукты.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением.
где vt 1 , vt 2 — скорости реакции соответственно при начальной ( t 1 ) и конечной ( t 2 ) температурах, а γ — температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Катализ (от греч. katálysis — разрушение), изменение скорости химических реакций в присутствии веществ (катализаторов),вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. Реакции с участием катализаторов называются каталитическими. Количество реагирующего вещества, которое может испытать превращение в присутствии определённого количества катализатора, не ограничивается какими-либо стехиометрическими соотношениями и может быть очень большим.
Ферментативный катализ — биокатализ, ускорение химических реакций под влиянием ферментов (См. Ферменты). В основе жизнедеятельности лежат многочисленные химические реакции расщепления питательных веществ, синтеза необходимых организму химических соединений и трансформации их энергии в энергию физиологических процессов (работа мышц, почек, нервная деятельность и т.п.). Все эти реакции не могли бы происходить с необходимой для живых организмов скоростью, если бы в ходе эволюции не возникли механизмы их ускорения с помощью Ф. к.
Равновесие химическое, состояние системы, в которой обратимо протекает одна или несколько реакций химических,причём для каждой из них скорости прямой и обратной реакций равны, вследствие чего состав системы остаётся постоянным, пока сохраняются условия её существования. В простейшем случае, когда система гомогенна и в ней протекает обратимая химическая реакция.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ.
Катализаторы не влияют на смещение химического равновесия!
6)Растворы. Классификация растворов. Физическая и химическая теории растворов. Растворимость. Факторы, влияющие на растворимость твердых веществ, жидкостей и газов. Способы выражения концентрации растворов (массовая доля растворенного вещества, молярная концентрация, эквивалентная концентрация, моляльная концентрация, мольная доля)
Свойства разбавленных растворов неэлектролитов. Давление насыщенного пара (закон Рауля). Температура замерзания и кипения растворов. Осмотическое давление. Значение осмоса. Основные положения теории электролитической диссоциации. Механизм диссоциации. Константа и степень диссоциации. Сильные и слабые электролиты Закон разбавления Оствальда. Ионное произведение воды. Водородный и гидроксильный показатель. Шкала кислотности. Константы диссоциации кислот и оснований. Кислотно-основные индикаторы. Гидролиз. Гидролиз по катиону и аниону. Полный гидролиз. Факторы, влияющие на гидролиз.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. «Гомогенный» — значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0; такие растворы принято называть идеальными). Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди СuSО4 в воде приводит к образованию окрашенного раствора, из которого выделяется не СuSО4, а голубой кристаллогидрат СuSО4·5Н2О). Современная термодинамика растворов основана на синтезе этих двух подходов.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов,молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
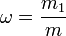
m1 — масса растворённого вещества, г ;
m — общая масса раствора, г .
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации 

ν — количество растворённого вещества, моль;
- http://biofile.ru/geo/15059.html
- http://cyberpedia.su/17x88f1.html
- http://ru.solverbook.com/spravochnik/ximiya/11-klass/stroenie-atoma/vanadij/
- http://studfiles.net/preview/3800932/page:2/