Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов.
Кислоты. Для кислот характерны следующие общие свойства:
способность взаимодействовать с основаниями с образованием солей;
способность взаимодействовать с некоторыми металлами с выделением водорода;
способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т.д. С устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее.
Величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации H2SO4 — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале 10 -4 — 10 -2 , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
способностью взаимодействовать с кислотами с образованием солей;
способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
Своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка:
а при взаимодействии с гидроксидом натрия — цинкат натрия:
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами или амфотерными электролитами. К таким гидроксидам, кроме гидроксида цинка, относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно выразить схемой
Н + + RO — — ROH-R + + OH —
Таким образом, в растворе амфотерного электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионов, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы Н + . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН — . Например, при растворении хлорида гидроксомагния диссоциации протекает согласно уравнениям:
MgOHCl = MgOH + + Сl —
MgOH + = Mg 2+ + ОН —
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима: В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства оснований. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в неводных средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теорий кислот и оснований принадлежит протонная теория, выдвинутая в 1923 г.
Согласно протонной теории, кислотой является донор протона, т.е. частица (молекула или ион), которая способна отдавать ион водорода — протон, а основанием — акцептор протона, т.е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Основание + Протон — Кислота
Связанные этим соотношением основание и кислота называются сопряженными. Например, ион HSO4 — является основанием, сопряженным кислоте H2SO4.
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион Сl — основание, сопряженное кислоте НС1, а ион NH3 + — кислота, сопряженная основанию NH3.
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду NH3 — Н2О — HF эта энергия максимальна для NH3 и минимальна для HF. Поэтому в смеси с NH3 вода функционирует как кислота, а в смеси с HF — как основание:
Теория слабых электролитов
К слабым электролитам относятся ковалентные соединения, обратимо (частично) диссоциирующие в водных растворах. К ним относятся:
(а) почти все органические и многие неорганические кислоты: H2S, H2SO3, HNO2, HCN, и др;
(б) труднорастворимые в воде основания, а также NH4OH,
В растворах слабых электролитов устанавливается равновесие между молекулами веществ и их ионами:
KaтAн
Из-за высокой концентрации ионов, в растворе сильного электролита создается собственное электромагнитное поле, интенсивность которого определяется величиной ионной силы раствора (I). Ионная сила раствора рассчитывается по уравнению:
где Сi — молярная концентрация каждого иона, моль/л,
Zi — заряд каждого иона
Пример. Рассчитайте ионную силу 0,1 М раствора азотной кислоты.
I = ½ [0,1·(+1) 2 + 0,1·(-1) 2 ] = 0, 1 моль/л
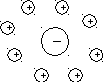
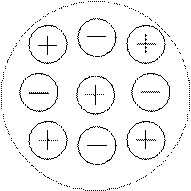
В растворе сильного электролита вокруг каждого иона создается ионная атмосфера, состоящая из ионов противоположного знака:
Рисунок 10. — Модель ионной атмосферы в растворе сильного электролита
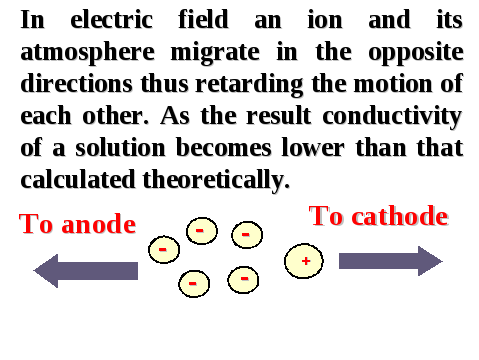
Во внешнем электрическом поле ион и его атмосфера приобретают разнонаправленное движение, вследствие чего происходит электрофоретическое торможение ионов и уменьшение электропроводности раствора.
Рисунок 11. — Электрофоретическое торможение ионов вследствие деформации ионной атмосферы
Из-за уменьшения электропроводности, вызванной взаимным торможением ионов, создается впечатление, что концентрация ионов в растворе меньше, чем истинная. Эта «кажущаяся» концентрация называется активностью (а) Активность ионов рассчитывается по уравнению:
Теория сильных электролитов
Отличие сильных электролитов от слабых. Исследование электростатического взаимодействия ионов. Коэффициент активности по Дебаю–Хюккелю. Активность и ионная сила раствора. Различие в свойствах концентрированных и разбавленных растворов электролитов.
| Рубрика | Физика и энергетика |
| Вид | статья |
| Язык | русский |
| Дата добавления | 14.11.2016 |
| Размер файла | 22,7 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Размещено на http://www.allbest.ru/
Теория сильных электролитов
Сильные электролиты полностью диссоциируют на ионы. В водных растворах сильных электролитов существуют простые или сольватированные катионы и анионы. Это подтверждается современными физическими и физико-химическими исследованиями. Однако опытным путем найдено, что электропроводность водных растворов сильных электролитов не эквивалентна той электропроводности, которую можно было бы ожидать при 100%-ной диссоциации молекул на ионы. Такое несоответствие объясняется теорией сильных электролитов, предложенной Дебаем и Хюккелем. Согласно этой теории, в растворах сильных электролитов между ионами существует электростатическое взаимодействие. Каждый ион окружен ионной атмосферой из противоионов. Ионная атмосфера тормозит движение ионов в электрическом поле, в результате чего создается эффект неполной диссоциации сильного электролита.
В связи с влиянием ионной силы раствора та концентрация, согласно которой ион действует в растворе, называется активной концентрацией (активностью):
электролит ион раствор
где f — коэффициент активности, который характеризует взаимодействие ионов.
Активность необходимо использовать при расчете любого химического равновесия, если в системе находится сильный электролит, концентрация которого больше 1 . 10 -4 моль/л.
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
1. Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л- 1 ).
2. Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Очевидно, что при электростатическом взаимодействии ионов противоположных знаков необходимо учитывать влияние ионной атмосферы. При движении катиона в электростатическом поле ионная атмосфера деформируется; она сгущается перед ним и разрежается позади него. Эта асимметрия ионной атмосферы оказывает тем более тормозящее действие движению катиона, чем выше концентрация электролитов и чем больше заряд ионов. В этих системах само понятие концентрации становится неоднозначиным и должно заменяться активностью. Для бинарного одно-однозарядного электролита KatAn > Kat + + An + активности катиона (a+) и аниона (a-) соответственно равны
Коэффициент активности по Дебаю-Хюккелю зависит по крайней мере от температуры, диэлектрической проницаемости растворителя (е) и ионной силы (I); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
где cB — молярные концентрации отдельных ионов (моль/л),
zB — заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na + и Cl ? с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
I(NaCl) = 0,5(zІ(Na + )*c(Na + ) + zІ(Cl ? )*c(Cl ? )) = 0,5(1І*c(NaCl) + (-1)І*c(NaCl)) = c(NaCl)
И ионная сила соответственно будет равна концентрации раствора:
I = 0.5(1І*0,001 моль/л + (-1)І*0,001 моль/л) = 0.5(0,001 моль/л + 0,001 моль/л) = 0,001 моль/л
Это верно для раствора любого сильного электролита, состоящего из однозарядных ионов. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде:
где г — коэффициент активности,
А — постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
Активность и ионная сила раствора. Различие в свойствах концентрированных и разбавленных растворов электролитов связано главным образом со значительным электростатическим взаимодействием ионов в концентрированных растворах. В связи с этим вместо понятия концентрация используется понятие активность. Активность i-й ионной частицы а связана с ее концентрацией с, уравнением:
где fi — коэффициент активности; его значение определяется концентрациями и зарядами всех ионных частиц раствора
Активность является мерой концентрации с учетом электростатических межионных взаимодействий.
Связь концентраций ионов и зарядов ионов со значением коэффициента активности ионной частицы fi выражается уравнением:
где k — константа,
При этом многозарядные ионы оказывают более сильное влияние на значение fi, чем однозарядные.
Размещено на Allbest.ru
Подобные документы
Вязкость, движение частиц в вязких средах. Электропроводность и ее виды. Удельная и молярная электропроводность растворов электролитов. Числа переноса и методы их определения. Проверка концентрации кислоты методом потенциометрического титрования.
курсовая работа [743,5 K], добавлен 17.12.2014
Особенности работы источника ионов. Распределение электростатических полей, состав ионов газа, металла. Экспериментальные данные по определению состава ионного пучка. Внедрение элементов в поверхностный слой обрабатываемого материала (ионная имплантация).
статья [105,9 K], добавлен 30.09.2012
Основные понятия и специальные разделы электродинамики. Условия существования электрического тока, расчет его работы и мощности. Закон Ома для постоянного и переменного тока. Вольт-амперная характеристика металлов, электролитов, газов и вакуумного диода.
презентация [8,4 M], добавлен 30.11.2013
Открытия явления электролиза. Сравнение первых гальванических элементов с современными батарейками ведущих фирм мира. Процесс электролиза в расплавах электролитов. Механизм электрического тока в жидких проводниках. Основные гальванические элементы.
отчет по практике [1,5 M], добавлен 27.05.2010
Принцип действия, конструкция и технология изготовления микромеханических реле. Методы получения гальванических покрытий. Состав электролитов никелирования, меднения и золочения. Характеристики исполнительных элементов для применения в устройствах МСТ.
дипломная работа [11,1 M], добавлен 17.06.2012
Ионная природа мембранных потенциалов. Потенциал покоя, уравнение Нернста. Стационарный потенциал Гольдмана-Ходжкина. Уравнение электродиффузии ионов через мембрану в приближении однородного поля. Механизм генерации и распространения потенциала действия.
реферат [158,6 K], добавлен 16.12.2015
Виды и категории сил в природе. Виды фундаментальных взаимодействий. Уравнения Ньютона для неинерциальной системы отсчета. Определение силы электростатического взаимодействия двух точечных зарядов. Деформация растяжения и сжатия стержня, закон Гука.
презентация [19,6 M], добавлен 13.02.2016
Термодинамические свойства растворов. Химический потенциал чистого компонента. Построение диаграмм плавкости квазирегулярных растворов. Параметры взаимодействия жидких и твердых растворов. Нахождение температурной зависимость энергии Гиббса реакции.
контрольная работа [212,6 K], добавлен 03.01.2016
Определение потенциала электростатического поля и напряжения (разности потенциалов). Определение взаимодействия между двумя электрическими зарядами в соответствии с законом Кулона. Электрические конденсаторы и их емкость. Параметры электрического тока.
презентация [1,9 M], добавлен 27.12.2011
Теоретическое исследование электростатического поля как поля, созданного неподвижными в пространстве и неизменными во времени электрическими зарядами. Экспериментальные расчеты характеристик полей, построение их изображений и описание опытной установки.
лабораторная работа [97,4 K], добавлен 18.09.2011
Свойства сильных электролитов с точки зрения теории сильных электролитов
Теория сильных электролитов
Сильные электролиты полностью диссоциируют на ионы. В водных растворах сильных электролитов существуют простые или сольватированные катионы и анионы. Это подтверждается современными физическими и физико-химическими исследованиями. Однако опытным путем найдено, что электропроводность водных растворов сильных электролитов не эквивалентна той электропроводности, которую можно было бы ожидать при 100%-ной диссоциации молекул на ионы. Такое несоответствие объясняется теорией сильных электролитов, предложенной Дебаем и Хюккелем. Согласно этой теории, в растворах сильных электролитов между ионами существует электростатическое взаимодействие. Каждый ион окружен ионной атмосферой из противоионов. Ионная атмосфера тормозит движение ионов в электрическом поле, в результате чего создается эффект неполной диссоциации сильного электролита.
Мерой электростатического взаимодействия ионов является ионная сила раствора μ, равная полусумме произведений квадрата заряда каждого из присутствующих в растворе ионов на его концентрацию.
В связи с влиянием ионной силы раствора та концентрация, согласно которой ион действует в растворе, называется активной концентрацией (активностью):
где f – коэффициент активности, который характеризует взаимодействие ионов.
Коэффициент активности может быть рассчитан в зависимости от ионной силы по выражениям:
 при µ -2 при µ -2 |
 при 10 -2 -1 при 10 -2 -1 |
 + 0,1z 2 µ при 0,1 . 10 -4 моль/л. + 0,1z 2 µ при 0,1 . 10 -4 моль/л. Пример оформления расчетной задачи Задача 1.Вычислите ионную силу, коэффициенты активности и активность ионов в 0,01 M растворе Fe(NO3)3. 1. Записываем уравнение диссоциации соли Fe(NO3)3, во второй строке указываем начальную концентрацию соли, а в третьей строке – концентрации ионов, образующихся в результате диссоциации. 2. Рассчитываем ионную силу раствора. 3. Рассчитываем коэффициенты активности ионов.
Следовательно, 4. Рассчитываем активности ионов. Ответ: μ=0,06; Свойства сильных электролитовЭлектролиты, практически полностью диссоциирующие в водных растворах, называются сильными электролитами. К сильным электролитам относятся большинство солей, которые уже в кристаллическом состоянии построены из ионов (они хорошо растворяются в воде), гидроксиды щелочных и щелочноземельных металлов (щелочи), некоторые кислоты (НСl, HBr, HI, HсlO4, HNO3, H2SO4). Многие свойства растворов, такие, как осмотическое давление, температура кипения и замерзания, давление насыщенного пара растворителя над раствором, зависят как от концентрации раствора, т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность их зарядов и чем меньше среднее расстояние между ними. В растворах слабых электролитов взаимодействие между ионами относительно невелико вследствие их незначительной концентрации. Сильные электролиты диссоциируют практически полностью. В растворах сильных электролитов из-за сильной диссоциации концентрация ионов довольно велика, так что силы межионного взаимодействия заметно проявляются даже при малой концентрации электролита. В результате ионы оказываются не вполне свободными в своем движении, и все свойства электролита, зависящие от числа ионов, проявляются слабее, чем следовало бы ожидать при полной диссоциации электролита на невзаимодействующие между собой ионы. Подобные несоответствия объясняет теория сильных электролитов, разработанная П. Дебаем и Э. Хюккелем (1923). Согласно этой теории, в растворах сильных электролитов действуют электростатические силы притяжения между разноименными ионами и силы отталкивания – между одноименными. Вокруг каждого иона образуется ионная атмосфера, состоящая из ионов противоположного знака. Каждый из ионов этой атмосферы находится в окружении другой ионной атмосферы. Поэтому раствор сильного электролита можно рассматривать как систему равномерно распределенных по всему объему раствора разноименных ионов, каждый из которых находится в центре силового поля создаваемого окружающими ионами. Тепловое движение постоянно изменяет картину распределения ионов в такой сфере: в ней происходит постоянный ионный обмен. Ввиду того, что радиус ионной атмосферы относительно велик, атмосферы двух соседних ионов пересекаются, в результате чего каждый ион в данный момент может входить в состав одной или даже нескольких ионных атмосфер других ионов. Все это обуславливает довольно сложные взаимоотношения между компонентами раствора, которые не могут не сказываться на его свойствах. Поэтому для описания состояния ионов в растворе пользуются их активностью, т. е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах (а = gС). Коэффициенты активности зависят от природы растворителя и растворенного вещества, концентрации раствора и температуры. Для сильных электролитов их называют кажущейся степенью диссоциации или коэффициентом электропроводности. В области разбавленных растворов (концентрация ниже 0,1 моль/дм 3 ) коэффициенты активности зависят главным образом от концентрации и заряда ионов, присутствующих в растворе и мало зависят от природы растворенных веществ. Эта закономерность известна в теории растворов под названием правила ионной силы. Согласно этому правилу, ионы с одинаковыми зарядами, независимо от их природы, в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионной силой раствора (I) называется полусумма произведений концентраций всех ионов присутствующих в растворе, на квадрат их заряда: Например, ионная сила раствора хлорида алюминия с концентрацией 0.01 моль/дм³, диссоциирующего AlCl3 D Al +3 + 3Cl — , равна I = 0,5(0,01 . 3 2 + 0, 03 . 1 2 ) = 0,06 Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы растворов и заряда ионов (табл. 6) Для разбавленных растворов, ионная сила которых не превышает 0,01, коэффициент активности ионов связан с ионной силой раствора следующим соотношением: lgg = -0,5z 2 √I (7.37) Коэффициенты активности широко используются в практике и теоретических расчетах, но сами по себе не раскрывают природу процессов, протекающих в реальных системах. Они просто позволяют, используя простейшие соотношения, быстро и легко рассчитать реальные свойства разбавленных растворов сильных электролитов. Таким образом, поведение растворов слабых электролитов описывается законом разведения Оствальда, а разбавленных растворов сильных электролитов – моделью ионной атмосферы Дебая-Хюккеля. Однако общая теория растворов, охватывающая все виды растворов электролитов и весь диапазон концентраций, до сих пор не создана. Коэффициент активности ионов в водных растворах (при 298 К)
Не нашли то, что искали? Воспользуйтесь поиском: Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 8558 — 193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь. Отключите adBlock! Лекция 9. Свойства растворов электролитов(4 часа).1. Электролитическая диссоциация С. Аррениуса. Степень и константа диссоциации. Закон разбавления Оствальда. 2. Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. 3. Диссоциация кислот, оснований и солей с точки зрения теории электролитической диссоциации Аррениуса. 4. Ионные уравнения реакций. Гидролиз солей. 5. Теория растворов сильных электролитов. 9.1 Электролитическая диссоциация. Степень и константа диссоциации. Закон разбавления Оствальда. Электролитами являются растворы кислот, оснований и солей. В воде эти вещества распадаются на ионы под действием полярных молекул воды. Количественно способность к диссоциации характеризуется степенью и константой диссоциации. Степень диссоциации (α) это частное от деления числа молекул, распавшихся на ионы на общее число молекул: α = n/N, где n –число молекул, распавшихся на ионы, а N – общее число молекул. Степень диссоциации измеряется в процентах и в долях единицы и может меняться от нуля до 100% и от нуля до единицы. Если α > 30% — электролит сильный, α Константа диссоциации связана со степенью диссоциации: Это закон разбавления Оствальда. Чем больше концентрация, тем меньше степень диссоциации: α 2 = Kd/C. 9.2 Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. Вода является слабым электролитом. Диссоциация воды протекает по уравнению: H2O ↔ H + + OH — и характеризуется константой диссоциации: Kd = [H + ]∙[OH — ] / [H2O] = 1,810 -16 , [H2O] = 1000/18 = 55,56 моль/л – концентрация воды в 1 литре, (Mr =18г/моль – молярная масса воды).Ионное произведение воды Kw = [H + ]∙[OH — ]= 1,8∙10 -16 ∙55,56 =10 -14 (при 22 0 С). В чистой воде концентрация катионов водорода равна концентрации гидроксид-ионов [H + ] = [OH — ] = 10 -7 моль/л. Если концентрация катионов водорода больше, чем 10 -7 моль/л, то раствор имеет кислую среду, а если меньше 10 -7 моль/л, то раствор имеет щелочную среду. Для удобства обозначения реакции среды вводятся водородный и гидроксильный показатели: pH = — ℓg [H + ] и pOH = — ℓg [OH — ], PH 7 – среда щелочная. pH = 7 – среда нейтральная. 9.3 Диссоциация кислот, оснований и солей с точки зрения теории электролитической диссоциации Аррениуса. Кислота — это электролит, при диссоциации которого в растворе появляется катион водорода. Так, например: азотная кислота является сильным электролитом и диссоциирует по схеме а азотистая кислота электролит слабый и в растворе этой кислоты в равновесии находятся ионы и молекулы Многоосновные кислоты являются слабыми электролитами и диссоциируют ступенчато, например: H2PO4 — ↔ H + + HPO4 2- — вторая ступень диссоциации, HPO4 2- ↔ H + + PO4 3- — третья ступень диссоциации. Основания — это электролиты, в растворе которых имеются гидроксид ионы. Они могут быть сильными и слабыми электролитами. Основания сильные электролиты образованы щелочными, щелочноземельными элементами и таллием(I). Их называют щелочами, они растворяются в воде. В водных растворах полностью диссоциируют на ионы, например: Все остальные основания в воде не растворимы (кроме NH4OH) и являются слабыми электролитами, в растворе которых в равновесии находятся молекулы и ионы, например: FeOH + ↔ Fe 2+ + OH — Соли являются сильными электролитами, если растворимы в воде. Они диссоциируют на катионы металла и кислотный остаток, например: 9.4 Ионные уравнения реакций. Гидролиз солей. Реакции между ионами доходят до конца, если образуются слабые электролиты, газообразные вещества или выпадают осадки (правило Бертолле), например: HCl + NaOH = NaCl + H2O H + + OH — = H2O (вода слабый электролит), Pb 2+ + SO4 2- = PbSO4↓(образуется осадок PbSO4). Гидролиз солей это реакция обратная реакции нейтрализации. Нейтрализация сильного основания сильной кислотой доходит до конца, т.к. образуется единственный слабый электролит вода. Нейтрализация слабого основания сильной кислотой (или наоборот) до конца не доходит, т.к. и слева и справа есть слабые электролиты. Следовательно, гидролизу подвергаются соли, образованные слабой кислотой и сильным основанием, слабым основанием и сильной кислотой, а также слабым основанием и слабой кислотой. В последнем случае гидролиз может доходит до конца, но может и не доходить. Результатом гидролиза может быть изменение реакции среды. Гидролиз – разложение солей водой или разложение воды солями. Его можно рассмотреть на примерах взаимодействия солей карбоната натрия, сульфата железа (II) и сульфида алюминия водой. 1. Na2CO3 – соль образована сильным основанием и слабой кислотой, подвергается гидролизу, гидролиз до конца не доходит, реакция среды щелочная (pH > 7). Na2CO3 + H2O ↔ NaHCO3 + NaOH – молекулярное уравнение CO3 2- + H2O ↔ HCO3 — + OH — — ионное уравнение 2. FeSO4 — cоль образована слабым основанием и сильной кислотой, гидролизу подвергается, до конца гидролиз не доходит, реакция среды кислая (pH 2+ + H2O ↔ FeOH + + H + — ионное уравнение 3. Al2S3 – соль образована слабым основанием и слабой кислотой, гидролизу подвергается, гидролиз доходит до конца, а реакция среды зависит от соотношения силы, образующихся кислоты и основания. 2Al 3+ + 3S 2- + 6H2O→ 2Al(OH)3 + 3H2S — ионное уравнение. 9.5 Теория растворов сильных электролитов. Сильные электролиты полностью распадаются на ионы в водных растворах. Но данные по электропроводности в растворах не соответствуют степени диссоциации, равной единице. Для растворов сильных электролитов вводится понятие кажущаяся степень диссоциации. Объясняется это тем, что в растворах сильных электролитов наблюдается межионное взаимодействие, особенно при больших концентрациях растворов. По этой причине вводится активность (a) ионов (a = C·f, где C –аналитическая концентрация, а f – коэффициент активности), т.к. часть ионов задействована в ионные двойники и тройники и, таким образом, не проявляет себя. Активная концентрация (a) это действующая концентрация ионов. Межинное взаимодействие (взаимодействие ионов через молекулы воды, окружающие ионы) учитывается ионной силой раствора (μ). μ = ½ Σ Ci∙ Zi 2 , где Ci – аналитическая концентрация ионов, а Zi – заряд ионов. Ионная сила позволяет рассчитать коэффициент активности (для μ 2 μ 1/2 . Дата добавления: 2017-12-05 ; просмотров: 143 ; Теория растворов сильных электролитовРазработана в 1923 г. П.Дебаем и С.Хюккелем. Основные положения.1. Сильные электролиты в водных растворах полностью диссоциируют, т.е. степень диссоциации = 1 или 100%. В растворах электролитов ионы взаимодействуют с полярными молекулами растворителя и образуются сольватные оболочки (гидратные оболочки, если растворитель – вода). Гидратные оболочки увеличивают размер ионов и поэтому уменьшается способность иона переносить электрический ток, участвовать в химических реакциях. . Ионы взаимодействуют с друг другом и вокруг каждого гидратированного иона возникает “ионная атмосфера” из гидратированных ионов противоположного знака, что тормозит действие каждого иона. Возникновение гидратных оболочек и ионных атмосфер позволяет говорить лишь о кажущейся степени диссоциации, так как она не соответствует действительной степени распада электролита на ионы. В связи с этим для растворов сильных электролитов вводится величина, называемая активностью (активной концентрацией). Под активностью электролита понимают условную эффективную концентрацию, в соответствии с которой электролит проявляет себя в химических реакциях, коллигативных свойствах растворов, при переносе электрических зарядов. Активность связана с истинной концентрацией растворенного вещества соотношением a = fа С, где С — аналитическая концентрация, моль/л; а — активность электролита, моль/л; fа — коэффициент активности (величина безразмерная). fа = кажущаяся Коэффициент активности fа характеризует отклонение некоторых свойств реального раствора сильного электролита с концентрацией С от свойств раствора при бесконечном разведении или идеального раствора, т.е. при отсутствии межионных взаимодействий. Например, если fа =1, то движение ионов в растворе свободное, отсутствует взаимодействие ионов и в этом случае а = С; если fа 1, то возникают электростатические взаимодействия между ионами. Коэффициент активности fазависит от величины заряда иона, природы растворителя, температуры и концентрации ионов. Другой количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора I : I = 1 /2 (С1z1 2 +С2 z2 2 + . Сi zi 2 ) где: С — концентрация данного иона в моль/кг, z — заряд каждого иона. Между ионной силой раствора I и коэффициентом активности fа существует взаимосвязь: lg fа = – 0,5 z 2 где z – заряд иона. Чем больше ионная сила раствора и величина заряда ионов, тем меньше коэффициент активности. Ионная сила плазмы крови человека близка к 0,15 моль/кг. Протонная (протолитическая) теория кислот и основанийПротонная теория кислот и оснований была разработана в 1923 г. И.Бренстедом и Т.Лоури. Основные положения.1. Кислоты — это нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). Основания — это нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). 2. В зависимости от партнера вещество может быть или основанием или кислотой. Понятие о теории сильных электролитовЭлектролиты — это вещества, способные распадаться на ионы в расплаве или растворе. Распад на ионы называется диссоциацией. Диссоциация слабых электролитов подчиняется закону действующих масс и количественно характеризуется константой диссоциации. Особенности процессадиссоциации разбавленных растворов слабых электролитов достаточно хорошо описываются классической теорией электролитической диссоциации Аррениуса. Эта теория не сразу получила признание, т.к. не объясняла причин диссоциации. А ведь энергетические затраты на ионизацию твердых солей довольно велики 100 ¸ 200 кДж/моль. Впоследствии было установлено, что энергетические затраты на разрушение кристаллической решетки при растворении кристаллов, на диссоциацию кислот и солей компенсируются энергией сольватации ионов. К началу ХХ века теория электролитической диссоциации достигла больших успехов. Однако поведение концентрированных растворов слабых электролитов и растворов сильных электролитов количественно описать с позиций теории Аррениуса невозможно. Многие аномалии в свойствах растворов сильных электролитов связаны с полной диссоциацией молекул сильных электролитов. Это приводит к возникновению межионного взаимодействия, т.к. концентрация ионов в растворе намного выше, чем у слабых электролитов. Необходимо отметить, что непостоянство Кд наблюдается и у слабых электролитов уже при умеренных концентрациях. И оно тоже связано с межионным взаимодействием, не предусмотренным теорией Аррениуса. Теория электролитической диссоциации не могла объяснить и солевой эффект. Этот и другие явления можно объяснить с помощью теории Дебая – Хюккеля (1923 г). В теории электролитов важным является вопрос о распределении ионов в растворе. Теория электролитической диссоциации Аррениуса рассматривает ионы в растворе, находящиеся в состоянии беспорядочного движения. Это не соответствует действительности, т.к. не учитывается электростатическое взаимодействие между ионами. Электрические силы проявляются на больших расстояниях, а в растворах сильных электролитов концентрация ионов большая, расстояния между ионами невелики. Поэтомумежионное взаимодействие влияет на распределение ионов. В распределении ионов будут участвовать два вида движения: беспорядочное тепловое и упорядоченное электростатическое, энергии которых сравнимы по величине. Конкуренция этих двух видов движения приводит к тому, что реальное распределение является промежуточным между хаотическим и упорядоченным, что создает трудности при создании теории электролитов. Электростатическое притяжение разноименно заряженных и отталкивание одноименно заряженных ионов приводит к тому, что вокруг положитель-но заряженного иона с большей вероятностью располагаются отрицатель-но заряженные ионы, а вокруг отрицательно заряженного иона распола-гается больше положительно заряженных ионов. При этом раствор в целом остается электронейтральным. Эти представления Дебай и Хюккель сформулировали в виде идеи о наличии ионной атмосферы вокруг каждого иона, состоящей из положи-тельно и отрицательно заряженных ионов. Электростатическая теория раз-бавленных растворов сильных электролитов Дебая — Хюккеля учитывает также взаимодействие ионов друг с другом. Основные положения теории Дебая-Хюккеля: 1) электролит диссоциирован полностью (a = 1); 2) растворитель представляет собой непрерывную среду, т.е. не учитывает-ся изменение диэлектрической проницаемости среды в результате образования раствора; 3) ионы взаимодействуют по закону Кулона, т.е. ионы рассматриваются как материальные точки (собственным объемом ионов пренебрегают); 4) электростатическое взаимодействие рассматривается как взаимодейст-вие между центральным ионом и его ионной атмосферой; 5) из всех свойств ионов учитывается только заряд. Рассмотрим положение катиона в растворе и образование ионной атмосферы: Вокруг каждого катиона располагаются другие ионы и (–) и (+), но вероятность нахождения анионов возле центрального катиона больше. В целом система будет электронейтральна. В теории Дебая-Хюккеля остает-ся неучтенным целый ряд взаимодействий и свойств ионов: сольватация ионов, особенности строения ионов (многие ионы состоят из нескольких структурных единиц и имеют неравномерное распределение заряда), их поляризуемость. Это ограничивает применимость теории. Тем не менее, ионная атмосфера – реально существующая система в растворах электролитов. Она обладает следующими характерными особенностями: 1) в состав ионной атмосферы входят катионы и анионы, причем суммарный заряд ионной атмосферы равен по величине заряду централь-ного иона и противоположен ему по знаку; 2) все ионы в растворе равноправны, поэтому каждый является центральным и одновременно входит в состав ионной атмосферы другого иона: 3) ионная атмосфера носит статистический характер, т. е. в следствие теплового движения ионов происходит постоянный обмен местами ионов из атмосферы с ионами, находящимися за ее пределами. Распределение избыточного заряда в ионной атмосфере дискретно, но теория Дебая — Хюккеля рассматривает ионную атмосферу, как непре-рывную, заряд которой «размазан» по всему пространству, убывая по мере удаления от центрального иона. Теория Дебая – Хюккеля позволяет рассчитать некоторую величину X (хи), связанную с термодинамическими свойствами ионов X = где хi – число ионов в единице объема, 1 см 3 ; где Сi – концентрация ионов, моль/л. Величина Толщина ионной атмосферы зависит от температуры, диэлектрической проницаемости (e) растворителя, числа и заряда ионов. Причем, X связано с электрохимическим потенциалом Если ион находится в покое, ионная атмосфера пребывает в стационарном состоянии и имеет сферическую поверхность. При движении иона впереди него непрерывно образуется новая атмосфера, а позади — разрушается старая. Этот процесс быстрый, но не мгновенный. Он характеризуется некоторым временем релаксации, т.е. ионная атмосфера теряет шаровую симметрию и возникает электростатическая сила, препятствующая движению центрального иона. Таким образом возникает релаксационный эффект торможения. Время релаксации – это время, за которое избыточная концентрация ионов в ионной атмосфере при распаде или возникновении ее изменится в е раз, е = 2,73. На ион, двигающийся в электрическом поле, действуют две силы: 1) Сила электрического поля, где V – градиент потенциала поля , z – заряд иона. 2) Сила вязкого сопротивления среды (растворителя), где k — коэффициент трения, u – скорость движения иона. Эти две силы уравновешивают друг друга Fo = F и ион движется равномерно. Кроме того, на движущийся ион действуют тормозящие силы, обусловленные электростатическим взаимодействием ионов и их ионных атмосфер (электрофоретическое торможение). Электрофоретическая сила торможения Fэ возникает потому, что ионная атмосфера, имея противоположный центральному иону заряд, движется ему навстречу под действием внешнего поля. К тому же, ионы — гидратированы, т.е. ионная атмосфера будет увлекать за собой центральный ион. Движение катионов тормозится, и это торможение называется электро-форетическим. Во время движения центрального иона из-за несим-метричности ионной атмосферы возникает уменьшение градиента потенциала внешнего поля на величину DV, т.е. возникает тормозящая сила Fр. Этот вид торможения называется релаксационным.Таким образом, при равновесии сил, действующих на ион Силы релаксационного и электрофоретического торможения опреде-ляются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита при прочих постоянных условиях эти силы возрастают с ростом концентрации.. Электростатическая теория сильных электролитов позволяет вычис-лить коэффициент активности отдельного иона gi и g± (средний коэффициент активности). Например, для бинарного раствора где А = 1,825 × 10 6 (e × p) –3/2 ; e — диэлектрическая проницаемость растворителя. В разбавленном водном растворе при 298 К e = 78,3 и Это уравнение (7.44) применимо только к сильно разбавленным растворам электролитов и называется предельным законом Дебая-Хюккеля. Оно теоретически обосновывает правило ионной силы. Т.е. при данной ионной силе раствора среднеионный коэффициент активности электролита в сильно разбавленном растворе является постоянной величиной. Предельный закон Дебая – Хюккеля, в связи с приближениями физической модели и математическими допущениями при выводе, справедлив лишь в растворах с ионной силой I 2 /eq = 2kT ® r = z1z2e 2 /2ekT, где r — максимальное расстояние между ионами. Для водных растворов электролитов типа 1,1 при 25°С r = 3,57 |
- http://studfiles.net/preview/5242345/page:13/
- http://otherreferats.allbest.ru/physics/00735640_0.html
- http://ido.tsu.ru/schools/chem/data/res/ion/metod/text/kadr_6.htm
- http://studopedia.ru/3_78016_svoystva-silnih-elektrolitov.html
- http://znatock.org/s2200t1.html
- http://studfiles.net/preview/3562532/page:10/
- http://lektsia.com/5x3899.html

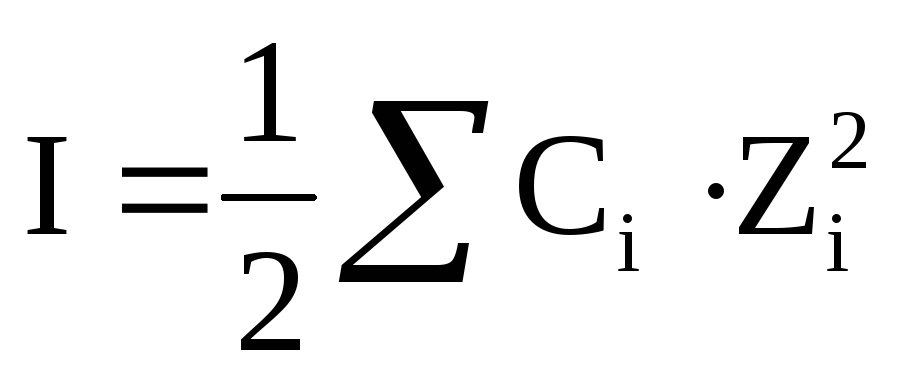







 = — 0,886;
= — 0,886;
 = — 0,098.
= — 0,098. = 0,13;
= 0,13;  = 0,80.
= 0,80.

 =0,0013 моль/л;
=0,0013 моль/л;  =0,024 моль/л.
=0,024 моль/л. | 6842 —
| 6842 —  или читать все.
или читать все. 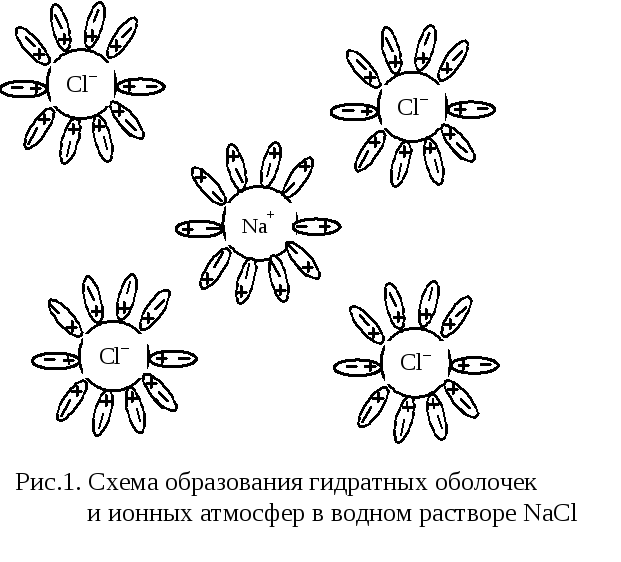
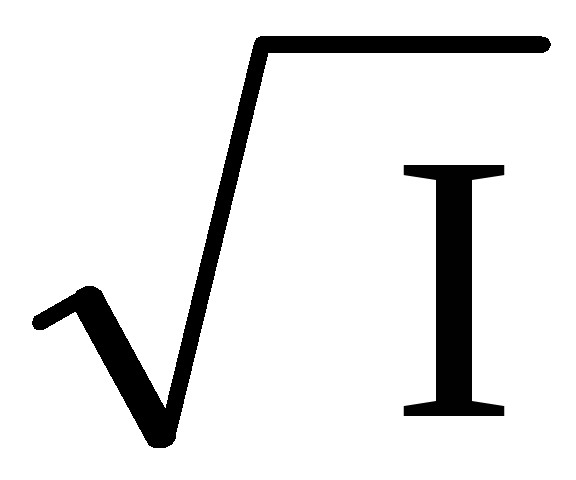 ,
,
 ,
,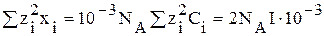 ,
, называется толщинойионной атмосферы.
называется толщинойионной атмосферы. .
.
 , (7.44)
, (7.44) . Т.е. ионные пары образуются, если расстояние между ионами меньше 3,57
. Т.е. ионные пары образуются, если расстояние между ионами меньше 3,57