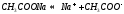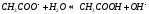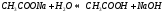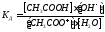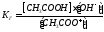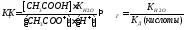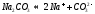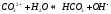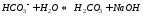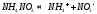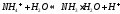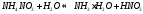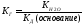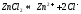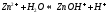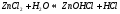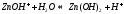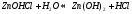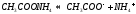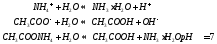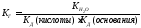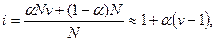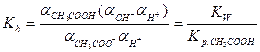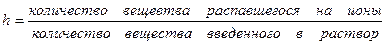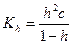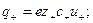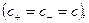Существует 2 теории растворов: физическая и химическая.
Была открыта Якобом Г. Вант-Гоффом и Свате А.Аррениусом.
Суть теории растворов: растворитель – химическая индифферентная среда, в которой равномерно распределены частицы растворенного вещества. Теория не предполагает наличие межмолекулярных связей между растворителем и растворенным веществом.
Под эту теорию подходят только идеальные растворы, где компоненты растворителя никак не воздействуют на растворимое соединение. Примером являются газовые растворы, где нереагирующие между собой газы смешиваются друг с другом в неограниченных количествах. Все физические данные (температура кипения и плавления, давление, теплоемкость) вычисляется исходя из свойств всех соединений, входящих в состав.
По закону Дальтона: общее давление газовой смеси равно сумме парциальных давлений ее компонентов:
Химическая теория растворов.
Химическую (сольватную) теорию растворов описал Д.И. Менделеев. Суть заключается в следующем: частицы растворителя и растворенного вещества реагируют друг с другом, в результате чего получаются нестойкие соединения переменного состава – гидраты (сольваты). Основные связи тут – водородные.
Вещество может распадаться на слои (растворяться) в случае полярного растворителя (воды). Ярким примером является растворение поваренной соли.
Также может проткать реакция между компонентами смеси:
В ходе процесса растворения происходит изменение состава и объема реакционной смеси, т.к. протекают 2 процесса: разрушение структуры растворяемого вещества и химическая реакция между частицами. Оба процесса идут с изменением энергии.
Тепловые эффекты могут быть экзотермическими и эндотермическими (с выделением и поглощением энергии).
Соединения с частицами растворителя называются гидратами.
Кристаллические вещества, в состав которых входят гидраты, называются кристаллогидратами и имеют различную окраску. Например, кристаллогидрат сульфата меди: CuSO4 ·5H2О. Раствор кристаллогидрата синий. Если рассмотреть кристаллогидрат кобальта CoCl2· 6H2O, то он обладает розовым цветом, CoCl2· 4H2O – красный, CoCl2 ·2H2O — сине-фиолетовый, CoCl2 ·H2О – темно-синий, а безводный раствор хлорида кобальта – бледно-синего цвета.
Теории растворов
Физическая теория растворов (Вант – Гофф, Аррениус – ученые внесшие вклад в развитие) рассматривала, растворитель, как инертную среду и приравнивала растворы к простым механическим смесям.
Недостатки теории: а) не объясняла энергетический эффект растворителя; б) не объясняла изменения объема в процессе растворения; в) не объясняла изменение окраски в процессе растворения
Химическая теория растворов (Д.И.Менделеев) Растворы рассматривались, как химические соединения. Однако, в растворах нет строгого соотношения между веществом и растворителем, т.е. растворы не подчиняются закону постоянства состава. Кроме того в свойствах растворов можно обнаружить многие свойства, его отдельных компонентов, чего не наблюдается в случае химического соединения.
Физико-химическая теория растворов (Каблуков) С этой точки зрения растворы занимают промежуточное положение, между механическими смесями и химического соединения.
Процесс растворения тесно связан с диффузией, под влияние растворителя от поверхности твердого вещества, постепенно отрываются молекулы или ионы и в растворе диффузий распределяются по всему объему растворителя. С поверхности затем снимается новый слой молекул и т.д. Перешедшие в растворе ионы остаются связанными с молекулами воды и образуют гидраты ионов. В общем случае любого растворителя эти соединения называют сольватами ионов. Одновременно происходит обратный процесс выделения молекул из раствора. Обратный процесс тем больше, чем выше концентрация раствора при динамическом равновесии, сколько молекул растворяются, столько же выделяется из раствора.
5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
Взаимодействие ионов соли с водой приводящее к образованию слабого электролита называется гидролизом соли. Различают несколько случаев гидролиза:
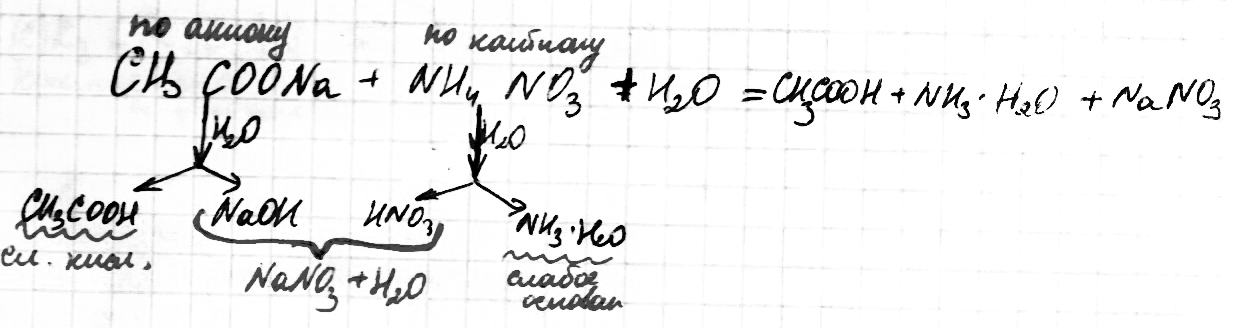
Соль сильного основания и слабой кислоты. (CH3COONa, NaCO3, KCN, Na2S)
В водном растворе соль сначала диссоциирует на катионы и анионы
диссоциация:
Анион слабой кислоты взаимодействует с водой, создавая щелочную среду (гидролиз по аниону):
гидролиз:
молекулярное уравнение гидролиза:
Константа диссоциации уравнения гидролиза:
т.к. 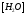
т.к. Кводы = [H + ]·[OH — ], то [OH — ]= Кводы/[H + ]
Т.е. чем слабее кислота, тем меньше ее Кд, тем сильнее будет гидролизована соль.
Гидролиз солей многоосновных кислот протекает ступенчато:
1 ступень:
2 ступень:
В растворах обычной концентрации гидролиз этой соли идет лишь по первой ступени с образованием кислой соли. В сильно разбавленных растворах гидролиз частично идет по 2 ступени с образованием свободной угольной кислоты. Гидролиз по 2 ступени не значителен, т.к. велика концентрация ионов ОН.
Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
диссоциация:
Катион слабого основания взаимодействует с водой, создавая кислую среду:
гидролиз:
молекулярное уравнение гидролиза:
Чем слабее основание, тем сильнее будет гидролизована соль.
Соли многокислотных оснований гидролизуются ступенчато:
1 ступень:
2 ступень:
В обычных условиях гидролиз этой соли идет только по первой ступени.
В данном случае гидролизу подвергается и катион, и анион соли (гидролиз по катиону и аниону)
Диссоциация:
Среда гидролиза определяется тем ионом соли, у которого степень гидролиза выше (кислая, щелочная, нейтральная)
Эти соли при растворении в воде не гидролизуются, их растворы имеют нейтральную реакцию.
Полный (совмещенный) гидролиз
Протекает при сливании 2х растворов разных солей, причем одна из солей гидролизована по катиону, а другая по аниону, при этом образуется слабая кислота и слабое основание.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
h связано с КГ уравнением аналогичным закону разбавления Оствальда
Химическая теория растворов.
Лекция 1.
«ПОНЯТИЕ «РАСТВОР». ХИМИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ»
Растворы имеют важное значение в жизни и практической деятельности человека. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). Организм – сложная химическая система, и подавляющее большинство химических реакций в организме происходит в водных растворах. Именно по этой причине человеческий организм на 70 % состоит из воды, а сильное обезвоживание организма наступает быстро и является очень опасным состоянием.
Многие технологические процессы, например получение соды или азотной кислоты, выделение и очистка редких металлов, отбеливание и окрашивание тканей, протекают в растворах.
Чтобы понять механизм многих химических реакций, необходимо изучить процессы, протекающие в растворах.
Понятие «раствор». Виды растворов
Раствор – твердая, жидкая или газообразная гомогенная система, состоящая из двух или более компонентов.
Гомогенная система состоит из одной фазы.
Фаза — часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства (плотность, теплопроводность, электропроводность, твердость и т.д.) изменяются скачкообразно. Фаза может быть твердой, жидкой, газообразной.
Наиболее важным видом растворов являются жидкие растворы, но в широком смысле растворы также бывают еще твердые (сплав латунь: медь, цинк; сталь: железо, углерод) и газообразные (воздух: смесь азота, кислорода, углекислого газа и различных примесей).
Раствор содержит не менее двух компонентов, из которых один является растворителем, а другие – растворенными веществами.
Растворитель – это компонент раствора, находящийся в том же агрегатном состоянии, что и раствор. Растворителя в растворе по массе всегда больше, чем остальных компонентов. Растворенное вещество находится в растворе в виде атомов, молекул или ионов.
От растворов отличаются:
Суспензия – это система, состоящая из мелких твердых частиц, взвешенных в жидкости (тальк в воде)
Эмульсия– это система, в которой одна жидкость раздроблена в другой, не растворяющей ее жидкости (т.е. мелкие капли жидкости, находящихся в другой жидкости: например,бензин в воде).
Аэрозоль – газ со взвешенными в нем твердыми или жидкими частицами (туман: воздух и капли жидкости)
Суспензии, эмульсии и аэрозоли состоят из нескольких фаз, они не гомогенны и являются дисперсными системами. Суспезии, эмульсии и аэрозоли – не растворы!
Химическая теория растворов.
Растворитель химически взаимодействует с растворенным веществом.
Химическая теория растворов создана Д.И. Менделеевым в конце ХIХв. на основании следующих экспериментальных фактов:
1) Растворение любого вещества сопровождается поглощением или выделением теплоты. То есть растворение является экзотермической или эндотермической реакцией.
Экзотермический процесс – процесс, сопровождающийся выделением тепла во внешнюю среду (Q>0).
Эндотермический процесс – процесс, сопровождающийся поглощением тепла из внешней среды (Q
3) При растворении некоторых бесцветных веществ образуются окрашенные растворы. (пример: CuSO4 – бесцветный, дает синий раствор).
Объяснение: при растворении некоторых бесцветных солей образуются окрашенные кристаллогидраты.
Вывод: Растворение – это сложный физико-химический процесс, при котором происходит взаимодействие (электростатическое, донорно-акцепторное, образование водородной связи) между частицами растворителя и растворенных веществ.
Процесс взаимодействия растворителя с растворенным веществом называется сольватацией. Продукты этого взаимодействия – сольваты. Для водных растворов применяются термины гидратация и гидраты.
Иногда при выпаривании воды кристаллы растворенного вещества оставляют часть молекул воды в своей кристаллической решетке. Такие кристаллы называются кристаллогидратами.Записываются так: CuSO4*5Н2О. То есть, каждая молекула сульфата меди CuSO4 удерживает около себя 5 молекул воды, встраивая их в свою кристаллическую решетку.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 7964 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Физическая теория растворов.
РАСТВОРЫ
Общие сведения
Растворы — это гомогенные системы переменного состава, состоящие из двух и более веществ, называемых компонентами. По агрегатному состоянию растворы могут быть газообразными (воздух), жидкими (кровь, лимфа) и твердыми (сплавы). В медицине наибольшее значение имеют жидкие растворы, которые играют исключительную роль в жизнедеятельности живых организмов. С образованием растворов связаны процессы усвоения пищи и выведения из организма продуктов жизнедеятельности. В форме растворов вводится большое количество лекарственных препаратов.
Для качественного и количественного описания жидких растворов используются термины «растворитель» и «растворенное вещество», хотя в некоторых случаях такое разделение является достаточно условным. Так, медицинский спирт (96% раствор этанола в воде) скорее следует рассматривать как раствор воды в спирте. Все растворители делятся на неорганические и органические. Важнейшим неорганическим растворителем (а в случае биологических систем – единственным) является вода. Это обусловлено такими свойствами воды, как полярность, низкая вязкость, склонность молекул к ассоциации, относительно высокие температуры кипения и плавления. Растворители органической природы разделяют на полярные (спирты, альдегиды, кетоны, кислоты) и неполярные (гексан, бензол, четыреххлористый углерод).
Процесс растворения в равной степени зависит как от природы растворителя, так и от свойств растворенного вещества. Очевидно, что способность образовывать растворы выражена у разных веществ по-разному. Одни вещества могут смешиваться друг с другом в любых количествах (вода и этанол), другие – в ограниченных (вода и фенол). Однако, следует помнить: абсолютно нерастворимых веществ не существует!
Склонность вещества растворяться в том или ином растворителе можно определить, используя простое эмпирическое правило: подобное растворяется в подобном. Действительно, вещества с ионным (соли, щелочи) или полярным (спирты, альдегиды) типом связи хорошо растворимы в полярных растворителях, например, в воде. И наоборот, растворимость кислорода в бензоле на порядок выше чем в воде, так как молекулы O2 и C6H6неполярны.
Степень сродства соединения к определенному типу растворителя можно оценить, анализируя природу и количественное соотношение входящих в его состав функциональных групп, среди которых выделяют гидрофильные (притягивающие воду) и гидрофобные (отталкивающие воду). К гидрофильным относят полярные группы, такие как гидроксильная (-OH), карбоксильная (-COOH), тиольная (-SH), амино (-NH2). Гидрофобными считают неполярные группы: углеводородные радикалы алифатического (-CH3, -C2H5) и ароматического (-C6H5) рядов. Соединения, имеющие в своем составе как гидрофильные, так и гидрофобные группы, называют дифильными. К таким соединениям относят аминокислоты, белки, нуклеиновые кислоты.
Теории растворов
В настоящее время известны две основные теории растворов: физическая и химическая.
Физическая теория растворов.
Физическая теория растворов была предложена С. Аррениусом (1883) и Я. Г. Вант-Гоффом (1885). В данной теории растворитель рассматривается как химически инертная среда, в которой равномерно распределены частицы (молекулы, ионы) растворенного вещества. При этом предполагается отсутствие межмолекулярного взаимодействия как между частицами растворенного вещества, так и между молекулами растворителя и частицами растворенного вещества. Однако впоследствии выяснилось, что условиям данной модели удовлетворяет поведение лишь малой группы растворов, которые были названы идеальными. В частности, идеальными растворами можно считать газовые смеси и очень сильно разбавленные растворы неэлектролитов.
Химическая теория растворов.
Химическая, или сольватная, теория растворов была предложена в 1887 г. Д.И. Менделеевым, который установил, что в реальном растворе присутствуют не только индивидуальные компоненты, но и продукты их взаимодействия. Исследования водных растворов серной кислоты и этилового спирта, проведенные Д.И. Менделеевым, легли в основу теории, суть которой заключается в том, что между частицами растворенного вещества и молекулами растворителя происходят взаимодействия, в результате которых образуются нестойкие соединения переменного состава, называемые сольватами или гидратами, если растворителем является вода. Главную роль в образовании сольватов играют непрочные межмолекулярные силы, в частности, водородная связь.
В этой связи следует принять следующую трактовку понятия «раствор»:
Раствором называется гомогенная система переменного состава, состоящая из двух и более компонентов и продуктов их взаимодействия.
Из данного определения следует, что растворы занимают промежуточное положение между химическими соединениями и смесями. С одной стороны, растворы однородны, что позволяет рассматривать их как химические соединения. С другой стороны, в растворах нет строгого стехиометрического соотношения между компонентами. Кроме того, растворы можно разделить на составные части (например, при упаривании раствора NaCl можно выделить соль в индивидуальном виде).
Связь между различными способами
Кислоты и основания
Несмотря на то, что понятия «кислота» и «основание» широко используются для описания химических процессов, единого подхода к классификации веществ с точки зрения отнесения их к кислотам или основаниям нет. Существующие в настоящее время теории (ионная теория С. Аррениуса, протолитическая теория И. Бренстеда и Т. Лоури и электронная теория Г. Льюиса) имеют определенные ограничения и, таким образом, применимы лишь в частных случаях. Остановимся подробнее на каждой из этих теорий.
Теория Аррениуса.
В ионной теории Аррениуса понятия «кислота» и «основание» тесно связаны с процессом электролитической диссоциации:
Кислотой является электролит, диссоциирующий в растворах с образованием ионов Н + ;
Основаниемявляется электролит, диссоциирующий в растворах с образованием ионовОН — ;
Амфолитом (амфотерным электролитом) является электролит, диссоциирующий в растворах с образованием как ионовН + , так и ионов ОН — .
|
НА ⇄ Н + + А —
|
МеОН⇄Ме + + ОН —
|
nH + +MeOn n — ⇄Ме(ОН)n⇄Ме n + +nОН —
В соответствии с ионной теорией кислотами могут быть как нейтральные молекулы, так и ионы, например:
Аналогичные примеры можно привести и для оснований:
КОН К + + ОН —
К амфолитам относят гидроксиды цинка, алюминия, хрома и некоторые другие, а также аминокислоты, белки, нуклеиновые кислоты.
В целом, кислотно-основное взаимодействие в растворе сводится к реакции нейтрализации:
H + + ОН — H2O
Однако, ряд экспериментальных данных показывает ограниченность ионной теории. Так, аммиак, органические амины, оксиды металлов типа Na2O, СаО, анионы слабых кислот и т.д. в отсутствии воды проявляют свойства типичных оснований, хотя не имеют в своем составе гидроксид-ионов.
С другой стороны, многие оксиды (SO2, SO3, Р2О5 и т.д.), галогениды, галогенангидриды кислот, не имея в своем составе ионов водорода, даже в отсутствии воды проявляют кислотные свойства, т.е. нейтрализуют основания.
Кроме того, поведение электролита в водном растворе и в неводной среде может быть противоположным.
Так, CH3COOH в воде является слабой кислотой:
а в жидком фтороводороде проявляет свойства основания:
Исследования подобных типов реакций и в особенности реакций, протекающих в неводных растворителях, привели к созданию более общих теорий кислот и оснований.
Теория Бренстеда и Лоури.
Дальнейшим развитием теории кислот и оснований явилась предложенная И. Бренстедом и Т. Лоурипротолитическая (протонная) теория. В соответствии с этой теорией:
Кислотой называют любое вещество, молекулы (или ионы) которого способны отдавать протон, т.е. быть донором протона;
Основанием называют любое вещество, молекулы (или ионы) которого способны присоединять протон, т.е. быть акцептором протона;
Таким образом, понятие основания значительно расширяется, что подтверждается следующими реакциями:
ОН — + Н + Н2О
NH3+H + NH4 +
H2N-NH3 + +H + H3N + -NH3 +
По теории И. Бренстеда и Т. Лоури кислота и основание составляют сопряженную пару и связаны равновесием:
КИСЛОТА ⇄ ПРОТОН + ОСНОВАНИЕ
Поскольку реакция переноса протона (протолитическая реакция) обратима, причем в обратном процессе тоже передается протон, то продукты реакции являются друг по отношению к другу кислотой и основанием. Это можно записать в виде равновесного процесса:
где НА – кислота, В – основание, ВН + – кислота, сопряженная с основанием В, А — – основание, сопряженное с кислотой НА.
Примеры.
HCl и H2O – кислоты, Cl — и OH — – соответствующие сопряженные с ними основания;
HSO4 — и H3O + – кислоты, SO4 2 — и H2O – основания;
NH4 + – кислота, NH2 — – основание, а NH3 выступает в роли как кислоты (одна молекула), так и основания (другая молекула), т.е. демонстрирует признаки амфотерности – способности проявлять свойства кислоты и основания.
Такой способностью обладает и вода:
Здесь одна молекула Н2О присоединяет протон (основание), образуя сопряженную кислоту – ион гидроксония Н3О + , другая отдает протон (кислота), образуя сопряженное основание ОН — . Этот процесс называется автопротолизом.
Из приведенных примеров видно, что в отличие от представлений Аррениуса, в теории Бренстеда и Лоури реакции кислот с основаниями не приводят к взаимной нейтрализации, а сопровождаются образованием новых кислот и оснований.
Необходимо также отметить, что протолитическая теория рассматривает понятия «кислота» и «основание» не как свойство, но как функцию, которую выполняет рассматриваемое соединение в протолитической реакции. Одно и то же соединение может в одних условиях реагировать как кислота, в других – как основание. Так, в водном растворе СН3СООН проявляет свойства кислоты, а в 100%-й H2SO4 – основания.
Однако, несмотря на свои достоинства, протолитическая теория, как и теория Аррениуса, не применима к веществам, не содержащим атомов водорода, но, в тоже время, проявляющим функцию кислоты: галогенидам бора, алюминия, кремния, олова.
Теория Льюиса.
Иным подходом к классификации веществ с точки зрения отнесения их к кислотам и основаниям явилась электронная теория Льюиса. В рамках электронной теории:
кислотой называют частицу (молекулу или ион), способную присоединять электронную пару (акцептор электронов);
основанием называют частицу (молекулу или ион), способную отдавать электронную пару (донор электронов).
Согласно представлениям Льюиса, кислота и основание взаимодействуют друг с другом с образованием донорно-акцепторной связи. В результате присоединения пары электронов у атома с электронным дефицитом возникает завершенная электронная конфигурация — октет электронов. Например:
Аналогичным образом можно представить и реакцию между нейтральными молекулами:
Реакция нейтрализации в терминах теории Льюиса рассматривается как присоединение электронной пары гидроксид-иона к иону водорода, предоставляющему для размещения этой пары свободную орбиталь:
Таким образом, сам протон, легко присоединяющий электронную пару, с точки зрения теории Льюиса, выполняет функцию кислоты. В этой связи, кислоты по Бренстеду могут рассматриваться как продукты реакции между льюисовскими кислотами и основаниями. Так, HCl является продуктом нейтрализации кислоты H + основанием Cl — , а ион H3O + образуется в результате нейтрализации кислоты H + основанием H2O.
Реакции между кислотами и основаниями Льюиса также иллюстрируют следующие примеры:
| Кислота | Основание | Кислотно-основный комплекс |
| SO2 | H2O | H2SO3 |
| Al(OH)3 | OH – | [Al(OH)4] – |
| Zn(OH)2 | 2OH – | [Zn(OH)4] 2 – |
| Ag + | 2CN – | [Ag(CN)2] – |
К основаниям Льюиса также относят галогенид-ионы, аммиак, алифатические и ароматические амины, кислородсодержащие органические соединения типа R2CO, (где R- органический радикал).
К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов.
Очевидно, что в теории Льюиса понятие «кислота» включает в себя более широкий круг химических соединений. Это объясняется тем, что по Льюису отнесение вещества к классу кислот обусловлено исключительно строением его молекулы, определяющим электронно-акцепторные свойства, и не обязательно связано с наличием атомов водорода. Льюисовские кислоты, не содержащие атомов водорода, называют апротонными.
РАСТВОРЫ
Общие сведения
Растворы — это гомогенные системы переменного состава, состоящие из двух и более веществ, называемых компонентами. По агрегатному состоянию растворы могут быть газообразными (воздух), жидкими (кровь, лимфа) и твердыми (сплавы). В медицине наибольшее значение имеют жидкие растворы, которые играют исключительную роль в жизнедеятельности живых организмов. С образованием растворов связаны процессы усвоения пищи и выведения из организма продуктов жизнедеятельности. В форме растворов вводится большое количество лекарственных препаратов.
Для качественного и количественного описания жидких растворов используются термины «растворитель» и «растворенное вещество», хотя в некоторых случаях такое разделение является достаточно условным. Так, медицинский спирт (96% раствор этанола в воде) скорее следует рассматривать как раствор воды в спирте. Все растворители делятся на неорганические и органические. Важнейшим неорганическим растворителем (а в случае биологических систем – единственным) является вода. Это обусловлено такими свойствами воды, как полярность, низкая вязкость, склонность молекул к ассоциации, относительно высокие температуры кипения и плавления. Растворители органической природы разделяют на полярные (спирты, альдегиды, кетоны, кислоты) и неполярные (гексан, бензол, четыреххлористый углерод).
Процесс растворения в равной степени зависит как от природы растворителя, так и от свойств растворенного вещества. Очевидно, что способность образовывать растворы выражена у разных веществ по-разному. Одни вещества могут смешиваться друг с другом в любых количествах (вода и этанол), другие – в ограниченных (вода и фенол). Однако, следует помнить: абсолютно нерастворимых веществ не существует!
Склонность вещества растворяться в том или ином растворителе можно определить, используя простое эмпирическое правило: подобное растворяется в подобном. Действительно, вещества с ионным (соли, щелочи) или полярным (спирты, альдегиды) типом связи хорошо растворимы в полярных растворителях, например, в воде. И наоборот, растворимость кислорода в бензоле на порядок выше чем в воде, так как молекулы O2 и C6H6неполярны.
Степень сродства соединения к определенному типу растворителя можно оценить, анализируя природу и количественное соотношение входящих в его состав функциональных групп, среди которых выделяют гидрофильные (притягивающие воду) и гидрофобные (отталкивающие воду). К гидрофильным относят полярные группы, такие как гидроксильная (-OH), карбоксильная (-COOH), тиольная (-SH), амино (-NH2). Гидрофобными считают неполярные группы: углеводородные радикалы алифатического (-CH3, -C2H5) и ароматического (-C6H5) рядов. Соединения, имеющие в своем составе как гидрофильные, так и гидрофобные группы, называют дифильными. К таким соединениям относят аминокислоты, белки, нуклеиновые кислоты.
Теории растворов
В настоящее время известны две основные теории растворов: физическая и химическая.
Физическая теория растворов.
Физическая теория растворов была предложена С. Аррениусом (1883) и Я. Г. Вант-Гоффом (1885). В данной теории растворитель рассматривается как химически инертная среда, в которой равномерно распределены частицы (молекулы, ионы) растворенного вещества. При этом предполагается отсутствие межмолекулярного взаимодействия как между частицами растворенного вещества, так и между молекулами растворителя и частицами растворенного вещества. Однако впоследствии выяснилось, что условиям данной модели удовлетворяет поведение лишь малой группы растворов, которые были названы идеальными. В частности, идеальными растворами можно считать газовые смеси и очень сильно разбавленные растворы неэлектролитов.
Физическая и химическая теории растворов.
Физическая и химическая теории растворов.
Растворы являются сложными системами, в которых имеют место различные виды взаимодействия между частицами (Ван-дер-Ваальсовы, электростатические и т.д.).
Существуют две точки зрения на природу растворения и растворов. Согласно физической точке зрения, растворение является чисто физическим процессом (разрушение кристаллической решетки при растворении твердых тел). Растворы при этом рассматриваются как молекулярные смеси нескольких веществ, не взаимодействующих химически. Противоположные представления были развиты Д. И. Менделеевым, который считал растворение химическим процессом, а растворы рассматривал как непрочные соединения компонентов раствора, находящихся в состоянии частичной диссоциации и отличающихся от обычных соединений переменным составом.
В настоящее время используются представления обеих теорий и доминирующая роль физической или химической компонент, в процессе растворения, определяется свойствами растворителя и растворенного вещества (системы).
Закон электронейтральности
При диссоциации молекул, число положительных и отрицательных ионов определяется стехиометрическими индексами в формуле молекулы. Электролиты, в которых ионы обладают одинаковым зарядом катиона и аниона, например, 1-1-электролит KCl 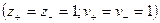
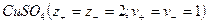
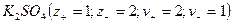
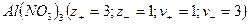
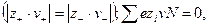
Где 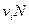
Степень диссоциации, изотонический коэффициент
Количественно диссоциация характеризуется степенью диссоциации

Величина 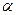

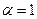
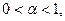
Изотонический коэффициент Вант-Гоффа i характеризует во сколько раз изменилось общее число частиц в растворе в результате диссоциации:
где числитель — общее число вещества в растворе: распавшихся на ионы 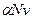
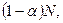
Для сильных электролитов изотонический коэффициент теоретически должен быть равен числу ионов, на которые распадается молекула при диссоциации: при 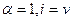

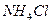
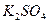
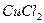

Как следует из приведенного выражения, константа гидролиза обратно пропорциональна константе диссоциации слабого электролита, участвующего в образовании соли (если в образовании соли участвуют два слабых электролита, то 
Степень гидролиза является величиной аналогичной степени диссоциации.
Уравнение, связывающую константу гидролиза со степенью гидролиза, по форме аналогично уравнению (32.3):
где h — число частиц введенных в раствор.
При повышении температуры степень диссоциации воды сильно увеличивается, тогда как у большинства других электролитов она изменяется незначительно. Вследствие этого степень гидролиза водных растворов при повышении температуры увеличивается.
Буферные растворы
В природе и практической деятельности многие реакции протекают при определенном значении pH, которое должно быть постоянным и не зависеть от разведения, изменения состава раствора, добавления кислоты или щелочи и т.д. Такими свойствами обладают буферные растворы, содержащие слабую кислоту и соль, образованную этой кислотой и сильным основанием (например, ацетатный буфер 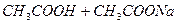
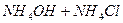
Присутствие ацетата натрия (сильного электролита), который полностью диссоциирован, настолько увеличивает концентрацию ионов CH 

В результате можно считать, что в буферном растворе активность анионов равна активности анионов соли 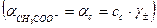
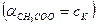
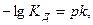
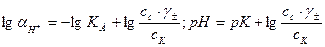
Эти формулы показывают, что pH буферного раствора зависит от константы диссоциации кислоты и соотношения аналитических концентраций соли и кислоты. При разбавлении буферного раствора это соотношение не меняется, а незначительное повышение pH обусловлено изменением коэффициента активности соли. Добавление сильной кислоты тоже сравнительно слабо отражается на изменении pH. При добавлении сильной кислоты к буферному раствору идет реакция с образованием недиссоциированной уксусной кислоты:
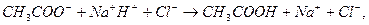
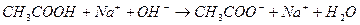
Ионы 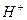
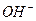
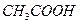
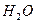
Способность буферных растворов противостоять изменению pH количественно выражается величиной, называемой буферной емкостью. Буферная емкость — это количество кислоты или щелочи которое нужно добавить к раствору, чтобы изменить его pH на единицу.
Числа переноса
Каждый вид ионов переносит определенное количество электричества, зависящее от заряда и концентрации ионов, а также скорости их движения в электрическом поле. Отношение количества электричества 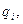
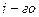
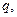
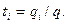
В соответствии с этим определением сумма чисел переноса всех видов ионов в растворе равна единице.
Для симметричного электролита KA, диссоциирующего на два вида ионов 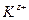

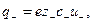
где 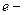
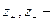

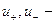

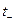

а поскольку 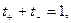

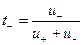
Из уравнений видно, что число переноса данного вида иона зависит от абсолютной скорости и подвижности обоих видов ионов, т. е. в растворах разных электролитах числа переноса одного и того же иона различны.
На степень гидратации ионов, величины их абсолютной скорости и числа переноса влияют концентрация раствора и температура. С ростом концентрации примерно до 0,1 моль/л для большинства электролитов числа переноса ионов изменяются незначительно; в области более высоких концентраций это изменение заметнее. При повышении температуры размеры гидратных оболочек слабо гидратированных ионов уменьшаются менее резко, чем сильно гидрати-рованных (а иногда даже увеличиваются). В результате величины абсолютной подвижности катионов и анионов сближаются, и их числа переноса стремятся к 0,5.
[1] Диэлектрическая проницаемость — величина, показывающая, во сколько раз сила взаимодействия двух зарядов в изучаемой среде меньше, чем в вакууме. [2] Зарядом иона z называют отношение заряда иона, выраженного в кулонах, к заряду электрона Кл; заряд иона, в кулонах, соответственно, равен произведению ez. [3] Далее во всех случаях, где это особо не оговаривается, с целью упрощения мы будем говорить о коэффициенте активности и активности электролитов, понимая, что речь идет о среднем коэффициенте активности и средней активности. В дальнейшем пренебрегается и различием между тремя способами выражения активности (коэффициента активности), что вполне допустимо для разбавленных растворов. [4] Используют также определение – радиус (толщина) ионной атмосферы, дебаевский радиус. [5] Обозначение единицы электрической проводимости сименс, как и всех других единиц, происходящих от имен собственных, пишется с прописной буквы (См). Это обозначение нельзя путать с обозначением единицы измерения длины – сантиметр (см).Физическая и химическая теории растворов.
Растворы являются сложными системами, в которых имеют место различные виды взаимодействия между частицами (Ван-дер-Ваальсовы, электростатические и т.д.).
Существуют две точки зрения на природу растворения и растворов. Согласно физической точке зрения, растворение является чисто физическим процессом (разрушение кристаллической решетки при растворении твердых тел). Растворы при этом рассматриваются как молекулярные смеси нескольких веществ, не взаимодействующих химически. Противоположные представления были развиты Д. И. Менделеевым, который считал растворение химическим процессом, а растворы рассматривал как непрочные соединения компонентов раствора, находящихся в состоянии частичной диссоциации и отличающихся от обычных соединений переменным составом.
В настоящее время используются представления обеих теорий и доминирующая роль физической или химической компонент, в процессе растворения, определяется свойствами растворителя и растворенного вещества (системы).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
- http://studfiles.net/preview/2823909/page:5/
- http://studopedia.ru/19_300061_himicheskaya-teoriya-rastvorov.html
- http://zdamsam.ru/a61197.html
- http://cyberpedia.su/7x6e.html