1867г – таблица Менделеева
Авторская формулировка(1869г): свойства элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов.
Современная формулировка: свойства простых веществ, а также форма и свойства элементов находятся в периодической зависимости от величин заряда числа атома.
Менделеев располагал элементы не только по принципу возрастания атомных масс, но и учитывал свойства элементов.
Каждому элементу присвоен порядковый (атомный) номер.
Порядковый номер совпадает с числом элементарных положительных электронных зарядов ядра атома этого элемента.
Порядковый номер частично равен положительному заряду ядра его атома.
Периодически повтор.след свойства элементов:
1.Металличность(легко отдают электроны)
2.Энергия ионизации атома – кол-во энергии, кот. Необходимо затратить отрыва электрона от атома.
3.Неметалличность(сильно притягивают электроны)
4.Сродство к электрону – кол-во энергии, которая выделяется при присоединении электрона к атому.
5.Электроотрицательность – способность атома притягивать электроны.
Причины: периодичное повторение св-в эл-ов объясняется периодическим повторением кол-во электронов по внешним электронам слое.
Вопрос. s-, p-, d-, f-элементы, положение в периодической системе. Основные химические свойства
Вопрос.Природа химической связи. Метод валентных связей.
(Хим. Связь имеет электронную природу, образ. за счет электронов)
Природа химической связи едина: взаимодействие атомов в молекуле (ионах, кристаллах) осуществляется под действием электрических сил между электронами и ядрами атомов.
(у S и P элементов за счет электронов внешнего слоя, у d элементов за счет электронов внешнего слоя и предвнешнего)
В формировании химической связи принимают участие валентные электроны. Это электроны внешних электронных слоев, которые наименее прочно связаны с ядром атома. Несмотря на единую электрическую природу связывания атомов существуют различные типы связей, формируемые по разным механизмам. К основным типам связи относятся ковалентная (полярная и неполярная) и ионная связи. Разновидностями этих типов являются донорно-акцепторная (координационная), водородная и другие. Между атомами металлов в конденсированной фазе действует металлическая связь. Метод базируется на двух положениях: 1 ) ковалентная химическая связь образуется парой электронов с антипараллельными спинами, пренадлежащей двум атомам; 2 ) ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
СОДЕРЖАНИЕ
Практическая работа 1. Характеристика состояния электронов в атоме и распределение их по орбиталям.
Практическая работа 2. Периодическая система химических элементов Д.И.Менделеева с точки зрения строения атомов.
Практическая работа 3. Химическая связь. Особенности и свойства ковалентной связи.
Практическая работа 4. Методы составления уравнений окислительно-восстановительных реакций.
Практическая работа 5. Получение комплексных соединений.
Практическая работа 6. Коллоидные растворы.
Практическая работа 7. Действие катализаторов.
Практическая работа 8. Химическое равновесие и его смещение.
Практическая работа 9. Восстановительные свойства металлов. Работа гальванического элемента.
Практическая работа 10. Роль гальванических пар при коррозии и защите металлов.
Практическая работа 11. Решение экспериментальных задач по разделу «Основы общей химии».
Практическая работа 1.
Характеристика состояния
электронов в атоме и распределение
их по орбиталям
Цели. Повторить и закрепить закономерности поведения электронов в атоме, их дуализм, понятия об орбиталях и квантовых числах, характеризующих состояние электрона в атоме, закономерности распределения электронов по орбиталям и взаимосвязь их со структурой периодической системы химических элементов (ПСХЭ) Д.И.Менделеева.
Оборудование. Периодическая система химических элементов Д.И.Менделеева, модели
s-, p-, d-, f-орбиталей, таблица распределения электронов по квантовым уровням, схема порядка заполнения электронных орбиталей.
Электроны в атомах обладают различным запасом энергии и двойственной природой. Это материальные частицы с очень незначительной массой, и одновременно их представляют как электромагнитные волны с определенной частотой колебаний. Электроны находятся лишь в определенных квантовых состояниях (квант – порция энергии), соответствующих значениям энергии связи с ядром. Согласно теории М.Планка испускание электромагнитных волн не непрерывно. Атомы поглощают и испускают энергию порциями – квантами. Вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: главным n, побочным l, магнитным m и спиновым s.
Главное квантовое число n определяет энергию электрона на данной орбитали и степень удаления от ядра. Значения n = 1, 2, 3… обозначают электронные слои: 1-й (n = 1) – K,
2-й (n = 2) – L и далее – M, N, O, P, Q.
Побочное (орбитальное) квантовое число l принимает значения от 0 до
n – 1. Оно определяет форму атомной орбитали. При l = 0, независимо от n, – сферическая форма (s-орбиталь); при l = 1 – гантелеобразная форма
(p-орбиталь); при l = 2 – форма розетки или сложной гантели (d-орбиталь).
Магнитное квантовое число m определяет положение атомной орбитали в пространстве относительно внешнего магнитного или электрического поля. Каждому значению l соответствует
2l + 1 значений m (от –l до +l).
Спиновое квантовое число s отражает собственный момент количества движения электрона. Оно может принимать два значения: +1/2 или –1/2.
Распределение электронов по квантовым уровням
Подобно любой системе, атомы стремятся к минимуму энергии. Это достигается при определенном состоянии электронов (распределение по орбиталям), которое можно оценить на основе следующих закономерностей.
Принцип Паули. В атоме не может быть двух электронов с одинаковыми значениями четырех квантовых чисел. На одной атомной орбитали не может быть более двух электронов с противоположными спинами.
Правило Хунда. Электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимальным.
Правило Клечковского. Порядок заполнения энергетических состояний определяется стремлением атома к минимальному значению суммы главного и побочного квантовых чисел, причем в пределах фиксированного значения n + l в первую очередь заполняются состояния, отвечающие минимальным значениям n.
Соответственно существует следующий порядок заполнения электронных орбиталей (схема).
Порядок заполнения электронных орбиталей
Пример. Рассмотреть применение правила Клечковского для определения распределения электронов по орбиталям в атомах калия (Z = 19) и скандия (Z = 21).
Решение
Предшествующий калию в ПСХЭ элемент аргон (Z = 18) имеет распределение электронов по орбиталям:
При распределении электронов по орбиталям в атоме К соответственно правилу Клечковского предпочтение отдается орбитали 4s, т. к. сумма квантовых чисел n + l равна 4 + 0 = 4 (если сравнить с орбиталью 3d, то n + l = 3 + 2 = 5). Орбиталь 4s имеет меньшее значение n + l. Поэтому электронная формула калия:
Предшествующий скандию элемент кальций (Z = 20) имеет следующее распределение электронов по орбиталям:
Из орбиталей 3d (n + l = 3 + 2 = 5) и 4p (n + l = 4 + 1 = 5) при распределении электронов в атоме Sc отдается предпочтение орбитали 3d, как имеющей минимальное значение n = 3 при одинаковых суммах квантовых чисел n + l = 5. Электронная формула атома скандия:
Задание. На основании положения химических элементов в ПСХЭ и закономерностей распределения электронов по орбиталям рассмотреть особенности электронной структуры:
а) атома кальция Ca;
б) атома железа Fe.
Практическая работа 2.
Периодическая система
химических элементов Д.И.Менделеева
с точки зрения строения атомов
Цели. Рассмотреть взаимосвязь состава и электронной структуры атомов химических элементов с их положением в ПСХЭ Д.И.Менделеева, периодичность расположения элементов и изменение электронных конфигураций их атомов, отвечающее периодичности изменения их свойств; значение периодического закона для развития науки и диалектико-материального понимания природы.
Оборудование. Периодическая система химических элементов Д.И.Менделеева, модели s-, p-, d-орбиталей, таблица распределения электронов по квантовым уровням, схема порядка заполнения электронных орбиталей; формулы определения числа элементов в четных и нечетных периодах ПСХЭ Д.И.Менделеева, таблица «Электронное строение атомов в основном состоянии».
Сведения об элементарных частицах
| Частица | Заряд | Масса | ||
|---|---|---|---|---|
| Kл | Условные единицы | г | а.е.м. | |
| Электрон e | –1,6•10 –19 | –1 | 9,1•10 –28 | 0,00055 |
| Протон p | 1,6•10 –19 | +1 | 1,67•10 –24 | 1,007825 |
| Нейтрон n | 1,67•10 –24 | 1,00866 | ||
Cходные по составу атомы
Примечание. A – массовое число, Z – заряд ядра атома, N – число нейтронов в ядре, A = Z + N.
Электронное строение атомов в основном состоянии
| Порядковый номер элемента | Элемент | Главное квантовое число | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | ||||||
| Электронный слой | |||||||||
| K | L | M | N | ||||||
| Энергетический подуровень | |||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | ||
| Число электронов на данном уровне | |||||||||
| 1 2 | Н He | 1 2 | |||||||
| 3 4 5 6 7 8 9 10 | Li Be B C N O F Ne | 2 2 2 2 2 2 2 2 | 1 2 2 2 2 2 2 2 | 0 0 1 2 3 4 5 6 | |||||
| 11 12 13 14 15 16 17 18 | Na Mg Al Si P S Cl Ar | 2 2 2 2 2 2 2 2 | 2 2 2 2 2 2 2 2 | 6 6 6 6 6 6 6 6 | 1 2 2 2 2 2 2 2 | 0 0 1 2 3 4 5 6 | |||
| 19 20 21 | K Ca Sc | 2 2 2 | 2 2 2 | 6 6 6 | 2 2 2 | 6 6 6 | 0 0 1 | 1 2 2 | |
Данные о строении ядра и распределении электронов в атомах позволяют рассмотреть ПСХЭ Д.И.Менделеева с фундаментальных физических позиций. Однозначным признаком химического элемента является заряд ядра Z, определяемый числом протонов в ядре и равный порядковому номеру элемента в ПСХЭ. Относительная атомная масса – усредненное значение Ar изотопов природной смеси.
Общее число электронов в электронейтральных атомах равно числу протонов в ядре или порядковому номеру элемента.
Число энергетических уровней, на которых располагаются электроны в атоме, определяется номером периода. Чем больше номер периода у элемента, тем больше энергетических уровней в его атоме.
Число элементов в периодах можно определить по следующим формулам:
для нечетных периодов
где Ln – число элементов в периоде, n – номер периода;
для четных периодов
Задание 1. Определить число химических элементов в каждом периоде ПСХЭ.
Задание 2. Определить число главных и побочных подгрупп в ПСХЭ.
Решение
Число главных подгрупп определяется максимальным числом электронов на s— и p-подуровнях.
Число переходных элементов в 4-м периоде (от 21Sc до 30Zn), в 5-м (от 39Y до 48Cd) и
6-м (57La и от 72Hf до 80Hg) периодах равно 10 в каждом случае.
Число переходных элементов равно максимальному числу электронов на d-подуровне (10). Именно поэтому на 3-м (М) уровне на 10 электронов больше, чем на 2-м (L). Поскольку в каждом большом периоде периодической системы Д.И.Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам:
4-й период – Fe–Co–Ni,
5-й период – Ru–Rh–Pd,
6-й период – Os–Ir–Pt,
то число побочных подгрупп . .
(Проверить по периодической системе, сколько в ней главных и побочных подгрупп.)
Задание 3. Определить (по аналогии с переходными элементами) число лантаноидов и актиноидов, вынесенных в виде самостоятельных рядов вниз периодической системы.
Оно должно быть равно разности между максимальным числом электронов на … и … энергетических уровнях. Это число равно максимальному числу электронов на …-подуровне.
(Сверить вывод с периодической системой.)
Таким образом, строгая периодичность расположения элементов в ПСХЭ полностью
объясняется . .
Периодическое изменение характера заполнения электронами внешних энергетических уровней вызывает периодические изменения химических свойств элементов и их соединений.
Электронные формулы элементов 2-го периода:
| 3Li – 1s 2 2s 1 , 6С – 1s 2 2s 2 2p 2 , 9F – 1s 2 2s 2 2p 5 , | 4Be – 1s 2 2s 2 , 7N – 1s 2 2s 2 2p 3 , 10Ne – 1s 2 2s 2 2p 6 , | 5B – 1s 2 2s 2 2p 1 , 8O – 1s 2 2s 2 2p 4 . |
При переходе от Li к Ne заряд ядра (Z) постепенно увеличивается от +3 до +10, что вызывает увеличение сил притяжения электронов к ядру. В результате радиусы атомов в этом ряду уменьшаются.
| Элемент | Li | Be | B | C | N | O | F |
|---|---|---|---|---|---|---|---|
| r (атома), в нм | 0,156 | 0,111 | 0,083 | 0,065 | 0,055 | 0,047 | 0,042 |
Поэтому способность отдавать электроны, ярко выраженная у лития, постепенно ослабевает при переходе к фтору, являющемуся типичным неметаллом. Элемент фтор в реакциях присоединяет электроны. Он имеет самую высокую электроотрицательность, равную 4. Начиная со следующего за неоном элемента натрия (Na, Z = 11), электронные структуры атомов повторяются. Как следствие, внешние электронные орбитали можно представить в общем виде, где n – номер периода:
| для Li и Na – ns 1 , для B и Al – ns 2 np 1 , для N и P – …….……. , для F и Cl – …….……. , | для Be и Mg – ns 2 , для C и Si – …….……. , для O и S – …….……. , для Ne и Ar – …….……. . |
В 4-м периоде появляются переходные элементы, принадлежащие побочным подгруппам. Элементы одной и той же подгруппы имеют идентичный характер расположения электронов на внешних электронных уровнях, а принадлежащие к разным подгруппам одной и той же
группы – … .
Например, галогены (главная подгруппа VIIa) – ns 2 np 5 (идентичная конфигурация), элементы побочной подгруппы VIIб – (n – 1)s 2 (n – 1)p 6 (n – 1)d 5 ns 2 (cходная конфигурация). Сходство состоит в наличии у атомов обеих подгрупп семи валентных электронов, но их расположение по подуровням существенно отличается.
Задание 4. Указать и обосновать сходство и различие элементов главной и побочной подгрупп: а) V группы ПСХЭ; б) VI группы ПСХЭ; принадлежность этих элементов к s-, p-, d-, f-типам.
Задание 5. Привести конкретные примеры важнейших направлений развития химии на основе периодического закона и системы химических элементов Д.И.Менделеева.
1. Периодический закон Д. И. Менделеева, его современная формулировка. Структура периодической системы с точки зрения строения атома.
| Название | 1. Периодический закон Д. И. Менделеева, его современная формулировка. Структура периодической системы с точки зрения строения атома. |
| Анкор | Otvety_k_modulyu_Med_Khimia.rtf |
| Дата | 28.01.2017 |
| Размер | 1.4 Mb. |
| Формат файла | |
| Имя файла | Otvety_k_modulyu_Med_Khimia.rtf |
| Тип | Закон #783 |
| страница | 1 из 5 |
| 1.Периодический закон Д.И. Менделеева, его современная формулировка. Структура периодической системы с точки зрения строения атома. Периодичность изменения свойств атомов: энергия ионизации, электроотрицательность, энергия сродства к электрону. Основные классы химических соединений. Классификация биогенных элементов. Качественное и количественное содержание макро- и микроэлементов в организме человека. Элементы — органогены. Периодический закон Д.И. Менделеева: Химические свойства атома или элемента находяться в периодической зависимости от строения атомного ядра или Св-ва химических элементов, а также формы и св-ва соединений элементов находяться в периодической зависимости от величины заряда ядер их атомов. Структура периодической системы с точки зрения строения атома: В 1869 г. Д.И. Менделеев обнаружил природную связь и объединил все элементы, открыв периодический закон. Физический смысл периодического закона: Порядковый номер элемента равен заряду ядра атома; Элементы в периодической системе размещены в порядке возрастания ядер их атомов; Кол-во протонов и ионов равно порядковому номеру; Кол-во нейтронов равно разности между нуклонным числом и протонным числом. Периодическая система состоит из рядов, периодов и групп. Периоды бывают малые (содержат по 8 элементов), (1, 2, 3) и большие (содержат 18 и более элементов), (4, 5, 6, и 7-ой не завершённый). Состоят из 2-х рядов: чётный содержит только металлы, а не чётнный содержит металлы и неметаллы. Периодичность изменения свойств атомов: энергия ионизации-это минимальная энергия необхадимая для отщепления электрона от невозбуждеённого атома и преобразование его на катион. Электронегативность — это электрооотрицательность — относительная способность его атомов притягивать электроны при связывании с другими атомами. Энергия сродства к электрону. Определение: энергия, которая выделяется (реже поглощается) при присоединении электрона к атому. Э0+е?Э- rат. Периодический закон Д.И.Менделеева и его трактовка с точки зрения современной теории строения атомов .На момент создания периодического закона : 1)было открыто не все химические элементы 2)для многих элементов значение атомных масс были определенны неправильно 3) некоторые химические елементы и их соединения были недостаточно выучены Графическим изображением периодического закона является периодическая таблица химических елементов.В процессе написания таблицы. Д. И. Менделееву приходилось оставлять места ( незаполненные клетки ) для не открытых на тот момент элементов. Формулировка периодического закона, данная Д.И. Менделеевым, гласила: свойства химических элементов находятся в периодической зависимости от атомных масс этих элементов. Современная формулировка гласит: свойства химических элементов находятся в периодической зависимости от заряда ядра этих элементов.Такое уточнение потребовалось, поскольку к моменту установления Менделеевым периодического закона еще не было известно о строении атома. После выяснения строения атома и установления закономерностей размещения электронов по электронным уровням стало ясно, что периодическая повторяемость свойств элементов связана с повторяемостью строения электронных оболочек. 69. Периодическая система элементов и ее структура . Периодическая система химических элементов — естественная классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева. Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г.. В 1870 г. Менделеев назвал систему естественной, а в 1871 г. — периодической. Число элементов в современной Периодической системе почти вдвое больше, чем было известно 60-х годах XIX в. (на сегодняшний день — 113), однако ее структура со времен Менделеева почти не изменилась. Хотя за всю историю Периодической системы было опубликовано более 50 различных вариантов ее изображения, наиболее популярными являются предложенные Менделеевым короткопериодная и длиннопериодная формы. Главный принцип построения Периодической системы — выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы — 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство. Номер группы в Периодической системе определяет число валентных электронов а атомах элементов. При этом в группах, обозначенных буквой А, содержатся элементы, в которых идет заселениеs— и р-подуровней — s-элементы (IA- и IIA-группы) и р-элементы (IIIA-VIIIA-группы), а в группах, обозначенной буквой Б, находятся элементы, в которых заселяются d-подуровни — d-элементы. Поскольку в каждом большом периоде должно находиться по 10 d-элементов (у которых заполняются пять d-орбиталей), то Периодическая система должна содержать 10 соответствующих групп. Однако традиционно используется нумерация групп лишь до восьми, поэтому число групп d-элементов расширяется за счет введения дополнительных цифр — это IБ-VIIБ, VIIIБ0, VIIIБ1 и VIIIБ2-группы. Для f-элементов номеров групп не предусмотрено. Обычно их условно помещают в ячейки Периодической системы, отвечающие лантану (лантаноиды) и актинию (актиноиды). Символы лантаноидов и актиноидов выносятся за пределы Периодической системы в виде отдельных рядов. Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами. Номер периода = Число энергетических уровней, заполненных электронами = Обозначение последнего энергетического уровня Порядок формирования периодов связан с постепенным заселением энергетических подуровней электронами. Последовательность заселения определяется принципом минимума энергии, принципом Паули и правилом Гунда. Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома. 70. Периодический характер изменения свойств элементов периодической системы . В 1869 г. Менделеев открыл периодический закон изменения химических и физических свойств элементов в зависимости от их атомных масс. Если расположить химические элементы в порядке возрастания их атомных масс, то периодически, через правильные промежутки, называемые периодами, элементы, оказавшиеся в таблице Менделеева в одном вертикальном ряду ( группе элементов), обнаруживают сходные физико-химические свойства. Однако сам Менделеев, расположив известные в его время 64 химических элемента в таблицу, отражающуюпериодическое изменение химических свойств элементов, был в ряде случаев вынужден отступить от принципа возрастания атомных масс. Менделеев ввел понятие о порядковом номере элемента, и, расположив химические элементы в порядке возрастания их номера, получил полную периодичность в изменении химических свойств элементов. Рассмотрим элементы первого периода. Периоды — это горизонтальные последовательности химических элементов. И в атоме водорода (Н) и в атоме гелия (Не) все электроны находятся на первом электронном уровне. У атома водорода заряд ядра +1 и на первом электронном слое находится 1 электрон. У атома гелия заряд ядра +2, и на первом электронном слое находится 2 отрицательно заряженных электрона. Попробуем понять в каком случае притяжение между ядром и электронами будет сильнее. Логично, что 2 больше, чем один. Значит электроны в атоме гелия притягиваются сильнее. Это означает, что они будут ближе находиться к ядру. Следовательно размер гелия будет меньше ,будет меньше и его радиус. Такая же закономерность будет повторяться в первом, втором и во всех последующих периодах. Это означает, что в периодах слева направо уменьшаются размеры атомов, а справа налево естественно увеличиваются. Группа элементов это вертикальная последовательность химических элементов в периодической системе. Каждая из групп имеет две подгруппы: главную и побочную. Элементы первых трех периодов относятся только к главным подгруппам. К главным подгруппам относятся также те элементы больших периодов (начиная с четвертого), которые расположены с той же стороны клеточки, как и элементы первых трех периодов. Так например, химический элемент калий (К), расположенный в четвертом периоде первой группе относится к главной подгруппе, а медь (Cu), расположенная в том же периоде и той же группе – к побочной. Рассмотрим два атома: атом водорода и атом лития (Li). Оба атома находятся в одной группе (I) и имеют по 1 электрону во внешнем электронном слое. Разница состоит в том, что у атома водорода внешний электрон находится на первом электронном слое, а у лития – на втором. Очевидно, что размер атома лития больше, чем атома водорода Таким образом в группах сверху вниз размеры атомов увеличиваются. С уменьшением размера атома увеличивается его способность притягивать не только свои электроны, но и принимать электроны от других атомов. Эта способность характеризует степень выраженности неметаллических свойств. Следовательно в периоде слева направо неметаллические свойства увеличиваются, а в группе сверху вниз уменьшаются. Металлические свойства понимаемые химиками как способность отдавать электроны изменяются с точностью наоборот. В периоде неметаллические свойства слева-направо уменьшаются, а в группе напротив увеличиваются. СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКАЯ СИСТЕМА химических ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.Периодичность свойств элементов и Их соединений. Между положением элемента в периодической системе и строением атома этого элемента существует взаимно-однозначное соответствие, т.е. координаты элемента в периодической системе определяют строение атома и наоборот, по строению атома можно определить его положение в периодической системе. Для каждого элемента в периодической системе существует пять характеристик: порядковый номер Z, атомная масса А, номер периода, номер группы и подгруппа (главная или побочная). С точки зрения строения атома порядковый номер показывает число протонов в ядре. Атомная масса даёт сумму масс всех частиц атома: протонов, нейтронов и электронов. Учитывая, что масса электрона мала по сравнению с массой протона и нейтрона округлённо можно определять атомную массу, как сумму масс протонов и нейтронов. Отсюда легко найти число нейтронов в ядре как разность атомной массы и числа протонов: А – Z.Атом электронейтрален, поэтому число электронов в электронной оболочке равно числу протонов в ядре, т.е. порядковому номеру элемента –Z. Номер периода показывает число энергетических электронных уровней в атоме. Номер группы показывает общее число «валентных» электронов, т.е. электронов, которые могут принимать участие в образовании химических связей. Положение элемента в подгруппе (главной или побочной) определяется распределением «валентных» электронов: если элемент расположен в главной подгруппе, то все его валентные электроны находятся на последнем энергетическом электронном уровне, а все предыдущие уровни заполнены. Если элемент расположен в побочной подгруппе, то все остальные валентные электроны находятся на предпоследнем энергетическом уровне. Существует форма записи энергетических состояний электронов в атоме, которая называется электронной формулой. В ней главное квантовое число обозначается цифрой (1, 2, 3, 4…), орбитальное –буквой(s-, p-, d-, f-),а число электронов на каждом подуровне показывается индексом вверху, например, электронная формула атома азота
Основным или нормальным состоянием атома называется состояние, отвечающее минимальному запасу энергии, т.е. электроны занимают энергетические состояния с меньшей энергией. С небольшой затратой энергии (например, при воздействии светового излучения) электроны могут переходить в пределах одного энергетического уровня на более высокий энергетический подуровень. Атом переходит в «возбуждённое» состояние, например, для атома бериллия:
Строение внешних электронных уровней определяет формы и свойства его соединений. Например, для атома № 22 Ti имеем электронную формулу Ti имеет всего четыре валентных электрона, поэтому высшая степень окисления +4. Оксид, отвечающий этой степени окисления – TiO2, имеет амфотерный характер (с преобладанием основных свойств), поэтому соответствующий ему гидроксид может быть записан в двух формах: Ti(OH)4 или H2TiO3, соответственно он образует соли при взаимодействии и с кислотами и со щелочами: Ti(OH)4 + 2Н2SO4 Ti(OH)4 + 2НCl Низшая степень окисления Ti (как у большинства d–элементов) +2. Оксид TiО имеет основный характер, гидроксид Ti(OH)2 образует соли только с кислотами, например, TiSO4 или TiCl2. Для характеристики любого элемента необходимо выполнить следующие действия: 1. Определить состав атома, т.е. указать число протонов, нейтронов и электронов. 2. Дать электронную формулу атома и распределение электронов внешних энергетических уровней по атомным орбиталям. 3. Определить высшую и низшую степень окисления и привести формулы и названия соединений, отвечающих данным степеням окисления. Например, элемент № 34 Se. Состав атома: (34 p, 46 n) 34 e. Электронная формула: 1s 2 2s 2 2р 6 3s 2 3p 6 3d 10 4s 2 4p 4 – это p–элемент.
Высшая степень окисления +6, оксид селена (VI) SeO3 – кислотный, гидроксид H2SeO4 — селеновая кислота, соли: Na2SeO4 — cеленат натрия, K2SeO4 — селенат калия. Низшая степень окисления -2, H2S — селеноводород, K2Se — селенид калия, Na2Se — селенид натрия. Свойства элементов, определяемые строением внешних электронных слоев атомов, закономерно изменяются по периодам и группам периодической системы. При этом сходство электронных структур порождает сходство свойств элементов–аналогов, но не тождественность этих свойств. Поэтому при переходе от одного элемента к другому в группах и подгруппах наблюдается не простое повторение свойств, а их более или менее ярко выраженное закономерное изменение. В частности, химическое поведение атомов элементов проявляется в их способности терять и приобретать электроны, т.е. в их способности к окислению и восстановлению. Количественной мерой способности атома терять электроны является потенциал ионизации(Еи), а мерой способности их приобретать – сродство к электрону (Ес). Характер изменения этих величин при переходе от одного периода к другому повторяется, причем в основе этих изменений лежит изменение электронной конфигурации атома. Так, завершенные электронные слои, соответствующие атомам инертных газов, обнаруживают повышенную устойчивость и повышенное значение потенциалов ионизации в пределах периода. В то же время наименьшими значениями потенциала ионизации обладают s–элементы первой группы (Li, Na, K, Rb, Cs). Электроотрицательность является мерой способности атома данного элемента оттягивать на себя электроны по сравнению с атомами других элементов в соединении. Согласно одному из определений (Малликен), электроотрицательность атома В периодах наблюдается общая тенденция роста электроотрицательности элемента, а в подгруппах – ее снижение. Наименьшими значениями электроотрицательности обладают s–элементы I группы, а наибольшими – р–элементы VII группы. Электроотрицательность одного и того же элемента может меняться в зависимости от валентного состояния, гибридизации, степени окисления и пр. Электроотрицательность существенно влияет на характер изменения свойств соединений элементов. Так, например, серная кислота проявляет более сильные кислотные свойства, чем ее химический аналог – селеновая кислота, поскольку в последней центральный атом селена из-за меньшей по сравнению с атомом серы электроотрицательности не так сильно поляризует связи Н–О в кислоте, что и означает ослабление кислотности. Другой пример: гидроксид хрома (II) и гидроксид хрома (VI). Гидроксид хрома (II), Cr(OH)2, проявляет основные свойства в отличие от гидроксида хрома (VI), Н2CrO4, поскольку степень окисления хрома +2 обусловливает слабость кулоновского взаимодействия Cr 2+ с гидроксид-ионом и легкость отщепления этого иона, т.е. проявление основных свойств. В то же время высокая степень окисления хрома +6 в гидроксиде хрома (VI) обусловливает сильное кулоновское притяжение между гидроксид-ионом и центральным атомом хрома и невозможность диссоциации по связи Следующей важной характеристикой атомов является их радиусы. В периодах радиусы атомов металлов с ростом порядкового номера элемента уменьшаются, т.к. с ростом порядкового номера элемента в пределах периода возрастает заряд ядра, а следовательно и уравновешивающий его общий заряд электронов; как следствие, возрастает и кулоновское притяжение электронов, что приводит в конечном счете к уменьшению расстояния между ними и ядром. Наиболее рельефно снижение радиуса наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня. В больших периодах у d- и f-элементов наблюдается более плавное снижение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов радиусы атомов, как правило, увеличиваются сверху вниз, так как такое смещение означает переход на более высокий энергетический уровень. Влияние радиусов ионов элементов на свойства образуемых ими соединений можно проиллюстрировать на примере возрастания кислотности галогенводородных кислот в газовой фазе: HI > HBr > HCl > HF. В этих соединениях сила кулоновского притяжения зависит от кулоновского радиуса, представляющего собой сумму радиусов ионов галогена и водорода. Очевидно, что с ростом радиуса галогена сила кулоновского притяжения снижается, что делает отщепление протона более выгодным. Дата добавления: 2016-10-07 ; просмотров: 3250 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ —>Сайт преподавателя химии и биологии Коноваловой Лидии —> |
—>
| —> —>Меню сайта —> |
| —> —> |
—> —>
| —>Поделиться —> |
| —> —> |
—> —> —> —>
| —>Учителю —> |
| —> —> |
—> —>
| —>Возраст сайта —> |
| —> —> |
—> —> —> —>
| —> —>Наш опрос —> |
| —> —> |
—> —>
| —> —>Друзья сайта —> |
| —>УчМаг |
—> —>
| —>Объявление —> |
| —>Решаю задачи по химии и биологии. Обращайтесь через электронную почту lidijav09@rambler.ru —> |
—> —>
| —>Статистика —> | ||
|
- http://him.1sep.ru/article.php?ID=200401004
- http://topuch.ru/1-periodicheskij-zakon-d-i-mendeleeva-ego-sovremennaya-formuli/index.html
- http://megalektsii.ru/s31088t9.html
- http://poznayka.org/s63810t1.html
- http://lidijavk.ucoz.ru/load/studentam/lekcii/lekcija_quot_stroenie_atoma_i_periodicheskij_zakon_quot/44-1-0-581




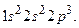 Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного
Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного 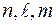 . Например, для атома азота электронно-графическая формула имеет вид:
. Например, для атома азота электронно-графическая формула имеет вид: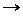
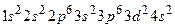 ,это d – элемент.
,это d – элемент.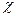 может быть выражена как полусумма его энергии ионизации и сродства к электрону:
может быть выражена как полусумма его энергии ионизации и сродства к электрону: 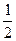 (Еи + Ес).
(Еи + Ес).
 Н–О O
Н–О O
 Se
Se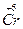 – OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности.
– OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности.

