Вопросы:
1) Дайте определение понятия «кислоты», исходя из их состава.
2) Дайте определение понятия «кислоты» с точки зрения теории электролитической диссоциации.
3) На какие группы делят кислоты?
4) Исходя из различных признаков классификации кислот, дайте полную характеристику азотной и уксусной кислот.
5) Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
6) В 200 мл воды растворили 33,6 л бромоводорода (н. у.). Определите массовую долю бромоводорода в растворе.
7) На полную нейтрализацию 110 г раствора серной кислоты потребовалось 80 г 10%-го раствора гидроксида натрия. Рассчитайте массовую долю кислоты в исходном растворе.
8) Из 80 г 60%-го раствора муравьиной кислоты и необходимого количества метилового спирта получили 43,8 г муравьино-метилового эфира. Определите массовую долю выхода продукта.
Ка – константа кислотности. Для количественной характеристики кислотных свойств используется величина рКа = -lgKa. Чем меньше рКа, тем больше кислотность по Бренстеду.
21. Дать определения кислоты и основания по теории Бренстеда.
Кислота- вещество, способное в растворах отдавать протон, т.е донор протонов, а основание – вещество, способное присоединять протон, т.е акцептор протонов.
22. От каких факторов зависит сила кислот? Перечислите их.
Сила кислоты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее кислота. Стабильность аниона зависит от делокализации (распределения) «отрицательного» заряда по всей частице (аниону). Стабильность аниона зависит от:
Природы атома в кислотном центре (электроотрицательности и поляризуемости элемента)
Характера связанного с кислотным центром органического радикала электроноакцепторного или электронодонорного
23. Как зависит кислотность от природы атома в кислотном центре? Как она изменяется в группах, периодах? Почему?
Под природой гетероатома понимают его электроотрицательность (Э.О.) и поляризуемость. Чем больше ЭО тем легче осуществляется гетеролитический разрыв в молекуле. В периодах слева направо с ростом заряда ядра растет ЭО, т.е. способность элементов удерживать отрицательный заряд. В результате смещения электронной плотности связь между атомами поляризуется. Чем больше электронов и чем больше радиус атома, тем дальше электроны внешнего энергетического уровня расположены от ядра, тем выше поляризуемость и выше кислотность.
24. Охарактеризуйте влияние донорных и акцепторных заместителей на силу кислоты и оснований.
Электроноакцепторые заместители способствуют делокализации отрицательного заряда, стабилизируют анион и увеличививают кислотность. Электронодонорные заместители, наоборот, препятствуют делокализации отрицательного заряда и понижают кислотность. Электронодонорные заместители повышают основные свойства, т.к увеличивают электронную плотность на атоме основного центра, а электроноакцепторные – понижают электронную плотность и выраженность основных свойств.
25. Как зависит кислотность от природы растворителя?
Растворители оказывают сильное влияние на стабилизацию образующегося аниона (эффект сольватации). Лучше гидратируются небольшие по размеру ионы с низкой степенью делокализации заряда. Например, в ряду карбоновых кислот с увеличением длины алифатического (гидрофобного) радикала кислотность уменьшается.
33.Почему реакция натрия со спиртом идет медленнее, чем с водой?
Нужно отметить, что реакция между спиртом и натрием протекает не так энергично, как реакция натрия с водой. Еще медленнее действуют на спирт другие металлы, сравнительно легко вытесняющие водород из воды, как, например, кальций. Таким образом, кислотные свойства у спирта выражены слабее, чем у воды.
34. почему вода разлагает этилат натрия?
СН3-СН2-О(-) + Н-О-Н ——> СН3-СН2-О-H + Н-О(-).
Реакция свелась к тому, что этилат-анион «оторвал» протон от молекулы воды.
Можно трактовать и иначе: будучи более сильной кислотой, чем этанол, вода передает свой протон этилат-аниону, при этом сама превращается в гидроксид-анион.
Таким образом, это самая обычная кислотно-основная реакция: более сильная кислота (вода) вытесняет более слабую кислоту (этанол) из ее соли (этилат натрия можно и нужно рассматривать как соль).
35. Основность диэтиламина и анилина
(C2H5)2NH.
Из-за наличия в молекулах неподеленной пары электронов амины, как и аммиак, проявляют основные свойства. В ряду
анилин аммиак первичный амин вторичный амин
основные свойства усиливаются, из-за влияния типа и числа радикалов.
Следовательно диэтиламин более сильное основание,чем анилин.
36 общая характеристика реакционной способности гетерофунсоединений. Кислотно-основная свойства.
Вещества природного происхождения часто представлены гетерофункциональными соединениями, поскольку они включают сочетание различных функциональных групп — карбоксильной, гидроксильной, карбонильной, аминогруппы и др. Не исключено, что при этом в молекуле может быть и несколько одинаковых функциональных групп.
В первом приближении химические свойства гетерофункциональных соединений представляют собой сумму свойств, обусловленных каждой группой в отдельности. Однако во многих случаях наличие двух (или более) различных функциональных групп приводит к усилению или ослаблению свойств, присущих монофункциональным соединениям, и, что важнее, порождает специфические химические свойства, присущие только гетерофункциональным соединениям. Кислотность гидроксикислот выше, чем незамещённых карбоновых кислот. Это обусловлено электроноакцепторным действием гидроксильной группы (-I-эффект), и чем ближе она к кислотному центру, тем это влияние сильнее. Так, pKa молочной кислоты на порядок выше, чем пропановой кислоты (3,9 и 4,9 соответственно).
Аминокислоты содержат одновременно кислотную (СООН) и основную (NH2) группы. Привычное написание формул аминокислот как соединений,
содержащих амино- и карбоксильную группу, например RCH(NH2)COOH, является условным и не отражает их истинного строения. Как в кристаллическом состоянии, так и в среде, близкой к нейтральной, аминокислоты существуют в виде внутренней соли — диполярного иона, называемого также цвиттер-ионом (от нем. Zwitter — смешанный тип).
В сильнокислой среде в аминокислотах полностью протонирована аминогруппа (катионная форма) и не диссоциирована карбоксильная группа. В сильнощелочной среде, напротив, не протонирована аминогруппа, а карбоксильная группа полностью ионизирована (анионная форма)
Кислоты определение
Кислота это:
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Содержание
- 1 Определение кислоты
- 2 Классификация кислот
- 3 Химические свойства кислот
- 4 Некоторые распространённые кислоты
- 4.1 Неорганические (минеральные) кислоты
- 4.1.1 Кислоты, образованные серой
- 4.2 Органические кислоты
- 4.1 Неорганические (минеральные) кислоты
- 5 Интересные факты
- 6 Примечания
- 7 См. также
Определение кислоты
Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических представлений о природе химической связи и механизмах химических реакций.
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
В настоящее время наиболее распространены три теории кислоты и оснований. Они не противоречат друг другу, а дополняют.
- По теории сольвосистем, начало которой положили работы американских химиков Кэди и Франклина, опубликованные в 1896—1905 гг., кислота — такое соединение, которое даёт в растворе те положительные ионы, которые образуются при собственной диссоциации растворителя (Н3О+, NH4+). Это определение хорошо тем, что не привязано к водным растворам.
- По протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты — водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие кислотные свойства, так называемые апротонные кислоты.
- По электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее электронные пары, то есть акцептор электронных пар. Таким образом, в теории Льюиса кислотой могут быть как молекула, так и катион, обладающие низкой по энергии свободной молекулярной орбиталью.
- Пирсон модифицировал теорию Льюиса с учётом характеристик орбиталей-акцепторов, введя понятие жёстких и мягких кислот и оснований (принцип Пирсона или принцип ЖМКО). Жёсткие кислоты характеризуются высокой электроотрицательностью и низкой поляризуемостью атома, несущего свободную орбиталь, мягкие кислоты, соответственно, характеризуются низкой электроотрицательностью и высокой поляризуемостью атома, несущего свободную орбиталь.
Следует также отметить, что многие вещества проявляют амфотерные свойства, то есть ведут себя как кислоты в реакциях с основаниями и как основания — в реакциях с более сильной кислотой.
Классификация кислот
- По содержанию кислорода
- бескислородные (HCl, H2S);
- кислородосодержащие (HNO3,H2SO4).
- По основности — количество кислых атомов водорода
- Одноосновные (HNO3);
- Двухосновные (H2SeO4, двухосновные предельные карбоновые кислоты);
- Трёхосновные (H3PO4, H3BO3).
- Полиосновные (практически не встречаются).
- По силе
- Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
- Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
- По устойчивости
- Устойчивые (H2SO4);
- Неустойчивые (H2CO3).
- По принадлежности к классам химических соединений
- Неорганические (HBr);
- Органические (HCOOH,CH3COOH);
- По летучести
- Летучие (H2S, HCl);
- Нелетучие (H2SO4) ;
- По растворимости в воде
- Растворимые (H2SO4);
- Нерастворимые (H2SiO3);
Химические свойства кислот
(в данном случае образуется неустойчивая угольная кислота , которая сразу же распадается на воду и углекислый газ)
- Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты ), если образующаяся соль растворима:
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
См. статью Взаимодействие кислот с металлами.
- Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
Некоторые распространённые кислоты
Неорганические (минеральные) кислоты
- Азотистая кислота
- Азотистоводородная кислота
- Азотная кислота
- Азотноватистая кислота
- Борная кислота
- Бромистая кислота
- Бромная кислота
- Бромноватая кислота
- Бромноватистая кислота
- Бромоводородная кислота
- Гексахлорплатиновая кислота
- Дихромовая кислота
- Иодистая кислота
- Иодная кислота
- Иодноватая кислота
- Иодноватистая кислота
- Иодоводородная кислота
- Кремнефтористоводородная кислота
- Кремниевая кислота
- Ксеноновая кислота
- Марганцовая кислота
- Марганцовистая кислота
- Ортоугольная кислота
- Плавиковая кислота
- Рениевая кислота
- Роданистоводородная кислота
- Селенистая кислота
- Селеновая кислота
- Синильная кислота
- Соляная кислота
- Теллуровая кислота
- Тетрацианоплатиновая кислота
- Тетрахлорозолотая кислота
- Технециевая кислота
- Угольная кислота
- Ортофосфорная кислота
- Метафосфорная кислота
- Хлористая кислота
- Хлорная кислота
- Хлорноватая кислота
- Хлорноватистая кислота
- Хромовая кислота
Кислоты, образованные серой
- Бромсульфоновая кислота
- Дитионистая кислота
- Дитионовая кислота
- Пероксомоносерная кислота
- Пероксодисерная кислота
- Дисерная кислота
- Дисернистая кислота
- Политионовые кислоты
- Политиосерные кислоты
- Серная кислота
- Сернистая кислота
- Сероводородная кислота
- Сульфоксиловая кислота
- Тетратионовая кислота
- Тиосерная кислота
- Тиосернистая кислота
- Фторсульфоновая кислота
- Хлорсульфоновая кислота
Муравьиная кислота
Органические кислоты
- Адипиновая кислота
- Азелаиновая кислота
- Акриловая кислота
- Аконитовая кислота
- Аскорбиновая кислота (витамин C)
- Валериановая кислота
- Винная кислота
- Гиалуроновая кислота
- Дезоксирибонуклеиновая кислота(ДНК)
- Капроновая кислота
- Лауриновая кислота
- Лизергиновая кислота
- Лимонная кислота
- Масляная кислота
- Малоновая кислота
- Молочная кислота
- Мочевая кислота
- Муравьиная кислота
- Олеиновая кислота
- Пальмитиновая кислота
- Пировиноградная кислота
- Пропионовая кислота
- Салициловая кислота
- Стеариновая кислота
- Уксусная кислота
- Щавелевая кислота
- Яблочная кислота
- Янтарная кислота
Интересные факты
- Подземное животное голый землекоп имеет нечувствительные к кислоте клетки кожи даже при pH менее 3,5.[1]
- У крокодила в желудке pH бывает меньше 0,5.
Примечания
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
- Теории кислот и оснований
- Апротонная кислота
- Константа диссоциации
- Суперкислота
- Список кислот
- Все о кислотах
- Органические и неорганические кислоты
- Кислоты: бескислородные и кислородосодержащие, соли бескислородных и кислородсодержащих кислот, типы химических реакций
Растворимость кислот, оснований и солей в воде
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Категория:
- Кислоты
Wikimedia Foundation. 2010.
Кислоты: примеры, таблица. Свойства кислот
Кислоты — это такие химические соединения, которые способны отдавать электрически заряженный ион (катион) водорода, а также принимать два взаимодействущих электрона, вследствие чего образуется ковалентная связь.
В данной статье мы рассмотрим основные кислоты, которые изучают в средних классах общеобразовательных школ, а также узнаем множество интересных фактов о самых разных кислотах. Приступим.
Кислоты: виды
В химии существует множество самых разнообразных кислот, которые имеют самые разные свойства. Химики различают кислоты по содержанию в составе кислорода, по летучести, по растворимости в воде, силе, устойчивости, принадлежности к органическому или неорганическому классу химических соединений. В данной статье мы рассмотрим таблицу, в которой представлены самые известные кислоты. Таблица поможет запомнить название кислоты и ее химическую формулу.
| Химическая формула | Название кислоты |
| H2S | Сероводородная |
| H2SO4 | Серная |
| HNO3 | Азотная |
| HNO2 | Азотистая |
| HF | Плавиковая |
| HCl | Соляная |
| H3PO4 | Фосфорная |
| H2CO3 | Угольная |
Итак, все наглядно видно. В данной таблице представлены самые известные в химической промышленности кислоты. Таблица поможет намного быстрее запомнить названия и формулы.
Сероводородная кислота
H2S — это сероводородная кислота. Ее особенность заключается в том, что она еще и является газом. Сероводород очень плохо растоворяется в воде, а также взаимодействует с очень многими металлами. Сероводородная кислота относится к группе «слабые кислоты», примеры которых мы рассмотрим в данной статье.
H2S имеет немного сладковатый вкус, а также очень резкий запах тухлых яиц. В природе ее можно встретить в природном или вулканическом газах, а также она выделяется при гниении белка.
Свойства кислот очень разнообразны, даже если кислота незаменима в промышленности, то может быть очень неполезна для здоровья человека. Данная кислота очень токсична для человека. При вдыхании небольшого количество сероводорода у человека пробуждается головная боль, начинается сильная тошнота и головокружение. Если же человек вдохнет большое количество H2S, то это может привести к судорогам, коме или даже мгновенной смерти.
Серная кислота
H2SO4 — это сильная серная кислота, с которой дети знакомятся на уроках химии еще в 8-м классе. Химические кислоты, такие как серная, являются очень сильными окислителями. H2SO4 действует как окислитель на очень многие металлы, а также основные оксиды.
H2SO4 при попадании на кожу или одежду вызывает химические ожоги, однако она не так токсична, как сероводород.
Азотная кислота
В нашем мире очень важны сильные кислоты. Примеры таких кислот: HCl, H2SO4, HBr, HNO3. HNO3 — это всем известная азотная кислота. Она нашла широкое применение в промышленности, а также в сельском хозяйстве. Ее используют для изготовления различных удобрений, в ювелирном деле, при печати фотографий, в производстве лекарственных препаратов и красителей, а также в военной промышленности.
Такие химические кислоты, как азотная, являются очень вредными для организма. Пары HNO3 оставляют язвы, вызывают острые воспаления и раздражения дыхательных путей.
Азотистая кислота
Азотистую кислоту очень часто путают с азотной, но разница между ними есть. Дело в том, что азотистая кислота намного слабее азотной, у нее совершенно другие свойства и действие на организм человека.
HNO2 нашла широкое применение в химической промышленности.
Плавиковая кислота
Плавиковая кислота (или фтороводород) — это раствор H2O c HF. Формула кислоты — HF. Плавиковая кислота очень активно используется в алюминиевой промышленности. Ею растворяют силикаты, травят кремний, силикатное стекло.
Фтороводород является очень вредным для организма человека, в зависимости от его концентрации может быть легким наркотиком. При попадании на кожу сначала никаких изменений, но уже через несколько минут может появиться резкая боль и химический ожог. Плавиковая кислота очень вредна для окружающего мира.
Соляная кислота
HCl — это хлористый водород, является сильной кислотой. Хлористый водород сохраняет свойства кислот, относящихся к группе сильных. На вид кислота прозрачна и бесцветна, а на воздухе дымится. Хлористый водород широко применяется в металлургической и пищевой промышленностях.
Данная кислота вызывает химические ожоги, но особо опасно ее попадание в глаза.
Фосфорная кислота
Фосфорная кислота (H3PO4) — это по своим свойствам слабая кислота. Но даже слабые кислоты могут иметь свойства сильных. Например, H3PO4 используют в промышленности для восстановления железа из ржавчины. Помимо этого, форсфорная (или ортофосфорная) кислота широко используется в сельском хозяйстве — из нее изготавливают множество разнообразных удобрений.
Свойства кислот очень схожи — практически каждая из них очень вредна для организма человека, H3PO4 не является исключением. Например, эта кислота также вызывает сильные химические ожоги, кровотечения из носа, а также крошение зубов.
Угольная кислота
H2CO3 — слабая кислота. Ее получают при растворении CO2 (углекислый газ) в H2O (вода). Угольную кислоту используют в биологии и биохимии.
Плотность различных кислот
Плотность кислот занимает важное место в теоретической и практической частях химии. Благодаря знанию плотности можно определить концентрацию той или иной кислоты, решить расчетные химические задачи и добавить правильное количество кислоты для совершения реакции. Плотность любой кислоты меняется в зависимости от концентрации. Например, чем больше процент концентрации, тем больше и плотность.
Общие свойства кислот
Абсолютно все кислоты являются сложными веществами (то есть состоят из нескольких элементов таблицы Менделеева), при этом обязательно включают в свой состав H (водород). Далее мы рассмотрим химические свойства кислот, которые являются общими:
- Все кислородсодержащие кислоты (в формуле которых присутствует O) при разложении образуют воду, а также кислотный оксид. А бескислородные при этом разлагаются на простые вещества (например, 2HF разлагается на F2 и H2).
- Кислоты-окислители взаимодействуют со всеми металлами в ряду активности металлов (только с теми, которые расположены слева от H).
- Взаимодействуют с различными солями, но только с теми, которые были образованы еще более слабой кислотой.
По своим физическим свойствам кислоты резко отличаются друг от друга. Ведь они могут иметь запах и не иметь его, а также быть в самых разных агрегатных состояниях: жидких, газообразных и даже твердых. Очень интересны для изучения твердые кислоты. Примеры таких кислот: C2H24 и H3BO3.
Концентрация
Концентрацией называют величину, которая определяет количественный состав любого раствора. Например, химикам часто необходимо определить то, сколько в разбавленной кислоте H2SO4 находится чистой серной кислоты. Для этого они наливают небольшое количество разбавленной кислоты в мерный стакан, взвешивают и определяют концентрацию по таблице плотности. Концентрация кислот узко взаимосвязана с плотностью, часто на определение концетрации встречаются расчетные задачи, где нужно определить процентное количество чистой кислоты в растворе.
Классификация всех кислот по количеству атомов H в их химической формуле
Одной из самых популярных классификаций является разделение всех кислот на одноосновные, двухосновные и, соответственно, трехосновные кислоты. Примеры одноосновных кислот: HNO3 (азотная), HCl (хлороводородная), HF (фтороводородная) и другие. Данные кислоты называются одноосновными, так как в их составе присутствует всего лишь один атом H. Таких кислот множество, абсолютно каждую запомнить невозможно. Нужно лишь запомнить, что кислоты классифицируют и по количеству атомов H в их составе. Аналогично определяются и двухосновные кислоты. Примеры: H2SO4 (серная), H2S (сероводородная), H2CO3 (угольная) и другие. Трехосновные: H3PO4 (фосфорная).
Основная классификация кислот
Одной из самых популярных классификаций кислот является разделение их на кислородосодержащие и бескислородные. Как запомнить, не зная химической формулы вещества, что это кислота кислородосодержащая?
У всех бескислородных кислот в составе отсутствует важный элемент O — кислород, но зато в составе есть H. Поэтому к их названию всегда приписывается слово «водородная». HCl — это хлороводородная кислота, a H2S — сероводородная.
Но и по названиям кислосодержащих кислот можно написать формулу. Например, если число атомов O в веществе — 4 или 3, то к названию всегда прибавляется суффикс -н-, а также окончание -ая-:
Если же в веществе меньше трех атомов кислорода или три, то в названии используется суффикс -ист-:
Общие свойства
Все кислоты имеют вкус кислый и часто немного металлический. Но есть и другие схожие свойства, которые мы сейчас рассмотрим.
Есть такие вещества, которые называются индикаторами. Индикаторы изменяют свой цвет, или же цвет остается, но меняется его оттенок. Это происходит в то время, когда на индикаторы действуют какие-то другие вещества, например кислоты.
Примером изменения цвета может служить такой привычный многим продукт, как чай, и лимонная кислота. Когда в чай бросают лимон, то чай постепенно начинает заметно светлеть. Это происходит из-за того, что в лимоне содержится лимонная кислота.
Существуют и другие примеры. Лакмус, который в нейтральной среде имеет сиреневый цвет, при добавлении соляной кислоты становится красным.
При взаимодействии кислот с металлами, находящимися в ряду напряженности до водорода, выделяются пузырьки газа — H. Однако если в пробирку с кислотой поместить металл, который находится в ряду напряженности после H, то никакой реакции не произойдет, выделения газа не будет. Так, медь, серебро, ртуть, платина и золото с кислотами реагировать не будут.
В данной статье мы рассмотрели самые известные химические кислоты, а также их главные свойства и различия.
Кислоты и основания это:
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
Кислоты классификация, применение, химические свойства.
Пирожок без никто!
§8.3 Кислоты. Классификация кислот. Химические свойства.
Слова «кислота» и «кислый» не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) знакомы вам именно своим кислым вкусом.
В этом параграфе мы рассмотрим только важнейшие неорганические кислоты, то есть такие, которые не синтезируются живыми организмами, но играют большую роль в химии и химической промышленности.
Все кислоты, независимо от их происхождения, объединяет общее свойство – они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение:
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
H2SO4
+
Mg
=
MgSO4
+
H2
серная кислота
металл
соль
водород
H2SO4
+
MgO
=
MgSO4
+
H2O
серная кислота
оксид
соль
вода
Давайте на примере серной кислоты рассмотрим ее образование из кислотного оксида SO3, а затем реакцию серной кислоты с магнием. Валентности всех элементов, участвующих в реакции, нам известны, поэтому напишем соединения в виде структурных формул:
Эти примеры позволяют легко проследить связь между кислотным оксидом SO3, кислотой H2SO4 и солью MgSO4. Одно «рождается» из другого, причем атом серы и атомы кислорода переходят из соединения одного класса (кислотный оксид) в соединения других классов (кислота, соль).
Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода.
По первому признаку кислоты делятся на кислородсодержащие и бескислородные (табл. 8-1).
Таблица 8-1. Классификация кислот по составу.
Кислородсодержащие кислоты
Бескислородные кислоты
H2SO4 серная кислота
H2SO3 сернистая кислота
HNO3 азотная кислота
H3PO4 фосфорная кислота
H2CO3 угольная кислота
H2SiO3 кремниевая кислота
HF фтороводородная кислота
HCl хлороводородная кислота (соляная кислота)
HBr бромоводородная кислота
HI иодоводородная кислота
H2S сероводородная кислота
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н), как показано в табл. 8-2:
Таблица 8-2. Классификация кислот по числу атомов водорода.
К И С Л О Т Ы
Одноосновные
Двухосновные
Трехосновные
HNO3 азотная
HF фтороводородная
HCl хлороводородная
HBr бромоводородная
HI иодоводородная
H2SO4 серная
H2SO3 сернистая
H2S сероводородная
H2CO3 угольная
H2SiO3 кремниевая
H3PO4 фосфорная
** Термин «одноосновная кислота» возник потому, что для нейтрализации одной молекулы такой кислоты требуется «одно основание», т. е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже «два основания», а трехосновная – «три основания»:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
Рассмотрим важнейшие химические свойства кислот.
Действие кислот на индикаторы1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Zhec89
Применение
Кислоты – необходимые для жизни человека химические соединения. Вместе с едой мы получаем растительные и животные белки, которые расщепляются на отдельные аминокислоты. Из аминокислот в каждом организме строятся свои белковые структуры, свои живые ткани.
Органические кислоты в свободном виде поступают в человеческий организм с молочнокислыми продуктами, ягодами, фруктами, овощами. Некоторые органические кислоты являются витаминами, например витамин C – это аскорбиновая кислота.
В организме человека есть и неорганические кислоты. Они либо вырабатываются в организме, либо поступают с пищей. Так, соляная кислота есть в желудочном соке, угольная и сероводородная – в природных минеральных водах.
Под действием соляной кислоты погибает большинство бактерий, попавших в желудок с пищей. Бактерицидным действием обладает и уксусная кислота. Именно поэтому ее раствор используют при консервировании продуктов.
Серная, азотная, соляная и фосфорная кислоты – важнейшие продукты химической промышленности.
Кратко рассмотрим применение кислоты, которая называется серной. Можно смело сказать, что эта кислота известна наибольшему числу людей. По разнообразию применения и объему промышленного производства она занимает первое место среди всех кислот. Применение кислот часто происходит на производствах и в быту. Среди применяемых в быту кислот выделяют: азотную, соляную, фосфорную.
Что такое кислоты ,соли,оксиды,основание? химия.
Mary cherry
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония NH4+ ; известны соли фосфония PH4+ или гидроксония H3O+) и анионов кислотного остатка.
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами.
Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
Анастасия харьковская
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония NH4+ ; известны соли фосфония PH4+ или гидроксония H3O+) и анионов кислотного остатка.
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами.
Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
Николай мельник
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония NH4+ ; известны соли фосфония PH4+ или гидроксония H3O+) и анионов кислотного остатка.
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами.
Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
Алексей самойленко
Не ну вы серьезно? думаете если скопировали все из вики такие умные? вот кратко
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Соли это сложные вещества, состоящие из ионов металлов и кислотного остатка
основание это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид ионов.
Оксид это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2
Артём саломатин
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония NH4+ ; известны соли фосфония PH4+ или гидроксония H3O+) и анионов кислотного остатка.
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Основания — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония» . Хорошо растворимые в воде основания называются щелочами.
Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
Определение кислота состава и с точки зрения
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
1. По числу атомов водорода: число атомов водорода ( n ) определяет основность кислот:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
Кислотный остаток (А)
Соответствующий кислотный оксид
SO 3 оксид серы ( VI )
MnO4 (I) перманганат
SO2 оксид серы ( IV )
PO4 (III) ортофосфат
CO 2 оксид углерода ( IV )
SiO2 оксид кремния (IV)
СlO (I) гипохлорит
С l2O оксид хлора ( I)
НСlO 3 хлорноватая
б) Таблица бескислородных кислот
Кислотный остаток (А)
HCl соляная, хлороводородная
H 2 S сероводородная
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO 3 , борная H 3 BO 3 . Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H 2 SiO 3 . Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
1. Прямое взаимодействие неметаллов
1. Кислотный оксид + вода = кислота
2. Реакция обмена между солью и менее летучей кислотой
Дайте определение понятия «кислоты» с точки зрения теории электролитической диссоциации. И если захотите помогите с вопросами, отблагодарю
Если тебя не устраивает ответ или его нет, то попробуй воспользоваться поиском на сайте и найти похожие ответы по предмету Химия.
Определите число протонов, нейтронов и электронов в атоме азота с массовым числом 15.
Назовите химический элемент, расположенный в 4 периоде. Известно, что в атоме данного элемента на последнем энергетическом уровне находится 3 электрона.
Определение кислота состава и с точки зрения
Определения кислот и оснований претерпели значительную эволюцию по мере расширения теоретических представлений о природе химической связи и механизмах химических реакций.
В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу.
В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H + ). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
В настоящее время наиболее распространены три теории кислоты и оснований. Они не противоречат друг другу, а дополняют.
- По теории сольвосистем, начало которой положили работы американских химиков Кэди и Франклина, опубликованные в 1896—1905 гг., кислота — такое соединение, которое даёт в растворе те положительные ионы, которые образуются при собственной диссоциации растворителя (Н3О + , NH4 + ). Это определение хорошо тем, что не привязано к водным растворам.
- По протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты — водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие кислотные свойства, так называемые апротонные кислоты.
- По электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее электронные пары, то есть акцептор электронных пар. Таким образом, в теории Льюиса кислотой могут быть как молекула, так и катион, обладающие низкой по энергии свободной молекулярной орбиталью.
- Пирсон модифицировал теорию Льюиса с учётом характеристик орбиталей-акцепторов, введя понятие жёстких и мягких кислот и оснований (принцип Пирсона или принцип ЖМКО). Жёсткие кислоты характеризуются высокой электроотрицательностью и низкой поляризуемостью атома, несущего свободную орбиталь, мягкие кислоты, соответственно, характеризуются низкой электроотрицательностью и высокой поляризуемостью атома, несущего свободную орбиталь.
Следует также отметить, что многие вещества проявляют амфотерные свойства, то есть ведут себя как кислоты в реакциях с основаниями и как основания — в реакциях с более сильной кислотой.
Классификация кислот
- По содержанию кислорода
- бескислородные (HCl, H2S);
- кислородосодержащие (HNO3,H2SO4).
- По основности — количество кислых атомовводорода
- Одноосновные (HNO3);
- Двухосновные (H2SeO4, двухосновные предельные карбоновые кислоты);
- Трёхосновные (H3PO4, H3BO3).
- Полиосновные (практически не встречаются).
- По силе
- Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10 −3 (HNO3);
- Слабые — константа диссоциации меньше 1·10 −3 (уксусная кислота Kд= 1,7·10 −5 ).
- По устойчивости
- Устойчивые (H2SO4);
- Неустойчивые (H2CO3).
- По принадлежности к классам химических соединений
- Неорганические (HBr);
- Органические (HCOOH,CH3COOH);
- По летучести
- Летучие (H2S, HCl);
- Нелетучие (H2SO4) ;
- По растворимости в воде
- Растворимые (H2SO4);
- Нерастворимые (H2SiO3);
Химические свойства кислот
- Взаимодействие с основными оксидами с образованием соли и воды:
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
- Взаимодействие со щелочами с образованием соли и воды(реакция нейтрализации):
- Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
- Взаимодействие с солями, если выпадает осадок или выделяется газ:
- Сильные кислоты вытесняют более слабые из их солей:
(в данном случае образуется неустойчивая угольная кислота 
- Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты
любой концентрации и концентрированной серной кислоты
), если образующаяся сольрастворима:
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:

- Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
Некоторые распространённые кислоты
Неорганические (минеральные) кислоты
- Азотистая кислота
- Азотистоводородная кислота
- Азотная кислота
- Азотноватистая кислота
- Борная кислота
- Бромистая кислота
- Бромная кислота
- Бромноватая кислота
- Бромноватистая кислота
- Бромоводородная кислота
- Гексахлорплатиновая кислота
- Дихромовая кислота
- Иодистая кислота
- Иодная кислота
- Иодноватая кислота
- Иодноватистая кислота
- Иодоводородная кислота
- Кремнефтористоводородная кислота
- Кремниевая кислота
- Ксеноновая кислота
- Марганцовая кислота
- Марганцовистая кислота
- Ортоугольная кислота
- Плавиковая кислота
- Рениевая кислота
- Роданистоводородная кислота
- Селенистая кислота
- Селеновая кислота
- Синильная кислота
- Соляная кислота
- Теллуровая кислота
- Тетрацианоплатиновая кислота
- Тетрахлорозолотая кислота
- Технециевая кислота
- Угольная кислота
- Ортофосфорная кислота
- Метафосфорная кислота
- Хлористая кислота
- Хлорная кислота
- Хлорноватая кислота
- Хлорноватистая кислота
- Хромовая кислота
Кислоты, образованные серой
- Бромсульфоновая кислота
- Дитионистая кислота
- Дитионовая кислота
- Пероксомоносерная кислота
- Пероксодисерная кислота
- Дисерная кислота
- Дисернистая кислота
- Политионовые кислоты
- Политиосерные кислоты
- Серная кислота
- Сернистая кислота
- Сероводородная кислота
- Сульфоксиловая кислота
- Тетратионовая кислота
- Тиосерная кислота
- Тиосернистая кислота
- Фторсульфоновая кислота
- Хлорсульфоновая кислота
Органические кислоты
Интересные факты
- Подземное животное голый землекоп имеет нечувствительные к кислоте клетки кожи даже при pH менее 3,5. [1]
- У крокодила в желудке pH бывает меньше 0,5.
Примечания
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
Растворимость кислот, оснований и солей в воде
Wikimedia Foundation . 2010 .
Смотреть что такое «Кислота» в других словарях:
кислота — сущ., кол во синонимов: 171 • абсцизин (2) • агарицин (1) • адипил (1) • … Словарь синонимов
КиСЛОТа — 1 капля Альбом ремиксов СЛОТ Дата выпуска 2008 Записан … Википедия
кислота — сущ., ж., употр. сравн. часто Морфология: (нет) чего? кислоты, чему? кислоте, (вижу) что? кислоту, чем? кислотой, о чём? о кислоте; мн. что? кислоты, (нет) чего? кислот, чему? кислотам, (вижу) что? кислоты, чем? кислотами, о чём? о кислотах 1.… … Толковый словарь Дмитриева
КИСЛОТА — КИСЛОТА, кислоты, мн. кислоты, жен. 1. только ед. отвлеч. сущ. к кислый, что нибудь кислое (разг.). Я попробовал, чувствую: кислота какая то. 2. Химическое соединение, обладающее кислым вкусом и окрашивающее синий лакмус в красный цвет (хим.).… … Толковый словарь Ушакова
кислота — КИСЛОТА, ы, мн. оты, от, жен. Химическое соединение, содержащее водород, дающее при реакции с основаниями (в 8 знач.) соли и окрашивающее лакмусовую бумагу в красный цвет. Азотная, уксусная к. | прил. кислотный, ая, ое. К. краситель. К. дождь (с… … Толковый словарь Ожегова
КИСЛОТА 1 — КИСЛОТА 1, Шы, мн. оты, от, ж. Химическое соединение, содержащее водород, дающее при реакции с основаниями (в 8 знач.) соли и окрашивающее лакмусовую бумагу в красный цвет. Азотная, уксусная к. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова … Толковый словарь Ожегова
КИСЛОТА 2 — см. кислый 1. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
кислота — КИСЛОТА, ы, ж Химическое соединение, обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. Кислота окрашивает лакмусовую бумагу в красный цвет … Толковый словарь русских существительных
КИСЛОТА — КИСЛОТА, химическое соединение, содержащее водород, который может быть замещен металлом или другим положительным ионом с образованием соли. Кислоты растворяются в воде с получением ионов водорода (Н+), то есть действуют как источник протонов;… … Научно-технический энциклопедический словарь
кислота́ — кислота, ы; мн. кислоты, кислот … Русское словесное ударение
Кислота — ж. 1. Химическое соединение, содержащее водород, способный замещаться металлом при образовании соли. 2. То, что своими свойствами цветом, запахом, едкостью и т.п. напоминает такое химическое соединение. Толковый словарь Ефремовой. Т. Ф. Ефремова … Современный толковый словарь русского языка Ефремовой
- http://studfiles.net/preview/6016217/page:24/
- http://zna4enie.ru/opredelenie/kisloty-opredelenie.html
- http://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no36-kisloty-klassifikacia-nomenklatura-fiziceskie-i-himiceskie-svojstva
- http://zadachki.net/himiya/page8324594.html
- http://dic.academic.ru/dic.nsf/ruwiki/16875
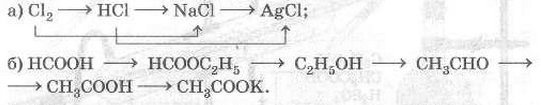
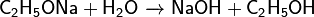











 любой концентрации и концентрированной серной кислоты
любой концентрации и концентрированной серной кислоты ), если образующаяся сольрастворима:
), если образующаяся сольрастворима:



