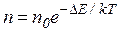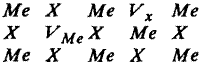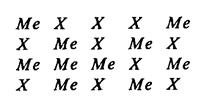Молекулярное строение твердых тел
Твердое тело имеет собственную форму, не растекается по объему и не принимает его форму. На микроскопическом уровне атомы прикрепляются друг к другу химическими связями, и их положение друг относительно друга фиксировано. При этом они могут образовывать как жесткие упорядоченные структуры — кристаллические решетки.
Кристаллическое тело может состоять из одного кристалла (монокристалл). Может состоять из многих «сросшихся» кристаллов (поликристаллы).
Монокристаллы обладают анизотропией, поликристаллы изотропны. Анизотропия — различие свойств по разным направлениям. Прежде всего, бросается в глаза различная механическая прочность кристаллов по разным направлениям. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Так же легко расслаивается в одном направлении кристалл графита. Когда вы пишете карандашом, такое расслоение происходит непрерывно и тонкие слои графита остаются на бумаге. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл алмаза по-разному преломляет свет в зависимости от направления падающих на него лучей.
Молекулы (ионы, атомы), образующие кристаллическую решетку, колеблются около положения узла, отклоняясь на малые, по сравнению с расстоянием между узлами, расстояния. Чем выше температура тела, тем больше размах колебаний молекул. Кинетическая энергия молекул значительно выше потенциальной энергии их взаимодействия.
Аморфные тела
Если связанные атомы образуют беспорядочные нагромождения, получим аморфное тело (именно такова структура полимеров, которые похожи на перепутанные и слипшиеся макароны в миске). К аморфным телам относятся стекло, смола, канифоль, сахарный леденец и др.
Следует иметь в виду, что в ряде случаев одно и то же вещество в зависимости от условий его получения может находиться как в кристаллическом, так и в аморфном состоянии. Так как аморфные тела могут самопроизвольно переходить в кристаллическое состояние, следует, что кристаллическая форма вещества более устойчива, чем аморфная.
Молекулы кварца: а) кристаллического, б) аморфного.
С точки зрения молекулярного строения аморфные тела следует отнести не к твердым телам — кристаллам, а к жидкостям с очень большой вязкостью.
Все аморфные тела изотропные, т.е. их физические свойства одинаковы по всем направлениям.
Молекулы аморфных тел движутся так, как движутся молекулы жидкостей, но их подвижность очень мала.
Жидкие кристаллы
Это фазовое состояние, в которое переходят некоторые вещества при определенных условиях (температура, давление, концентрация в растворе). Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия).
По структуре представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всем объёме этой жидкости.
Модель жидкого кристалла
Деформация твердого тела
Изменение линейных размеров или форм твердого тела под действием внешних сил.
Виды деформаций. Деформация растяжения или сжатия — изменение любого линейного размера тела (длины, ширины или высоты). Деформация сдвига — перемещение всех слоев твердого тела в одном направлении параллельно некоторой плоскости сдвига. Деформация изгиба — сжатие одних частей тела при растяжении других. Деформация кручения — поворот параллельных сечений образца вокруг некоторой оси под действием внешней силы.
Механические свойства твердых тел
Сила упругости возникает при деформации тела, обусловлена электромагнитными силами взаимодействия составляющих его частиц. При небольшом внешнем воздействии атомы выходят из состояния равновесия и стремятся вернуться в исходное положение. Сила упругости направлена противоположно деформации.
Возьмем медную проволоку длиной l и площадью поперечного сечения S. Подвесим груз, под действием силы тяжести проволока удлинится на
Абсолютное удлинение
Относительное удлинение
При деформации растяжения , при сжатии — .
Жесткость образца. Модуль Юнга.
Модуль Юнга характеризует упругие свойства вещества. Это постоянная величина, зависящая только от материала, его физического состояния. Физический смысл модуля Юнга: он численно равен напряжению, которое возникло бы в образце при относительной деформации, равной единице. Характеризует способность материала сопротивляться деформации растяжения или сжатия. Значение модуля Юнга табличное.
Механическим напряжением называется отношение силы упругости, возникающей в образце, к площади поперечного сечения образца
Зависимость между ? и ? является одной из важнейших характеристик механических свойств твердых тел. Графическое изображение этой зависимости называется диаграммой растяжения.
Предел пропорциональности. Существует максимальное напряжение (до точки a на диаграмме) , при котором сохраняется прямая пропорциональность между механическим напряжением и относительным удлинением
Предел упругости. Максимальное напряжение (точка b на диаграмме), при котором еще не возникают заметные остаточные деформации. При снятии внешней силы, деформирующей образец, размеры и формы возвращаются к исходным. При дальнейшем воздействии образец после снятия напряжения уже не восстанавливает свои первоначальные размеры и у тела сохраняется остаточная деформация. Такие деформации называются пластическими (участки bc, cd и de). На участке bc деформация происходит почти без увеличения напряжения. Это явление называется текучестью материала. В точке d достигается наибольшее напряжение, которое способен выдержать материал без разрушения (предел прочности). В точке e происходит разрушение материала.
Материалы, у которых область текучести незначительна, называются хрупкими (стекло, фарфор, чугун).
Механические свойства твердого вещества можно отобразить и на диаграмме
Закон Гука справедлив на участке 01.
Напряжение, при котором материал разрушается называется пределом прочности. При проектировании зданий нельзя допускать, чтобы механическое напряжение в элементах конструкций достигали предельных значений. Для этого вводится так называемый запас прочности или коэффициент безопасности
Значения пределов прочности веществ при различных видах деформации являются табличными.
Пластичные металлы
Одним из наиболее пластичных металлов является золото. Из него можно изготовить так называемое сусальное золото — золотую фольгу толщиной всего несколько микрон.
§ 8.6. Объяснение механических свойств твердых тел на основании молекулярно-кинетической теории
Механические свойства твердых тел и виды их деформаций: упругих и пластических — были достаточно подробно рассмотрены в «Механике», в § 2.4 было дано качественное объяснение справедливости закона Тука при малых деформациях. В дальнейшем после знакомства с законами электрических взаимодействий мы рассмотрим простейшую количественную теорию упругих деформаций ионных кристаллов. Теперь же познакомимся с объяснением пластических деформаций.
Механизм пластических деформаций
При упругих деформациях в кристаллических телах атомы лишь незначительно смещаются относительно друг друга. При пластических деформациях смещения атомов или молекул могут во много раз превышать расстояния между ними. Однако нарушения всей кристаллической структуры тела не происходит. Отдельные слои кристаллической решетки проскальзывают относительно друг друга. На рисунке 8.25 изображен тонкий кристалл меди после растяжения. Хорошо видны скольжения слоев.
Важно, что у всех кристаллов скольжение атомных слоев происходит не сразу по всему объему кристалла, а осуществляется за счет передвижения дислокаций. Перемещение же дислокаций связано с перестройкой решетки, затрагивающей одновременно небольшую группу атомов вдоль одной линии. Из-за этого прочность кристалла оказывается в десятки раз меньше той, которая была бы в совершенном кристалле без дислокаций. В таком кристалле один атомный слой должен был бы смещаться относительно другого сразу по всему кристаллу.
Процесс перемещения дислокаций подобен перемещению складки по ковру (рис. 8.26). Складку перемещать легче, чем весь ковер, а в результате ковер в целом сдвигается на некоторое расстояние, и складка исчезает. Точно так же дислокация исчезает после того, как движущаяся линия дислокации достигает поверхности кристалла.
Дислокации и прочность твердых тел
Пластические деформации, как мы выяснили, связаны с наличием дислокаций в кристаллах и возможностью их перемещений. Эти перемещения тормозятся различными препятствиями: атомами примесей, твердыми микроскопическими включениями, границами кристаллических зерен в поликристаллах, пересечениями с другими дислокациями. Если бы подобных торможений не было, то деформирующие силы быстро переместили бы все дислокации на поверхность кристалла, после чего кристалл стал бы исключительно прочным. На самом деле торможение дислокаций приводит к увеличению их числа в кристалле, к размножению дислокаций.
Наиболее прочными должны быть кристаллы, совершенно лишенные дислокаций. Но в реальных кристаллах они всегда имеются. Если число дислокаций невелико, то они практически перемещаются без пересечений, и прочность кристалла не очень велика. Упрочнение кристалла может быть достигнуто включением в него примесей или уменьшением размеров зерен в поликристаллах, а также увеличением числа дислокаций.
В технике широко используют повышение прочности металлов путем введения в них специальных добавок: никеля, вольфрама, ванадия и др.
Пластические деформации сами могут привести к увеличению количества дислокаций за счет их размножения при пересечениях. Этот способ повышения прочности называют наклепом. Наклеп осуществляют, протягивая металлические заготовки между валками или другими способами. Однако чрезмерное увеличение числа дислокаций делает кристаллическую решетку неустойчивой, и материал теряет прочность. В настоящее время знания о кристаллах и их дефектах достигли такого уровня, что можно точно предсказать, какова может быть прочность различных материалов. Разработаны принципы проектирования материалов с заданными свойствами. А это чрезвычайно важно для создания сверхзвуковых самолетов, космических ракет, дешевых и прочных автомобилей, тракторов и т. д. Появилась возможность повышения прочности материалов и тем самым уменьшения веса машин и механизмов, увеличения их надежности.
Пластические деформации вызываются перемещением дислокаций. Материал без дислокаций был бы исключительно прочен.
Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории
Характеристика тепловых явлений в молекулярной физике. Рассмотрение основных положений молекулярно-кинетической теории. Основной порядок взаимодействия молекул. Изучение строения газообразных, жидких и твердых тел. Описание Броуновского движения.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 16.01.2015 |
| Размер файла | 358,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ГБОУ НПО АО «Профессиональное училище № 1»
РЕФЕРАТ НА ТЕМУ:
«Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории»
Выполнил: Акишин Дмитрий Андреевич
Проверил: Жубрева Лидия Николаевна
1. Тепловые явления в молекулярной физике
2. Основные положения молекулярно-кинетической теории
3. Взаимодействие молекул
4. Строение газообразных, жидких и твердых тел
5. Броуновское движение
1. Тепловые явления в молекулярной физике
тепловой броуновский кинетический твердый
Тепловые явления привлекали внимание людей с древних времён. Умение добывать и поддерживать огонь сделало человека относительно независимым от колебаний температуры окружающей среды. Это было одним из величайших изобретений человечества. Изменение температуры оказывает влияние на все свойства тел. Кроме механических свойств, при изменении температуры меняются и другие свойства тел, например сопротивление электрическому току, магнитные свойства и др. Так, если сильно нагреть постоянный магнит, то он перестанет притягивать железные предметы. Все перечисленные выше и многие другие тепловые явления подчиняются определённым законам. Открытие законов тепловых явлений позволяет с максимальной пользой применять эти явления на практике и в технике. Молекулярно-кинетическая теория. Ещё философы древности догадывались о том, что теплота — это вид внутреннего движения. Но только в ХVIII в. Начала развиваться последовательная молекулярно — кинетическая теория. Цель молекулярно-кинетической теории — объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, беспорядочно движущихся частиц. Большой вклад в развитие молекулярно-кинетической теории был сделан М.В. Ломоносовым. Он рассматривал теплоту как вращательное движение частиц, составляющих тела.
2. Основные положения молекулярно-кинетической теории
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Каждое утверждение строго доказано с помощью опытов. Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или ещё более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в реальности молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займёт всю поверхность, если сосуд велик. Нельзя заставить капельку объёмом 1 мм(в кубе) расплыться так, чтобы она заняла площадь поверхности более 0,6 м(в квадрате). Объём V слоя масла равен произведению его площади поверхности S на толщину d слоя, т.е V=Sd. Следовательно, размер молекулы оливкового масла равен: d = ? 1,7 Ч см.
При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно, объёмом 1.
Диаметр молекулы воды равен примерно 3 Ч . Считая, что каждая молекула воды при плотной упаковке молекул занимает объём капли (1 на объём, приходящийся на одну молекулу:
Размеры атома надо запомнить: D ?см ? м.
3. Взаимодействие молекул
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел. Молекула- это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими.
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличиваются, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул.
При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и между молекулами возникают быстро нарастающие силы отталкивания.
4. Строение газообразных, жидких и твердых тел
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга.
Молекулы с огромными скоростями — сотни метров в секунду -движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т.е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12-10-13 с). С повышением температуры время оседлой жизни молекул уменьшается. Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И. Френкелем, позволяет понять основные свойства жидкостей. Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.8.8). Вот почему жидкость течет и принимает форму сосуда.
Атомы или молекулы твёрдых тел колеблются около определённых положений равновесия, поэтому твёрдые тела сохраняют не только объём ,но и форму
Если соединить центр равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристалической
Кристаллы — это твёрдые тела, атомы или молекулы которых занимают определённое, порядочное положение в пространстве. Поэтому кристаллы имеют плоские грани. Например крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное- это зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Зависимость физических свойств от направления внутри кристалла называют анизотропией. Все кристаллические тела анизотропны.
Монокристаллы и поликристаллы.
Кристаллическую структуру имеют металлы. Если взять большой кусок металла, то на первый взгляд его кристаллическое строении никак не проявляется ни во внешнем виде куска, ни в его физических свойствах
Обычно металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению к друг другу беспорядочно. В результате в объеме, значительно превышающем объем отдельных кристалликов, все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллическим. Одиночные кристаллы называют монокристаллами.
5. Броуновское движение
Броуновское движение- это тепловое движение взвешенных в жидкости( или газе) частиц.
Наблюдения броуновского движения. Английский ботаник Р.Броун (1773-1858) впервые наблюдал это явление 1827 г. Рассматривая в микроскоп взвешенные в воде споры плауна. Позже он рассматривал и другие мельчайшие частицы, в том числе частички камня египетских пирамид. Сейчас для наблюдения броуновского движения используют частички краски гуммируют, которая нерастворима в воде. Эти частички совершают беспорядочное движение. Броуновское движение — тепловое движение, и оно не может прекратиться. С увеличением температуры интенсивность его растёт. Положения частиц, отмеченные точками, определены через равные промежутки времени — 30 с. Броуновское движение можно наблюдать и в газе. Его совершают взвешенные в воздухе частицы пыли или дыма.
Газы — агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек.
Жидкость — агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д.
Твёрдое тело — одно из четырёх агрегатных состояний вещества, отличающееся от др. агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует
1. Физика 10 класс Г. Я Мякишев М. «Просвещение» 2007.
2. Арцимович Л. А., Элементарная физика плазмы, 3 изд., М., 2002;
3. Франк-Каменецкий Д. А., Лекции по физике состояний вещества, М., 2003 (переиздание);
4. Френкель Я. И., Собрание избранных трудов, т. 3, М., 2001;
5. Фишер И.3., Статистическая теория жидкостей, М., 2003;
6. Физика простых жидкостей. Экспериментальные исследования, пер. с англ., М., 2002
Размещено на Allbest.ru
Подобные документы
Основные положения атомно-молекулярного учения. Закономерности броуновского движения. Вещества атомного строения. Основные сведения о строении атома. Тепловое движение молекул. Взаимодействие атомов и молекул. Измерение скорости движения молекул газа.
презентация [226,2 K], добавлен 18.11.2013
Анализ теорий, устанавливающих связи между измеряемыми на опыте величинами и свойствами молекул. Идеальный газ как газ, взаимодействие между молекулами которого пренебрежимо мало. Причины возникновения давления газа в молекулярно-кинетической теории.
презентация [151,4 K], добавлен 08.01.2015
Определения молекулярной физики и термодинамики. Понятие давления, основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Уравнение состояния идеального газа (Менделеева — Клапейрона).
презентация [972,4 K], добавлен 06.12.2013
Основные понятия и определения молекулярной физики и термодинамики. Основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Состояние идеального газа (уравнение Менделеева-Клапейрона).
презентация [1,1 M], добавлен 13.02.2016
Вычисление скорости молекул. Различия в скоростях молекул газа и жидкости. Экспериментальное определение скоростей молекул. Практические доказательства состоятельности молекулярно-кинетической теории строения вещества. Модуль скорости вращения.
презентация [336,7 K], добавлен 18.05.2011
Содержание молекулярно-кинетической теории газов. Химический состав жидкости. Особенности межмолекулярного взаимодействия в данном агрегатном состоянии. Механические и тепловые свойства твердых тел. Практическое применение плазмы — ионизованного газа.
контрольная работа [26,0 K], добавлен 27.10.2010
Характеристика законов Бойля-Мариотта, Бойля-Мариотта, Авогадро. Парциальное давление как давление, которое оказывал бы каждый газ смеси, если бы он один занимал объем, равный объему смеси. Знакомство с положениями молекулярно-кинетической теории газа.
презентация [625,5 K], добавлен 06.12.2016
Изучение корпускулярной концепции описания природы, сущность которой в том, что все вещества состоят из молекул — минимальных частиц вещества, сохраняющих его химические свойства. Анализ молекулярно-кинетической теории газа. Законы для идеальных газов.
контрольная работа [112,2 K], добавлен 19.10.2010
Особенности определения давления газа на стенку сосуда с использованием второго закона Ньютона. Связь этой величины со средней кинетической энергией молекул и их концентрацией. Специфика схематичного вывода основного уравнения упрощенным методом.
презентация [316,6 K], добавлен 19.12.2013
Молекулярная физика как раздел физики, в котором изучаются свойства вещества на основе молекулярно-кинетических представлений. Знакомство с основными особенностями равновесной термодинамики. Общая характеристика молекулярно-кинетической теории газов.
курсовая работа [971,8 K], добавлен 01.11.2013
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории
Характеристика тепловых явлений в молекулярной физике. Рассмотрение основных положений молекулярно-кинетической теории. Основной порядок взаимодействия молекул. Изучение строения газообразных, жидких и твердых тел. Описание Броуновского движения.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 16.01.2015 |
| Размер файла | 358,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ГБОУ НПО АО «Профессиональное училище № 1»
РЕФЕРАТ НА ТЕМУ:
«Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории»
Выполнил: Акишин Дмитрий Андреевич
Проверил: Жубрева Лидия Николаевна
1. Тепловые явления в молекулярной физике
2. Основные положения молекулярно-кинетической теории
3. Взаимодействие молекул
4. Строение газообразных, жидких и твердых тел
5. Броуновское движение
1. Тепловые явления в молекулярной физике
тепловой броуновский кинетический твердый
Тепловые явления привлекали внимание людей с древних времён. Умение добывать и поддерживать огонь сделало человека относительно независимым от колебаний температуры окружающей среды. Это было одним из величайших изобретений человечества. Изменение температуры оказывает влияние на все свойства тел. Кроме механических свойств, при изменении температуры меняются и другие свойства тел, например сопротивление электрическому току, магнитные свойства и др. Так, если сильно нагреть постоянный магнит, то он перестанет притягивать железные предметы. Все перечисленные выше и многие другие тепловые явления подчиняются определённым законам. Открытие законов тепловых явлений позволяет с максимальной пользой применять эти явления на практике и в технике. Молекулярно-кинетическая теория. Ещё философы древности догадывались о том, что теплота — это вид внутреннего движения. Но только в ХVIII в. Начала развиваться последовательная молекулярно — кинетическая теория. Цель молекулярно-кинетической теории — объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, беспорядочно движущихся частиц. Большой вклад в развитие молекулярно-кинетической теории был сделан М.В. Ломоносовым. Он рассматривал теплоту как вращательное движение частиц, составляющих тела.
2. Основные положения молекулярно-кинетической теории
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Каждое утверждение строго доказано с помощью опытов. Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или ещё более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в реальности молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займёт всю поверхность, если сосуд велик. Нельзя заставить капельку объёмом 1 мм(в кубе) расплыться так, чтобы она заняла площадь поверхности более 0,6 м(в квадрате). Объём V слоя масла равен произведению его площади поверхности S на толщину d слоя, т.е V=Sd. Следовательно, размер молекулы оливкового масла равен: d = ? 1,7 Ч см.
При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно, объёмом 1.
Диаметр молекулы воды равен примерно 3 Ч . Считая, что каждая молекула воды при плотной упаковке молекул занимает объём капли (1 на объём, приходящийся на одну молекулу:
Размеры атома надо запомнить: D ?см ? м.
3. Взаимодействие молекул
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел. Молекула- это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими.
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличиваются, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул.
При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и между молекулами возникают быстро нарастающие силы отталкивания.
4. Строение газообразных, жидких и твердых тел
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга.
Молекулы с огромными скоростями — сотни метров в секунду -движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т.е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12-10-13 с). С повышением температуры время оседлой жизни молекул уменьшается. Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И. Френкелем, позволяет понять основные свойства жидкостей. Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.8.8). Вот почему жидкость течет и принимает форму сосуда.
Атомы или молекулы твёрдых тел колеблются около определённых положений равновесия, поэтому твёрдые тела сохраняют не только объём ,но и форму
Если соединить центр равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристалической
Кристаллы — это твёрдые тела, атомы или молекулы которых занимают определённое, порядочное положение в пространстве. Поэтому кристаллы имеют плоские грани. Например крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное- это зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Зависимость физических свойств от направления внутри кристалла называют анизотропией. Все кристаллические тела анизотропны.
Монокристаллы и поликристаллы.
Кристаллическую структуру имеют металлы. Если взять большой кусок металла, то на первый взгляд его кристаллическое строении никак не проявляется ни во внешнем виде куска, ни в его физических свойствах
Обычно металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению к друг другу беспорядочно. В результате в объеме, значительно превышающем объем отдельных кристалликов, все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллическим. Одиночные кристаллы называют монокристаллами.
5. Броуновское движение
Броуновское движение- это тепловое движение взвешенных в жидкости( или газе) частиц.
Наблюдения броуновского движения. Английский ботаник Р.Броун (1773-1858) впервые наблюдал это явление 1827 г. Рассматривая в микроскоп взвешенные в воде споры плауна. Позже он рассматривал и другие мельчайшие частицы, в том числе частички камня египетских пирамид. Сейчас для наблюдения броуновского движения используют частички краски гуммируют, которая нерастворима в воде. Эти частички совершают беспорядочное движение. Броуновское движение — тепловое движение, и оно не может прекратиться. С увеличением температуры интенсивность его растёт. Положения частиц, отмеченные точками, определены через равные промежутки времени — 30 с. Броуновское движение можно наблюдать и в газе. Его совершают взвешенные в воздухе частицы пыли или дыма.
Газы — агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек.
Жидкость — агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д.
Твёрдое тело — одно из четырёх агрегатных состояний вещества, отличающееся от др. агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует
1. Физика 10 класс Г. Я Мякишев М. «Просвещение» 2007.
2. Арцимович Л. А., Элементарная физика плазмы, 3 изд., М., 2002;
3. Франк-Каменецкий Д. А., Лекции по физике состояний вещества, М., 2003 (переиздание);
4. Френкель Я. И., Собрание избранных трудов, т. 3, М., 2001;
5. Фишер И.3., Статистическая теория жидкостей, М., 2003;
6. Физика простых жидкостей. Экспериментальные исследования, пер. с англ., М., 2002
Размещено на Allbest.ru
Подобные документы
Основные положения атомно-молекулярного учения. Закономерности броуновского движения. Вещества атомного строения. Основные сведения о строении атома. Тепловое движение молекул. Взаимодействие атомов и молекул. Измерение скорости движения молекул газа.
презентация [226,2 K], добавлен 18.11.2013
Анализ теорий, устанавливающих связи между измеряемыми на опыте величинами и свойствами молекул. Идеальный газ как газ, взаимодействие между молекулами которого пренебрежимо мало. Причины возникновения давления газа в молекулярно-кинетической теории.
презентация [151,4 K], добавлен 08.01.2015
Определения молекулярной физики и термодинамики. Понятие давления, основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Уравнение состояния идеального газа (Менделеева — Клапейрона).
презентация [972,4 K], добавлен 06.12.2013
Основные понятия и определения молекулярной физики и термодинамики. Основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Состояние идеального газа (уравнение Менделеева-Клапейрона).
презентация [1,1 M], добавлен 13.02.2016
Вычисление скорости молекул. Различия в скоростях молекул газа и жидкости. Экспериментальное определение скоростей молекул. Практические доказательства состоятельности молекулярно-кинетической теории строения вещества. Модуль скорости вращения.
презентация [336,7 K], добавлен 18.05.2011
Содержание молекулярно-кинетической теории газов. Химический состав жидкости. Особенности межмолекулярного взаимодействия в данном агрегатном состоянии. Механические и тепловые свойства твердых тел. Практическое применение плазмы — ионизованного газа.
контрольная работа [26,0 K], добавлен 27.10.2010
Характеристика законов Бойля-Мариотта, Бойля-Мариотта, Авогадро. Парциальное давление как давление, которое оказывал бы каждый газ смеси, если бы он один занимал объем, равный объему смеси. Знакомство с положениями молекулярно-кинетической теории газа.
презентация [625,5 K], добавлен 06.12.2016
Изучение корпускулярной концепции описания природы, сущность которой в том, что все вещества состоят из молекул — минимальных частиц вещества, сохраняющих его химические свойства. Анализ молекулярно-кинетической теории газа. Законы для идеальных газов.
контрольная работа [112,2 K], добавлен 19.10.2010
Особенности определения давления газа на стенку сосуда с использованием второго закона Ньютона. Связь этой величины со средней кинетической энергией молекул и их концентрацией. Специфика схематичного вывода основного уравнения упрощенным методом.
презентация [316,6 K], добавлен 19.12.2013
Молекулярная физика как раздел физики, в котором изучаются свойства вещества на основе молекулярно-кинетических представлений. Знакомство с основными особенностями равновесной термодинамики. Общая характеристика молекулярно-кинетической теории газов.
курсовая работа [971,8 K], добавлен 01.11.2013
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Твердое состояние вещества
Твердое состояние вещества характеризуется сохранением формы тела без внешних ограничителей (сосудов) в течение длительного времени. Сохранение формы твердого тела обеспечивается за счет сил взаимодействия микрочастиц, составляющих тело — атомов, ионов, молекул. Важнейшие для практического использования свойства твердых тел значительно различаются в зависимости от состава и внутреннего строения (структуры) тел. В курсе “Основы пирометаллургического производства” и далее в других металлургических курсах вы так или иначе будете сталкиваться с такими важными свойствами твердых тел, как:
· скорость диффузионного переноса;
· коррозионная стойкость и др.
Детально исследование свойств твердых тел и влияния на них различных факторов рассматривается в специальных материаловедческих курсах и курсах, посвященных обработке металлов. Мы в данном разделе в самом общем виде, принципиально, коснемся только некоторых особенностей строения твердых тел, объясняющих основные их свойства (и, прежде всего, металлов).
Химическая связь в кристаллах и элементы зонной теории твердых тел
Природа химической связи рассматривается в курсах физики, химии, физической химии. Поэтому ограничимся лишь напоминанием отличительных особенностей некоторых типов связи, что необходимо для целостности изложения и понимания дальнейшего текста.
Химическая связь осуществляется главным образом силами электрического происхождения, обусловленными взаимодействием внешних электронных оболочек атомов.
В зависимости от характера химической связи все кристаллические тела можно разделить на следующие группы: молекулярные, ионные, ковалентные (атомные) и металлические.
Зонное строение твердых тел подробно рассматривается в курсе физики. В настоящем издании приведены отдельные элементы этой теории.
Положение каждого электрона в атоме отвечает строго определенному квантовому состоянию. В данном квантовом состоянии может находиться лишь один электрон, или эти уровни могут быть не заполнены (принцип Паули).
Электронная конфигурация атомов различных элементов, как известно, записывается следующим образом. Например, натрий: (1s) 2 (2s) 2 (2p) 6 (3S) 1 .
Электроны в атоме натрия располагаются на разрешенных уровнях в количествах, соответствующих принципу Паули.
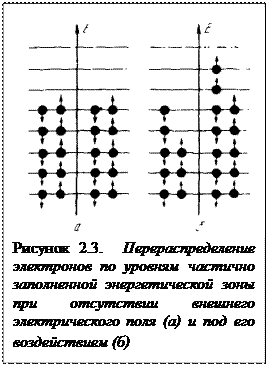
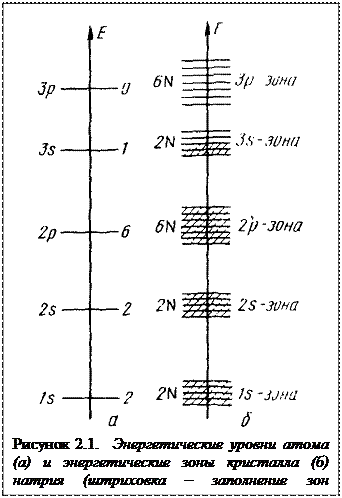
Энергетическое состояние электронов в атоме натрия может быть изображено и другими средствами. На рисуноке 2.1 приведено графическое изображение в условных координатах расположения разрешенных уровней энергии, на которых располагаются электроны.
При образовании из нескольких атомов, того же натрия, твердого кристалла в системе возникают изменения. Сближение отдельных атомов до определенного расстояния вызывает возникновение сил, обеспечивающих взаимное притяжение. Из отдельных атомов образуются молекулы, из молекул твердые тела.
Между разрешенными энергетическими зонами располагается запрещенная зона, которую не могут занимать электроны.
Схематичное графическое изображение образования из атомов натрия твердого кристалла и изменения в структуре энергетических уровней и зон иллюстрирует рисунок 2.1.
Если N атомов образуют кристалл, то, как уже говорилось, вместо дискретных квантовых состояний отдельных атомов образуется энергетическая зона, содержащая N квантовых состояний. В соответствии с принципом Паули в s-состоянии может располагаться не более двух электронов (учитывая различные спины электронов). Таким образом, для заполнения этой энергетической зоны электронами имеется 2N вакантных мест. В зоне p-уровней, соответственно, 6N вакантных мест.
Рассмотрим образование кристалла из атомов натрия (рисунок 2.1). Одноквантовый 1s-уровень превратится в 1s-зону, занимаемую 2N электронами; 1з-зона будет заполнена полностью. То же относится к 2s- и 2р-зонам. В Зs-зоне могут разместиться 2N электронов, но у N атомов Na есть лишь N электронов в состоянии 3s. Следовательно, эта зона заполнена только наполовину. Зоны, лежащие выше, будут совсем не заполнены.
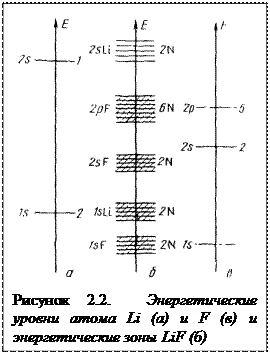
Рассмотрим теперь образование кристалла из атомов лития и фтора (рисунок 2.2). При образовании кристалла из атомов фтора и лития будут полностью заполнены зоны: 1sF, 1sLi, 2sF, 2р-зона фтора имеет 6N вакантных мест для электронов. По у фтора всего 5N электронов в 2р-состояниях. Заполнение электронных оболочек наряду с принципом Паули подчиняется также принципу сохранения системой минимума энергии. Поэтому электроны лития, находящиеся в 2s-состоянии, при наличии свободного места перейдут в зону 2рF, занимающую более низкое энергетическое положение. Количество этих электронов N, общее количество электронов в зоне 2pF-6N. Таким образом, эта зона оказывается заполненной до отказа, а зона 2s остается пустой (рисунок 2.2).
При отсутствии внешнего электрического поля (рисунок 2.3, а) движение электронов хаотично. Такие электроны имеют одинаковые скорости движения во всех направлениях. Приложение внешнего поля (рисунок 2.3, 6) делает движение электронов направленным. В кристалле возникает электрический ток. Сама возможность перемещения электрона при наложении поля обусловлена тем, что имеются очень близкие по энергии вакантные квантовые уровни, поскольку зона не заполнена полностью. Такой случай характерен для металлов.
Совершенно другая картина возникает, если валентная зона оказывается заполненной полностью. Наложение электрического поля в этом случае не приводит к возникновению электрического тока по той причине, что нет вакантных квантовых уровней, куда бы электрон мог переместиться. Хотя следующая разрешенная энергетическая зона (зона проводимости) не заполнена, энергии электрического поля не недостаточно, чтобы возбудить электрон и перевести его в эту незаполненную зону со свободными квантовыми уровнями. Необходимы большие энергии для возбуждения перехода электрона на вышележащие уровни. Величина этой энергии зависит от разности энергий в валентной зоне и зоне проводимости, т.е. от ширины запрещенной ЗОНЫ. Если ширина запрещенной зоны велика, то материал относится к классу диэлектриков (например, такие важные для цветной металлургии вещества, как SiО2, А12O3, NaCl и др.).
Таким образом, диэлектрики характеризуются полностью заполненной валентной зоной и большой шириной запрещенной зоны.
Если энергетический зазор между дном зоны проводимости и верхом валентной зоны невелик, то приложение незначительной внешней энергии, например тепловой, может оказаться достаточной для перехода части электронов из заполненной валентной ЗОНЫ в свободную зону проводимости (рисунок 2.4). Повышение температуры позволяет электронам в ряде соединений преодолеть энергетический барьер запрещенной зоны. В этом. случае зона проводимости оказывается частично заполненной, а в валентной зоне появляются вакантные места электронов. Такие незанятые квантовые состояния электронов называются дырками, которым приписывается положительный заряд. В этом случае приложение внешнего электрического поля к кристаллу вызовет электрический ток, как вследствие перемещения электронов в зоне проводимости, так и дырок в валентной зоне.
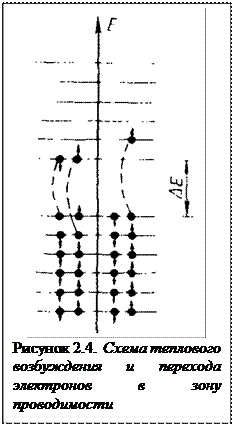
где ∆E — ширина запрещенной зоны, эВ; k= 8,б1б7 . 10 -5 постоянная Больцмана эВ/град; n — число электронов в валентной зоне.
Таким образом, чем больше ширина запрещенной зоны, тем более высокая температура требуется для разрушения связей, поскольку энергия пропорциональна величине kT.
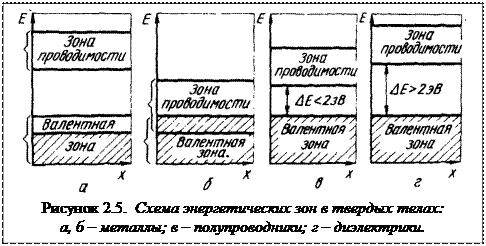
Таким образом, согласно зонной теории твердых тел, различие между металлами (удельная электропроводность æ = 10 6 ÷10 8 Ом -1 м -1 ) полупроводниками (æ = 10 5 ÷10 -7 Ом -1 м -1 ) и диэлектриками (æ = 10 -8 ÷10 -20 Ом -1 м -1 ) связано с разным расположением энергетических зон (рисунок 2.5). На рисунке 2.5а валентная зона не заполнена, на рисунке 2.5 б валентная зона и зона проводимости перекрываются. В обоих случаях существуют незаполненные квантовые уровни, на которые могут переходить электроны практически без затраты энергии. Это обусловливает высокую электропроводность материалов с такой структурой. Зонная структура, приведенная на рисунке 2.5 а и б, характерна для металлов.
Полупроводники характеризуются наличием запрещенной зоны и полностью заполненной валентной зоной. К классу полупроводников условно относятся вещества с шириной запрещенной зоны до 2,5 эВ (рисунок 5 в). Вещества, имеющие ширину запрещенной зоны > 2,5 эВ, относятся к классу диэлектриков (рисунок 5 г).
Кристаллическая структура и свойства твердых тел. Дефекты структуры кристаллов
Большинство твердых тел, в том числе и металлы, имеют кристаллическую структуру. Тип кристаллической решетки твердого тела во многом определяет его физические свойства. Например, графит и алмаз – это две разные кристаллические формы (модификации) одного и того же элемента – углерода. Несмотря на то, что химический состав этих веществ полностью идентичен, за счет различий в типе кристаллических решеток физические (и некоторые физико-химические) свойства графита и алмаза различаются значительно (твердость, электропроводность,кинетика окисления и др.). Однако, подобных примеров существования различных типов кристаллической решетки для разных веществ немного. В большинстве случаев для одного и того же вещества в твердом виде (при одной температуре) характерен один тип кристаллической решетки, который во многом определяется строением и свойствами атомов и молекул ее составляющими.
Для металлов характерны типы кристаллических решеток, отличающиеся высокой плотностью упаковки. Во многом благодаря этому (помимо собственных размеров атомов и молекул, входящих в состав кристалла) большинство металлов имеют более высокую плотность по сравнению, например, с неметаллами, или их соединениями с металлами.
С ростом температуры плотность твердых веществ снижается. Связано это с тем, что с увеличением температуры увеличивается амплитуда колебаний атомов (ионов, молекул) в узлах кристаллической решетки, в результате чего возрастает расстояние между ними и, соответственно плотность твердого тела снижается. Коэффициенты температурного расширения металлов как правило выше, чем неметаллов. Коэффициенты теплового расширения твердых тел имеют важное значение для практического использования изделий из твердых тел.
В природе и технике с идеальными кристаллами приходится встречаться редко. Наличие дефектов в кристаллах существенно сказывается на физико-химических свойствах вещества. От наличия дефектов зависят такие свойства твердых тел, как электро- и теплопроводность, механические, химические свойства и т.д. дефекты в кристаллах влияют на термодинамические свойства вещества и кинетику металлургических процессов. Различают следующие два основных вида дефектов в кристаллах: точечные и линейные или плоскостные. Точечные дефекты можно подразделить на атомные (ионные) и электронные.
К атомным можно отнести следующие шесть типов дефектов.
1. Химические примеси. Кристалл с содержанием примеси 0,1 % с химической точки зрения можно считать чистым, но с позиции физики такое содержание будет весьма значительным. Любая точка в подобном кристалле удалена от атома примеси (при равномерном распределении) не более чем на несколько межатомных расстояний. Чужеродные атомы могут быть примесями замещения или примесями внедрения (рис. 2.6).

2. Дефект Френкеля. В результате каких-то воздействий атом (ион) из узла решетки может перейти в междузлие с возникновением вакансии в решетке. Этот тип дефекта называется дефектом Френкеля. Он встречается как в элементарных веществах, так и в химических соединениях. В случае химических соединений дефекты Френкеля могут возникать в подрешетке как металла, так и аниона. Не исключена возможность одновременного возникновения дефектов Френкеля в подрешетках металла Ме и аниона Х (анти Френкель):
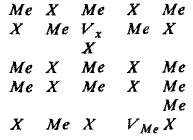 |
Электронейтральность системы и стехиометрические соотношения между катионами и анионами при образовании этого типа дефекта в кристалле не нарушаются.
З. Дефекты Шотки связаны с выходом атома (иона) из узла решетки на поверхность и возникновением в кристалле вакансий. В случае соединения дефекты Шотки могут возникать в подрешетке металла, аниона или одновременно и в той, и в другой подрешетках:
В случае одновременного возникновения вакансий в подрешетках металла и аниона стехиометрические соотношения между компонентами соединения не нарушаются. Образование вакансий одного типа связано с отклонением в стехиометрии соединения и дополнительным возникновением электронных дефектов с сохранением электронейтральности системы дефект анти Шотки — равные количества межузельных атомов М и Х, имеющих одинаковую валентность.
4. Дефект антиструктуры в кристаллах соединений — место катиона в узле решетки занимает анион или наоборот:
5. Наряду с возникновением перечисленных относительно простых дефектов возможно образование и более сложных комплексных дефектов В частности, при образовании ковалентных связей у атомов серы, селена и теллура друг с другом возможно их сближение вокруг вакансии металла с образованием сложных комплексных дефектов с замыканием связей между отдельными атомами (Например, S-S).
6. Дефектами в кристаллах следует считать наличие электронов в зоне проводимости и дырок в валентной зоне дефекты такого рода характерны для диэлектриков и полупроводников.
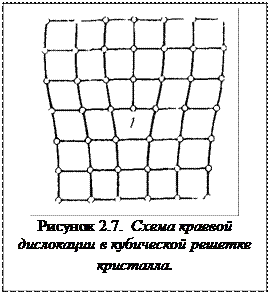
Дефекты кристаллической решетки оказывают большое влияние на механические, электрофизические свойства кристаллов (кристаллических веществ), кинетику металлургических процессов. Например, присутствие даже небольших количеств (0,1-1 %) серы, свинца, мышьяка, сурьмы в меди в несколько раз (и даже на порядки) ухудшает такие важнейшие свойства меди как электропроводность, теплопроводность, пластичность, коррозионная стойкость и др., и во многом это связано с возникновением различных дефектов в кристаллической структуре металла.
Далеко не всегда те или иные изменения в кристаллической структуре металла, связанные с присутствием примесей, оказывают негативные воздействие на все свойства металла. Например, добавка небольших количеств меди, марганца и магния к алюминию приводит к значительному увеличению его прочности, что позволяет расширить диапазон применения алюминия.
Диффузия в твердых телах
Металлургам обычно приходится иметь дело с реакциями, протекающими в гетерогенных системах. Во многих случаях скорость протекания процесса лимитируется скоростью процессов массообмена и в том числе скоростью молекулярной диффузии. В свою очередь скорость процесса диффузии в твердых телах зависит от структуры дефектов, а изучение закономерностей массообмена дает ценную информацию о природе дефектов. Общие закономерности диффузионного перемещения частиц в веществе определяются законами Фика.
При наличии градиента концентрации какого-либо вещества вдоль оси Х возникает поток П, который пропорционален градиенту концентрации дс. Это первый закон Фика:
где: D — коэффициент пропорциональности или коэффициент диффузии, см 2 /c.
Если исчезнет градиент концентрации, исчезнет и поток компонентов вдоль оси.
Если стационарное состояние не достигнуто, т.е. концентрация компонента меняется в каждой точке в зависимости от времени, первый закон Фика удобнее выражать в дифференциальной форме:
дс/дt = — D . (д 2 с/дx 2 )
Уравнение представляет собой второй закон Фика. Коэффициент диффузии D различен для разных веществ и даже для одного и того же вещества в сильной степени зависит от структуры дефектов и их концентрации. Эта характеристика не является постоянной величиной для всей области гомогенности существования данного вещества или твердого раствора.
Атомы и ноны могут диффундировать в твердом теле по различному механизму. В литературе рассматриваются четыре различных варианта механизма диффузии в твердых телах.
1. Межузельный механизм. Можно предположить, что атом (ион) диффундирует из одного положения в другое по межузлиям, не вызывая смещения атомов матрицы. Прежде чем атом 1 (рис. 2.8, а) может перейти в состояние 2, атомы З и 4 должны раздвинуться, чтобы дать ему возможность провести перемещение. Такое расширение атомов, или искажение решетки, требует затраты энергии Считается, что такой механизм доминирует в сплавах, в которых посторонние атомы образуют раствор внедрения и атомы примеси по размерам существенно отличаются от атомов матрицы.
2. Вакансионный механизм. Пусть в плотно упакованной гранецентрированной решетке имеется вакансия (см. рисунок 2.8, 6). Казалось бы, при этом энергия, которую необходимо затратить на переход атома в вакансию, сравнительно невелика (так же как и в предыдущем случае, энергия должна быть затрачена на искажение решетки). Исходя из этого, следовало бы ожидать высоких коэффициентов диффузии. В действительности же коэффициенты диффузии при вакансионном механизме нередко меньше, чем для случая межузельной диффузии.
З. Диффузия по межузлиям путем вытеснения (обменный механизм). Примесные атомы, образующие растворы внедрения, обычно по размерам заметно меньше, чем атомы металла—растворителя. Если внедренные атомы близки по размеру к атомам растворителя, то переход таких больших атомов из одного межузлия в другое будет сопряжен с большими затратами энергии, с серьезным искажением решетки диффузии в этом случае может происходить путем выталкивания внедренным атомом одного из ближайших соседей в соседнее межузлие (см. рис. 2.8, в).
Атом 1, находящийся в межузлии, выталкивает с мест “хозяина” атом 2 и занимает его место. Атом 2 перемещается в ближайшее межузлие (положение 3).
4. Кольцевой .механизм. Самодиффузия частиц в кристаллах может осуществляться по кольцевому механизму (см рис. 2.8). При этом для перемещения одной частицы требуется большая затрата энергии на искажение решетки Если же в движение вовлекаются 2—3 частицы или более, то затрата энергии будет значительно меньшей.
Приведенные варианты механизмов диффузии тесно связаны со строением твердого тела. Так, чем большее количество вакансий имеется в твердом теле, тем легче и быстрее должна осуществляться диффузия частиц, тем с большей скоростью будут протекать металлургические процессы.
Оценку тому или иному механизму диффузии в твердом теле можно дать на основании изучения зависимости диффузии от температуры:
(D — коэффициент диффузии, м 2 /c; D — предэкспоненциальный фактор, характеризующий величину коэффициента диффузии при высоких температурах, м 2 /c; Е — энергия активации диффузии, величина, определяющая высоту потенциального барьера, который надо преодолеть частице, чтобы перейти из одного положения в решетке в соседний узел или межузлие, кДж/моль)
Величины Е и Р можно найти аналитическим или графическим путем по экспериментальным данным. Температурной зависимости коэффициента диффузии золота в серебре соответствует выражение: D = 5,3 . 10 -8. exp(124862/8,31 . Т), м 2 /c; D = 5,3 . 10 -8 м 2 /c; Е = 125 кДж/моль.
Так как lnD = lnD — Е/RТ, то, продифференциировав последнее выражение, получим dlnD/d(1/Т) —Е/R, из которого определим Е при известных Т и D. Подставляя значение Е в предыдущую формулу, можно определить D.
Величины Е и D определяются и из графической зависимости. Очевидно, тангенс угла наклона прямой в осях lnD -1/Т будет равен Е/R, а отрезок на оси ординат при 1/Т =0 соответствует lnD.
Наиболее совершенным методом определения коэффициентов диффузии является метод определения изменения концентра диффундирующего вещества о времени в толще образца с использованием радиоизотопов.
- http://studfiles.net/preview/2383541/page:104/
- http://revolution.allbest.ru/physics/00507166_0.html
- http://revolution.allbest.ru/physics/00507166_0.html
- http://helpiks.org/6-85488.html