Групповая работа как эффективная форма организации работы учащихся
Методическая разработка урока химии в восьмом классе
Ефимова Галина Михайловна
учитель химии и биологии
г. Санкт- Петербурга
В последнее время большое внимание уделяется формированию у учащихся самостоятельности, инициативности, умению находить, анализировать и систематизировать информацию. Работа учащихся строится таким образом, чтобы привить навык сотрудничества, общения, научить слушать других и одновременно делать самостоятельные выводы. Этому способствует групповая работа на уроках, которая дает возможность формировать умение сообща выполнять задания, использовать прием взаимоконтроля и оценки. Кроме того, работа в группа сближает ребят, привносит новизну в учебный процесс. Таким образом групповой метод работы становится очень актуальным, особенно с переходом на новые ФГОС. Уроки химии не стали исключением, в курсе очень много тем, где можно применять такой метод работы, например, «Свойства кислот, солей и оснований с точки зрения ТЭД».
Цели урока: изучить свойства кислот с позиции ТЭД, продолжить формирование навыка групповой работы, с целью повышения мотивации к обучению.
- на основе ранее изученного материала, сформировать понятия кислот и их свойств, продолжить формирования навыка составления ионных уравнений реакций
- формировать навыки коллективной и индивидуальной работы
- развивать навыки устной и письменной речи, умение наблюдать за изменениями, происходящими во время эксперимента, продолжить формирование умения работы с химическими [g1] реактивами.
Оборудование набор реактивов, инструктивные карты для работы на уроке, учебник «Химия 8» О. С. Габриелян.
- Повторение ранее изученного.
В ходе фронтальной беседы необходимо вспомнить материал прошлого урока.
Какие реакции называются реакциями ионного обмена?
В каких случаях реакции обмена протекают до конца.
При изучении новой темы, мы вновь обратимся к составлению ионных уравнений, продолжив формирование данного навыка.
Вспомните, какие классы неорганических соединений мы изучали? Каждый класс соединений характеризуется определенными химическими свойствами. Нам предстоит разобрать подробно каждое их них. И начнем мы со свойств кислот. Давайте попробуем вместе сформулировать тему сегодняшнего урока.
«Кислоты, их классификация и свойства с точки зрения ТЭД».
- Изучение нового материала.
Итак, что мы знаем о кислотах. Все ранее полученные знания выясняются в ходе фронтальной беседы.
Что такое кислота?
Перечислите общие черты в строении кислот.
Кислоты делят на группы. Какие признаки лежат в основе этого деления?
(кислородсодержащие, бескислородные, одноосновные, двухосновные, трехосновные.)
Учащиеся выполняют следующее задание по вариантам. После его выполнения необходимо поменяться работами и проверить правильность выполнения задания.
Из предложенного ряда веществ выпишите кислоты, дайте им названия. Пользуясь параграфом учебника 39 на странице 235 классифицируйте кислоты по различным признакам. Составьте уравнение диссоциации любой одноосновной кислоты из предложенных вам.
По наличию кислорода
По количеству атомов водорода (основность)
Одноосновные Двухосновные Трехосновные
Степень электролитической диссоциации
Уравнение электролитической диссоциации кислоты
Из предложенного ряда веществ выпишите кислоты, дайте им названия. Пользуясь параграфом учебника 39 на странице 235 классифицируйте кислоты по различным признакам. Составьте уравнение диссоциации любой одноосновной кислоты из предложенных вам.
По наличию кислорода
По количеству атомов водорода (основность)
Одноосновные Двухосновные Трехосновные
Степень электролитической диссоциации
Уравнение электролитической диссоциации кислоты
Далее следует сделать выводы:
Что такое кислота с точки зрения ТЭД?
Что такое электролит, какие вещества относят к электролитам и неэлектролитам, приведите примеры.
Что такое диссоциация?
Все кислоты различны, одни содержат один атом водорода, их называют одноосновными, другие два. Перечислите их. Есть кислоты сильные и слабые, но по каким бы свойствам не различались кислоты, их объединяет одно общее свойство- все кислоты диссоциируют одинаково. При диссоциации образуются катионы водорода и анионы кислотного остатка.
Вам было предложено написать уравнение диссоциации одноосновной кислоты, давайте проверим, что у вас получилось. (Вызвать двух учащихся к доске)
Свойства бывают физические и химические. Химические- это способность веществ реагировать друг с другом.
Теперь нам предстоит разобрать химические свойства кислот.
Для этого мы будем работать в группах. Пересаживаемся. (Следует заранее определить состав групп, напомнить правила техники безопасности при проведении лабораторных работ)
У каждого есть лист, на котором приведены химические свойства кислот и план работы для каждой группы. Вам необходимо выбрать человека, который будет следить за временем на выполнение работы, того, кто будет проводить опыты, записывать результаты, на чьи плечи выпадет роль отвечать и поводить уроки. Далее следует объяснить ход работы, определить время, обратить внимание на то, что необходимо записать результаты работы- выводы и ионные уравнения реакций. После проведения работы необходимо дать высказаться каждой группе, дать возможность рассказать о своей работе.
Каждая группа разбирала одно их химических свойств, поэтому необходимо подвести общие итоги по свойствам кислот.
В качестве домашнего задания, ребятам предлагается закончить изучение свойств кислот, записав уравнения химических свойств в молекулярном и ионном виде.
Химические свойства кислот
- Изменение цвета индикатора.
2.Кислота + основание=соль + вода (реакция обмена)
3.Кислота + металл=соль+ водород (реакция замещения)
Не забыть ряд активности металлов!
4. Кислота+ соль= новая соль+ новая кислота (реакции обмена)
5. Кислота + оксид металла= соль + вода (реакция обмена)
План работы. Группа 1.
Действие кислот на индикаторы.
Цель: с помощью индикатора, определить в какой пробирке находится кислота.
1. Вспомнить, что такое индикатор. Определить какой из предложенных индикаторов изменит цвет в кислой среде.
2. Налейте в пробирки по одному миллилитру веществ и добавьте к ним индикатор.
3. По изменению цвета, определите в какой пробирке находится кислота.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Кислоты. Для кислот характерны следующие общие свойства:
- а) способность взаимодействовать с основаниями с образованием солей;
- б) способность взаимодействовать с некоторыми металлами с выделением водорода;
Константы диссоциации некоторых сильных кислот в водных растворах при 25 °С
Константа диссоциации К
- в) способность изменять цвета индикаторов, в частности вызывать красную окраску лакмуса;
- г) кислый вкус.
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т.д. C устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее.
Из сравнения данных, приведенных в табл. 12 и 14, видно, что величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации H2SO4 — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале IO -4 —10“ 2 , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
- а) способностью взаимодействовать с кислотами с образованием солей;
- б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
- в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, очевидно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
а при взаимодействии с гидроксидом натрия — цинкат натрия:
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами. К таким гидроксидам, кроме гидроксида цинка, относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно выразить схемой:
Таким образом, в растворе амфотерного электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионов, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы H + . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН
. Например, при растворении хлорида гидроксомагния диссоциация протекает согласно уравнениям:
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима. В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства оснований. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в неводных средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теорий кислот и оснований принадлежит протонная теория, созданная в 1923 г.
Согласно протонной теории, кислотой является донор протона, т.е. частица (молекула или ион), которая способна отдавать ион водорода — протон, а основанием — акцептор протона, т.е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Связанные этим соотношением основание и кислота называются сопряженными. Например, ион НСО4 является основанием, сопряженным кислоте H2SO4.
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион Cl — — основание, сопряженное кислоте НС1, а ион NH4 — кислота, сопряженная основанию NH3.
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду NH3-H2O-HF эта энергия максимальна для NH3 и минимальна для HF. Поэтому в смеси с NH3 вода функционирует как кислота, а в смеси с HF — как основание:
Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
Билет№15
Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
Кислоты – это электролиты, при диссоциации водных растворов которых в качестве катионов отщепляются только ионы водорода.
Отрицательные ионы, которые отщепляются от молекулы кислоты называются кислотными остатками.
Кислоты классифицируют по нескольким признакам.
По составу:
Бескислородные HCl, HNO3
По основности:
Одноосновные HCl, HNO3
По силе:
Общие химические свойства кислот обусловлены наличием иона водорода. Для кислот характерны следующие химические свойства:
1. Взаимодействие с активными металлами.
2. Взаимодействие с основными оксидами.
3. Взаимодействие с основаниями.
HCl + NaOH = NaCl + H2O
H + + Cl — + Na + + OH — = Na + + Cl — + H2O
4. Взаимодействие с солями – такая реакция протекает только в том случае, е6сли образуется осадок, летучее вещество или слабый электролит.
H + + Cl — + Ag + + NO3 — = AgCl↓ + H + + NO3 —
Глицерин – многоатомный спирт; состав молекулы, физические и химические свойства, применение.
Глицери́н — химическое соединение с формулой HOCH2CH(OH)-CH2OH или C3H5(OH)3. Простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость.
Глицерин — бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества.
Взаимодействие глицерином с натрием:
2СН2ОН – СНОН-СН2ОН + 6Nа = 2СН2ОNа –СНОNa- СН2ОNа +3 Н2 глицерат натрия.
Билет №16
Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
Основания — вещества, диссоциирующие в водном растворе с образованием катионов металла и гидроксид-анионов ОН − .
Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4 + (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в рекции присоединения воды к аммиаку, когда аммиак растворяют в воде:
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей скользкие на ощупь («мыльные») и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками.
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH – гидроксид калия (едкое кали), NaOH – гидроксид натрия (едкий натр), LiOH – гидроксид лития, Ca(OH)2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 – гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Щелочами называются растворимые в воде сильные основания.
Свойства, характерные для всех оснований, проявляются благодаря присутствию в их растворах гидроксид- ионов OH -. .
1. Наиболее важное химическое свойство всех оснований – взаимодействие с кислотами – реакция нейтрализации.
NaOH + HCl = NaCl + H2O
Na + + OH — + H + + Cl — = Na + + Cl — + H2O
2. Взаимодействие щелочей с кислотными оксидами.
3. Взаимодействие щелочей с солями, если в результате реакции одно из веществ выпадает в осадок.
3Na + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3↓ + 3Na + + 3Cl —
Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
3. Задача. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором содержание хлорида натрия 0, 05 или 5%.
m(NaCl) = 0,05 × 500 = 25 (г)
Ответ: для приготовления 500 г раствора необходимо взять 25 г хлорида натрия и 475 г воды.
Билет №17
Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
Строение
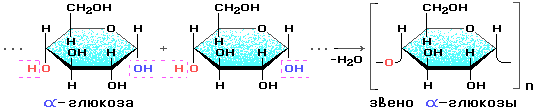
Состоит из остатков α — глюкозы.
В состав крахмала входят:
· амилоза (внутренняя часть крахмального зерна) – 10-20%
· амилопектин (оболочка крахмального зерна) – 80-90%
Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
· Ценный питательный продукт.
· Для накрахмаливания белья.
· В качестве декстринового клея.
Билет №18
Природные
Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот – незаменимые (не синтезируются в организме человека), они поступают с пищей.
Синтетические
Получают кислотным гидролизом белков, либо из карбоновых кислот, воздействуя на них галогенном и, далее, аммиаком.
Физические свойства.
Хорошо растворимы в воде, но нерастворимы в эфире.
В зависимости от R могут быть сладкими, горькими или безвкусными.
Обладают оптической активностью.
Плавятся с разложением при температуре выше 200º.
Химические свойства.
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2.
1. Аминокислоты взаимодействуют с кислотами и щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
2. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Основная биологическая роль аминокислот заключается в том, что они являются основными «кирпичиками» для построения белковых молекул. Некоторые аминокислоты используют в медицине в лечебных целях (при сильном истощении, после тяжелых операций).
Некоторые аминокислоты используют в сельском хозяйстве для подкормки животных.
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Билет№15
Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
Кислоты – это электролиты, при диссоциации водных растворов которых в качестве катионов отщепляются только ионы водорода.
Отрицательные ионы, которые отщепляются от молекулы кислоты называются кислотными остатками.
Кислоты классифицируют по нескольким признакам.
По составу:
Бескислородные HCl, HNO3
По основности:
Одноосновные HCl, HNO3
По силе:
Общие химические свойства кислот обусловлены наличием иона водорода. Для кислот характерны следующие химические свойства:
1. Взаимодействие с активными металлами.
2. Взаимодействие с основными оксидами.
3. Взаимодействие с основаниями.
HCl + NaOH = NaCl + H2O
H + + Cl — + Na + + OH — = Na + + Cl — + H2O
4. Взаимодействие с солями – такая реакция протекает только в том случае, е6сли образуется осадок, летучее вещество или слабый электролит.
H + + Cl — + Ag + + NO3 — = AgCl↓ + H + + NO3 —
Последнее изменение этой страницы: 2016-12-10; Нарушение авторского права страницы
18.Характеристики кислот, оснований и солей с точки зрения теории электролитической диссоциации. Амфотерность гидроксидов.
Диссоциация оснований. Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-ионы OH : NaOH Na + + OH ; Ca(OH)2 CaOH + + OH ; CaOH + Ca 2+ + OH .
Ступенчатость диссоциации обусловливает возможность образования основных и кислых (см. ниже) солей.
Диссоциация кислот. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода H + . HCl H + + Cl ; HNO3 H + + NO3 ; H2SO4 H + + HSO4 — ; HSO4 H + + SO4 2 ; H3PO4 H + + H2PO4 ; H2PO4 H + + HPO4 2 ; HPO4 2 H + + PO4 3 .
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды дис-социируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H + и гидроксид-анионы OH : H + + MeO ⇄ MeOH ⇄ Me + + OH .
К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома Cr(OH)3, свинца Pb(OH)2 и др.
1. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка. Напри-мер, Na2SO4 2 Na + + SO4 2 ; Ca3(PO)4 3 Ca 2+ + 2 PO4 3 .
2.Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода и кислотного остатка: KHSO3 K + + HSO3 ( = 1).
Сложный анион диссоциирует частично: HSO3 ⇄ H + + SO3 2 ( : Al(OH)2Cl Al(OH)2 + + Cl ( = 1).
Сложный катион диссоциирует частично: Al(OH)2 + ⇄ AlOH 2+ + OH ( 2+ ⇄ Al 3+ + OH ( + + Al 3+ + 2 SO4 2 ;
Сложные соли диссоциируют на катион металла и анионы кислотных остатков. Например, ZnClNO3 Zn 2+ + Cl + NO3 ;
19. Окислительно-восстановительные реакции (овр). Степень окисления атомов Основные окислители и восстановители. Составление уравнений овр методами электронного и электронно-ионного баланса.
ОВР-реакции, протекающие с изменением степени окисления.
Окисление – это процесс отдачи электронов при этом происходит понижение степени окисления.
Восстановление – это процесс присоединения электронов, при этом происходит понижение степени окисления.
Реакции, в кот. ок-ль. и восст-ль предс. собой различные ве-ва наз. межмолеклярными. Если ок-ль и восс-ль атомы одной молекулы — внутримолекулярные.
Под степенью окисления (окислительным числом) понимают условный заряд атома в соединении, вычисленный из предположения, что в молекуле все связи ионные. Степень окисления указывает, сколько электронов оттянуто от атома (положительная степень окисления) или притянуто к нему от другого атома (отрицательная степень окисления). Мера удаления или приближения электронов к атому в степени окисления не отражена.Восстановители
а) Металлы как простые вещества: K 0 , Na 0 , Ca 0 , Al 0 и др.
б) Простые анионы неметаллов: S 2 , Cl , J , Br , Se 2 и др.
в) Сложные анионы и молекулы, содержащие электроположитель-ные элементы в промежуточной степени окисления: S +4 O3 2 , N +3 O2 , As +3 O3 3 , Cr +3 O2 , [Fe +2 (CN)6] 4 , C +2 O, N +2 O, S +4 O2 и др.
г) Простые катионы в низшей степени окисления: Fe 2+ , Sn 2+ , Cr 3+ , Cu + , Mn 2+ , As 3+ и др.
д) Некоторые простые вещества:
е) Катод при электролизе.
а) Неметаллы как простые вещества с большой электроотрицательностью: F2, O2, Cl2 и др.
б) Простые катионы в высокой степени окисления: Sn 4+ , Fe 3+ , Cu 2+ и др., а также H + .
г) Сложные ионы и молекулы, содержащие атомы неметаллов в положительной степени окисления: H2S +6 O4, S +6 O3, HOCl +1 , HCl +5 O3,
д) Анод при электролизе.
В соединениях, когда атомы находятся в промежуточной степени окисления, последние могут проявлять как восстановительные, так и окислительные свойства (окислительно-восстановительная двойствен-ность):
Применяют два метода составления уравнений реакций окисления-восстановления:
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
Читайте также:
- I. 36. Состав, свойства и применение азотных удобрений.
- I. Первая группа теорий – детерминистские теории.
- IV. система педагогических исследований с методологической точки зрения
- PGP. Принцип функционирования. Свойства ключа.
- V2: 01.01. Предмет и метод экономической теории
- VIII . Механические свойства металлов. Диаграмма растяжения металлов.
- XV. Влияние углерода и постоянных примесей на свойства стали
- Абсолютные величины и их виды, познавательные свойства и условия применения в экономико-статистическом анализе.
- Автономные системы и свойства их решений.
- Азотирование и нитроцементация. Структура, свойства и области получения.
- Аксиомы теории вероятностей.
- Актуальность проблематики с точки зрения изменения роли ИТ в бизнесе и обществе
Кислоты основания соли с точки зрения электролитической диссоциации
Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов.
Кислоты. Для кислот характерны следующие общие свойства:
а) способность взаимодействовать с основаниями с образованием солей;
б) способность взаимодействовать с некоторыми металлами с выделением водорода;
в) способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации любой кислоты образуются иокы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т. д. С устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т. е. чем больше ее константа диссоциации, тем она сильнее.
Сравнивая данные, приведенные в табл. 12 и 14, можно заметить, что величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
а) способностью взаимодействовать с кислотами с образованием солей;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
а при взаимодействии с гидроксидом натрия — цинкат натрия;
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами. К таким гидроксидам кроме гидроксида цинка относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфо-терный электролит формулой ROH, то его диссоциацию можно выразить схемой:
Таким образом, в растворе амфотериого электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионоз, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы . Например, при растворении хлорида гидроксомагния диссоциация протекает согласно уравнениям:
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима.
В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ноны. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства основании. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в иеводиых средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теории кислот и оснований принадлежит протонная теория, выдвинутая в 1923 г.
Согласно протонной теории, кислотой является донор протона, т. е. частниа (молекула или ион), которая способна отдавать ион водорода — прогон, а основанием — акцептор протона, т. е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Связанные этим соотношением основание и кислота называются сопряженными. Например, является основанием, сопряженным кислоте .
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион — основание, сопряженное кислоте , а ион — кислота, сопряженная основанию .
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду эта энергия максимальна для и минимальна для HF. Поэтому в смеси с вода функционирует как кислота, а в смеси с HF — как основание:
Дата добавления: 2015-04-24 ; Просмотров: 2985 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Урок по химии на тему: «Кислоты с точки зрения ТЭД»
за привлеченного слушателя на курсы профессиональной переподготовки
МИНИСТЕРСТВО ОБРАЗОВАНИЯ МОСКОВСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ МОСКОВСКОЙ ОБЛАСТИ «ЧЕХОВСКИЙ ТЕХНИКУМ»
«Кислоты в свете теории электролитической диссоциации»
Подготовила преподаватель химии
Урок по теме «Кислоты в свете теории электролитической диссоциации»
Тема: Кислоты в свете теории электрической диссоциации
Цель: и зучить химические свойства кислот, выявить причину этих свойств.
актуализировать знания о кислотах (состав, номенклатура, классификация, диссоциация);
научить объяснять свойства кислот в свете ТЭД;
составлять уравнения реакции в молекулярном и ионном виде;
развивать логическое мышление, умение анализировать, делать выводы;
развивать общеучебные компетенции: умение слушать, делать записи, применять полученные знания в практической деятельности.
формировать естественно-научное мировоззрение учащихся;
поддерживать интерес к науке «химия».
Тип урока: комбинированный.
Формы и методы работы на уроке: фронтальный, объяснительно – иллюстративный, наглядный, работа с дидактическим материалом, лабораторный практикум.
ТСО – компьютер, проектор, экран, колонки;
Таблица растворимости, ПСХЭ Д. И. Менделеева;
Карточки с заданиями.
I. Организационный момент (2 мин)
Подготовка учащихся к уроку.
II. Актуализация знаний
Проверка домашнего задания (5 мин)
Самостоятельная работа (10 мин)
Закончите уравнения реакций. Запишите уравнения в молекулярном, полном ионном и сокращенном ионном виде:
б ) AgNO3 + BaBr2 =
б ) MgSO4 + K2CO3 =
г ) Na2CO3 + H2SO4 =
III. Изучение нового материала (25 мин)
Состав, номенклатура, классификация, диссоциация кислот
Химические свойства кислот в свете ТЭД
— Из предложенного списка выберете формулы кислот: HNO3, BaCl2, HBr, CuO,NaOH, H2SO4, Fe(OH)3, H3PO4 (HNO3, HBr, H2SO4, H3PO4 – т.к. они состоят из атомов водорода и кислотного остатка.)
— Что представляют собой кислоты с точки зрения ТЭД? ( Кислоты — это электролиты, которые при диссоциации образуют катион водорода и анионы кислотного остатка)
Катион водорода обуславливает общие свойства всех кислот: растворы кислот кислые на вкус. Индикаторы в растворах кислот изменяют свой цвет.
Кислоты классифицируются по следующим признакам:
Наличие кислорода в кислотном остатке – кислородсодержащие и бескислородные кислоты.
Основность (количество атомов водорода в молекуле кислоты) – одноосновные, двухосновные, трехосновные.
Степень электролитической диссоциации – сильные и слабые (как электролиты).
Стабильность – стабильные и нестабильные.
В свете ТЭД катионы водорода обусловливают общие химические свойства всех кислот:
а) Взаимодействие кислот с растворимыми основаниями
б) Взаимодействие кислот с оксидами металлов (реакция обмена)
в) Взаимодействие кислот с нерастворимыми основаниями
г) Взаимодействие металлов с растворами кислот (реакция замещения)
Убучающиеся работают в четырех группах:1 группа определяет взаимодействие кислот с металлами, 2 группа-с оксидами металлов, 3 группа – с основаниями, 4 группа- с солями.
Перед учащимися стоят реактивы, и лежит карточка с инструкцией. Следуя всем инструкциям и соблюдая правила безопасности, ребята выполняют задание. Затем оформляют результаты в тетрадь, составляя уравнение химической реакции в молекулярном и ионном виде. Цель исследования – провести опыт, оформите результат, сделать вывод, представить результат другим группам. По истечении 10 минут к доске приглашаются по одному ученику от группы, который рассказывает результаты своей работы. Все остальные записывают себе в тетрадь
1 группа — Взаимодействие кислот с основаниями (реакция обмена)
NaOH + фенолфтолеин + HCl = NaCl + H2O – реакций обмена, реакция нейтрализации
Наблюдаем обесцвечивание раствора
Na + + OH — + H + + Cl — = Na + + Cl — + H2O
Вывод: кислоты взаимодействуют с основаниями. Тип реакции – реакция обмена.
2 группа — Взаимодействие кислот с оксидами металлов (реакция обмена)
H2SO4 + CuO=CuSO4+ H2O
2H + +SO4 2- + CuO =Cu 2+ +SO4 2- +H2O
2H + + CuO =Cu 2+ +H2O
Вывод: кислоты взаимодействуют с оксидами металлов. Тип реакции – реакция обмена.
3 группа — Взаимодействие металлов с растворами кислот (реакция замещения)
Открываем ряд напряжений металлов (форзац учебника). Все металлы, расположенные в ряду напряжений левее водорода, вытесняют его из растворов кислот.
Zn+2H + +2Cl — =Zn 2+ +2Cl — +H2
Вывод: кислоты взаимодействуют с металлами стоящими до водорода. Тип реакции – реакция замещения.
Следует запомнить! Большинство тяжелых металлов практически не взаимодействуют с растворами серной, фосфорной, угольной и сероводородной кислот, так как образовавшаяся соль вызывает пассивацию металла.
Концентрированные серная и азотная кислоты, а также разбавленная азотная кислота взаимодействуют с металлами иначе: водород не выделяется.
4 группа — Взаимодействие кислот с солями (реакция обмена)
Na2CO3 + 2HCl = 2NaCl + H2O+CO2
2Na + + CO3 2- + 2H + + 2Cl — = 2Na + + 2Cl — + H2O+CO2
CO3 2- + 2H + = H2O+CO2
Вывод: кислоты взаимодействуют с солями. Тип реакции – реакция обмена.
Изучите химическое свойство кислот – взаимодействие с основаниями по плану:
Налейте в пробирку 1 мл гидроксида натрия.
Добавьте с помощью пипетки 1-2 капли фенолфтолеина.
Отметьте окраску раствора после добавления фенолфтолеина.
К раствору гидроксида натрия аккуратно понемногу добавляйте соляной кислоты. Кислоту добавляйте до тех пор, пока не исчезнет окраска индикатора.
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия гидроксида натрия с соляной кислотой.
Укажите название реакции.
Сделайте вывод о взаимодействии кислот с основаниями и укажите тип химической реакции.
Изучите химическое свойство кислот – взаимодействие с оксидами металлов по плану:
Насыпьте в пробирку небольшое количество оксида меди.
Аккуратно понемногу добавляйте серной кислоты. Примерно 1мл.
Для того, чтобы реакция началась необходимо нагреть пробирку. Аккуратно нагреваем. Какого цвета образуется раствор?
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия оксида меди с соляной кислотой.
Сделайте вывод о взаимодействии кислот с оксидами металлов и укажите тип химической реакции.
Изучите химическое свойство кислот – взаимодействие с металлами по плану:
Возьмите 2 пробирки. В 1-ю положите кусочек цинка, во 2-ю кусочек меди.
Налейте в каждую пробирку по 1 мл соляной кислоты.
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия меди с соляной кислотой и цинка с соляной кислотой.
Сделайте вывод о взаимодействии кислот с металлами и укажите тип химической реакции
Изучите химическое свойство кислот – взаимодействие с основаниями по плану:
Налейте в пробирку 1 мл соляной кислоты.
Добавьте 1мл карбоната натрия.
Наблюдайте за происходящим.
Запишите в тетради полное ионное и сокращенное ионное уравнение химической реакции взаимодействия карбоната натрия с соляной кислотой.
Укажите название реакции.
Сделайте вывод о взаимодействии кислот с солями и укажите тип химической реакции
IV.Закрепление изученного материала (8 мин)
(Убучающиеся выполняют задание №16 с. 76 (в сборнике Ю.М. Ерохина «Химия»)
ОСНОВАНИЯ, КИСЛОТЫ И СОЛИ В СВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
С точки зрения теории электролитической диссоциации кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов водорода и анионов кислотного остатка.
Следует различать кислородсодержащие кислоты типа H2SO4, HNO3 и бескислородные кислоты типа HCl, H2S.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
кислота ® ион водорода + анион кислотного остатка
К кислотам — сильным электролитам относят H2SO4, HNO3, HCl, HBr, HI и др. В водном растворе они полностью распадаются на ионы.
Двухосновная H2SO4 диссоциирует ступенчато, причем первый ион H + отрывается от молекулы легче, чем второй. Вторая ступень диссоциации является обратимым процессом и характеризуется значением константы диссоциации:
К кислотам — слабым электролитам относят HF, H2CO3, HCN, H2S, CH3COOH и др. В водном растворе они частично распадаются на ионы. Например,
Слабые многоосновные кислоты диссоциируют ступенчато. Каждую ступень характеризуют своим значением константы диссоциации, например:
Первый ион водорода H + отрывается от молекулы легче, чем последующие от положительно заряженных анионов, поэтому
.
В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли, NaHSO4, NaHCO3, K2HPO4 и т.д.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием гидроксид-ионов OH — и катионов металла.
В общем виде уравнение электролитической диссоциации основания имеет вид:
основание ® гидроксид-ион + катион металла
Сильные основания (щелочи) в водном растворе практически полностью распадаются на ионы, например:
BaOH + ® OH — + Ba 2+
Слабые многокислотные основания диссоциируют ступенчато:
Этим объясняют способность многокислотных оснований образовывать основные соли: CuOHCl, (ZnOH)2SO4 и др.
С точки зрения теории электролитической диссоциации амфотерные гидроксиды (амфолиты) — это вещества, диссоциирующие в водном растворе как по типу кислот, так и по типу оснований. К ним относят Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3, и др. Например, уравнения электролитической диссоциации Be(OH)2:
1) диссоциация по типу основания:
2) диссоциация по типу кислоты:
Рассмотрим некоторые общие закономерности в изменении свойств гидроксидов. Диссоциация кислородсодержащих гидроксидов зависит от сравнительной прочности и полярности связей Э-О и О-Н. Чем менее прочна или более полярна связь, тем легче происходит электролитическая ионизация по этой связи в водных растворах. Таким образом, диссоциация гидроксидов может протекать по двум направлениям:
1) ЭОН « ОН — + Э + (по типу основания)
2) ЭОН « Н + + ЭО — (по типу кислоты)
Чем больше степень окисления и меньше радиус центрального иона (Э), тем менее полярна связь Э-О и выше ее прочность сравнительно со связью О-Н. В данном случае диссоциация идет по типу кислоты, т.е. с отщеплением иона водорода. И наоборот, чем меньше степень окисления и больше радиус центрального иона, тем более полярна связь Э-О и меньше ее прочность, чем связи О-Н. В этом случае диссоциация идет, преимущественно, по типу основания, т.е. с отщеплением гидроксид-ионов. Если полярности связей Э-О и О-Н близки, то диссоциация гидроксида ЭОН может протекать как по типу основания, так и по типу кислоты, т.е. гидроксид является амфотерным.
В периодах с увеличением заряда ядер элементов радиусы ионов уменьшаются, а максимальная степень окисления в соединениях типа ЭОm(ОН)n возрастает от 1 до 7. В связи с этим уменьшается полярность и увеличивается прочность связи Э-О, т.е. основные свойства
гидроксидов ослабевают, а кислотные возрастают. Так, в ряду
NaOH — сильное основание, Al(OH)3 — амфолит, H2SiO3 — слабая кислота, HClO4 — сильная кислота.
В главных подгруппах с увеличением заряда ядер элементов радиусы ионов увеличиваются, а максимальная степень окисления постоянна. В связи с этим увеличивается полярность и уменьшается прочность связи Э-О, т.е. сверху вниз основные свойства увеличиваются, а кислотные убывают. Это хорошо видно на примере гидроксидов элементов IIА группы: Be(OH)2 — амфолит, Mg(OH)2 — основание средней силы, Ba(OH)2 — сильное основание.
Если элемент образует гидроксиды в различных степенях окисления, то в соединениях элементов с низшими степенями окисления более выражены основные свойства, а в соединениях с высшими степенями окисления преобладают кислотные свойства, например:
Объясняется это тем, что для одного и того же элемента с увеличением степени окисления его электроотрицательность растет, а радиус иона уменьшается, что приводит к уменьшению полярности и увеличению прочности связи Э-О и, следовательно, ослаблению основных свойств гидроксида.
Следовательно, с возрастанием степени окисления и уменьшением ионного радиуса у кислородсодержащих гидроксидов преобладает кислотный тип диссоциации. Наоборот, с уменьшением степени окисления и увеличением ионного радиуса центрального иона преобладает основный тип диссоциации.
В бескислородных кислотах (образуют элементы VIА — VIIА групп) полярность связи Э-Н возрастает при переходе от элементов VIА группы к элементам VIIА группы и уменьшается в пределах каждой группы сверху вниз. Однако, в этом же направлении, соответственно, увеличивается и уменьшается прочность связи. Поэтому сила кислот возрастает в ряду HF — HCl — HBr — HI, несмотря на то, что полярность связи в этом направлении уменьшается.
С точки зрения теории электролитической диссоциации соли — это вещества, диссоциирующие в водном растворе на катион металла и анион кислотного остатка. Соли, как правило, являются сильными электролитами (исключение составляют ZnCl2, Fe(CNS)3, HgCl2, Mg(CN)2, и др.) и в водных растворах полностью распадаются на ионы:
.
При этом, в отличие от средних солей, кислые и основные соли диссоциируют ступенчато:
Следует иметь в виду, что определения Аррениуса справедливы только для водных растворов электролитов.
- http://bstudy.net/634904/estestvoznanie/svoystva_kislot_osnovaniy_soley_tochki_zreniya_teorii_elektroliticheskoy_dissotsiatsii
- http://infopedia.su/13x200e.html
- http://studfiles.net/preview/2180772/page:8/
- http://studopedia.su/15_96479_svoystva-kislot-osnovaniy-i-soley-s-tochki-zreniya-teorii-elektroliticheskoy-dissotsiatsii.html
- http://infourok.ru/urok-po-himii-na-temu-kisloti-s-tochki-zreniya-ted-3645676.html
- http://sdamzavas.net/3-20187.html