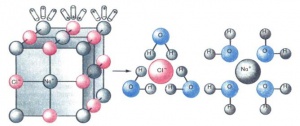
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблукови В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения.
Основные положения ТЭД (Теории электролитической диссоциации):
Молекулы распадаются на положительно и отрицательно заряженные ионы (простые и сложные).
Под действием электрического тока катионы (положительно заряженные ионы движутся к катоду(-), а анионы (отрицательно заряженные ионы) к аноду(+)
Степень диссоциации зависит от природы вещества и растворителя, концентрации, температуры.
Если степень диссоциации зависит от природы вещества, то можно судить, что существует разграничение между определёнными группами веществ.
Большая степень диссоциации присуща сильным электролитам (большинству оснований, солям, многим кислотам). Стоит учесть, что распад на ионы – обратимая реакция. Так же стоит сказать, что в данной теме не будут разобраны примеры диссоциации двойных и основных солей, их диссоциация описана в теме “соли”.
Примеры сильных электролитов:
NaOH, K2SO4, HClO4
Уравнения диссоциации:
NaOH⇄Na + +OH —
Количественной характеристикой силы электролитов является степень диссоциации (α) – отношение молярной концентрации продиссоциировавшего электролита к его общей молярной концентрации в растворе.
Степень диссоциации выражается в долях единицы или в процентах. Интервал значений – от 0 до 100%.
α = 0% относится к неэлектролитам (диссоциация отсутствует)
У каждой ступени диссоциации своя степень диссоциации.
Например, диссоциация солей CuCl2, HgCl2:
CuCl2⇄Cu 2+ +2Cl — диссоциация протекает полностью
А в случае с хлоридом ртути диссоциация идёт неполностью и то не до конца.
Возвращаясь же к раствору серной кислоты, стоит сказать, что степень диссоциации обеих ступеней разбавленной кислоты гораздо больше, чем у концентрированной. При диссоциации концентрированного раствора очень много молекул вещества и большая концентрация гидроанионов HSO4 — .
У многоосновных кислот и многокислотных оснований диссоциация идёт в несколько ступеней (в зависимости от основности).
Перечислим сильные и слабые кислоты и приступим к уравнениям ионного обмена:
Сильные кислоты ( HCl, HBr, HI, HClO3, HBrO3, HIO3, HClO4, H2SO4, H2SeO4,HNO3, HMnO4, H2Cr2O7)
Химические реакции в растворах и расплавах электролитов протекают с участием ионов. В таких реакциях степени окисления элементов не изменяются, и сами реакции называются реакциями ионного обмена.
Реакции ионного обмена будут протекать до конца (необратимо) , если образуются малорастворимые или практически нерастворимые вещества (они выпадают в осадок), летучие вещества (выделяются в виде газов) или слабые электролиты (например, вода).
Реакции ионного обмена принято писать в три стадии:
1. Молекулярное уравнение
2. Полное ионное уравнение
3. Сокращенное ионное уравнение
При написании обязательно указывать осадки и газы, а так же руководствоваться таблицей растворимости.
Реакции, где все реагенты и продукты получились растворимые в воде, не протекают.
Сокращённое ионное уравнение получается с помощью вычёркивания одинаковых ионов из обеих частей полного ионного уравнения.
Если реакция ионного обмена идёт между двумя солями с образованием осадка, то следует брать два хорошо растворимых реагента. То есть, реакция ионного обмена пойдёт если растворимость реагентов будет выше, чем у одного из продуктов.
Иногда при написании реакций ионного обмена пропускают полное ионное уравнение и сразу пишут сокращенное.
Для получения осадка малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты в их концентрированных растворах.
Например:
2KF+FeCl2→FeF2↓+2KCl
Данные правила подбора реагентов для осаждения продуктов справедливы только для солей.
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации
Читайте также:
- I. 36. Состав, свойства и применение азотных удобрений.
- I. Первая группа теорий – детерминистские теории.
- IV. система педагогических исследований с методологической точки зрения
- PGP. Принцип функционирования. Свойства ключа.
- V2: 01.01. Предмет и метод экономической теории
- VIII . Механические свойства металлов. Диаграмма растяжения металлов.
- XV. Влияние углерода и постоянных примесей на свойства стали
- Абсолютные величины и их виды, познавательные свойства и условия применения в экономико-статистическом анализе.
- Автономные системы и свойства их решений.
- Азотирование и нитроцементация. Структура, свойства и области получения.
- Аксиомы теории вероятностей.
- Актуальность проблематики с точки зрения изменения роли ИТ в бизнесе и обществе
Кислоты основания соли с точки зрения электролитической диссоциации
Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов.
Кислоты. Для кислот характерны следующие общие свойства:
а) способность взаимодействовать с основаниями с образованием солей;
б) способность взаимодействовать с некоторыми металлами с выделением водорода;
в) способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации любой кислоты образуются иокы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т. д. С устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т. е. чем больше ее константа диссоциации, тем она сильнее.
Сравнивая данные, приведенные в табл. 12 и 14, можно заметить, что величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
а) способностью взаимодействовать с кислотами с образованием солей;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
а при взаимодействии с гидроксидом натрия — цинкат натрия;
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами. К таким гидроксидам кроме гидроксида цинка относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфо-терный электролит формулой ROH, то его диссоциацию можно выразить схемой:
Таким образом, в растворе амфотериого электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионоз, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы . Например, при растворении хлорида гидроксомагния диссоциация протекает согласно уравнениям:
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима.
В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ноны. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства основании. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в иеводиых средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теории кислот и оснований принадлежит протонная теория, выдвинутая в 1923 г.
Согласно протонной теории, кислотой является донор протона, т. е. частниа (молекула или ион), которая способна отдавать ион водорода — прогон, а основанием — акцептор протона, т. е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Связанные этим соотношением основание и кислота называются сопряженными. Например, является основанием, сопряженным кислоте .
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион — основание, сопряженное кислоте , а ион — кислота, сопряженная основанию .
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду эта энергия максимальна для и минимальна для HF. Поэтому в смеси с вода функционирует как кислота, а в смеси с HF — как основание:
Дата добавления: 2015-04-24 ; Просмотров: 2879 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
2.Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
способность взаимодействовать с основаниями с образованием солей
способность взаимодействовать с некоторыми металлами с выделением водорода
способность изменять цвет индикатора (красная окраска лакмуса)
Согласно теории электролитической диссоциации кислоты – это электролиты, диссоциирующие в растворах с образованием ионов (катионов) водорода и анионов кислотного остатка.
Именно ионы водорода вызывают красный цвет лакмуса и сообщают кислотам кислый вкус.
способность взаимодействовать с кислотами с образованием солей
способность изменять цвет индикатора иначе, чем их изменяют кислоты (синяя окраска лакмуса)
своеобразный «мыльный вкус»
Согласно теории электролитической диссоциации основания – это электролиты, диссоциирующие в растворах с образованием аниона гидроксила и катиона металла.
Носителем щелочных свойств является анион гидроксила.
Соли при электролитической диссоциации распадаются на катион металла и анион кислотного остатка. Так как таких ионов, которые были бы общими для водных растворов всех солей нет, поэтому соли и не обладают общими свойствами.
3.Реакции нейтрализации
А) при нейтрализации любой сильной кислоты любым сильным основанием на каждую грамм-молекулу образующейся воды выделяется около 13,8 ккал теплоты.
Это говорит о том, что подобные реакции сводятся к одному процессу. Рассмотрим одну из этих реакций. Перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме, а слабые — в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул.

В ходе реакции ионы Na + и 
Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к одному и тому же процессу – к образованию молекул воды из ионов водорода и гидроксила.
Реакция образования воды из ионов обратима
Но так как вода слабый электролит и диссоциирует в ничтожно малой степени, то равновесие в этой реакции сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца.
В дальнейшем мы будем широко пользоваться ионно-молекулярной формой записи уравнений реакций с участием электролитов.
При составлении ионно-молекулярных уравнений надо знать, какие соли растворимы в воде и какие практически нерастворимы.
Общие данные о растворимости важнейших солей обычно приведены в таблицах во всех учебниках химии.
Б) нейтрализация слабой кислоты сильным основанием
Здесь сильные электролиты – NaOH и соль, а слабые – кислота и вода:
Так как только ионы натрия не претерпевают изменений, то ионно-молекулярное уравнение имеет вид:
В) нейтрализация сильной кислоты слабым основанием
Здесь в виде ионов мы должны записать кислоту и образующуюся соль, а в виде молекул – гидроксид аммония и воду:
Не изменяются только ионы 
Г) нейтрализация слабой кислоты слабым основанием
В этой реакции все вещества, кроме образующейся соли, слабые электролиты. Поэтому ионно-молекулярная форма имеет вид:
Реакции нейтрализации сильных кислот сильными основаниями протекают практически до конца. Реакции нейтрализации, в которых хотя бы одно из исходных веществ – слабый электролит, и при которых молекулы малодиссоциирующих веществ имеются не только в правой, но и в левой части ионно-молекулярного уравнения, протекают не до конца. Они доходят до состояния равновесия, при котором соль существует с кислотой и основанием, из которых она образована. Поэтому уравнения подобных реакций правильнее записывать как обратимые реакции.
При растворении твердого тела в воде растворение прекращается, когда получается насыщенный раствор, т.е. когда между растворяемым веществом и находящимися в растворе молекулами того же вещества устанавливается равновесие.
При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами.
Например, в насыщенном растворе сульфата кальция устанавливается равновесие
твердая соль ионы в растворе
Если обозначим концентрацию катионов кальция 

ПРCaSO4=[Ca 2+ ][SO
Свойства кислот оснований и солей с точки зрения ТЭД (теории электролитической диссоциации). Амфотерность.
Основания. Название «основание» первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Примеры: NaOH — гидроксид натрия (едкий натр), KOH — гидроксид калия (едкое кали), Ca(OH)2 — гидроксид кальция (гашёная известь).
Основания, которые хорошо растворяются в воде, называются щелочами, К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид — ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид — ион
NaOH 
Ba(OH)2
NH3·H2O 
Кислоты. Кислоты исторически получили своё название из-за кислого вкуса водных растворов тактх веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остатка
H2SO4
CH3COOH 
Соли. С точки зрения теории электролитической реакции соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
Соль -> Катион основания + Анион кислотного остатка
BaCl2
K2CO3
Амфотерность — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H + ), так и по механизму оснований (отщепление гидроксид-ионов, OH – ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
H + + XO − ⇄ XOH ⇄ X + + OH −
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2 ⇄ NO + + OH − Kb ≈ 10 − 7
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы.
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротоли:
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
H2N — CH(R) — COOH + H2O ⇄ [ H3N — CH(R) — COOH ] + + OH −
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3 + являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома (III) известны реакции:
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами H2O и OH – . Например, для Al(OH3) ионные равновесия могут быть записаны следующим образом:
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Окислительно-восстановительные реакции. Понятие «степень окисления». Типы окислительно-восстановительных реакций (привести примеры).
Окислительно-восстановительные реакции, также редокс— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2-х атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окислении вещества в результате отдачи электронов увеличивается его степени окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель +e− ↔ сопряжённый восстановитель.
Восстановление — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель -e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Последнее изменение этой страницы: 2017-02-05; Нарушение авторского права страницы
Свойства кислот солей и оснований с точки зрения теории электролитической диссоциации
Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов.
Кислоты.Кислоты исторически получили своё название из-за кислого вкуса водных растворов тактх веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остатка
H2SO4 
Основания.Название «основание» первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Примеры: NaOH — гидроксид натрия (едкий натр), KOH — гидроксид калия (едкое кали), Ca(OH)2 — гидроксид кальция (гашёная известь).
Основания, которые хорошо растворяются в воде, называются щелочами, К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид — ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид — ион
NaOH 
Соли. С точки зрения теории электролитической реакции соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
Соль -> Катион основания + Анион кислотного остатка
BaCl2 
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 7964 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Электролитическая диссоциация
Самопроизвольный частичный или полный распад растворенных электролитов на ионы называется электролитической диссоциацией. Термин «ионы» введен английским физиком М. Фарадеем (1833). Теория электролитической диссоциации была сформулирована шведским ученым С. Аррениусом (1887) для объяснения свойств водных растворов электролитов. В дальнейшем она развивалась многими учеными на основе учения о строении атома и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде диссоциируют (распадаются) на ионы — положительно и отрицательно заряженные. («Ион» в переводе с греческого означает «странствующий». В растворе ионы беспорядочно движутся в различных направлениях.)
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженных электродами.
3. Диссоциация — обратимый процесс. Это означает, что наступает такое состояние равновесия, при котором сколько молекул распадается на ионы (диссоциация), столько их вновь образуется из ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
где KA — молекула электролита, K + — катион, A − — анион.
Учение о химической связи помогает ответить на вопрос, почему электролиты диссоциируют на ионы. Легче всего диссоциируют вещества с ионной связью, так как они уже состоят из ионов (см. Химическая связь). При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. Аналогично диссоциируют и электролиты, молекулы которых образованы по типу ковалентной полярной связи. Диссоциация полярных молекул может быть полной или частичной — всё зависит от степени полярности связей. В обоих случаях (при диссоциации соединений с ионной и полярной связью) образуются гидратированные ионы, т. е. ионы, химически связанные с молекулами воды.
Основоположником такого взгляда на электролитическую диссоциацию был почетный академик И. А. Каблуков. В отличие от теории Аррениуса, не учитывавшей взаимодействия растворенного вещества с растворителем, И. А. Каблуков к объяснению электролитической диссоциации применил химическую теорию растворов Д. И. Менделеева. Он показал, что при растворении происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. И. А. Каблуков полагал, что в водном растворе содержатся только гидратированные ионы. В настоящее время это представление общепринято. Итак, гидратация ионов — основная причина диссоциации. В других, неводных растворах электролитов химическая связь между частицами (молекулами, ионами) растворенного вещества и частицами растворителя называется сольватацией.
Гидратированные ионы имеют как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ионы водорода Н + , удерживающие одну молекулу воды,— это гидратированный протон H + (H2O). В научной литературе его принято изображать формулой H3O + (или OH3 + ) и называть ионом гидроксония.
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой а). Степень диссоциации — это отношение числа молекул, распавшихся на ионы, n к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1, или 100%, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации. С разбавлением раствора она увеличивается, а при добавлении одноименных ионов (одинаковых с ионами электролита) — уменьшается.
Однако для характеристики способности электролита диссоциировать на ионы степень диссоциации не очень удобная величина, так как она. зависит от концентрации электролита. Более общей характеристикой является константа диссоциации K. Ее легко вывести, применив закон действия масс к равновесию диссоциации электролита (1):
где KA — равновесная концентрация электролита, [K + ] и [A − ] — равновесные концентрации его ионов (см. Равновесие химическое). K от концентрации не зависит. Она зависит от природы электролита, растворителя и температуры. Для слабых электролитов чем больше K (константа диссоциации), тем сильнее электролит, тем больше ионов в растворе.
Сильные электролиты констант диссоциации не имеют. Формально их можно вычислить, но они не будут постоянными при изменении концентрации.
Многоосновные кислоты диссоциируют по ступеням, а значит, такие кислоты будут иметь несколько констант диссоциации — для каждой ступени свою. Например:
Всегда K1>K2>K3, т.е. многоосновная кислота при диссоциации по первой ступени ведет себя как более сильная кислота, чем по второй или третьей.
Ступенчатой диссоциации подвергаются и многокислотные основания. Например:
Pb(OH) + ↔ Pb2 + + OH −
Кислые и основные соли также диссоциируют ступенчато. Например:
Mg(OH)Cl ↔ Mg(OH) + + Cl −
Mg(OH) + ↔ Mg 2+ + OH −
При этом на первой ступени соль полностью распадается на ионы, что обусловлено ионным характером связи между Na + и HSO3 − ; Mg(OH) + и Cl − ; диссоциация по второй ступени незначительная, так как заряженные частицы (ионы) дальнейшей диссоциации подвергаются как очень слабые электролиты.
С точки зрения теории электролитической диссоциации даются определения и описываются свойства таких классов химических соединений, как кислоты, основания, соли.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например:
Все общие характерные свойства кислот — кислый вкус, изменение цвета индикаторов, взаимодействие с основаниями, основными оксидами, солями — обусловлены присутствием ионов водорода Н + , точнее Н3O + .
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы:
Ca(OH) + ↔ Ca 2+ + OH −
Согласно теории электролитической диссоциации все общие щелочные свойства растворов — мылкость на ощупь, изменение цвета индикаторов, взаимодействие с кислотами, ангидридами кислот, солями — обусловлены присутствием гидроксид-ионов OH − .
Правда, имеются электролиты, при диссоциации которых одновременно образуются и ионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, в незначительных количествах диссоциирует на ионы H + и OH − :
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием ионов водорода H + , и щелочные свойства, обусловленные наличием ионов OH − .
Диссоциацию гидроксида цинка Zn(OH)2 можно выразить уравнением:
Солями называются электролиты, при диссоциации которых образуются катионы металлов (сюда же относят и катион аммония NH4 + ) и анионы кислотных остатков. Например:
Так диссоциируют средние соли. Кислые же и основные соли, как уже отмечалось, диссоциируют ступенчато.
Поскольку все реакции в водных растворах электролитов представляют собой взаимодействие ионов, уравнения этих реакций можно составлять в ионной форме.
Значение теории электролитической диссоциации состоит в том, что она объяснила многочисленные явления и процессы, протекающие в водных растворах электролитов. Однако она не объясняет процессов, протекающих в неводных растворах. Так, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы NH4 + Cl − ), то в жидком аммиаке проявляет свойства кислоты — растворяет металлы с выделением водорода. Как основание ведет себя азотная кислота, растворенная в жидком фтороводороде или в безводной серной кислоте.
Все эти факторы противоречат теории электролитической диссоциации. Их объясняет протолитическая теория кислот и оснований.
Сам термин «диссоциация» означает распад молекул на несколько более простых частиц. В химии помимо электролитической диссоциации различают термическую диссоциацию. Это обратимая реакция, происходящая при повышении температуры. Например, термическая диссоциация водяного пара:
молекул иода: I2 ↔ 2I
Равновесие термической диссоциации подчиняется закону действия масс.
mozok.click
Электролитическая диссоциация кислот, оснований и солей в водных растворах
Электролитическая диссоциация кислот
При растворении в воде кислоты, соли и основания диссоциируют на положительно и отрицательно заряженные ионы (катионы и анионы). Определим характерные общие признаки диссоциации электролитов каждого класса соединений.
Кислоты, как вы помните, состоят из Гидрогена и кислотного остатка, соединенных ковалентной полярной связью. В предыдущем параграфе на примере растворения гидроген хлорида мы рассмотрели, как под действием молекул воды полярная связь превращается в ионную, и кислота распадается на катионы Гидрогена и хлорид-ионы.
Таким образом, с точки зрения теории электролитической диссоциации Аррениуса,
Кислоты — это электролиты, при диссоциации которых образуются катионы Гидрогена и анионы кислотного остатка.
Подобно хлоридной кислоте протекает диссоциация и других кислот, например нитратной:
При диссоциации молекулы сульфатной кислоты число катионов Гидрогена вдвое превышает число анионов кислотного остатка — сульфат-ионов. Заряд аниона равен -2 (в формулах ионов записывают «2-»):
Названия анионов, образующихся при диссоциации кислот, совпадают с названиями кислотных остатков. Они приведены в таблице растворимости на форзаце.
Легко заметить, что при диссоциации различных кислот образуются различные анионы, но катионы только одного типа — катионы Гидрогена H+. Значит, именно катионы Гидрогена определяют характерные свойства кислот — кислый вкус, изменение окраски индикаторов, реакции с активными металлами, основными оксидами, основаниями и солями.
Многоосновные кислоты диссоциируют ступенчато, отщепляя ионы Гидрогена последовательно, друг за другом. Например, в растворе сульфатной кислоты протекают следующие процессы:
Как видно из приведенных уравнений диссоциации многоосновной кислоты, анионы, образующиеся при ступенчатой диссоциации на первой стадии, содержат ионы Гидрогена. Это отражено в названии анионов: HSO — — гидрогенсульфат-ион.
Электролитическая диссоциация ортофосфатной кислоты проходит в три стадии:
Суммарное уравнение диссоциации ортофосфатной кислоты имеет вид:
Таким образом, каждой многоосновной кислоте соответствует несколько анионов, и все они одновременно присутствуют в растворе.
Обратите внимание, что в некоторых уравнениях диссоциации стоят двунаправленные стрелки. Что они означают, вы узнаете в следующем параграфе.
Электролитическая диссоциация оснований
Основания состоят из катионов металлического элемента и гидроксид-анионов. При диссоциации оснований эти ионы переходят в раствор. Число гидроксид-ионов, образующихся при диссоциации, равно заряду иона металлического элемента. Таким образом, с точки зрения теории электролитической диссоциации
Основания — это электролиты, которые диссоциируют на катионы металлического элемента и гидроксид-анионы.
Рассмотрим уравнения диссоциации оснований на примере диссоциации натрий и барий гидроксидов:
При диссоциации оснований образуются анионы одного типа — гидроксид-ионы, определяющие все характерные свойства растворов щелочей: способность менять окраску индикаторов, реагировать с кислотами, кислотными оксидами и солями.
Электролитическая диссоциация солей
Соли образованы катионами металлического элемента и анионами кислотного остатка. При растворении солей в воде эти ионы переходят в раствор.
Соли — это электролиты, которые диссоциируют на катионы металлического элемента и анионы кислотного остатка.
Рассмотрим диссоциацию солей на примере диссоциации калий нитрата:
Аналогично диссоциируют и другие соли, например нитрат кальция и калий ортофосфат:
В уравнениях диссоциации солей заряд катиона по абсолютной величине равен степени окисления металлического элемента, а заряд аниона — сумме степеней окисления элементов в кислотном остатке. Например, купрум(П) сульфат распадается на ионы
а феррум(Ш) нитрат — на ионы
Заряд катионов металлических элементов в большинстве случаев можно определить по Периодической системе. Заряды катионов металлических элементов главных подгрупп обычно равны номеру группы, в которой расположен элемент:
Металлические элементы побочных подгрупп обычно образуют несколько ионов, например Fe 2 +, Fe 3 +.
Заряды кислотных остатков проще определять по числу ионов Гидрогена в составе молекулы кислоты, как вы это делали в 8 классе. Заряды некоторых кислотных остатков приведены в таблице растворимости на форзаце.
Обратите внимание, что в уравнениях диссоциации кислот, оснований и солей суммарный заряд катионов и анионов должен быть равен нулю, поскольку любое вещество является электронейтральным.
Ступенчатая диссоциация обусловливает возможность существования кислых и основных солей. Кислые соли содержат ионы Гидрогена, как кислоты. Именно поэтому такие соли называют кислыми. А в основных солях содержатся гидроксид-ионы, как в основаниях.
На первой стадии диссоциации сульфатной кислоты образуется гидрогенсульфат-ион HSO-, благодаря чему существуют кислые соли: NaHSO4 (натрий гидрогенсульфат), Al(HSO4)3 (алюминий гидрогенсульфат) и др. Для ортофосфатной кислоты также характерны кислые соли K2HPO4 (калий гидрогенортофосфат) или KH2PO4 (калий дигидрогенортофосфат).
В растворах кислые соли диссоциируют в две стадии:
Кислые соли характерны только для многоосновных кислот, поскольку они диссоциируют ступенчато. Единственным исключением является одноосновная кислота — флуоридная. Благодаря водородным связям в растворе этой кислоты присутствуют частицы H2F2, и флуоридная кислота может образовывать кислую соль состава KHF2.
Некоторые нерастворимые гидроксиды образуют катионы, в которых имеется гидроксид-ион. Например, алюминий содержится в составе катиона AlOH 2+ , благодаря чему существует соль состава AlOHCl2 (алюминий гидроксохлорид). Такую соль называют основной.
100. Дайте определение кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
101. В чем особенность диссоциации многоосновных кислот по сравнению с одноосновными? Объясните на примере сульфатной кислоты.
Задания для усвоения материала
102. В результате диссоциации молекулы кислоты образовался ион с зарядом 3—. Сколько ионов Гидрогена при этом образовалось?
103. Составьте уравнения электролитической диссоциации кислот: карбонатной, бромидной, нитритной. Назовите образующиеся анионы.
104. Какие из приведенных кислот будут диссоциировать ступенчато: HCl, H2CO3, HNO3, H2S, H2SO3? Ответ подтвердите уравнениями реакций.
105. Составьте уравнения диссоциации солей: магний нитрата, алюминий хлорида, барий бромида, натрий карбоната, натрий ортофосфата.
106. Приведите по одному примеру солей, при диссоциации которых количеством вещества 1 моль образуется: а) 2 моль ионов; б) 3 моль ионов; в) 4 моль ионов; г) 5 моль ионов. Запишите уравнения диссоциации.
108. Составьте уравнения электролитической диссоциации веществ: калий гидроксида, барий сульфида, феррум(Ш) нитрата, магний хлорида, алюминий сульфата.
109. Составьте формулу вещества, при диссоциации которого образуются ионы Кальция и гидроксид-ионы.
110. Из перечня веществ выпишите отдельно электролиты и неэлектролиты: HCl, Ca, Cr2(SO4)3, Fe2O3, Mg(OH)2, CO2, Sr(OH)2, Sr(NO3)2, P2O5, H2O. Составьте уравнения диссоциации электролитов.
111. При диссоциации некоего нитрата образовался 1 моль катионов с зарядом 2+. Какое количество вещества нитрат-ионов при этом образовалось?
112. Составьте формулы и запишите уравнения диссоциации феррум(П) сульфата и феррум(Ш) сульфата. Чем отличаются эти соли?
113. Приведите по одному примеру уравнений диссоциации солей в соответствии со схемами (буквой М обозначен металлический элемент, а Х — кислотный остаток): а) МХ ^ М 2+ + Х 2- ; б) МХ3 ^ М 3+ + 3Х — ;
114. В растворе присутствуют ионы K+, Mg 2 +, NO-, SO4 — . Какие вещества растворили? Приведите два варианта ответа.
115*. Составьте уравнения диссоциации тех электролитов, которые образуют хлорид-ионы: CrCl3, KClO3, BaCl2, Ca(ClO)2, HClO4, MgOHCl.
- http://studopedia.su/15_96479_svoystva-kislot-osnovaniy-i-soley-s-tochki-zreniya-teorii-elektroliticheskoy-dissotsiatsii.html
- http://studfiles.net/preview/7015876/page:5/
- http://infopedia.su/17x4d38.html
- http://studopedia.ru/19_370506_svoystva-kislot-soley-i-osnovaniy-s-tochki-zreniya-teorii-elektroliticheskoy-dissotsiatsii.html
- http://yunc.org/%D0%AD%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F
- http://mozok.click/838-elektroliticheskaya-dissociaciya-kislot-osnovaniy-i-soley-v-vodnyh-rastvorah.html