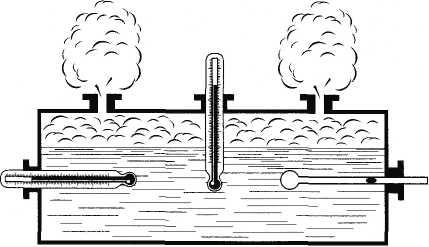
Изопроцессы. Газовые законы
Изопроцессами называют термодинамические процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров состояния системы.
1 ˚ Изотермический процесс.
Р.Бойль (англ.), Э. Мариотт (фр.), ХХVII в.
Произведение pV = const для данного количества газа при постоянной температуре.
Объяснение закона Бойля-Мариотта с точки зрения МКТ.
Давление — это обобщенная, усредненная действие молекул (атомов, частиц) на стены. При уменьшении объема в несколько раз во столько же раз увеличивается число молекул в единице объема (концентрация), а значит и число ударов молекул в стенки за единицу времени. Последнее ведет к росту давления.
2 ˚ Изохорный процесс.
Ж. Шарль (фр.), 1787 год.
Давление определенной массы газа при нагревании на 1 ˚ С при постоянном объеме увеличивается на 1/273 часть его давления при 0 ˚ С.
где α = (p — p0) / p0t = 1/273 (K-1) — температурный коэффициент давления.
Tt = T — 273, р = р0 (1 + αt) = р0 + р0 α (T — 273) = p0αT.
Поэтому р = p0αT или р / Т = const при неизменной массе идеального газа.
Объяснение закона Шарля на основе МКТ.
Согласно основным положениям МКТ при росте температуры идеального газа растет средняя скорость движения молекул (атомов, частиц), а потому возрастает частота соприкосновения со стенками сосуда. Это вызывает рост давления молекул на стенки.
3 ˚ Изобарный процесс.
Ж. Гей-Люссак (фр.), 1802 год.
Увеличение температуры газа на 1 ˚ С при постоянном давлении увеличивает его объем на 1/273 часть того объема, который занимает газ при 0 ˚ С.
где β = (V — V0) / V0t — температурный коэффициент объемного расширения газа.
Учитывая, что t = T — 273, закон Гей-Люссака можно представить в следующем виде:
V = V0βt, V / T = const, при неизменной массе идеального газа.
Объяснение закона Гей-Люссака на основе МКТ.
Согласно основным положениям МКТ при росте температуры идеального газа растет средняя скорость движения молекул (атомов, частиц), а потому растет среднее расстояние между молекулами, и вызывает рост объема, который занимает идеальный газ.
Объединенный газовый закон.
Законы Бойля-Мариотта, Шарля и Гей-Люссака, установленные экспериментально, объединяются в одну формулу, которую называют объединенным газовым законом.
Для данной массы идеального газа (m = const) в ходе произвольного равновесного термодинамического процесса величина pV / T остается постоянной:
Если в ходе данного процесса масса газа меняется, то объединенный газовый закон приобретает следующий вид:
Уравнением состояния идеального газа называют соотношение, которое связывает между собой параметры идеального газа в равновесном состоянии: f (p, V, T, m) = 0.
Экспериментально установлено уравнение
называют уравнением состояния или уравнением Клапейрона-Менделеева.
В последнем уравнении R = 8,31 Дж / (моль • К) называют универсальной газовой постоянной, а число ν = m / μ указывает на количество молей вещества, для которых записано уравнение состояния и коре находятся в состоянии термодинамического равновесия.
Закон бойля мариотта с точки зрения мкт
Автор работы награжден дипломом победителя II степени
1. Введение. ( Введение должно включать в себяформулировку постановки проблемы, отражение актуальности темы, определение целей и задач, поставленных перед исполнителем работы,краткий обзор используемой литературы и источников,степень изученности данного вопроса,характеристику личного вклада автора работы в решение избранной проблемы. )
Исследовать с помощью оборудования лаборатории L -микро изотермический, изохорный и изобарный процессы реального газа (воздуха).
Выяснить, что разряжённые газы с большой степенью точности подчиняются законам идеального газа.
Измерить в ходе работы температурные коэффициенты объёмного расширения и давления газа и сравнить экспериментальные значения с теоретическими.
Убедиться в том, что газовая шкала температур позволяет измерять температуры вне зависимости от рабочего вещества.
2. Основная часть. (Основная часть должна содержать информацию, собранную и обработанную исследователем.)
Теоретическая часть. Изотермический процесс.
Под вакуумную тарелку насоса поместим надутый до размеров яблока воздушный шарик. Откачивая воздух из-под купола насоса, обнаружим увеличение размеров шарика в несколько раз. Процесс откачивания воздуха сопровождается охлаждением воздуха под куполом и внутри шарика. Объём, давление и температура воздуха в шарике изменяются.
Уравнение, определяющее связь температуры, объёма и давления тел, называют уравнением состояния.
1. Определение равновесных и неравновесных процессов.
При медленном протекании процесса в любой момент времени успевает устанавливаться новое состояние равновесия с новыми значениями давления и объёма. Такие медленные процессы называют равновесными. Если после медленного сжатия проводить процесс в обратном направлении, т.е. предоставить газу возможность медленно расширяться, то он пройдёт через ту же последовательность равновесных состояний, что и при сжатии. По этой причине равновесные процессы называются обратимыми.
2. Закон Бойля-Мариотта.
Первый газовый закон был открыт английским учёным Робертом Бойлем в 1662 году и опубликован во втором издании его книги «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменения давления газа в зависимости от объёма при постоянной температуре. Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим (от греческих слов isos – равный, therme – тепло). Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении опыта.
Бойль наблюдал за изменением объёма воздуха, запертого в длинной изогнутой трубке столбом ртути. Вначале уровни ртути в обоих коленах трубки были одинаковыми, и давление воздуха было равно атмосферному, т.е. 760 мм ртутного столба. Доливая ртуть в длинное колено трубки, Бойль заметил, что объём воздуха уменьшился вдвое, когда разность уровней в обоих коленах оказалась равной 760 мм, и, следовательно, давление увеличилось вдвое. Это навело Бойля на мысль о том, что объём данной массы газа и его давление находятся в обратно пропорциональной зависимости. В 1667 году независимо от Бойля этот же закон установил французский физик Эдм Мариотт (1620-1684). Он проделал аналогичные опыты и в 1679 г. описал их в своей работе «Речи о природе воздуха». Поэтому закон, связывающий давление газа и его объём, называется законом Бойля-Мариотта. Согласно этому закону давление данной массы (или количества) газа при постоянной температуре обратно пропорционально объёму газа: p
Герметичный гофрированный сосуд соединён с манометром, регистрирующим давление внутри сосуда. Вращением винта можно изменять объём сосуда. Об объёме можно судить с помощью линейки. Меняя объём и измеряя давление, можно заметить, что выполняется уравнение P * V = const при t = const . Произведение давления данной массы газа на его объём постоянно, если температура не меняется.
Опыт №3. «Экспериментальное определение зависимости давления газа от объёма при постоянной температуре».
Запустить программу L -физика. Выбрать раздел «Газовые законы и свойства насыщенных паров», а в нём – эксперимент «Изотермический процесс». Медленно вращая рукоятку винта, сжимаем газ и переводим поршень в другое предельное положение. Кривые и цифровые индикаторы на экране при этом показывают изменение давления и объёма газа от занимаемого им объёма. На экране монитора учащиеся видят гиперболу.
На втором экране те же самые полученные в эксперименте точки перестраиваются в координатах (1/ V , P ). Для изотермического процесса зависимость 1/ V от Р представляет собой линейную функцию.[3]
Таблица 1. Характеристики изотермического процесса [2]
Связь между другими параметрами
С точки зрения МКТ
(закон Бойля- Мариотта)
P * V = const или
Давление газа зависит
от числа ударов молекул о стенки сосуда.
Число ударов прямо пропорционально концентрации:
Исследовательская часть. Изотермический процесс.
Под вакуумную тарелку насоса поместили надутый до размеров яблока воздушный шарик. Откачивая воздух из-под купола насоса, обнаружили увеличение размеров шарика в несколько раз. Объём, давление и температура воздуха в шарике изменились.
В молекулярно-кинетической теории модель «идеальный газ» удовлетворяет следующим требованиям:
объём всех молекул газа много меньше объёма сосуда;
силами притяжения между молекулами пренебрегают;
молекулы взаимодействуют только при соударении (удар упругий), при этом действуют силы отталкивания;
время столкновения много меньше времени между столкновениями.
Первый газовый закон был открыт английским учёным Робертом Бойлем в 1662 году и опубликован во втором издании его книги «Новые эксперименты, касающиеся воздушной пружины».
Бойль изучал изменения давления газа в зависимости от объёма при постоянной температуре. Мы также исследовали этот процесс.
С помощью программы L-микро был исследован изотермический процесс.
Медленно вращая рукоятку винта, сжимали газ, при этом температура газа оставалась равной температуре окружающей среды.
На первом экране был получен график зависимости P = P ( V ) при T = const , представляющий собой гиперболу,
то есть pV = const
График зелёного цвета описывает состояния воздуха в изотермическом процессе.
График красного цвета описывает состояния идеального газа.
Экспериментально доказано, что состояния разрежённых реальных газов можно описывать с помощью модели идеального газа.
На втором экране те же самые полученные в эксперименте точки были перестроены в координатах (1/V, P).
Для изотермического процесса зависимость Р= P (1/ V ) представляет собой линейную функцию.
Экспериментально доказали, что закон Бойля-Мариотта выполняется с большой степенью точности.
Теоретическая часть. Изобарный процесс. Закон Гей-Люссака.
Сообщение об открытии закона, определяющего зависимость объёма газа от температуры при постоянном давлении (и неизменной массе), установленного французским учёным Гей-Люссаком, было опубликовано лишь в 1802 году. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческих слов: isos – равный и baros – тяжесть, вес). Исследуемый газ находится в стеклянном баллончике, соединённом с длинной стеклянной трубкой. Газ заперт небольшой капелькой ртути в трубке. Так как трубка расположена горизонтально, то давление в баллончике всё время остаётся равным атмосферному. Температура газа увеличивается от 0 до 100 о С. За изменением объёма можно следить по перемещению капельки ртути. Гей-Люссак измерял объём газа в интервале температур от 0 до 100 о С. При исследовании различных газов он получил для них следующие значения температурного коэффициента объёмного расширения = (V – V0 )/V0 · t:
Таблица 1. Температурный коэффициент объемного расширения газов.
Газ
Температурный коэффициент объёмного расширения, 1/ о С
Анализ полученных результатов позволил Гей-Люссаку сделать следующие выводы:
все газы и пары одинаково расширяются при одном и том же повышении температуры;
для всех газов увеличение объёма в интервале температур от температуры таяния льда до температуры кипения воды равно 100/26666 первоначального объёма.
Таким образом, на основании наблюдений Гей-Люссак установил закон: относительное изменение объёма газа данной массы при постоянном давлении прямо пропорционально изменению температуры t. (V – V)/V = at, где a – температурный коэффициент объёмного расширения, численно равный относительному изменению объёма газа при изменении его температуры на 1 градус. Опыт показывает, что при малых плотностях коэффициент объёмного расширения одинаков для всех газов: a = 1/273 1/ о C. С точки зрения МКТ этот факт объясняется тем, что молекулы газа находятся в среднем на больших расстояниях друг от друга, и особенности межмолекулярных сил для различных газов в этих условиях не сказываются. Закон можно записать в виде: V = V(1 + t). Объём данной массы газа при постоянном давлении меняется линейно при изменении температуры. [4]
Опыт №4 «Экспериментальное определение зависимости объёма газа от температуры при постоянном давлении. Определение температурного коэффициента объёмного расширения газа» [3]
Запустить программу L-физика. Выбрать раздел «Газовые законы и свойства насыщенных паров», а в нём – эксперимент «Изобарный процесс». Поместить гофрированный полиэтиленовый резервуар в горячую воду (t = 70 о C), извлечь и подождать 2 минуты. Измерения проводить в течение 10-15 минут. На первом экране будет получена зависимость
V = V(t). Аппроксимировать экспериментальные результаты в виде прямой, уравнение прямой имеет вид: У= к Х + b, где к = V, b = Vo. На основе данных эксперимента получить значение температурного коэффициента объёмного расширения газа и сравнить его с теоретическим значением(1/273 = 0,0037)
4. Введение понятия идеального газа.
Если продолжить изобару в область низких температур, где измерения не проводились, то прямая пересекает ось температуры в точке, соответствующей объёму, равному нулю. Но, это не означает, что объём газа действительно обращается в ноль. Ведь все газы при сильном охлаждении превращаются в жидкости, а к жидкостям ни закон Бойля – Мариотта, ни закон Гей-Люссака не применимы. Реальные газы подчиняются основным газовым законам лишь приближённо и тем менее точно, чем больше плотность газа и ниже его температура. Газ, который в точности подчиняется газовым законам, называют идеальным.
В молекулярно-кинетической теории модель «идеальный газ» удовлетворяет следующим требованиям:
объём всех молекул газа много меньше объёма сосуда;
силы притяжения между молекулами малы, и ими пренебрегают;
молекулы взаимодействуют только при соударении (удар упругий), при этом действуют силы отталкивания;
время столкновения много меньше времени между столкновениями.
5. Введение понятия газовой шкалы температур.
Тот факт, что численное значение температурного коэффициента объёмного расширения в предельном случае малых плотностей одинаково для всех газов, позволяет установить температурную шкалу, не зависящую от вещества, – идеальную газовую шкалу температур.
Приняв за основу шкалу Цельсия, можно определить температуру из соотношения: t = (V – V)/ V, где V – объём газа при 0 о С, а V – его объём при температуре t. Так осуществляется определение температуры, не зависящее от вещества термометра.
6. Ввести понятие абсолютной температуры.
Предельную температуру, при которой объём идеального газа становится равным нулю, принимают за абсолютный нуль температуры. Найдём значение абсолютного нуля по шкале Цельсия. Приравнивая объём V к нулю и учитывая, что = 1/273 1/ о С, получим: 0 = V(1 + 1/273t). Отсюда абсолютный нуль температуры равен: t = – 273 о C. Это предельная, самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказал Ломоносов.
Английский учёный Уильям Кельвин ввёл абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, и единица температуры по этой шкале равна градусу по шкале Цельсия, поэтому абсолютная температура Т связана с температурой по шкале Цельсия формулой: Т = t + 273 о , причём 1 о С = 1К. С точки зрения МКТ при Т = 0К тепловое движение молекул прекращается.
Применяя шкалу Кельвина, закон Гей-Люссака можно записать в более простой форме: 1 + t = 1 + 1/273(T – 273) = T . Тогда V = V T.
Объём газа данной массы при постоянном давлении прямо пропорционален абсолютной температуре.
Отсюда следует, что отношение объёмов газа одной и той же массы в различных состояниях при постоянном давлении равно отношению абсолютных температур: V1/V2 = T1/T2.[1]
7. Результаты эксперимента позволят продолжить работу с таблицей. [2]
Таблица 2. Характеристики изобарного процесса
Постоянный параметр
Название изопроцесса
Связь между другими параметрами
Объяснение связи Между параметрами с точки зрения МКТ
Графики изопроцесса
Р = const
При m = cost.
Изобарный процесс (закон Гей-Люссака, 1802 год).
Рост температуры означает увеличение средней кинетической энергии теплового движения молекул газа. Чтобы поддерживать давление постоянным, необходимо не допустить увеличения числа ударов о единицу площади поверхности стенки
Авогадро в 1811 году высказал смелую гипотезу: в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
В настоящее время гипотеза Ампера строго доказана и носит название закона Авогадро. Согласно закону Авогадро различные газы, взятые в количестве 1 моль, имеют одинаковые объёмы при одинаковых давлениях и температурах, так как число молекул в них одинаковое. При нормальных условиях, т.е. при температуре 0 o С и атмосферном давлении 101325 Па, этот объём, как показывают измерения, равен Vµ = 0,0224 м 3 /моль = 22,4 л/моль. Объём Vµ называют молярным.
9. Закон Дальтона
Давление, которое имел бы каждый из газов, составляющих смесь, если удалить из сосуда остальные газы, называют парциальным (т.е. частным) давлением.
Английский химик Дальтон установил, что для достаточно разряжённых газов давление смеси газов p равно сумме парциальных давлений всех газов p1, p2, p3 … : p = p1 + p2 + p3
С точки зрения МКТ закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает давление на стенки сосуда независимо от присутствия других газов.
10. Уравнение состояния идеального газа
Используя законы Бойля – Мариотта и Гей-Люссака, можно получить уравнение, связывающее все три параметра p, V и T, то есть уравнение состояния идеального газа:
Итак, произведение давления данной массы газа на его объём, делённое на абсолютную температуру, есть величина постоянная, не зависящая от состояния, в котором находится газ: PV/T=const (Уравнение Клапейрона).
11. Опыт № 2.Экспериментальная проверка уравнения состояния идеального газа. [3]
Запустить программу L-физика, выбрать эксперимент «Уравнение состояния идеального газа», использовать установку для демонстрации изотермического процесса. Сосуды с водой различной температуры готовятся заранее. Резервуар с газом попеременно погружается в сосуд с горячей или холодной водой. В целях оптимизации эксперимента следует сначала записать параметры газа в 2-3 состояниях при одном значении температуры, затем при другом. На экране данные представляются в координатах (T, PV). Из уравнения состояния идеального газа следует, что произведение PV прямо пропорционально абсолютной температуре газа T. Именно это и демонстрируется при нажатии кнопки «прямая».
12.Универсальная газовая постоянная [1]
Возьмём газ в количестве 1 моль. При нормальных условиях Vµ = 0,0224м 3 /моль. Следовательно, для моля любого газа pV/T = 8,31 Дж/(моль·К). Таким образом, для одного моля газа произведение давления на объём, отнесённое к абсолютной температуре, является постоянной величиной для всех газов. Эту постоянную величину называют универсальной газовой постоянной и обозначают буквой R : R = 8, 31 Дж/(моль·К).
13. Уравнение Менделеева – Клапейрона
Для 1 моль идеального газа p · Vµ = RT. Если взять газ в количестве молей v = m/M, где m – масса газа, а М – его молярная масса, то объём этого количества вещества при тех же значениях давления и температуры равен V = vVµ. Умножим обе части уравнения состояния для 1 моля газа на v и получим уравнение состояния идеального газа, то есть уравнение Менделеева – Клапейрона: pV = (m/M)RT. Единственная величина в уравнении состояния, зависящая от рода газа, это его молярная масса.
Исследовательская часть. Изобарный процесс. Закон Гей-Люссака.
С помощью программы L-микро был исследован изобарный процесс.
Поместили гофрированный полиэтиленовый резервуар в горячую воду (t = 70оC). После извлечения измерения проводили в течение 15 минут.
На первом экране получили зависимость V = V(t). Аппроксимировали экспериментальные результаты в виде прямой, уравнение которой имеет вид: V= к t + b, где к = α Vо, b = Vo.
На основе данных эксперимента получили значение температурного коэффициента объёмного расширения газа.
α э V0 = 1,76 см 3/K
α э = 1,76/427 1/ K = 0,00412 1/ K = 0,004 1/ K
Экспериментальное значение температурного коэффициента объёмного расширения совпало
с теоретическим значением :
Понятие газовой шкалы температур
Тот факт, что численное значение температурного коэффициента объёмного расширения одинаково для всех разрежённых газов, позволяет установить температурную шкалу, не зависящую от вещества, – идеальную газовую шкалу температур.
Приняв за основу шкалу Цельсия, можно определить температуру из соотношения:
где V0 – объём газа при 0°С, а V – объём при t.
Понятие идеального газа
Если продолжить изобару в область низких температур, где измерения не проводились, то прямая пересекает ось температуры в точке, соответствующей объёму, равному нулю.
Но, это не означает, что объём газа действительно обращается в ноль. Ведь все газы при сильном охлаждении превращаются в жидкости, а к жидкостям ни закон Бойля – Мариотта, ни закон Гей-Люссака не применимы.
Реальные газы подчиняются основным газовым законам лишь приближённо.
Газ, который в точности подчиняется газовым законам, называют идеальным.
Понятие абсолютной температуры
Предельную температуру, при которой объём идеального газа становится равным нулю, принимают за абсолютный нуль температуры. Найдём значение абсолютного нуля по шкале Цельсия.
Приравнивая объём V к нулю и учитывая, что α = 1/273 1/ °С, получим: 0 = V0(1 + 1/273t).
Отсюда абсолютный нуль температуры равен:
Это предельная, самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказал Ломоносов.
Английский учёный Уильям Кельвин ввёл абсолютную шкалу температур.
Нулевая температура по шкале Кельвина соответствует абсолютному нулю,
единица температуры по этой шкале равна градусу по шкале Цельсия,
абсолютная температура Т связана с температурой по шкале Цельсия формулой:
Т = t + 273°, причём 1°С = 1К.
С точки зрения МКТ при Т = 0К тепловое движение молекул прекращается.
Применяя шкалу Кельвина, закон Гей-Люссака можно записать в более простой форме.
Объём газа данной массы при постоянном давлении прямо пропорционален абсолютной температуре.
Отсюда следует, что отношение объёмов газа одной и той же массы в различных состояниях при постоянном давлении равно отношению абсолютных температур:
Теоретическая часть. Изохорный процесс. Закон Шарля.
С помощью уравнения состояния можно найти зависимость давления газа от температуры при постоянном объёме: Р = mRT/MV. Эту зависимость экспериментально установил французский физик Жак Шарль (1746-1823) в 1787 году (Шарль – в 1787 г., то есть раньше, чем Гей-Люссак, установил и зависимость объёма от температуры при постоянном давлении, но он своевременно не опубликовал своих работ).
Закон Шарля: давление данной массы газа при постоянном объёме прямо пропорционально абсолютной температуре. Следовательно, отношение давлений данной массы газа при постоянном объёме равно отношению его абсолютных температур: p1/p2 = T1/T2.
Процесс изменения давления газа, вызванный изменением температуры при постоянном объёме, называют изохорным (от греческих слов isos – равный и – занимаемое место). [4]
15. Заполним таблицу для изохорного процесса [2]
Таблица 3. Характеристики изохорного процесса.
Постоянный параметр
Название изопроцесса
Связь между другими параметрами
Объяснение связи между параметрами с точки зрения МКТ
График изопроцесса (изохоры)
V = const
При m = const.
Изохорный (закон Шарля)
Увеличение температуры газа означает увеличение средней кинетической энергии теплового движения частиц. При постоянном объёме это приводит к увеличению числа ударов частиц о единицу площади поверхности стенки в единицу времени, то есть к увеличению давления.
Зависимость давления газа от температуры графически изображается прямой линией – изохорой. Большему объёму соответствует нижняя изохора.
Убедитесь самостоятельно, что р = р · · Т, где р – давление газа при Т = 273К, а коэффициент , называемый температурным коэффициентом давления газа, равен температурному коэффициенту объёмного расширения = 1/273 1/К, = (р – р) /рt
Исследовательская часть. Изохорный процесс. Закон Шарля.
С помощью уравнения состояния можно найти зависимость давления газа от температуры при постоянном объёме: Р = mRT/MV. Эту зависимость экспериментально установил французский физик Жак Шарль (1746-1823) в 1787 году.
Закон Шарля: давление данной массы газа при постоянном объёме прямо пропорционально абсолютной температуре:
p/T = const при V= const
Отношение давлений данной массы газа при постоянном объёме равно отношению его абсолютных температур: p1/p2 = T1/T2.
С помощью программы L-микро был исследован изохорный процесс.
Поместили установку в горячую воду при 80°С на 5 мин. Датчик температуры успевал приходить в равновесие с окружающим его газом при медленном изменении температуры во время остывания резервуара с газом на воздухе.
На основе данных эксперимента получили значение температурного коэффициента давления газа.
Экспериментальное значение температурного коэффициента давления газа совпало с теоретическим значением:
Применяя шкалу Кельвина, закон Шарля
можно записать в более простой форме.
Экспериментально доказали, что для воздуха применим закон идеального газа для изохорного процесса Шарля.
3. Заключение. (В заключении в лаконичном виде формулируются выводы и результаты, полученные автором.)
1.В ходе исследовательской работы с помощью оборудования лаборатории L -микро были произведены измерения параметров реального газа ( воздуха) и построены графики в изотермическом, изохорном и изобарном процессах.
2.Убедились, что разряжённые газы с большой степенью точности подчиняются законам идеального газа.
3.Измеренные в ходе работы температурные коэффициенты объёмного расширения и давления газа практически совпали с теоретическими значениями.
4.Удостоверились, что газовая шкала температур позволяет измерять температуры вне зависимости от рабочего вещества.
4. Список использованных источников и литературы. (В список литературы заносятся публикации, издания и источники, использованные автором – в алфавитном порядке. Они должны быть оформлены по библиографическому ГОСТу. )
1). Руководство по выполнению работ L -микро. Авторы: Хоменко С.В., Чарушин А.В. Москва: МГИУ, 2007г
2). Г.Я.Мякишев, А.З.Синяков. Молекулярная физика. Термодинамика. 10 класс. Учебник для углублённого изучения физики. – М: Дрофа, 2016. https :// yandex . ru / images
3)Н.С.Пурышева, Н.В.Шаронова, Д.А.Исаев Фундаментальные эксперименты в физической науке. Элективный курс. – М.: Бином, 2005
Закон Бойля-Мариотта. Молекулярно-Кинетическая теория (МКТ) идеальных газов
Молекулярно-Кинетическая теория (МКТ) идеальных газов
Молекулярная физика – это раздел физики, изучающий строение и свойства веществ исходя из молекулярно-кинетического представления, основывающийся на том, что все тела состоят из молекул, находящиеся в непрерывном хаотическом движении.
Законы поведения огромного числа молекул изучаются с помощью статистического метода. Этот метод основан на том, что все свойства молекулярно-кинетической систем определяется свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик (энергия и скорость) этих частиц.
В МКТ пользуются идеализированной моделью идеального газа, согласно которой считают, что:
· Собственный объем идеального газа пренебрежимо мал по сравнению с объемом сосуда
· Между молекулами газа отсутствуют силы взаимодействия
· Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие
Рассмотрим закон, описывающий поведение идеальных газов.
Для каждой масс газа при постоянной температуре, произведение объема на давление постоянно. T=const, pV=const, m=const.
Кривая изображает зависимость между p и V характеризующими свойства вещества при постоянной температуре называется Изотермой, а процесс – изотермическим.
P
T2
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 9491 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Молекулярно-кинетическое истолкование закона Бойля—Мариотта
Давление газа зависит от числа ударов молекул о стенку сосуда. Число ударов прямо пропорционально числу молекул в единице объема (концентрации п). При уменьшении объема газа концентрация увеличивается, так как п = 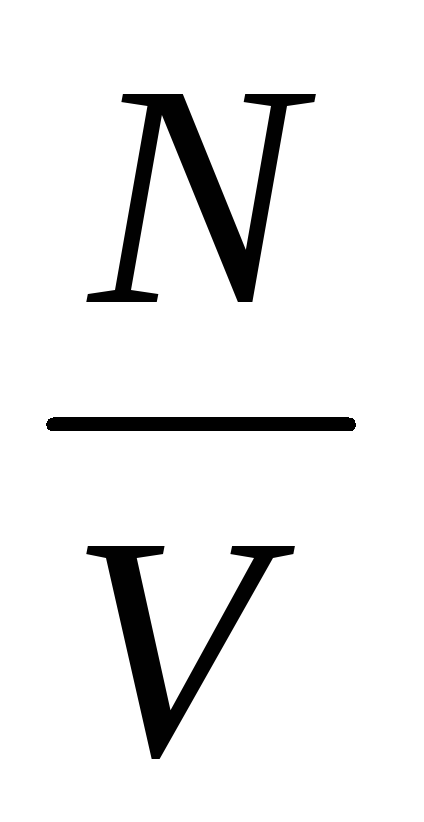
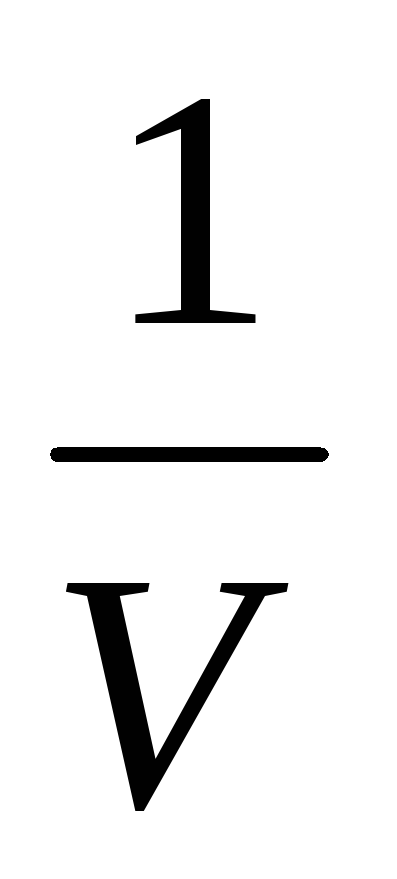
Закон Бойля—Мариотта устанавливает простую обратно пропорциональную зависимость между давлением и объемом газа при постоянной температуре.
§ 3.6. Закон Гей-Люссака. Идеальный газ
Сообщение об открытии еще одного газового закона было опубликовано лишь в 1802 г., спустя почти 150 лет после открытия закона Бойля—Мариотта. Закон, определяющий зависимость объема газа от температуры при постоянном давлении (и неизменной массе), был установлен французским ученым Гей-Люссаком (1778— 1850).
Закон Гей-Люссака
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческих слов: isos — равный и baros — тяжесть, вес).
Схематически прибор Гей-Люссака показан на рисунке 3.9. Исследуемый газ находится в стеклянном баллончике, соединенном с длинной стеклянной трубкой. Газ заперт небольшой капелькой ртути в трубке. Так как трубка расположена горизонтально, то давление в баллончике все время остается равным атмосферному. Температура газа с помощью специального нагревателя увеличивается от 0 до 100 °С. За изменением объема можно следить по перемещению капельки ртути.
При изучении теплового расширения следует рассматривать не абсолютное изменение объема, а относительное. Если при температуре t= 0 °С объем газа равен V, а при температуре t он равен V, то относительное изменение объема есть 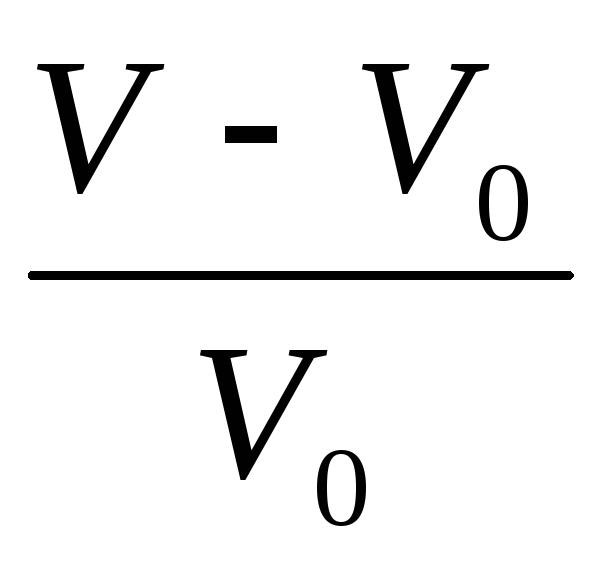
На основании наблюдений Гей-Люссак установил закон: относительное изменение объема газа данной массы при постоянном давлении прямо пропорционально изменению температуры t:
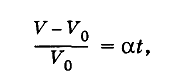
где α — температурный коэффициент объемного расширения.
Температурный коэффициент объемного расширения ос численно равен относительному изменению объема газа при изменении его температуры на 1 °С.
Измеряя объем газа при двух опорных точках, например 0 и 100 °С, можно найти коэффициент α:
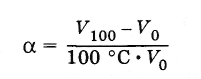
Опыт показывает, что при малых плотностях температурный коэффициент объемного расширения одинаков для всех газов:
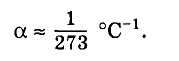
Это означает, что газы изменяют свой объем примерно на 1/273 того объема, который каждый из газов занимал при 0 °С, если температура меняется на 1 °С.
С точки зрения молекулярно-кинетической теории, одинаковое значение коэффициента а для всех газов объясняется тем, что молекулы газа находятся в среднем на больших по сравнению с их размером расстояниях друг от друга. Особенности межмолекулярных сил для различных газов в этих условиях не сказываются.
Уравнение (3.6.1) можно записать в другой форме:

Объем газа определенной массы согласно уравнению (3.6.4) при постоянном давлении меняется линейно при изменении температуры.
Закон бойля мариотта с точки зрения мкт
Закон Бойля-Мариотта характерен для 1 из трех изопроцессов (процессы, в которых 1 из параметров T,P или V постоянные), в частности для изотермического процесса, т. Е температура в таком процессе не меняется. Вот тебе и весь закон:
При Т=const P*V=const. Можешь еще график начертить, чтобы было понятнее, это будет изотерма. Начерти в координатах РV, график-парабола и чем меньше будет Т, тем график бкдет сильнее»прижиматься» к осям, но касаться их не будет
как объяснить закон бойля мариотта с помощью молекулярно кинетической теории?
P=1/3nmvv (vv это v в квадрате)
Закон Бойля — Мариотта. В формуле через n обозначено не полное число молекул, а число молекул в единице объема. Если то же число молекул поместить в половину объема (не изменив при этом температуру), то величина n удвоится, при этом удвоится и давление, если v2 не зависит от плотности. Иначе говоря, при постоянной температуре давление газа обратно пропорционально объему. Английский физик Р. Бойль и французский физик Э. Мариотт экспериментально установили, что при низких давлениях это утверждение справедливо для любого газа. Таким образом, закон Бойля — Мариотта можно объяснить, сделав разумное предположение, что при низких давлениях скорость молекул не зависит от n.
Изопроцессы в газах. Закон Бойля-Мариотта.
Закон Бойля-Мариотта — один из основных газовых законов, он описывает изотермические процессы в газе.
Процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим. Закон Бойля-Мариотта гласит:
Для данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Этот закон был экспериментально открыт английским ученым Р. Бойлем в 1662 г., в 1676 г. его сформулировал также французский ученый Э. Мариотт.
Закон строго выполняется только для идеальных газов. Для реальных газов он выполняется достаточно хорошо при небольших давлениях и высоких температурах. Так, при давлении 100 атм и температуре 0 °С отклонение измеренного значения pV от расчетного составляет 7%. Закон Бойля-Мариотта, как и другие газовые законы, является следствием уравнения состояния идеального газа.
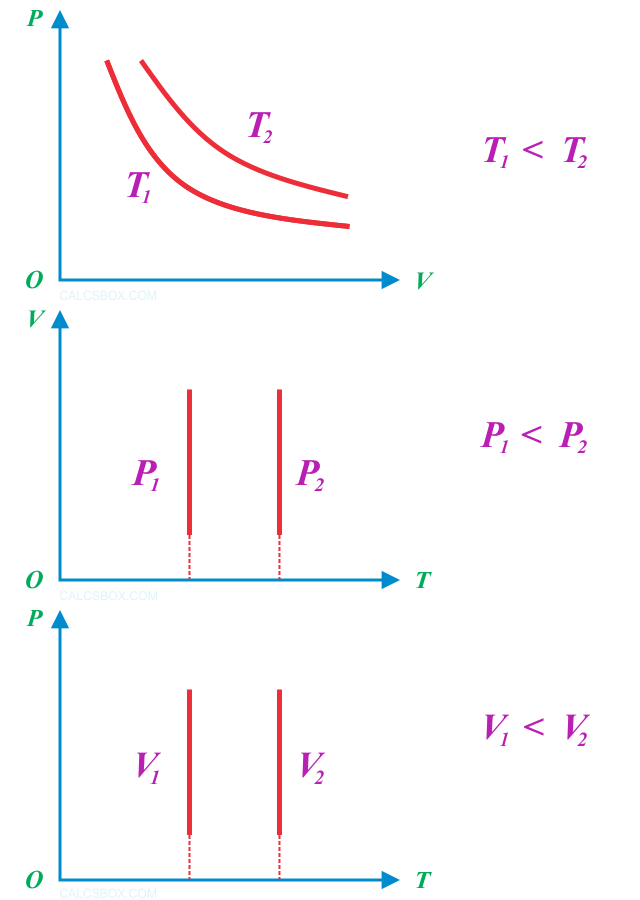
Графики зависимости p(V) при Т = const (р = const/V) называются изотермами и представляют собой равносторонние гиперболы (площади S1 = S2). Чем выше температура, тем выше лежит соответствующая ей изотерма
Большая Энциклопедия Нефти и Газа
Закон — бойля-мариотт
Мариот-том ( закон Бойля-Мариотта ): при столкновении молекулы газа оказывают давление на стенки сосуда. [16]
Как объяснить закон Бойля-Мариотта с точки зрения молекулярно-кинетический теории. Какими законами описываются изобарные и изохорные процессы. [17]
Отклонение от закона Бойля-Мариотта впервые было установлено в конце XVIII в. Морумом, который, изучая аммиак, нашел, что он сжимается сильнее воздуха. [18]
С помощью законов Бойля-Мариотта и Гей-Люссака ( или Шарля) легко найти связь между давлением, объемом и температурой для произвольного равновесного состояния идеального газа. Пусть при температуре Т4 и давлении pi рассматриваемый идеальный газ, имеющий общую массу / И, занимает объем Vlt а при произвольной температуре Т и произвольном давлении р — занимает объем V. Осуществим переход газа из начального состояния ( рь Vlt 7) в состояние ( р, V, Т) в два этапа. [19]
Отклонение от закона Бойля-Мариотта впервые было установлено в конце XVIII в. Морумом, который, изучая аммиак, нашел, что он сжимается сильнее воздуха. [20]
Отклонение от закона Бойля-Мариотта впервые было установлено в конце XVI II в. Морумом, который, изучая аммиак, нашел, что он сжимается сильнее воздуха. [21]
Кривые, иллюстрирующие закон Бойля-Мариотта , называются изотермами. Изотерма / ( см. рис. 1.2) соответствует более низкой температуре, а изотермы / / — IV — более высокой. [22]
Простейшую зависимость дает закон Бойля-Мариотта , который верен при условии постоянства температуры. [23]
В чем заключается закон Бойля-Мариотта . [24]
Простейшую зависимость дает закон Бойля-Мариотта , который верен при условии постоянства температуры. [25]
Для воздуха применим закон Бойля-Мариотта . [26]
Отклонение азота от закона Бойля-Мариотта настолько мало, что его обычно не принимают во внимание. [27]
Но, согласно закону Бойля-Мариотта , концентрация газа и его давление прямо пропорциональны друг другу при постоянной температуре. [28]
Жидкости не подчиняются закону Бойля-Мариотта и другим законам идеальных газов. [29]
Решение, По закону Бойля-Мариотта с повышением давления удельный вес газов увеличивается. [30]
Закон Бойля-Мариотта. Изотерма
если при постоянной температуре происходит термодинамический процесс, вследствие которого газ переходит из одного состояния (p1 и V1) в другое (p2 и V2), то произведение давления на объем данной массы газа при постоянной температуре является постоянным: pV = const.
Первый газовый закон был открыт английским ученым Р. Бойлем в 1662 г. при исследовании упругости воздуха.
Между давлением и объемом данной массы газа при постоянной температуре существует обратная зависимость: p
Немного позже, в 1676 году французский ученый Э. Мариотт независимо от Р. Бойля обобщенно сформулировал газовый закон, который теперь называют законом Бойля-Мариотта. По его утверждению, если при определенной температуре данная масса газа занимает объем V1 при давлении p1 , а в другом состоянии при этой же температуре его давление и объем равняются p2 и V2 , то справедливо соотношение:
Закон Бойля-Мариотта: если при постоянной температуре происходит термодинамический процесс, вследствие которого газ переходит из одного состояния ( p1 и V1 ) в другое ( p2 и V2 ), то произведение давления на объем данной массы газа при постоянной температуре является постоянным: pV = const .
\[ pV = const (при T = const) \]
где p — давление, V — объем, T — термодинамическая температура (изотермический процесс).
Закон Бойля-Мариотта устанавливает соотношение между давлением и объемом газа для изотермических процессов: при постоянной температуре объем V данной массы газа обратно пропорциональный его давлению P .
Термодинамический процесс, который происходит при постоянной температуре, называется изотермическим (от гр. isos — равный, therme — теплота). Графически на координатной плоскости pV он изображается гиперболой, которая называется изотермой . Разным температурам отвечают разные изотермы — чем выше температура, тем выше на координатной плоскости pV находится гипербола ( T2>T1 ). Очевидно, что на координатной плоскости рТ и VT изотермы изображаются прямыми, перпендикулярными оси температур.
График изотермического процесса
Поделитесь с другими:
Если материал понравился Вам и оказался для Вас полезным, поделитесь им со своими друзьями!
Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
Свойства реальных газов рассматриваются на примере поведения физической модели «идеальный газ», в которой молекулы представлены в виде материальных точек, отсутствуют силы межмолекулярного взаимодействия, взаимодействие молекул происходит только при их соударениях и со стенками сосуда и является упругим.
Связь термодинамических макропараметров газа (p-давление,V-объем, T-температура) с его микропараметрами (m-масса молекул, -средняя квадратичная скорость молекул, -средняя кинетическая энергия молекул, n-концентрация молекул) устанавливает основное уравнение МКТ идеального газа.
Реальные газы при не слишком низких температурах и достаточно малых давлениях по своим свойствам близки к идеальному газу.
- http://school-science.ru/6/11/36191
- http://studopedia.ru/3_163767_zakon-boylya-mariotta.html
- http://studfiles.net/preview/2383541/page:26/
- http://fizikahelp.ru/92/923/11032.html
- http://irc.lv/qna/%D0%BA%D0%B0%D0%BA_%D0%BE%D0%B1%D1%8A%D1%8F%D1%81%D0%BD%D0%B8%D1%82%D1%8C_%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD_%D0%B1%D0%BE%D0%B9%D0%BB%D1%8F_%D0%BC%D0%B0%D1%80%D0%B8%D0%BE%D1%82%D1%82%D0%B0_%D1%81_%D0%BF%D0%BE%D0%BC%D0%BE%D1%89%D1%8C%D1%8E_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE_%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9_%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D0%B8
- http://www.calc.ru/Izoprotsessy-V-Gazakh-Zakon-Boylyamariotta.html
- http://www.ngpedia.ru/id27647p2.html
- http://calcsbox.com/post/zakon-bojla-mariotta.html
- http://fizclass.ru/idealnyj-gaz-osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-idealnogo-gaza/