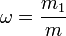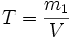1. Закон сохранения массы вещества. Применяя количественные методы исследования химических реакций, М. В. Ломоносов установил, что при химических превращениях общий вес вещества остается неизменным. На основании своих опытов он сформулировал закон сохранения массы веществ:
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
С точки зрения атомно-молекулярной теории закон сохранения массы веществ объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит только их перегруппировка. А так как атомы имеют постоянную массу, то это и приводит к закону сохранения массы веществ.
Закон сохранения массы веществ при химических реакциях Ломоносов рассматривал как одно из проявлений всеобщего закона сохранения материн и движения.
Достижения современной физики подтвердили взгляды Ломоносова на то, что закон сохранения массы веществ является частным случаем более общего закона сохранения материи. Только материя в любых процессах сохраняется, а масса, которая является лишь одной из характеристик материи, может переходить в другую ее форму — энергию. Математически этот закон выражается известным уравнением Эйнштейна
Закон Эйнштейна подробно, изучался вами в курсе физики. Он имеет большое значение при изучении радиоактивных превращений.
2. Закон постоянства состава. Закон сохранения
массы веществ послужил основой для изучения количественного состава различных веществ, и к началу XIX в. накопился уже большой экспериментальный материал, обобщив который французский ученый Ж. Л. Пруст сформулировал закон постоянства состава:
Независимо от способа получения данного соединения весовой состав его всегда один и тот же.
Закон постоянства состава находится в полном соответствии с атомно-молекулярным учением. Действительно, любое вещество состоит из молекул, а каждая молекула — из определенного количества атомов. Атомы имеют постоянную массу, следовательно, весовой состав вещества остается всегда постоянным.
3. Закон эквивалентов. К концу XVIII в. на основе изучения опытных данных было замечено, что элементы взаимодействуют друг с другом в строго определенных весовых отношениях. Так, с 1,008 весовыми частями (в. ч.) водорода соединяются 8 в. ч. кислорода, или 16 в. ч. серы, или 35,5 в. ч. хлора и т. д. Эти весовые Количества эквивалентны (равноценны) между собой. Понятие о соединительных весах элементов — их эквивалентах— впервые было введено Дальтоном.
Эквивалентом элемента называется число, которое показывает, сколько весовых частей элемента соединяется с 8 весовыми частями кислорода или с 1 весовой частью водорода, или замещает (непосредственно или косвенно) те же количества водорода и кислорода в, их соединениях при химических превращениях.
Закон эквивалентов формулируется таким образом:
Элементы соединяются между собой и замещают друг друга в количествах, пропорциональных их эквивалентам.
Закон эквивалентов можно записать



Этим уравнением, выражающим закон эквивалентов в математическом виде, очень удобно пользоваться при решении различных задач.
Из закона эквивалентов непосредственно вытекает, что
1) число 8 для кислорода и число 1 для водорода являются эквивалентами этих элементов, т. е.
2) эквивалент элемента можно определить по составу его соединения с другим элементом, эквивалент которого известен.
Если элемент образует несколько соединений с другим элементом, то эквивалент его, очевидно, будет иметь различные значения в зависимости от того, из какого соединения он был вычислен. Но все эти различные значения эквивалента будут относиться друг к другу как небольшие целые числа. Когда два элемента образуют несколько различных соединений друг с другом, массы одного элемента, приходящиеся в этих соединениях на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа (закон кратных отношений -подробнее см. далее).
Закон эквивалентов находится в полном соответствии с атомно-молекулярной теорией. При химических реакциях атомы одного элемента соединяются с определенным числом атомов другого элемента, а поскольку атом каждого элемента характеризуется постоянной массой, то количества вступающих в реакцию элементов также вполне определенны и равноценны между собой (эквивалентны).
Важнейшей характеристикой химического элемента является его валентность — свойство атомов данного элемента присоединять определенное число атомов другого элемента (подробно см. § 2, гл. III).
Между эквивалентом Э, атомной массой А и валентностью В элемента существует зависимость 
Понятие об эквиваленте распространяется и на сложные вещества (подробно см. § 4, гл. VI). Заметим, что в этом случае закон эквивалентов для веществ можно сформулировать так:
Химические вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам.
Математическое выражение этого закона останется в прежней форме , только в этом случае—» массы взаимодействующих веществ
эквиваленты этих веществ.
4. Закон кратных отношений определяет, что если два элемента образуют несколько соединений, то массы одного из элементов в разных соединениях относятся между собой как целые числа.
Способность элементов вступать в соединения лишь определенными «порциями» свидетельствует об атомно-молекулярном строении вещества. Например, азот и кислород дают пять окислов:
Количества кислорода в них, приходящиеся на одно и то же количество азота, относятся как целые .числа — 1 : 2 : 3 : 4 : 5. Это объясняется тем, что одинаковое число атомов азота в молекулах разных окислов связано с различным числом атомов кислорода.
Таким образом, после прочтения настоящей главы мы убедились, что к концу 60-х годов прошлого века было неоспоримо доказано существование атомов и молекул, была разработана стройная теория атомно-молекулярного учения, на которой базировалась вся физика и химия того времени. Мы познакомились пока лишь с основными понятиями и некоторыми из основных законов химии. Подчеркнем еще раз, что атомно-молекулярное учение базировалось на представлениях о том, что атом неделим. Вследствие этого атомно-молекулярная теория оказалась не в состоянии объяснить ряд экспериментальных фактов конца XIX и начала XX в., показавших, что атомы «делимы», т. е. состоят из каких-то более мелких частиц. Более того, на основании только атомно-молекулярного учения трудно было понять и целый ряд ранних результатов. Например, без дополнительных сведений о природе газообразного состояния трудно объяснить закон Авогадро. Поэтому
закон Авогадро и ряд других законов и понятий мы рассмотрим далее (см. гл. IV), когда познакомимся подробнее с современными представлениями о молекуле, веществе и т. д.
Основы атомно-молекулярной теории создали русский ученый М.В.Ломоносов (1741 г.) и английский ученый Дж. Дальтон (1808 г.).
Атомно-молекулярная теория – это учение о строении вещества, основными положениями которого являются:
1. Все вещества состоят из молекул и атомов. Молекула – это наименьшая частица вещества, которая способна существовать самостоятельно и не может дробится дальше без потери основных химических свойств данного вещества. Химические свойства молекулы определяются её составом и химическим строением.
2. Молекулы находятся в непрерывном движении. Молекулы двигаются беспорядочно и непрерывно. Скорость движения молекул зависит от агрегатного состояния веществ. С повышением температуры скорость движения молекул увеличивается.
3. Молекулы одного и того же вещества одинаковы, а молекулы различных веществ отличаются массой, размерами, строением и химическими свойствами. Каждое вещество существует до тех пор, пока сохраняются его молекулы. Как только молекулы разрушаются, перестает существовать и данное вещество: возникают новые молекулы, новые вещества. При химических реакциях молекулы одних веществ разрушаются, образуются молекулы других веществ.
4. Молекулы состоят из более мелких частиц – атомов. Атом – это наименьшая частица химического элемента, которую нельзя разложить химическим путем.
Следовательно, атом обуславливает свойства элемента.
Атом– электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Химическим элементом называется вид атомов, характеризующихся определенной совокупностью свойств.
В настоящее время элемент определяется как вид атомов, обладающих одинаковым зарядом ядра.
Вещества, молекулы которых состоят из атомов одного элемента, называются простыми веществами (С, Н2, N2, О3, S8 и т.д.).
Вещества, молекулы которых состоят из атомов двух или более элементов, называются сложными веществами (H2O, H2SO4, KHCO3 и т.д.). Существенное значение имеет число и взаимное расположение атомов в молекуле.
Способность атомов одного и того же элемента к образованию нескольких простых веществ, различных по строению и свойствам называется аллотропией, а образовавшиеся вещества – аллотропными видоизменениями или модификациями,так например, элемент кислород образует две аллотропные модификации: О2 – кислород и О3 – озон; элемент углерод – три: алмаз, графит и карбин и т.д.
Явление аллотропии вызывается двумя причинами: различным числом атомов в молекуле (кислород О2 и озон О3), или образованием различных кристаллических форм (алмаз, графит и карбин).
Элементы принято обозначать химическими знаками. Следует всегда помнить, что каждый знак химического элемента обозначает:
1. название элемента;
2. один атом его;
3. один моль его атомов;
4. относительную атомную массу элемента;
5. его положение в периодической системе химических элементов
Так, например, знак S показывает, что перед нами:
1. химический элемент сера;
2. один атом его;
3. один моль атомов серы;
4. атомная масса серы равна 32 а. е. м. (атомная единица массы);
5. порядковый номер в периодической системе химических элементов Д.И. Менделеева 16.
Абсолютные массы атомов и молекул ничтожно малы, поэтому для удобства массу атомов и молекул выражают в относительных единицах. В настоящее время за единицу атомных масс принята атомная единица массы (сокращенно а. е. м.), представляющая собой 1/12 часть массы изотопа углерода 12 С, 1 а. е. м. составляет 1,66 × 10 -27 кг .
Атомной массой элемента называется масса его атома, выраженная в а. е. м.
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы изотопа углерода 12 С.
Относительная атомная масса величина безразмерная и обозначается Аr,
например, для водорода
для кислорода .
Молекулярная масса вещества – это масса молекулы, выраженная в а. е. м. Она равна сумме атомных масс элементов, входящих в состав молекулы данного вещества.
Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы изотопа углерода 12 С. Она обозначается символом Мr. Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в молекулу с учетом количества атомов. Например, относительная молекулярная масса ортофосфорной кислоты Н3РО4 равна массе атомов всех элементов, входящих в молекулу:
Мr(Н3РО4) = 1,0079 × 3 + 30,974 × 1 + 15,9994 × 4 = 97, 9953 или ≈ 98
Относительная молекулярная масса показывает, во сколько раз масса молекулы данного вещества больше 1 а. е.м.
Наряду с единицами массы, в химии пользуются также единицей количества вещества, называемой молем (сокращенное обозначение «моль»).
Моль вещества– количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится в 12 г (0,012 кг) изотопа углерода 12 С.
Зная массу одного атома углерода 12 С (1,993 × 10 -27 кг), можно вычислить число атомов в 0,012 кг углерода:
Число частиц в моле любого вещества одно и то же. Оно равно 6,02 × 10 23 и называется постоянной Авогадро или числом Авогадро (NА).
Например, в трёх моль атомов углерода будет содержится
3 × 6,02 × 10 23 = 18,06 × 10 23 атомов
Применяя понятие «моль», необходимо в каждом конкретном случае точно указать, какие именно структурные единицы имеются в виду. Например, следует различать моль атомов водорода Н, моль молекул водорода Н2, моль ионов водорода или Один моль частиц имеет определенную массу.
Молярная масса – это масса одного моля вещества. Обозначается буквой М.
Молярная масса численно равна относительной молекулярной массе и имеет единицы измерения г/моль или кг/моль.
Масса и количество вещества – понятие разные. Масса выражается в кг (г), а количество вещества – в молях. Между массой вещества (m, г), количеством вещества (n, моль) и молярной массой (М, г/моль) существуют соотношения:
n = , г/моль; М = , г/моль; m = n × M, г.
По этим формулам легко вычислить массу определенного количества вещества, молярную массу вещества или количества вещества.
Пример 1. Чему равна масса 2 моль атомов железа?
Решение: Атомная масса железа равна 56 а.е.м. (округленно), следовательно, 1 моль атомов железа весит 56 г, а 2 моль атомов железа имеют массу 56×2 =112 г
Пример 2. Сколько моль гидроксида калия содержится в 560 г КОН?
Решение:Молекулярная масса КОН равна 56 а.е.м. Молярная = 56 г/моль. В 560 г гидроксида калия содержится: 10 моль КОН. Для газообразных веществ существует понятие молярный объём Vm. Согласно закону Авогадро моль любого газа при нормальных условиях (давление 101,325 кПа и температуре 273К) занимает объем 22,4 л. Эта величина называется молярным объемом (его занимают 2 г водорода (Н2), 32 г кислорода (О2) и т.д.
Пример 3. Определить массу 1 л оксида углерода (ΙV) при нормальных условиях (н. у.).
Решение: Молекулярная масса СО2 равна М = 44 а.е.м., следовательно, молярная масса равна 44 г/моль. По закону Авогадро один моль СО2 при н.у. занимает объем 22,4 л. Отсюда масса 1 л СО2 (н. у.) равна г.
Пример 4. Определить объём, занимаемый 3,4 г сероводорода (Н2S) при нормальных условиях (н.у.).
Решение: Молярная масса сероводорода равна 34 г/моль. Исходя из этого, можно записать: 34 г Н2S при н.у. занимает объем 22,4 л.
3,4 г ________________________ Х л,
отсюда Х = л.
Пример 5. Сколько молекул аммиака содержится:
а) в 1 л б) в 1 г ?
Решение: Число Авогадро 6,02 × 10 23 указывает на количество молекул в 1 моле (17 г/моль) или в 22,4 л при н.у., следовательно, в 1 л содержится
6,02 × 10 23 × 1 = 2,7 × 10 22 молекул.
Число молекул аммиака в 1 г находим из пропорции:
17 г содержат 6,02 × 10 23 атомов
1 г Х,
отсюда Х =6,02 × 10 23 × 1 = 3,5 × 10 22 молекул.
Пример 6.Какова масса 1 моль воды?
Решение: Молекулярная масса воды H2O равна 18 а.е.м. (атомная масса водорода – 1, кислорода – 16, итого 1 + 1 + 16 = 18). Значит, один моль воды равен по массе 18 граммов, и эта масса воды содержит 6,02 × 10 23 молекул воды.
Количественно масса 1 моль вещества – масса вещества в граммах, численно равная его атомной или молекулярной массе.
Например, масса 1 моля серной кислоты H2SO4 равна 98 г
(1 +1 + 32 + 16 + 16 + 16 + 16 = 98),
а масса одной молекулы H2SO4 равна 98 г = 16,28 × 10 -23 г
Таким образом, любое химическое соединение характеризуется массой одного моля или мольной (молярной) массой М, выражаемой в г/моль (М(H2O) = 18 г/моль, а М(H2SO4) = 98 г/моль).
Дата добавления: 2014-11-25 ; Просмотров: 2789 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Атомно — молекулярное учение.
1. Все вещества состоят из молекул. Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 117 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро — центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра — положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы — химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Аллотропия — явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Химические формулы
Любое вещество может быть охарактеризовано качественным и количественным составом. Под качественным составом понимают набор химических элементов, образующих вещество, под количественным, в общем случае, соотношение между числом атомов этих элементов. Атомы, образующие молекулу, соединяются между собой в определенной последовательности, эта последовательность называется химическим строением вещества (молекулы).
Состав и строение молекулы может быть изображено с помощью химических формул. Качественный состав записывается в виде символов химических элементов, количественный – в виде подстрочных индексов у символа каждого элемента. Например: С6Н12О6.
Химическая формула — это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс — цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Химические формулы бывают следующих видов:
а) молекулярные – показывают сколько атомов элементов входят в состав молекулы вещества, например Н2О – одна молекула воды содержит два атома водорода и один атом кислорода.
б) графические – показывают в каком порядке связаны атомы в молекуле, каждая связь изображается черточкой, для предыдущего примера графическая формула будет выглядеть так: Н—О—Н
в) структурные – показывают взаимное расположения в пространстве и расстояния между атомами, входящими в состав молекулы.
Необходимо иметь в виду, что однозначно идентифицировать вещество позволяют только структурные формулы, молекулярные или графические формулы могут соответствовать нескольким или даже многим веществам (особенно в органической химии).
Международная единица атомных масс равна 1/12 массы изотопа 12C — основного изотопа природного углерода.
1 а.е.м = 1/12 m (12C) = 1,66057 10 -24 г
Относительная атомная масса (Ar) — безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
m (Mg) = 24,312·1,66057 · 10 -24 = 4,037 · 10 -23 г
Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mr = mг / (1/12 mа(12C))
mr — масса молекулы данного вещества;
mа(12C) — масса атома углерода 12C.
Mr = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr (KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) == 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = = 258
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м. Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения — моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль — количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 · 10 23 . (Постоянная Авогадро имеет размерность — моль -1 ).
Сколько молекул содержится в 6,4 г серы?
Молекулярная масса серы равна 32 г /моль. Определяем количество г/моль вещества в 6,4 г серы:
n(s) = m(s) / M(s) = 6,4г / 32 г/моль = 0,2 моль
Определим число структурных единиц (молекул), используя постоянную Авогадро NA
N(s) = n(s) · NA = 0,2· 6,02· 1023 = 1,2· 1023
Молярная масса показывает массу 1 моля вещества (обозначается M).
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
Молярная масса вещества численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая — безразмерная.
M = NА · m(1 молекула) = NА · Mг · 1 а.е.м. = (NА · 1 а.е.м.) · Mr = Mr
Это означает, что если масса некоторой молекулы равна, например, 80 а.е.м. (SO3), то масса одного моля молекул равна 80 г. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных соотношений к молярным. Все утверждения относительно молекул остаются справедливыми для молей (при замене, в случае необходимости, а.е.м. на г) Например, уравнение реакции: 2Na + Cl2
Вещество это с точки зрения атомно молекулярной теории
Известно, что химия изучает вещества и их свойства. Для того чтобы объяснить почему то или иное вещество вступает или не вступает в химические процессы, нужно заглянуть внутрь его. Но атомы и молекулы, из которых состоят вещества, нельзя увидеть даже с помощью мощного микроскопа. Из материалов урока вы узнаете, как ученые-химики познавали и познают микромир.
1. Роль и место метода моделирования в химии
Основной метод познания в химии — моделирование.
Моделирование – это один из способов познания реального мира, при котором представления об изучаемом объекте строятся не путем непосредственного наблюдения, а по косвенным данным.
Модель может быть выполнена из какого-либо материала (т.е. быть реальной), а может существовать только в нашем воображении. Первоначально созданная модель может перестраиваться или вовсе заменяться другой моделью при встрече с противоречащими данной модели фактами.
Запомните, что природа гораздо разнообразнее, чем любая, даже самая хорошая, теоретическая модель. Поэтому все разрабатываемые теоретические модели постоянно приходится совершенствовать.
- Моделирование – основано на изучении моделированного объекта. Модель строится по подобию оригинала, на ней воспроизводят, свойственные оригиналу процессы и полученные сведения переносятся на моделируемый объект – оригинал.
Различают несколько видов моделирования:
- Мысленное. К нему относятся самые различные мыслительные представления в форме тех или иных воображаемых моделей.
- Физическое. Оно характеризуется физическим подобием между моделью и оригиналом.
- Символическое – связано с построением графиков, схем.
Моделирование как метод познания бывает единственно необходимым для исследования некоторых явлений.
Таким образом, все названные методы научного познания являются важными и необходимыми для познания окружающего мира.
2. Сущность теоретического моделирования
Так как же зарождались первые модели веществ и химических реакций? Еще во времена Античности ученых интересовал вопрос: «Можно ли из одного вещества получить какое угодно другое вещество?».
Древнегреческий философ Аристотель предположил, что основу всего составляют 4 стихии: огонь, вода, воздух и земля. Эти стихии находятся во взаимосвязи и взаимодействии.
Рис. 1. Теория «4 стихий» Аристотеля
Аристотель считал огонь, воду, воздух и землю неделимыми элементами, которые могут превращаться друг в друга, а также соединяться друг с другом, образуя новые тела. Соединение элементов с противоположными свойствами считалось невозможным: огонь не может соединиться с водой, а воздух с землей.
Предположение Аристотеля было очевидным, поэтому его представления владели умами более тысячи лет. Например, мы знаем, что вода не горит. В соответствие с данной моделью Аристотель считал, что из одного вещества можно получить любое другое вещество. Главное – подобрать условия его превращения.
3. Модельные представления Аристотеля и Демокрита
Другая модель строения вещества была предложена еще одним древнегреческим ученым Демокритом.
Рис. 2. Древнегреческий философ Демокрит
Он считал, что вещества состоят из неделимых частиц – атомов. Атомы отличаются формой и размером. Благодаря особенностям своей формы и размера атомы могут соединяться, образуя вещества.
В соответствии с моделью Демокрита, из одного вещества нельзя получить какое угодно другое вещество. Но учение об атомах было неочевидным, поэтому модель Демокрита была забыта вплоть до 17 в.
4. Основные положения атомно-молекулярной теории
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
Основные положения атомно-молекулярного учения можно сформулировать так:
- Существуют вещества с молекулярным и немолекулярным строением.
- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
- Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
- Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
- Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
- Атомы одного вида отличаются от атомов другого вида массой и свойствами.
- При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
- У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
- У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
АТОМНО-МОЛЕКУЛЯРНАЯ ТЕОРИЯ
Закон сохранения массы веществ
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов
*Атомно-молекулярное учение этот закон объясняет следующим образом: в результатехимических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е.химическое превращение- это процесс разрыва одних связей между атомами и образование
других, в результате чего из молекул исходных веществ получаются молекулы продуктовреакции). Поскольку число атомов до и после реакции остается неизменным, то их общая массатакже изменяться не должна. Под массой понимали величину, характеризующую количество
Исходя из закона сохранения массы, можно составлять уравнения химических реакций ипо ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава
Все индивидуальные химические вещества имеют постоянный качественный и
количественный состав и определенное химическое строение, независимо от способаполучения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы
соединяются друг с другом в определенных массовых соотношениях.
Закон Авогадро ди Кваренья (1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление ит.д.) содержится одинаковое число молекул. (Закон справедлив только для газообразныхвеществ.)
1. Одно и то же число молекул различных газов при одинаковых условиях занимает
2. При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает
Закон действующих масс
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Закон сохранения энергии: энергия изолированной системы (не обменивающейся с окружающей средой ни веществом, ни энергией) остается постоянной, возможны лишь переходы ее из одного вида в другой.
Закон сохранения электрического заряда: алгебраическая сумма электрических зарядов в изолированной системе сохраняется.
2. Основной закон химии как частный случай общего закона материального мира. Понятия: материя, вещество, поле, движение — и их количественные характеристики и взаимосвязь. Математические выражения законов сохранения массы и энергии.
Закон действующих масс
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Материя существует в форме вещества и поля. Химия изучает окружающий нас мир объединяемым понятием материи существующей вне и независимо от сознания человека.
вещество — это любая совокупность атомов и молекул
Закон сохранения массы: масса веществ, вступивших в реакцию равна массе веществ, образовавшихся в результате реакции.
* Полностью эквивалентна этой и другая формулировка: в химической реакции число атомов химического элемента сохраняется.Последняя формулировка является основой для написания стехиометрических уравнений реакций.
Закон сохранения энергии: энергия изолированной системы (не обменивающейся с окружающей средой ни веществом, ни энергией) остается постоянной, возможны лишь переходы ее из одного вида в другой.
3. Атомно-молекулярное учение: современные положения, краткая история (основоположники).
АТОМНО-МОЛЕКУЛЯРНАЯ ТЕОРИЯ
Атомно-молекулярное учение — учение о строении веществ из атомов и молекул, создано трудами Ломоносова и Дальтона.
*В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров.
Состав и свойства химического соединения не зависит от способа и условий его получения.
Все молекулы состоят из атомов. Совокупность или набор атомов одного вида называют химическим элементом.
Атомно-молекулярная теория основные положения:
Все вещества состоят из атомов
Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
4. Основные понятияхимии: атом, молекула, химический элемент, вещество (простое и сложное). Количественные характеристики атома и молекулы: размеры, абсолютная и относительная атомная и молекулярная массы, атомная единица массы (а.е.м.).
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и одного или нескольких электронов.
Молекула — наименьшая частица вещества, обладающая всеми химическими свойствами данного вещества. Для некоторых веществ понятия атома и молекулы совпадают.
Химический элемент — вид атомов, характеризующихся определенным зарядом ядра.
Простым веществом называется вещество, молекулы которого состоят из атомов одного элемента,
Соединениями или сложными веществами называются вещества, молекулы которых состоят из атомов разных элементов
Молекулы различных веществ отличаются друг от друга массой, размерами и химическими свойствами. Все молекулы одного вещества одинаковы.
Молекулы состоят из более мелких частиц — атомов. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ состоят из разных атомов.
Атомы одного элемента отличаются от атомов других элементов зарядом атомного ядра, размером и химическими свойствами. При химических реакциях изменяется состав молекулы. Атомы при химических реакциях не разрушаются.
Международная единица атомных масс равна 1/12 массы изотопа 12C — основного изотопаприродного углерода.
Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколькораз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
5. Расчет количества, молярной массы и молярного объема вещества. Число Авогадро.
Молярная масса вещества М равна отношению массы вещества к его количеству
и имеет принятую в химии размерность г/моль. Молярная масса вещества, выраженная в г/моль численно равна его относительной молекулярной массе. Численное равенство означает совпадение числовых значений величин, но не их размерностей.
Аналогично определяется и молярный объем как отношение объема вещества к его количеству:
Молярный объем может иметь размерность м3/моль, л/моль, см3/моль. Молярный объем определен для любого агрегатного состояния вещества и связан с его молярной массой через плотность :
Закон Авогардо: в равных объемах различных газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул.
NA = 6,022 141 29(27)·10 23 моль−1
6. Химический элемент, символы элементов. Химическая формула вещества, вид формулы: эмпирическая, молекулярная, графическая. Понятия: валентность (стехиометрическая, связевая, координационная) и степень окисления химического элемента. Примеры.
Химический элемент — вид атомов, характеризующихся определенным зарядом ядра.
Молекулярная (брутто-) формула, показывающая число атомов в молекуле — C6H14,
Эмпирическая формуладающая только соотношение элементов C:H = 3:7 — C3H7
Валентность — свойство атомов данного элемента присоединить или замещать в молекуле определенное число атомов других элементов. За единицу валентности принята валентность водорода.
Степенью окисления атома называется величина электростатического заряда атома в простом веществе, в молекуле химического соединения, в ионе
7. Понятия и количественное определение массовой, мольной и объемной долей элемента в молекуле вещества и вещества в смеси. Алгоритм установления эмпирической и молекулярной формул.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
,
m1 — масса растворённого вещества, г;
m — общая масса раствора, г .
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
,
V1 — объём растворённого вещества, л;
V — общий объём раствора, л.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
νi — количество i-го компонента, моль;
n — число компонентов;
Титр раствора — масса растворённого вещества в 1 мл раствора.
,
m1 — масса растворённого вещества, г;
V — общий объём раствора, мл;
Эмпирическая формула химического соединения — запись простейшего выражения относительного числа каждого типа атомов в нём; представляет собой линейную запись из символов химических элементов, сопровождающуюся подстрочными индексами, указывающими отношение элементов в соединении[1.
Эмпирическая формула не содержит информации ни о структуре, ни о изомерии, ни о числе атомов в молекуле. Эмпирическая (от греч. εμπειρια — опыт) означает, что определение элементного состава производится при помощи количественного анализа. Например, в случае н-гексана рациональная (линейная) формула, отражающая структуру соединения имеет вид CH3CH2CH2CH2CH2CH3, молекулярная (брутто-) формула, показывающая число атомов в молекуле — C6H14, в то время как эмпирическая формула, дающая только соотношение элементов C:H = 3:7 — C3H7
8. Стехиометрия: предмет изучения, основные законы (перечислить). Закон эквивалентов. Понятия: эквивалент, число и фактор эквивалентности, молярная масса эквивалента вещества.
Раздел химии, изучающий количественные соотношения между реагирующими и образующимися веществами называется стехиометрией. Стехиометрия основывается на законе сохранения массы.
Схема реакции, для которой обеспечено выполнение закона сохранения массы, называется стехиометрическим уравнением реакции. Это выполнение достигается расстановкой коэффициентов, которые называются стехиометрическими коэффициентами.
Например: Н2 + О2 Н2О — это схема реакции (закон сохранения массы еще не выполняется). Расстановкой коэффициентов добиваются равенства числа атомов каждого химического элемента в левой и правой частях:
Теперь это стехиометрическое уравнение, которое показывает соотношение между количествами реагирующих и образующихся веществ. Следует иметь в виду, что в химии соизмеримы только количества веществ (и несоизмеримы в общем случае ни массы, ни объемы). Важнейшим свойством стехиометрических коэффициентов является то, что их можно одновременно умножать и делить на одно и то же число, при этом смысл стехиометрического уравнения не меняется.
Количества веществ, отвечающие стехиометрическому уравнению, называются стехиометрическими. Например, для приведенного выше уравнения стехиометрическими количествами будет 2 моль водорода, 1 моль кислорода и 2 моль воды, или 0,4 моль водорода, 0,2 моль кислорода и 0,4 моль воды, и, вообще говоряV моль водорода, 0,5V моль кислорода и V моль воды. В общем виде уравнение любой химической реакции можно записать в виде:
где строчные буквы обозначают стехиометрические коэффициенты, а заглавные – формулы веществ. При этом, если, например известно количество вещества А, количество вещества С может быть рaссчитно по формуле:
Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные соотношения между реагирующими веществами. Исключительное значение для развития химии имело установление основных стехиометрических законов.
1. Закон сохранения массы веществ (М. В. Ломоносов, 1748-1756 гг., А. Лавуазье, 1777 г.).
Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции.
Закон сохранения массы веществ может быть объяснен с точки зрения атомно-молекулярного учения так: при химических реакциях атомы не исчезают и не могут возникать из ничего; общее число атомов остается постоянным до и после реакции. Например, при взаимодействии двухатомных молекул водорода и хлора должно образоваться столько молекул НС1, чтобы число атомов водорода и хлора оставалось равным двум, т.е. две молекулы:
И поскольку атомы имеют постоянную массу, не меняется и масса веществ до и после реакции.
Закон сохранения массы веществ М. В. Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как всеобщий закон природы.
Таким образом, законы сохранения массы веществ и сохранения энергии — это две стороны единого закона природы — закона вечности материи и ее движения.
Взаимосвязь массы и энергии (она рассматривается в физике) выражают уравнением Эйнштейна:
где E — энергия; m — масса; c — скорость света в вакууме.
Закон сохранения массы веществ дает материальную основу для составления уравнений химических реакций. Опираясь на него, можно проводить расчеты по химическим уравнениям.
2. Закон постоянства состава вещества (Ж. Л. Пруст, 1808 г.).
Каждое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Например, воду можно получить по любой из следующих реакций:
*Химически чистая вода содержит 11,19% водорода и 88,81% кислорода, независимо от способа ее получения, то есть на один атом кислорода приходится два атома водорода. Иной состав свидетельствует либо о наличии примесей, либо о том, что это другое вещество (например, Н2О2).
Ж. Пруст писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании».
В этой формулировке закона, как и в приведенном выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Эквивалентная молярная масса вещества [править]
Молярная масса эквивалентов обычно обозначается как или . Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как ).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Фактор эквивалентности [править]
Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как ).
Число эквивалентности [править]
Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности связан с числом эквивалентности z следующим соотношением: =1/z.
Например, в реакции:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Эквивалентом является частица ½Zn(OH)2. Число ½ есть фактор эквивалентности, z в данном случае равно 2
9. Химическая реакция: определение, признаки, отличие от физических явлений, классификации.
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Классификация
По изменению степеней окисления реагентов[править]
В данном случае различают
Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления.
Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
NH4NO3 = N2O + 2H2O (до 250 °C)
Не окислительно-восстановительные реакции — соответственно, реакции, в которых не происходит изменения степеней окисления атомов, например, указанная выше реакция нейтрализации.
По тепловому эффекту реакции[править]
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, указанное выше горение водорода
эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды.
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH 0) — поглощение.
По типу превращений реагирующих частиц[править]
обмена (тип реакции-нейтрализация):
обмена (тип реакции-обмена):
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
10.Схема и уравнение химической реакции (алгоритм записи уравнения). Физический смысл стехиометрических коэффициентов. Типы уравнения: полное, неполное, молекулярное, ионное, термохимическое. Привести примеры.
При химических реакциях одни вещества превращаются в другие. Вспомним известную нам реакцию серы с кислородом. И в ней из одних веществ (исходных веществ или реагентов) образуются другие (конечные вещества или продукты реакции).
Для записи и передачи информации о химических реакциях используются схемы и уравнения реакций.
Схема химической реакции – условная запись,дающая качественнуюинформацию о химической реакции.
Схема реакции показывает, какие вещества вступают в реакцию и какие образуются в результате реакции. И в схемах, и в уравнениях реакций вещества обозначаются их формулами.
Схема горения серы записывается так: S8 + O2 SO2.
Это означает, что при взаимодействии серы с кислородом протекает химическая реакция, в результате которой образуется диоксид серы (сернистый газ). Все вещества здесь молекулярные, поэтому при записи схемы использованы молекулярные формулы этих веществ. То же относится и к схеме другой реакции – реакции горения белого фосфора:
При нагревании до 900 oС карбоната кальция (мела, известняка) протекает химическая реакция: карбонат кальция превращается в оксид кальция (негашеную известь) и диоксид углерода (углекислый газ) по схеме:
Для указания на то, что процесс происходит при нагревании, схему (и уравнение) обычно дополняют знаком » t» , а то, что углекислый газ при этом улетучивается, обозначают стрелкой, направленной вверх:
Карбонат кальция и оксид кальция – вещества немолекулярные, поэтому в схеме использованы их простейшие формулы, отражающие состав их формульных единиц. Для молекулярного вещества – углекислого газа – использована молекулярная формула.
Рассмотрим схему реакции, протекающей при взаимодействия пентахлорида фосфора с водой: PCl5 +H2O H3PO4 + HCl.
Из схемы видно, что при этом образуется фосфорная кислота и хлороводород.
Иногда для передачи информации о химической реакции бывает достаточно и краткой схемы этой реакции, например:
S8 SO2; P4 P4O10; CaCO3 CaO.
Естественно, что краткой схеме может соответствовать и несколько разных реакций.
Уравнение химической реакции – условная запись, дающая качественную и количественную информацию о химической реакции.
Для любой химической реакции справедлив один из важнейших законов химии:
При протекании химических реакций атомы не появляются, не исчезают и не превращаются друг в друга.
При записи уравнений химических реакций, кроме формул веществ, используются коэффициенты. Как и в алгебре, коэффициент «1» в уравнении химической реакции не ставится, но подразумевается. Рассмотренные нами реакции описываются следующими уравнениями:
1S8 + 8O2 = 8SO2, или S8 + 8O2 = 8SO2;
1P4 + 5O2 = 1P4O10, или P4 + 5O2 = P4O10;
1CaCO3 = 1CaO + 1CO2, или CaCO3 = CaO + CO2;
1PCl5 + 4H2O = 1H3PO4 + 5HCl, или PCI5 + 4H2O = H3PO4 + 5HCI.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 7702 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
- http://studopedia.su/12_128145_osnovnie-polozheniya-atomno-molekulyarnoy-teorii.html
- http://studfiles.net/preview/5188069/page:2/
- http://kardaeva.ru/88-dlya-uchenika/8-klass/106-8klass-1-3
- http://studopedia.ru/19_369775_atomno-molekulyarnaya-teoriya.html