Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название галогены. Обозначение – Cl. Порядковый номер – 17. Относительная атомная масса – 35,453 а.е.м.
Электронное строение атома хлора
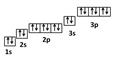
Атом хлора состоит из положительно заряженного ядра (+17), состоящего из 17 протонов и 18 нейтронов, вокруг которого по 3-м орбитам движутся 17 электронов.
Рис.1. Схематическое строение атома хлора.
Распределение электронов по орбиталям выглядит следующим образом:
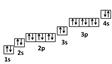
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие одного неспаренного электрона свидетельствует о том, что хлор способен проявлять степень окисления +1. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d-орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d-орбитали, а после – электроны 3s-подуровня:
Этим объясняется наличие у хлора ещё трех степеней окисления: +3, +5 и +7.
Примеры решения задач
| Задание | Даны два элемента с зарядами ядер Z=17 и Z=18. Простое вещество, образованное первым элементом, — ядовитый газ с резким запахом, а вторым – не ядовитый, лишенный запаха, не поддерживающий дыхания газ. Напишите электронные формулы атомов обоих элементов. Какой из них образует ядовитый газ? |
| Решение | Электронные формулы заданных элементов будут записываться следующим образом: |
Заряд ядра атома химического элемента равен его порядковому номеру в Периодической таблице. Следовательно, это хлор и аргон. Два атома хлора образуют молекулу простого вещества – Cl2, которое представляет собой ядовитый газ с резким запахом
| Задание | Назовите элементы, в атомах которых распределение электронов по энергетическим уровням в основном состоянии соответствует рядам чисел: а) 2,8,7; б) 2,8,8,1; в) 2,8,13,1; г)2,8,18,1. Какие из них относятся к одной группе? Какие находятся в одном периоде? |
| Ответ | Определить положение химического элемента в Периодической таблице можно сложив все электроны, имеющиеся в атоме, не учитывая их распределения по энергетическим уровням: |
а) 2+8+7 =17. Это хлор.
б) 2+8+8+1 =19. Это калий.
в) 2+8+13+1 = 24. Это хром.
г) 2+8+18+1 = 29. Это медь.
В одной группе –первой, но разных подгруппах расположены калий и медь. Калий и хром находятся в одном периоде – четвертом.
валентные возможности хлора
1s2 2s2 2p6 3s2 3p5
Валентные электроны: 3s2 3p5
В невозбужденном состоянии у атома хлора на 3 энергетическом уровне находится один неспаренный электрон, следовательно невозбужденный атом хлора может проявлять валентность 1. Валентность 1 проявляется в следующих соединениях:
— газообразный хлор Cl2 (или Сl-Cl)
— хлорид натрия NaCl (или Na+ Cl-)
— хлороводород HCl (или H-Cl)
— хлорноватистая кислота HOCl (или H-O-Cl)
В возбужденном сотоянии:
1 )
3s2 3p5 3d0 + hn —> 3s2 3p4 3d1
3 неспаренных электрона (2 электрона на 3р-подуровне и 1 электрон на 3d-подуровне) , следовательно валентность равна 3
Пример соединения: HClO2, Cl2O3
2 )
3s2 3p4 3d1 + hn —> 3s2 3p3 3d2
5 неспаренных электронов (3 электрона на 3р-подуровне и 2 электрона на 3d-подуровне) , следовательно валентность равна 5
Пример соединения: HClO3, Cl2O5
Валентные возможности атома хлора с точки зрения его электронного строения
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Валентные возможности атомов химических элементов
Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев.
Для того чтобы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного (основного, или стационарного) состояния атома и для возбужденного (то есть получившего дополнительную энергию, в результате чего происходит распаривание электронов внешнего слоя и переход их на свободные орбитали). Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:
В невозбужденном состоянии атом фосфора имеет три не-спаренных электрона на р-подуровне. При переходе атома в возбужденное состояние один из пары электронов d-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).
Разъединение спаренных электронов требует затрат энергии, так как спаривание электронов сопровождается понижением потенциальной энергии атомов. Вместе с тем расход энергии на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химических связей неспаренными электронами.
Так, атом углерода в стационарном состоянии имеет два неспаренных электрона. Следовательно, с их участием могут образоваться две общие электронные пары, осуществляющие две ковалентные связи. Однако вам хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии.
Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s 2 2р 2 в возбужденное — 2s 1 2р 3 требуется затратить около 400 кДж/моль энергии. Но при образовании С—Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С—Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.
В заключение следует отметить, что валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов. Если вы вспомните донорно-ак-цепторный механизм образования ковалентных связей, то вам станут понятны и две другие валентные возможности атомов химических элементов, которые определяются наличием свободных орбиталей и наличием неподеленных электронных пар, способных дать ковалентную химическую связь по донор-но-акцепторному механизму. Вспомните образование иона аммония NH4+. (Более подробно мы рассмотрим реализацию этих валентных возможностей атомами химических элементов при изучении химической связи.)
Сделаем общий вывод.
Валентные возможности атомов химических элементов определяются: 1) числом неспаренных электронов (одноэлектронных орбиталей); 2) наличием свободных орбиталей; 3) наличием неподеленных пар электронов.
1. Какими тремя факторами определяются валентные возможности атомов химических элементов?
2. Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?
3. Вспомните, чем отличаются понятия валентности и степени окисления. Что между ними общего?
4. Укажите валентность и степень окисления атомов азота в ионе аммония NH4+.
5. Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2.
6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Н202, ОF2, 02F2.
7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.
акселеративные методы по химии 11 класса, дискуссионные вопросы по химии, приколы и анекдоты к урокам
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Рассмотрите валентные возможности атомов хлора и фтора с точки зрения метода валентных связей.
ХИМИЯ
студент группы З2Б6С1 Гареев З.З. 31.01.2017
преподаватель Абрамова П.В.
| 4, 25, 40, 55, 75, 90, 110, 125, 152, 160, 173, 189, 198, 213, 228, 243, 258, 283, 298, 313. |
4. Сколько атомов в молекуле серы при 500 0 С и при 1160 0 С, если плотность паров серы по воздуху при этих температурах соответственно равна 6,55 и 2,2?


При температуре 500 0 С:
M(SN) = 6,55∙28 = 183,4 г/моль
При температуре 1160 0 С:
25. Составьте уравнения реакций взаимодействия с водой следующих оксидов: Na2O, SO3, CaO, P2O5. К какому классу соединений относятся полученные вещества? Назовите их.
Na2O + H2O →2NaOH (гидроксид натрия, класс – основания)
CaO + H2O → Сa(OH)2 (гидроксид кальция, класс – основания)
40. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ba(OH)2 → BaO + H2O (Реакция протекает при температуре 780-800 0 C)
55. Назовите элементы, имеющие по одному электрону на подуровне: а) 3d; б) 4p; в) 2s. Напишите электронные формулы атомов этих элементов, укажите их порядковые номера.
21Sc 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2
31Ga 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1
75. Составьте электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей: Ca +2 , C +4
20Ca 0 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
Ca 2+ 1s 2 2s 2 2p 6 3s 2 3p 6
(ушли 2 внешних электрона – 18е, конфигурация инертного газа аргона)
С 4+ 1s 2
90. Элементы подгрупп 1 группы резко различаются по химическим свойствам. Чем это можно объяснить?
Первая группа состоит из главной (щелочные металлы) и побочной (подгруппа меди) подгрупп, резко различающихся по свойствам входящих в них элементов.
Подгруппа меди характеризуется наличием переменной валентности у элементов вследствие незаполненности d-оболочки: так, например, медь обычно двухвалентна (реже- одновалентна), серебро – одновалентно (реже – двухвалентно) и золото – трехвалентно (реже одновалентно). Заметно различаются и ионные радиусы элементов этой группы. Так, для однозарядных ионов характерны следующие величины:
Элемент Cu + Ag + Au +
Ионный радиус 0,98 1,13 1,37
Малый радиус атомов объясняет также более высокие значения энергии ионизации металлов этой подгруппы, чем щелочных металлов. Это приводит к большим различиям в химических свойствах металлов обеих подгрупп. Элементы подгруппы меди — малоактивные металлы. Они с трудом окисляются, и, наоборот, их ионы легко восстанавливаются они не разлагают воду, гидроксиды их являются сравнительно слабыми основаниями, в ряду напряжений они стоят после водорода.
Иначе обстоит дело со щелочными металлами. Элементы подгруппы щелочных металлов, включающей литий, натрий, калий, рубидий и цезий (франций встречается лишь в продуктах ядерных реакций и в обычных химических процессах редко сопровождает остальные элементы рассматриваемой группы) в водных растворах практически всех неорганических соединений присутствуют в форме однозарядных катионов. Их ионные радиусы закономерно и в заметной степени возрастают по мере увеличения порядкового номера элемента.
Строение внешних электронных оболочек атомов щелочных металлов ns 1 . Поэтому они имеют низкие энергии ионизации, уменьшающиеся при переходе по подгруппе элементов сверху вниз. При этом ослабление связн электрона с ядром вызывается ростом радиуса атома (обусловленного увеличением главного квантового числа внешнего электрона) и экранированием заряда ядра предшествующими внешнему электрону оболочками. Поэтому данные элементы легко образуют катионы Э + , имеющие конфигурацию атомов благородного газа.
Рассмотрите валентные возможности атомов хлора и фтора с точки зрения метода валентных связей.
Оба элемента F и Cl расположены в VIIА группе, являются электронными аналогами и имеют строение внешнего энергетического уровня ns 2 np 5 . Но у атома фтора внешним является второй энергетический уровень, имеющий только 2 подуровня: s- и p-, в то время как внешние электроны атома хлора занимают третий энергетический уровень, содержащий подуровень d-:
Валентность обоих элементов, определяемая числом неспаренных электронов, в невозбужденных атомах равна 1. Но при возбуждении электроны атома хлора могут переходить на свободные 3d-орбитали, и соответственно валентность данного элемента может быть равна 3,5,7:
125. Определите пространственную конфигурацию и тип гибридизации атомных орбиталей центрального атома в молекулах BeBr2 и POCl3. Ответ поясните.
Для объяснения формы молекул в методе ВС необходимо определить тип гибридизации АО центрального атома. При переходе атома Be из основного состояния в возбужденное электрон с 2s- АО перемещается на незанятую 2p-АО:
В возбужденном состоянии атом бериллия имеет два неспаренных электрона, с которыми атомы фтора образуют две связи по обменному механизму. Гибридизации подвергается АО валентного уровня центрального атома (то есть атома Be), имеющие электроны. У атома бериллия это одна s-АО и одна p-АО, поэтому тип гибридизации – sp.Этому типу гибридизации соответствует валентный угол 180 0 С, вследствие чего молекула BeBr2 линейна.
В молекуле POCl3 (оксихлорида) центральным атомом является атом фосфора P, электронная конфигурация которого в основном состоянии такова: [Ne]3s 2 3p 3 . его 5 электронов внешнего уровня занимают 4 орбитали, гибридизация sp 3 , все 4 орбитали примут участие в образовании химической связи (4 вал. пары). Поэтому у POCl3 тетраэдральная форма молекулы.
Структура POCl3 – искаженный тетраэдр.
152. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии газообразного этилена С2Н4 и водяных паров. Напишите термохимическое уравнение реакции.
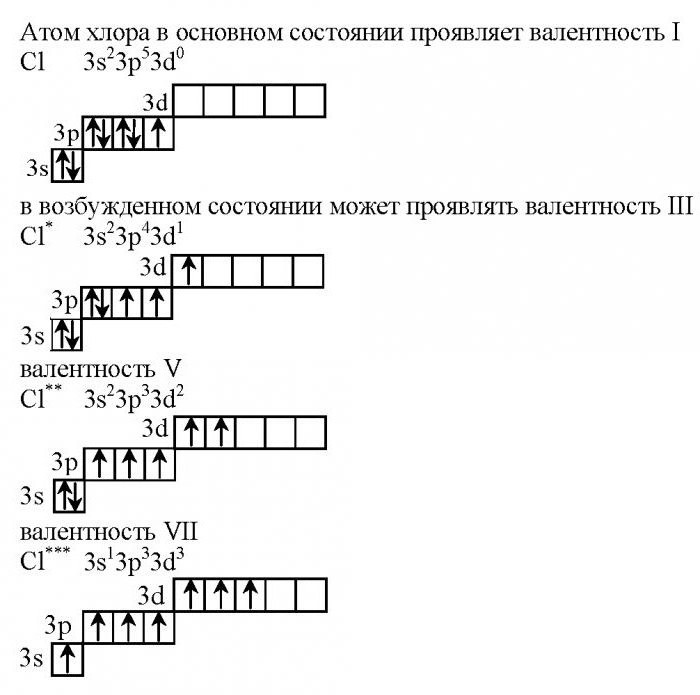
Определить валентные возможности атома хлора.
Октавия111
Заряд ядра атома + 17
Количество протонов 17
Количество электронов 17
Электронная формула 1s2 2s2 2p6 3s2 3p5
Валентные электроны: 3s2 3p5
В невозбужденном состоянии у атома хлора на 3 энергетическом уровне находится один неспаренный электрон, следовательно невозбужденный атом хлора может проявлять
— газообразный хлор Cl2 (или Сl-Cl)
— хлорид натрия NaCl (или Na+ Cl-)
— хлороводород HCl (или H-Cl)
— хлорноватистая кислота HOCl (или H-O-Cl)
В возбужденном состоянии:
3s2 3p5 3d0 + hn —> 3s2 3p4 3d1
3 неспаренных электрона (2 электрона на 3р-подуровне и 1 электрон на 3d-подуровне),
Пример соединения: HClO2, Cl2O3
3s2 3p4 3d1 + hn —> 3s2 3p3 3d2
5 неспаренных электронов (3 электрона на 3р-подуровне и 2 электрона на 3d-подуровне)
Пример соединения: HClO3, Cl2O5
3s2 3p3 3d2 + hn —> 3s1 3p3 3d3
7 неспаренных электронов (1 электрон на 3s-подуровне, 3 электрона на 3р-подуровне и 3 электрона на 3d-подуровне),
Хлор: валентность, химические свойства
Валентность определяет способность хлора присоединять к себе атомы других химических элементов.
Хлор, валентность которого имеет различные значения, располагается в седьмой группе, в главной подгруппе таблицы элементов. Выясним особенности строения атома этого галогена.
Хлор в нормальном состоянии
Валентность атомов хлора определяется особенностями строения его внешнего уровня. Данный элемент находится в 7(А) группе, имеет семнадцатый порядковый номер. Учитывая, что элемент является представителем четвертого периода, он имеет не только s-, p-, но и d-орбитали.
Электронная конфигурация атома
Какую электронную формулу имеет хлор? Валентность связана с особенностями внешнего энергетического уровня, поэтому запишем конфигурацию данного элемента.
В невозбужденном состоянии на первом уровне у хлора располагаются всего два электрона, второй занимают восемь, на третьем уровне их 10 штук. Отметим, что на последнем уровне есть незаполненная d-орбиталь, которая и характеризует валентные возможности данного галогена.
- 1s22s22p63s23p53d0.
В данном случае валентность хлора равна I. Это характерно при взаимодействии с металлами (образуются хлориды). Высшую валентность VII хлор имеет в соединениях с неметаллами, например, в оксиде хлора (7), а также в хлорной кислоте.
Приведем в качестве примеров формулы соединений хлора, в которых он проявляет такую валентность: HClO4, Cl2O7.
Последний электронный уровень называют в неорганической химии валентным, так как именно он объясняет способность элемента вступать в химические взаимодействия с другими атомами.
Возбужденное состояние
Как ведет себя при нагревании хлор? Валентность его будет меняться в том случае, если атом будет находиться в возбужденном состоянии.
Учитывая тот факт, что у каждого энергетического уровня есть определенный запас энергии, электроны двух первых уровней не изменяют своего первоначального положения. Наблюдается переход одного p-электрона с 3p энергетического уровня на 3d-подуровень. Как будет при этом менять свое участие в химических реакциях хлор? Валентность его изменится, она будет равна трем.
Рассмотрим электронную конфигурацию, которую приобретет в этом случае хлор.
Такая конфигурация не является устойчивой, поэтому соединения хлора, в которых он проявляет степень окисления +3, быстро разлагаются.
Так как на 3d-орбитали есть еще четыре свободные квантовые ячейки, возможен последующий переход электрона с 3p-подуровня, который приводит к образованию еще одной конфигурации атома хлора.
В этом случае существует пять неспаренных электронов, поэтому хлор способен проявлять валентность V, степень окисления +5.
При максимальном разогревании атома хлора происходит переход электрона с 3s-подуровня на 3d-орбиталь. В этом случае хлор имеет максимальную валентность, равную семи.
На внешнем энергетическом уровне у него располагается семь неспаренных электронов, поэтому валентность хлора в соединениях равна 7.
Распределение электронов по уровням, подуровням, их переход осуществляются в соответствии с правилом Хунда и принципом Паули.
Как в этом случае обозначается хлор? Валентность элемента принято указывать римскими цифрами, а возбужденное состояние атома отмечают звездочкой.
Заключение
Все затраты внутренней энергии, которые идут на процесс возбуждения атома хлора, полностью компенсируются той энергией, которая выделяется при образовании ковалентных связей. Это объясняет повышенную химическую активность хлора, находящегося в возбужденном состоянии. В своей максимальной степени окисления (+7) он проявляет свойства сильного окислителя.
Валентные возможности атома химического элемента не ограничиваются только количеством неспаренных электронов в стационарном и возбужденном виде. Например, при образовании связей в молекулах посредством донорно-акцепторного механизма, предполагают использование и свободных орбиталей.
Какие факторы влияют на валентные возможности атома хлора? Подводя итог, скажем, что в первую очередь необходимо отметить количество неспаренных электронов (незаполненные орбитали). Кроме того, в атоме должна быть свободная орбиталь, на которую будут при нагревании переходить электроны.
Валентные возможности атомов химических элементов
Данный урок посвящен повторению понятия «валентность» и изучению принципов определения валентных возможностей атомов химических элементов. В ходе изучения материала вы узнаете, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Валентные электроны и валентность
Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. Например, в атоме фосфора 5 валентных электронов: 
Рис. 3. Электронное строение атома углерода в основном состоянии
Во всех органических веществах и некоторых неорганических соединениях углерод четырехвалентен. Такая валентность возможна только в возбужденном состоянии атома углерода, в которое он переходит при получении дополнительной энергии.
В возбужденном состоянии в атоме углерода распариваются 2s-электроны, один из которых переходит на свободную 2р-орбиталь. Четыре неспаренных электрона могут участвовать в образовании четырех ковалентных связей. Возбужденное состояние атома принято обозначать «звездочкой» (Рис. 4).
Рис. 4. Электронное строение атома углерода в возбужденном состоянии
Валентные возможности атомов
Может ли азот иметь валентность, равную пяти – по числу его валентных электронов? Рассмотрим валентные возможности атома азота.
В атоме азота два электронных слоя, на которых расположено всего 7 электронов (Рис. 5).
7N
Рис. 5. Электронная схема строения внешнего слоя атома азота
Азот может образовать три общие электронные пары с тремя другими электронами. Пара электронов на 2s-орбитали тоже может участвовать в образовании связи, но по другому механизму – донорно-акцепторному, образуя четвертую связь.
Распаривание 2s-электронов в атоме азота невозможно, т. к. на втором электронном слое нет d-подуровня. Поэтому высшая валентность азота равна IV.
Подведение итога урока
На уроке вы научились определять валентные возможности атомов химических элементов. В ходе изучения материала вы узнали, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Список литературы
- Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§ 9)
- Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учеб. для общеобраз. учрежд.: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010. (§ 5)
- Радецкий А.М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011.
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 8)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
- Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
- с. 30 №№ 2.41, 2.43 из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008.
- Запишите электронные схемы строения атома хлора в основном и возбужденном состояниях.
- Сколько валентных электронов в атоме: а) бериллия; б) кислорода; в) серы?
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта.
Валентные возможности атома хлора с точки зрения его электронного строения
Владельцы сайта
- Галина Пчёлкина
Обратная связь
Урок №7. Валентность. Валентные возможности и размеры атомов химических элементов.
Слово «валентность» (от лат. «valentia») возникло в середине XIX в., в период завершения химико-аналитического этапа развития химии. К тому времени было открыто более 60 элементов. Истоки понятия «валентность» содержатся в работах разных ученых. Дж.Дальтон установил, что вещества состоят из атомов, соединенных в определенных пропорциях. Э. Франкланд, собственно, и ввел понятие валентности как соединительной силы. Ф.А. Кекуле отождествлял валентность с химической связью. А.М.Бутлеров обратил внимание на то, что валентность связана с реакционной способностью атомов. Д.И.Менделеев создал периодическую систему химических элементов, в которой высшая валентность атомов совпадала с номером группы элемента в системе. Он же ввел понятие «переменная валентность».
Валентность – это количество ковалентных связей, которое образует атом в соединении с ковалентной связью.
Валентность азота равна III , т.к. азот образует три связи
Валентность азота равна IV , т.к. азот образует четыре связи
Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента.
7 N 1 s 2 2s 2 2p 3
У атома азота на внешнем втором уровне 1 s и 3 p орбитали, всего 4 орбитали, следовательно, максимально возможная валентность равна IV
У атома фосфора в основном (стационарном) состоянии валентность как и у азота равна IV
У атома фосфора, в отличие от азота есть свободные d – орбитали, поэтому для фосфора характерно возбуждённое состояние, когда 3 s 2 электроны распариваются и валентность принимает значение V
Валентные возможности атомов определяются числом не спаренных электроном, а так же числом не поделённых электронных пар способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму).
Например, образование третьей связи при образовании иона гидроксония, неподелённая пара электронов атома кислорода (донор) переходит на свободную орбиталь иона водорода (акцептор):
Рассмотрим электронографические формулы элементов и установим причину разной валентности.
Валентность Н – I , Нe – , Be – I I , B – III , P – III , V .
Вывод
Валентные возможности атомов химических элементов определяются:
1) числом неспаренных электронов (одноэлектронных орбиталей);
2) наличием свободных орбиталей;
3) наличием неподеленных пар электронов.
Вопросы для закрепления
1. Какими тремя факторами определяются валентные возможности атомов химических элементов?
2. Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?
3. Вспомните, чем отличаются понятия валентности и степени окисления. Что между ними общего?
4. Укажите валентность и степень окисления атомов азота в ионе аммония NH 4 +
5. Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2, этиленгликоле, феноле.
6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Н2 О 2, ОF2, О2, F2, СО.
7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.
Валентные возможности атомов.
Читайте также:
|
| ( 3s 2 3p 4 3d 1 ) Валентность равна 3, а степень окисления +3 | |
| (3s 2 3p 3 3d 2 ) Валентность равна 5, а степень окисления +5 | |
| (3s 1 3p 3 3d 1 ) Валентность равна 7, а степень окисления +7 |
Таким образом, валентность атома хлора и его полных электронных аналогов (брома и йода) изменяется от 1 до 7, а степени окисления –1, 0, +1, +3, +5, +7.
Дата добавления: 2015-07-08 ; просмотров: 3006 | Нарушение авторских прав
Метод валентных связей
Метод валентных связей (МВС) описывает образование ковалентных связей в молекулах с позиций квантовой механики.
Он базируется на следующих основных положениях:
1. Химическая связь образуется за счет попарного перекрывания валентных атомных орбиталей (АО).
2. В результате перекрывания АО появляется общая для двух атомов электронная пара с антипараллельными (т.е. противоположными по знаку) спинами, которая обеспечивает одну химическую связь.
3. В ходе взаимодействия АО могут подвергаться гибридизации (при этом получаются ГАО — гибридные атомные орбитали).
По сути дела, МВС является более совершенным вариантом теории ковалентной связи. В МВС химическая связь так же может быть образована двумя способами:
1. Обменный механизм
2. Донорно-акцепторный механизм
Связи, образованные одними и теми же атомами различными способами абсолютно неотличимы друг от друга. Так, молекула водорода может быть получена как по обменному, так и по донорно-акцепторному механизмам:
МВС дает ясную и точную трактовку понятия валентности. Валентность — это число АО данного атома, принявших участие в перекрывании с АО других атомов по обменному или донорно-акцепторному механизмам.
Атомы могут образовывать связи как в нормальном (невозбужденном), так и в возбужденном состоянии. Переход атома в возбужденное состояние связан с перескоком валентных электронов с одного валентного подуровня на другой. При этом появляется дополнительное количество неспаренных электронов и увеличиваются валентные возможности атома по обменному механизму.
Пример: атом фосфора в нормальном состоянии имеет электронное строение 1s 2 2s 2 2p 6 3s 2 3p 3 или [Ne] 3s 2 3p 3 . Валентные электроны фосфора (3s 2 3p 3 ) распределены по валентным орбиталям следующим образом:
Невозбужденный атом фосфора может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному (за счет пары электронов 3s 2 ). Поэтому такой атом фосфора может иметь валентность или III или IV.
Возбужденный атом фосфора (Р * ) может образовать 5 связей по обменному механизму, то есть его валентность равна V. И, действительно, фосфор в своих соединениях проявляет валентность III (PH3— фосфин), IV (P — ион фосфоний), V (H3PO4 — фосфорная кислота). Другие валентности для фосфора нехарактерны.
Если атомы в ходе химического взаимодействия не подвергаются гибридизации, то описание образования связей с позиций МВС осуществляется следующим образом:
а) составляется орбитальная диаграмма образования связей;
б) схематически изображается перекрывание орбиталей в пространстве.
Пример: молекула Cl2.
Данная диаграмма показывает, что в молекуле Cl2существует одна ковалентная связь, образованная по обменному механизму. Графическая формула этой молекулы: Cl — Cl .
Пространственное строение молекулы Cl2 (изображены только 3p — орбитали):
По типу перекрывания орбиталей различаются s — связи, p — связи и d — связи.
s — cвязь образуется при “лобовом” перекрывании орбиталей, т.е. максимум перекрывания АО находится на прямой линии, соединяющей ядра атомов. s — связь самая прочная. Она может образовываться при перекрывании орбиталей любого вида:
В случае p — связи максимумы перекрывания АО находятся в 2-х областях, лежащих на плоскости, проходящей через ядра атомов:
В случае d — связи максимумы перекрывания АО находятся в 4-х областях, лежащих на 2-х взаимно перпендикулярных плоскостях, проходящих через ядра атомов. Связи такого типа могут возникать только при перекрывании d — и f — орбиталей и изучены очень мало.
Попытки применения МВС в простейшем варианте, изложенном выше для описания химического строения большинства молекул состоящих из 3 и более атомов оказались неудачными. Во многих случаях теория абсолютно не соответствовала экспериментальным данным. Для устранения этого противоречия была разработана теория гибридизации.
Гибридизация — это глубокая перестройка АО, возникающая при переходе атома из нормального в возбужденное состояние. При этом АО превращаются в ГАО (гибридные атомные орбитали). ГАО резко отличаются от исходных АО по энергии, форме и ориентации в пространстве. В то же время ГАО одного атома абсолютно одинаковы по энергии и форме между собой.
Пример : sp 3 — гибридизация атома углерода:
Все ГАО имеют форму ассиметричной гантели (т.е. вытянуты в одном направлении). Гибридизации могут подвергаться только орбитали валентных подуровней. В ходе гибридизации из n АО получаются n ГАО. ГАО участвуют в образовании только s — связей, причем эти связи более прочные, чем аналогичные s — связи с участием негибридных АО.
В настоящее время в различных веществах обнаружено около 20 различных типов гибридизации. Но чаще всего встречаются 6 типов гибридизации:
| Тип гибридизации | Взаимное расположение ГАО в пространстве | Структурные формы |
| sp | ||
| sp 2 | ||
| sp 3 | ||
| sp 3 d 1 | ||
| sp 3 d 2 | ||
| spd 2 |
Наличие гибридизации и ее тип у того или иного атома в молекуле в общем случае предсказать нельзя.
Для однозначного решения этой задачи в большинстве случаев нужно знать:
1. Сколько связей между каждой парой атомов (первая связь — всегда s — связь, вторая и третья — p — связи).
2. Чему равны валентные углы (углы между связями) или, по крайней мере, чему равен дипольный момент молекулы (сумма дипольных моментов связей).
Пример 1 . Известно, что молекула CСl4неполярна (½m½ = 0). Углы между связями С — Сl одинаковы и равны 109°28¢. Все связи C — Cl одинаковы по длине и энергии. Все эти данные свидетельствуют в пользу того факта, что углерод в этой молекуле находится в состоянии sp 3 — гибридизации.
Поэтому орбитальная диаграмма выглядит следующим образом:
Пространственноестроение CCl4 — атомы Cl образуют правильную фигуру (тетраэдр). Относительно возможной гибридизации атомов хлора ничего сказать нельзя, т.к. исходных данных недостаточно для этого.
Пример 2 . Молекула Н2О полярна ( çm ç ¹ 0 ), угол между связями Н-О равен 105°30¢. Водород не может подвергаться гибридизации, так как у него всего одна валентная орбиталь. Кислород может быть негибридизированным (тогда угол между связями должен быть 90°) или иметь один из 3 типов гибридизации (другие невозможны из-за отсутствия валентных d и f — орбиталей): sp — гибридизация (валентный угол 180°), sp 2 — гибридизация (120°), sp 3 — гибридизация (109°28¢).
Так как валентный угол в молекуле воды наиболее близок к таковому для случая sp 3 — гибридизации, орбитальная диаграмма этой молекулы следующая:
Валентный угол в такой молекуле отличается от стандартного тетраэдрического (109°28¢) за счет того, что ГАО кислорода неравноценны: две из них связывающие (принимают участие в образовании связей О — Н), а две – несвязывающие:
Несвязывающие атомные орбитали кислорода сильно отталкиваются друг от друга и это приводит к тому, что валентный угол в молекуле воды меньше на 5° относительно стандартного для sp 3 -гибридизации.
Пример 3 : Молекула СО2неполярна ( çm ç = 0). Этого вполне достаточно, чтобы описать строение этой молекулы. Каждая связь С — О является полярной, так как атомы углерода и кислорода сильно отличаются по электроотрицательности. Чтобы молекула в целом была неполярной, необходимо чтобы связи С — О имели валентный угол равный 180°:
При сложении 2 векторов одинаковых по длине и противополжных по направлению получается ноль. Угол 180° соответствует sp -гибридизации атома углерода. Отсюда следует орбитальная диаграмма:
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8019 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
- http://otvet.mail.ru/question/28087599
- http://edufuture.biz/index.php?title=%D0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D1%8B%D0%B5_%D0%B2%D0%BE%D0%B7%D0%BC%D0%BE%D0%B6%D0%BD%D0%BE%D1%81%D1%82%D0%B8_%D0%B0%D1%82%D0%BE%D0%BC%D0%BE%D0%B2_%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2
- http://lektsii.org/16-11110.html
- http://znanija.com/task/25336202
- http://www.syl.ru/article/300549/hlor-valentnost-himicheskie-svoystva
- http://interneturok.ru/lesson/chemistry/11-klass/bstroenie-atoma-periodicheskij-zakonb/valentnye-vozmozhnosti-atomov-himicheskih-elementov
- http://www.sites.google.com/site/himulacom/zvonok-na-urok/11-klass---cetveertyj-god-obucenia/urok-no7-valentnost-valentnye-vozmoznosti-i-razmery-atomov-himiceskih-elementov
- http://mybiblioteka.su/1-31734.html
- http://studopedia.ru/3_77991_metod-valentnih-svyazey.html










.</p>%0A<p%20style=)
.%20%D0%9F%D0%BE%20%D1%87%D0%B8%D1%81%D0%BB%D1%83%20%D0%BD%D0%B5%D1%81%D0%BF%D0%B0%D1%80%D0%B5%D0%BD%D0%BD%D1%8B%D1%85%20%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BE%D0%B2%20%D0%BC%D1%8B%20%D0%BC%D0%BE%D0%B6%D0%B5%D0%BC%20%D1%81%D0%BA%D0%B0%D0%B7%D0%B0%D1%82%D1%8C,%20%D1%87%D1%82%D0%BE%20%D1%82%D0%B0%D0%BA%D0%BE%D0%B9%20%D0%B0%D1%82%D0%BE%D0%BC%20%D1%83%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4%D0%B0%20%D0%BC%D0%BE%D0%B6%D0%B5%D1%82%20%D0%BF%D1%80%D0%BE%D1%8F%D0%B2%D0%BB%D1%8F%D1%82%D1%8C%20%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%BE%D1%81%D1%82%D1%8C,%20%D1%80%D0%B0%D0%B2%D0%BD%D1%83%D1%8E%20II.</p>%0A<p%20style=)
















