Молекулярная теория объясняет физические явления, происходящие с веществами. Учение об атомах приходит на помощь молекулярной теории при объяснении химических явлений. Обе эти теории – молекулярная и атомная – объединяются в атомно–молекулярное учение, на которое опирается все современное естествознание. Сущность этого учения можно сформулировать в виде нескольких положений:
1. Вещества делимы не до бесконечности, а лишь до молекул.
2. При физических явлениях молекулы сохраняются, при химических – разрушаются.
3. Молекулы веществ состоят из атомов; при химических реакциях атомы, в отличие от молекул, сохраняются.
4. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента), в частности атомным весом.
5. Химические реакции заключаются в образовании новых молекул из тех же самых атомов, из которых состояли молекулы первоначальных веществ.
Учение об атомах зародилось в трудах древнегреческих философов задолго до начала нашей эры. Отвергая веру в богов и чудеса, они пытались объяснить все загадочные явления природы естественными причинами – соединением и разъединением, перемещением и смешиванием невидимых частичек – вечно существующих атомов. Учение об атомах, как безбожное, на протяжении многих веков преследовалось служителями церкви. Его последователи подвергались гонениям, их книги сжигались. Но философы древности называли атомами то, что мы сейчас называем молекулами. Поэтому они смогли объяснить лишь физические явления: ветер и бури, распространение запахов, испарение воды.
Основные положения атомно–молекулярного учения были разработаны лишь в середине XVIII века М. В. Ломоносовым. Он объявил изучение строения веществ главной задачей химии.
Всеобщее признание атомно–молекулярное учение получило после работ английского химика Д. Дальтона, который в начале XIX века ввел в науку понятие об атомных весах элементов.
Химия действительно стала наукой лишь с тех пор, как химические реакции стали истолковываться с точки зрения атомно–молекулярного учения.
1. Все вещества состоят из молекул. Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 117 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро — центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра — положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы — химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Аллотропия — явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Химические формулы
Любое вещество может быть охарактеризовано качественным и количественным составом. Под качественным составом понимают набор химических элементов, образующих вещество, под количественным, в общем случае, соотношение между числом атомов этих элементов. Атомы, образующие молекулу, соединяются между собой в определенной последовательности, эта последовательность называется химическим строением вещества (молекулы).
Состав и строение молекулы может быть изображено с помощью химических формул. Качественный состав записывается в виде символов химических элементов, количественный – в виде подстрочных индексов у символа каждого элемента. Например: С6Н12О6.
Химическая формула — это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс — цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Химические формулы бывают следующих видов:
а) молекулярные – показывают сколько атомов элементов входят в состав молекулы вещества, например Н2О – одна молекула воды содержит два атома водорода и один атом кислорода.
б) графические – показывают в каком порядке связаны атомы в молекуле, каждая связь изображается черточкой, для предыдущего примера графическая формула будет выглядеть так: Н—О—Н
в) структурные – показывают взаимное расположения в пространстве и расстояния между атомами, входящими в состав молекулы.
Необходимо иметь в виду, что однозначно идентифицировать вещество позволяют только структурные формулы, молекулярные или графические формулы могут соответствовать нескольким или даже многим веществам (особенно в органической химии).
Международная единица атомных масс равна 1/12 массы изотопа 12C — основного изотопа природного углерода.
1 а.е.м = 1/12 m (12C) = 1,66057 10 -24 г
Относительная атомная масса (Ar) — безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
m (Mg) = 24,312·1,66057 · 10 -24 = 4,037 · 10 -23 г
Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mr = mг / (1/12 mа(12C))
mr — масса молекулы данного вещества;
mа(12C) — масса атома углерода 12C.
Mr = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr (KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) == 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = = 258
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м. Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения — моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль — количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 · 10 23 . (Постоянная Авогадро имеет размерность — моль -1 ).
Сколько молекул содержится в 6,4 г серы?
Молекулярная масса серы равна 32 г /моль. Определяем количество г/моль вещества в 6,4 г серы:
n(s) = m(s) / M(s) = 6,4г / 32 г/моль = 0,2 моль
Определим число структурных единиц (молекул), используя постоянную Авогадро NA
N(s) = n(s) · NA = 0,2· 6,02· 1023 = 1,2· 1023
Молярная масса показывает массу 1 моля вещества (обозначается M).
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
Молярная масса вещества численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая — безразмерная.
M = NА · m(1 молекула) = NА · Mг · 1 а.е.м. = (NА · 1 а.е.м.) · Mr = Mr
Это означает, что если масса некоторой молекулы равна, например, 80 а.е.м. (SO3), то масса одного моля молекул равна 80 г. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных соотношений к молярным. Все утверждения относительно молекул остаются справедливыми для молей (при замене, в случае необходимости, а.е.м. на г) Например, уравнение реакции: 2Na + Cl2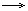
как объяснить физические и химические явления с точки зрения атомно-молекулярного учения
Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Другие вопросы из категории
реакций ионного обмена напишите уранения в ионном виде,для окислительно-восстановительных реакций составте электронный баланс
39.Выведите молекулярную формулу этого вещества.
А)Ca и P
Б)Li и Cu
В)N и F
Г)Si и Fe
Только объясните ответ 😀
Читайте также
1) напишите по два уравнения каждого из известных вам типов химических реакций и объясните их с точки зрения атомно-молекулярного учения.
2) на основании закона сохранения массы веществ рассчитайте массу кислорода, вступившего в реакцию 3,2грамма меди,если в результате реакции образовалось 4 грамма оксида меди(2валентность)
спирта; в) горение свечи; г) вытягивание медной проволоки; д) пожелтение листвы деревьев; е) плавление алюминия; ж) таяние снега; з) прогоркание масла; и) взрыв петарды; к) кристаллизация соли; л) отбеливание ткани; м) ржавление лезвия ножа; н) очистка лезвия ножа от ржавчины наждачной бумагой? По каким признакам вы отличили химические явления?
а) воды;
б) воздуха;
в) перманганата калия.
напишите уравнения химических реакций, относящихся к химическим явлениям.
Конспект урока на тему «СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ».
за привлеченного слушателя на курсы профессиональной переподготовки
СУЩНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
Тип урока: Урок изучения нового материала.
Способствовать формированию представлений о сущности химических реакций.
Создать условия для формирования представлений о механизмах химических реакций.
Создать условия для развития умений применять полученные знания в неорганической и органической химии для характеристики типов химических реакций.
Способствовать обучению школьников умению выделять главную мысль в содержании текста учебной статьи.
Способствовать развитию умений классифицировать химические реакции на основе различных признаков.
Способствовать развитию знаний об атомно-молекулярном учении, законе сохранения массы веществ, механизмах химических реакций и химической кинетики.
Способствовать пониманию единства органического и неорганического мира через химическую форму движения материи
Воспитывать уважительное отношение друг к другу.
Способствовать формированию культуры умственного труда, умение слушать, общаться, наблюдать и делать выводы.
Методы обучения: репродуктивный, частично-поисковый.
Формы организации познавательной деятельности: групповая, индивидуальная, фронтальная.
Урок проводится в системе личностно-ориентированного обучения
Оргмомент (3 минуты)
Целеполагание и мотивация
Актуализация знаний и умений – короткий этап
Изучение нового материала (преобладает)
Этап первичного закрепления знаний и умений
Рефлексия – итоги урока
Целеполагание и мотивация.
химическая реакция есть
главный предмет химии»
(акад. Н.Н. Семенов)
Изучая химию с 8 по 11 класс, мы сталкивались с многообразием химических реакций, изучали их признаки, механизмы, условия, закономерности этих процессов. Реакции производственных процессов рассматривали с позиций управления, экологии и энергетики. Сейчас в химической науке накоплены знания о тысячах химических реакций. Целая армия исследователей в лабораториях всех стран продолжают расширять и углублять знания о новых химических процессах, которые возможны с веществами. Сумма накопленных знаний столь велика, что химикам пришлось разделиться в зависимости от характера реакций по отдельным областям: на органиков и неоргаников, аналитиков, специалистов в области химического синтеза, катализа, биохимиков, физхимиков, фармацевтов и т.д.
Поэтому сейчас мы постараемся определить, в чем суть любой химической реакции с точки зрения атомно-молекулярного учения, химической кинетики и строения вещества, а также попробуем провести классификацию реакций по разным признакам, опираясь на знания о химических реакциях, полученные в разных разделах и темах химии. Когда вы будете учиться в ВУЗах и средних учебных заведениях, вам предстоит столкнуться с вопросами, которые рассматривают реакции на более высоком уровне, и материал данного урока поможет вам в этом.
на доске Цель: суть, классификация, применение
В переводе с латыни «реакция» означает «противодействие», «отпор», «ответное действие».
Вопрос: с учетом перевода с латыни как вы понимаете, что такое химическая реакция?
— когда происходит химическая реакция?
— что помогает началу и проведению реакции?
Поэтому термин «химическая реакция» можно понимать как ответное действие вещества на воздействие извне других веществ и физических факторов – тепла, давления, излучения и т.д.
Но под такое определение попадают и физические явления – плавление, кипение, замерзание и др.
Поэтому следует уточнить
— что происходит с частицами вещества при химических реакциях?
— что разрушается в молекулах, кристаллах веществ? – химические связи.
Химическая реакция – это такое изменение вещества, при котором разрываются старые и образуются новые химические связи между атомами с образованием веществ с новыми свойствами.
Изучение нового материала.
Для понимания сущности химических реакций служат теории атомно-молекулярного учения, химической связи, химической кинетики.
Изучать данный материал мы будем во время групповой работы. В каждом тексте освещается теория, которая поможет понять сущность химической реакции. Каждая группа получит свой теоретический вопрос, который необходимо изучить, осмыслить, ответить на поставленные вопросы и довести до сведения учащихся других групп. На работу вам дается 7 минут. На изложение материала вам дается 3 минуты, т.к остальные должны тезисно данное выступление зафиксировать в рабочую тетрадь.
Атомно-молекулярное учение создали русский ученый М.В.Ломоносов (1741 г.) и английский ученый Дж.Дальтон (1808 г.) Основные положения учения состоят:
Вещество состоит из молекул. Молекула – это мельчайшая частица вещества, которая сохраняет его химические свойства
Молекулы состоят из атомов. Атом – мельчайшая частица химического элемента. Химический элемент – это отдельный вид атомов с одинаковым зарядом ядра
Молекулы и атомы находятся в непрерывном движении
При химических реакциях молекулы разрушаются до атомов, затем происходит их перегруппировка и образование новых молекул из тех же атомов
В химических реакциях число атомов до реакции равно числу атомов после реакции (закон сохранения масс веществ Ломоносов 1748 и Лавуазье 1789)
В чем сущность химических реакций с позиций атомно-молекулярного учения?
Как используется закон сохранения масс при составлении уравнений реакций?
От строения вещества, от того, как соединяются атомы между собой, зависит реакционная способность веществ. Учение о химических связях, понимание сущности образования молекул, кристаллов веществ позволяет судить о протекании химических реакций и рассматривать их механизмы. Между атомами неметаллов может быть простая, двойная и тройная связи. Зная это, мы говорим о наличии σ- и π-связях. Кроме того, длина связи характеризует ее прочность: чем меньше длина, тем прочнее связь и тем больше энергии затратится на ее разрыв.
Чем больше энергия связи, тем прочнее молекула и тем менее она реакционно-способна.
Энергия связи отвечает и за тепловые эффекты химических реакций: если энергия исходных веществ меньше энергии продуктов реакции, то теплота выделяется («экзо» – «наружу»), а если наоборот – теплота поглощается («эндо» — «внутрь»).
Благодаря полярности молекул происходит изменение степени окисления. В таких реакциях одно из веществ является восстановителем (степень окисления повышается) – отдающим электроны, другое вещество – служит «грабителем» электронов – это окислитель (степень окисления понижается). В таких реакциях происходят два процесса: окисление и восстановление.
Какие реакции осуществляются при разрыве π-связи?
Как будут называться реакции по тепловому эффекту?
Как будут называться реакции, если происходит изменения степеней окисления?
Раздел химической кинетики дает ответы на вопросы о том, как реакции протекают во времени, рассматривают «движущие силы» химической реакции, «пробуксовку» химических процессов, а также запланированные сдвиги химических реакций в сторону продуктов реакции или в сторону исходных веществ. Мы знаем с вами, что на ход химической реакции влияет ряд физических факторов. Для вступления вещества в реакцию, частице вещества необходимо пройти энергетический барьер – энергию активации.
Вставьте пропущенные слова, чтобы предложения были по смыслу правильно закончены: химическое равновесие; катализатор; температура, обратимые.
Так, чтобы ускорить процесс взаимодействия веществ необходима ………………
Для некоторых реакций требуются так называемые вещества-ускорители – ……………….. …
Большинство реакций в органической химии идут в противоположных направлениях и называются ………………….. Когда скорость обратной реакции оказывается равной скорости прямой, то говорят, наступает …………………………….
Когда наступает динамическое равновесие?
Когда реакция соляной кислоты пройдет быстрее: с гранулой цинка или же такой же массы порошка?
Какие факторы изменяют скорость химической реакции?
Классификация – это деление на группы
В основу классификации химических реакций берутся различные признаки:
По количеству и составу исходных и полученных веществ
Типы химических реакций с точки зрения атомно молекулярного учения
Известно, что химия изучает вещества и их свойства. Для того чтобы объяснить почему то или иное вещество вступает или не вступает в химические процессы, нужно заглянуть внутрь его. Но атомы и молекулы, из которых состоят вещества, нельзя увидеть даже с помощью мощного микроскопа. Из материалов урока вы узнаете, как ученые-химики познавали и познают микромир.
1. Роль и место метода моделирования в химии
Основной метод познания в химии — моделирование.
Моделирование – это один из способов познания реального мира, при котором представления об изучаемом объекте строятся не путем непосредственного наблюдения, а по косвенным данным.
Модель может быть выполнена из какого-либо материала (т.е. быть реальной), а может существовать только в нашем воображении. Первоначально созданная модель может перестраиваться или вовсе заменяться другой моделью при встрече с противоречащими данной модели фактами.
Запомните, что природа гораздо разнообразнее, чем любая, даже самая хорошая, теоретическая модель. Поэтому все разрабатываемые теоретические модели постоянно приходится совершенствовать.
- Моделирование – основано на изучении моделированного объекта. Модель строится по подобию оригинала, на ней воспроизводят, свойственные оригиналу процессы и полученные сведения переносятся на моделируемый объект – оригинал.
Различают несколько видов моделирования:
- Мысленное. К нему относятся самые различные мыслительные представления в форме тех или иных воображаемых моделей.
- Физическое. Оно характеризуется физическим подобием между моделью и оригиналом.
- Символическое – связано с построением графиков, схем.
Моделирование как метод познания бывает единственно необходимым для исследования некоторых явлений.
Таким образом, все названные методы научного познания являются важными и необходимыми для познания окружающего мира.
2. Сущность теоретического моделирования
Так как же зарождались первые модели веществ и химических реакций? Еще во времена Античности ученых интересовал вопрос: «Можно ли из одного вещества получить какое угодно другое вещество?».
Древнегреческий философ Аристотель предположил, что основу всего составляют 4 стихии: огонь, вода, воздух и земля. Эти стихии находятся во взаимосвязи и взаимодействии.
Рис. 1. Теория «4 стихий» Аристотеля
Аристотель считал огонь, воду, воздух и землю неделимыми элементами, которые могут превращаться друг в друга, а также соединяться друг с другом, образуя новые тела. Соединение элементов с противоположными свойствами считалось невозможным: огонь не может соединиться с водой, а воздух с землей.
Предположение Аристотеля было очевидным, поэтому его представления владели умами более тысячи лет. Например, мы знаем, что вода не горит. В соответствие с данной моделью Аристотель считал, что из одного вещества можно получить любое другое вещество. Главное – подобрать условия его превращения.
3. Модельные представления Аристотеля и Демокрита
Другая модель строения вещества была предложена еще одним древнегреческим ученым Демокритом.
Рис. 2. Древнегреческий философ Демокрит
Он считал, что вещества состоят из неделимых частиц – атомов. Атомы отличаются формой и размером. Благодаря особенностям своей формы и размера атомы могут соединяться, образуя вещества.
В соответствии с моделью Демокрита, из одного вещества нельзя получить какое угодно другое вещество. Но учение об атомах было неочевидным, поэтому модель Демокрита была забыта вплоть до 17 в.
4. Основные положения атомно-молекулярной теории
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
Основные положения атомно-молекулярного учения можно сформулировать так:
- Существуют вещества с молекулярным и немолекулярным строением.
- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
- Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
- Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
- Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
- Атомы одного вида отличаются от атомов другого вида массой и свойствами.
- При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
- У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
- У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
8 класс химия Рудзитис, Фельдман вопросы к §11-13 12. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
12. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
Вот так можно ответить
Вопрос 12.
С точки зрения атомно-молекулярного уче-
ния химические явления объясняются наличием
связей между атомами, молекулами и другими
частицами. Так, например, в ходе химических
реакций может происходить разрушение связей
между атомами одних веществ и образованием
новых связей, то есть новых веществ. Примером
физического явления может быть процесс диф-
фузии, объяснимый способностью частиц одного
вещества проникать между частицами другого
вещества.
Возможности использования атомно-молекулярной теории для объяснения различных химических явлений
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта.
Атомно-молекулярное учение. Химические элементы
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М.В.Ломоносов. Основные положения этого учения изложены в работе «Элементы математической химии» (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Через 67 лет после Ломоносова атомистическое учение в химии применил английский ученый Джон Дальтон. Он изложил основные положения атомистики в книге «Новая система химической философии» (1808). В своей основе учение Дальтона повторяет учение Ломоносова. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в. На международном съезде химиков г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям:
Атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.
Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Большинство же твердых неорганических веществ не имеет молекулярной структуры: их решетка состоит не из молекул, а из других частиц (ионов, атомов); они существуют в виде макротел (кристалл хлорида натрия, кусок меди и др.). Не имеют молекулярной структуры соли, оксиды металлов, алмаз, кремний, металлы.
Атомно-молекулярное учение позволило объяснить основные понятия и законы химии. С точки зрения атомно-молекулярного учения химическим элементом называется каждый отдельный вид атомов. Важнейшей характеристикой атома является положительный заряд его ядра, численно равный порядковому номеру элемента. Значение заряда ядра служит отличительным признаком для различных видов атомов, что позволяет дать более полное определение понятия элемента:
Химический элемент — это определенный вид атомов с одинаковым положительным зарядом ядра.
Известно 107 элементов. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы обычно делят на металлы и неметаллы . Однако это деление условно. Важной характеристикой элементов является их распространенность в земной коре, т.е. в верхней твердой оболочке Земли, толщина которой принята условно равной 16 км. Распределение элементов в земной коре изучает геохимия — наука о химии Земли. Геохимик А.П.Виноградов составил таблицу среднего химического состава земной коры. Согласно этим данным самым распространенным элементом является кислород — 47,2% массы земной коры, затем следует кремний — 27,6, алюминий — 8,80, железо -5,10, кальций — 3,6, натрий — 2,64, калий — 2,6, магний — 2,10, водород — 0,15%.
Типы химических реакций с точки зрения атомно молекулярного учения
1) Все вещества состоят из молекул.
2) Молекулы состоят из атомов. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида.
3) Частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4) При взаимодействии атомов образуются молекулы: гомоядерные – при соединении атомов одного вида (например, H2, O2), образующиеся при этом вещества называются простыми; гетероядерные – при взаимодействии атомов разного вида (например, H2O, H2SO4), образующиеся при этом вещества называются сложными.
5) При физических явлениях молекулы сохраняются, при химических – разрушаются (или образуются новые), атомы же и при физических, и при химических реакциях остаются неизменными.
6) Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
Тема лекции: ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ.
План:
МЕСТО ХИМИИ СРЕДИ ДРУГИХ НАУК
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТНЫХ ОТНОШЕНИЙ
ХИМИЧЕСКИЕ РЕАКЦИИ. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
МЕСТО ХИМИИ СРЕДИ ДРУГИХ НАУК
Химия относится к естественным наукам, изучающим окружающий нас материальный мир, его явления и законы.
Основным законом природы является закон вечности материи и ее движения. Отдельные формы движения материи изучаются отдельными науками. Место химии, имеющей дело главным образом с молекулярным (и атомным) уровнем организации материи, между физикой элементарных частиц (субатомный уровень) и биологией (надмолекулярный уровень).
Химия— наука о веществах, их составе, строении, свойствах и превращениях, связанных с изменением состава, строения и свойств образующих их частиц.
Великий русский ученый М. В. Ломоносов сказал: «Широко простирает химия руки свои в дела человеческие». Действительно, практически нет ни одной технической дисциплины, которая могла бы обойтись без знаний химии. Даже такие современные и далекие, казалось бы, от химии науки, как электроника, информатика, сегодня получили новый импульс в своем развитии, заключив «союз» с химией (запись информации на молекулярном уровне, разработка биокомпьютеров и др.). Что тогда говорить о фундаментальных дисциплинах: физике, биологии и др., где давно существуют самостоятельные разделы, пограничные с химией (химическая физика, биохимия, геохимия и пр.).
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
Представление об атомах, как конструкционных элементах вещественного мира, зародилось еще в древней Греции (Левкипп, Демокрит, 1У-Ш вв. до н. э.). Но только в конце XVIII — начале XIX в. было создано атомно-молекулярное учение. Важнейший вклад в обобщение накопленного материала был сделан М. В. Ломоносовым.
Атомно-молекулярное учение включает в себя следующие основные положения:
1. Все вещества не являются сплошными, а состоят из частиц (молекул, атомов, ионов).
2. Молекулы состоят из атомов (элементов).
3. Различия между веществами определяются различиями образующих их частиц, которые отличаются друг от друга составом, строением и свойствами.
4. Все частицы находятся в постоянном движении, скорость которого увеличивается при нагревании.
Атом — наименьшая частица химического элемента, являющаяся носителем его свойств. Это электронейтральная микросистема, поведение которой подчиняется законам квантовой механики.
Химический элемент — вид атомов, имеющих одинаковый положительный заряд ядра и характеризующихся определенной совокупностью свойств.
Изотопы — атомы одного элемента, различающиеся массой (количеством нейтронов в ядре).
Любой химический элемент в природе представлен определенным изотопным составом, поэтому его масса рассчитывается как некоторая средняя величина из масс изотопов с учетом их содержания в природе.
Молекула — наименьшая частица вещества, являющаяся носителем его свойств и способная к самостоятельному существованию.
Простое вещество — вещество, молекулы которого состоят только из атомов одного элемента.
Аллотропия — способность элемента образовать простые вещества, имеющие различный состав, строение и свойства.
Разновидности аллотропных модификаций определяются:
• различным числом атомов элемента в составе молекулы простого вещества, например, кислород (О2) и озон (О3).
• различиями в строении кристаллической решетки простого вещества, например, соединения углерода: графит (плоская, или двумерная, решетка) и алмаз (объемная, или трехмерная решетка).
Сложное вещество — вещество, молекулы которого состоят из атомов разных элементов.
Сложные вещества, состоящие только из двух элементов, называются бинарными, например:
Ø гидриды: CaH2, LiH, NaH;
Сложные соединения, состоящие более чем из двух элементов, относятся к основным классам неорганических соединений. Это гидроксиды (кислоты и основания) и соли, в том числе комплексные соединения.
Атомы и молекулы имеют абсолютную массу, например, масса атома С 12 равна 2·10 -26 кг.
Такими величинами пользоваться на практике неудобно, поэтому в химии принята относительная шкала масс.
Атомная единица массы (а. е. м.) равна 1/12 массы изотопа С 12 .
Относительная атомная масса (Аr— безразмерная величина) равна отношению средней массы атома к а. е. м.
Относительная молекулярная масса (Мr— безразмерная величина) равна отношению средней массы молекулы к а. е. м.
Моль (ν — «ню» или n) — количество вещества, содержащее столько же структурных единиц (атомов, молекул или ионов), сколько атомов содержится в 12 г изотопа С 12 .
Число Авогадро — число частиц (атомов, молекул, ионов и др.), содержащееся в 1 моле любого вещества.
Более точные значения некоторых фундаментальных констант приводятся в таблицах приложения.
Молярная масса вещества (М) — это масса 1 моля вещества. Она рассчитывается как отношение массы вещества к его количеству:
(1)
Молярная масса численно равна Аr(для атомов) или Мr(для молекул).
Из уравнения 1 можно определить количество вещества, если известны его масса и молярная масса:
(2)
Молярный объем (Vmдля газов) — объем одного моля вещества. Рассчитывается как отношение объема газа к его количеству:
(3)
Объем 1 моля любого газа при нормальных условиях (Р = 1 атм = 760 мм. рт. ст. = 101,3 кПа; T = 273ТС = 0°С) равен 22,4 л.
(4)
Плотность вещества равна отношению его массы к объему.
(5)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 7965 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
- http://studfiles.net/preview/5188069/page:2/
- http://himia.neznaka.ru/answer/80596_kak-obasnit-fiziceskie-i-himiceskie-avlenia-s-tocki-zrenia-atomno-molekularnogo-ucenia/
- http://infourok.ru/konspekt_uroka_na_temu_suschnost_himicheskih_reakciy.-119543.htm
- http://kardaeva.ru/88-dlya-uchenika/8-klass/106-8klass-1-3
- http://class.rambler.ru/temy-gdz/8-klass-himiya-rudzitis-feldman-voprosy-k-11-13-12-kak-obyasnit-fizicheskie-i-himicheskie-yavleniya-s-tochki-zreniya-atomno-molekulyarnogo-ucheniya-8704.htm
- http://interneturok.ru/lesson/chemistry/8-klass/obobschenie-proydennogo-materiala/vozmozhnosti-ispolzovaniya-atomno-molekulyarnoy-teorii-dlya-ob-yasneniya-razlichnyh-himicheskih-yavleniy
- http://www.himhelp.ru/section23/section1/section2cdty/
- http://ido.tsu.ru/schools/chem/data/res/chemfor/uchpos/text/g1_1_2.html
- http://studopedia.ru/12_137417_atomno-molekulyarnoe-uchenie.html


