Читайте также:
- I. 36. Состав, свойства и применение азотных удобрений.
- I. Первая группа теорий – детерминистские теории.
- IV. система педагогических исследований с методологической точки зрения
- PGP. Принцип функционирования. Свойства ключа.
- V2: 01.01. Предмет и метод экономической теории
- VIII . Механические свойства металлов. Диаграмма растяжения металлов.
- XV. Влияние углерода и постоянных примесей на свойства стали
- Абсолютные величины и их виды, познавательные свойства и условия применения в экономико-статистическом анализе.
- Автономные системы и свойства их решений.
- Азотирование и нитроцементация. Структура, свойства и области получения.
- Аксиомы теории вероятностей.
- Актуальность проблематики с точки зрения изменения роли ИТ в бизнесе и обществе
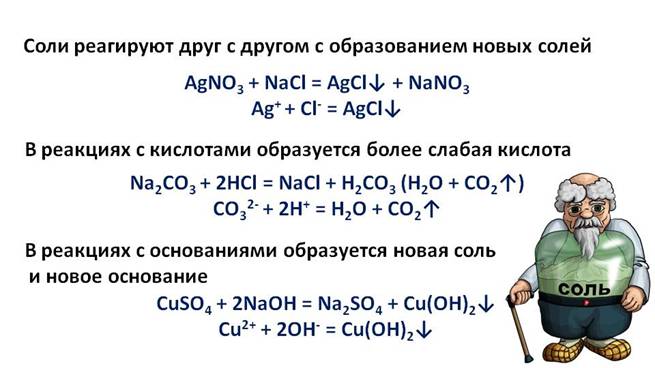
Кислоты основания соли с точки зрения электролитической диссоциации
Рассмотрим в свете теории электролитической диссоциации свойства веществ, которые в водных растворах проявляют свойства электролитов.
Кислоты. Для кислот характерны следующие общие свойства:
а) способность взаимодействовать с основаниями с образованием солей;
б) способность взаимодействовать с некоторыми металлами с выделением водорода;
в) способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации любой кислоты образуются иокы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т. д. С устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т. е. чем больше ее константа диссоциации, тем она сильнее.
Сравнивая данные, приведенные в табл. 12 и 14, можно заметить, что величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
а) способностью взаимодействовать с кислотами с образованием солей;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
а при взаимодействии с гидроксидом натрия — цинкат натрия;
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами. К таким гидроксидам кроме гидроксида цинка относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфо-терный электролит формулой ROH, то его диссоциацию можно выразить схемой:
Таким образом, в растворе амфотериого электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионоз, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы . Например, при растворении хлорида гидроксомагния диссоциация протекает согласно уравнениям:
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима.
В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ноны. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства основании. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в иеводиых средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теории кислот и оснований принадлежит протонная теория, выдвинутая в 1923 г.
Согласно протонной теории, кислотой является донор протона, т. е. частниа (молекула или ион), которая способна отдавать ион водорода — прогон, а основанием — акцептор протона, т. е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Связанные этим соотношением основание и кислота называются сопряженными. Например, является основанием, сопряженным кислоте .
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион — основание, сопряженное кислоте , а ион — кислота, сопряженная основанию .
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду эта энергия максимальна для и минимальна для HF. Поэтому в смеси с вода функционирует как кислота, а в смеси с HF — как основание:
Дата добавления: 2015-04-24 ; Просмотров: 3010 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Диссоциация оснований. Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-ионы OH : NaOH Na + + OH ; Ca(OH)2 CaOH + + OH ; CaOH + Ca 2+ + OH .
Ступенчатость диссоциации обусловливает возможность образования основных и кислых (см. ниже) солей.
Диссоциация кислот. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода H + . HCl H + + Cl ; HNO3 H + + NO3 ; H2SO4 H + + HSO4 — ; HSO4 H + + SO4 2 ; H3PO4 H + + H2PO4 ; H2PO4 H + + HPO4 2 ; HPO4 2 H + + PO4 3 .
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды дис-социируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H + и гидроксид-анионы OH : H + + MeO ⇄ MeOH ⇄ Me + + OH .
К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома Cr(OH)3, свинца Pb(OH)2 и др.
1. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка. Напри-мер, Na2SO4 2 Na + + SO4 2 ; Ca3(PO)4 3 Ca 2+ + 2 PO4 3 .
2.Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода и кислотного остатка: KHSO3 K + + HSO3 ( = 1).
Сложный анион диссоциирует частично: HSO3 ⇄ H + + SO3 2 ( : Al(OH)2Cl Al(OH)2 + + Cl ( = 1).
Сложный катион диссоциирует частично: Al(OH)2 + ⇄ AlOH 2+ + OH ( 2+ ⇄ Al 3+ + OH ( + + Al 3+ + 2 SO4 2 ;
Сложные соли диссоциируют на катион металла и анионы кислотных остатков. Например, ZnClNO3 Zn 2+ + Cl + NO3 ;
19. Окислительно-восстановительные реакции (овр). Степень окисления атомов Основные окислители и восстановители. Составление уравнений овр методами электронного и электронно-ионного баланса.
ОВР-реакции, протекающие с изменением степени окисления.
Окисление – это процесс отдачи электронов при этом происходит понижение степени окисления.
Восстановление – это процесс присоединения электронов, при этом происходит понижение степени окисления.
Реакции, в кот. ок-ль. и восст-ль предс. собой различные ве-ва наз. межмолеклярными. Если ок-ль и восс-ль атомы одной молекулы — внутримолекулярные.
Под степенью окисления (окислительным числом) понимают условный заряд атома в соединении, вычисленный из предположения, что в молекуле все связи ионные. Степень окисления указывает, сколько электронов оттянуто от атома (положительная степень окисления) или притянуто к нему от другого атома (отрицательная степень окисления). Мера удаления или приближения электронов к атому в степени окисления не отражена.Восстановители
а) Металлы как простые вещества: K 0 , Na 0 , Ca 0 , Al 0 и др.
б) Простые анионы неметаллов: S 2 , Cl , J , Br , Se 2 и др.
в) Сложные анионы и молекулы, содержащие электроположитель-ные элементы в промежуточной степени окисления: S +4 O3 2 , N +3 O2 , As +3 O3 3 , Cr +3 O2 , [Fe +2 (CN)6] 4 , C +2 O, N +2 O, S +4 O2 и др.
г) Простые катионы в низшей степени окисления: Fe 2+ , Sn 2+ , Cr 3+ , Cu + , Mn 2+ , As 3+ и др.
д) Некоторые простые вещества:
е) Катод при электролизе.
а) Неметаллы как простые вещества с большой электроотрицательностью: F2, O2, Cl2 и др.
б) Простые катионы в высокой степени окисления: Sn 4+ , Fe 3+ , Cu 2+ и др., а также H + .
г) Сложные ионы и молекулы, содержащие атомы неметаллов в положительной степени окисления: H2S +6 O4, S +6 O3, HOCl +1 , HCl +5 O3,
д) Анод при электролизе.
В соединениях, когда атомы находятся в промежуточной степени окисления, последние могут проявлять как восстановительные, так и окислительные свойства (окислительно-восстановительная двойствен-ность):
Применяют два метода составления уравнений реакций окисления-восстановления:
Свойства кислот оснований и солей с точки зрения ТЭД (теории электролитической диссоциации). Амфотерность.
Основания. Название «основание» первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Примеры: NaOH — гидроксид натрия (едкий натр), KOH — гидроксид калия (едкое кали), Ca(OH)2 — гидроксид кальция (гашёная известь).
Основания, которые хорошо растворяются в воде, называются щелочами, К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид — ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид — ион
NaOH 
Ba(OH)2
NH3·H2O 
Кислоты. Кислоты исторически получили своё название из-за кислого вкуса водных растворов тактх веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остатка
H2SO4
CH3COOH 
Соли. С точки зрения теории электролитической реакции соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
Соль -> Катион основания + Анион кислотного остатка
BaCl2
K2CO3
Амфотерность — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H + ), так и по механизму оснований (отщепление гидроксид-ионов, OH – ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
H + + XO − ⇄ XOH ⇄ X + + OH −
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2 ⇄ NO + + OH − Kb ≈ 10 − 7
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы.
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротоли:
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
H2N — CH(R) — COOH + H2O ⇄ [ H3N — CH(R) — COOH ] + + OH −
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3 + являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома (III) известны реакции:
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами H2O и OH – . Например, для Al(OH3) ионные равновесия могут быть записаны следующим образом:
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Окислительно-восстановительные реакции. Понятие «степень окисления». Типы окислительно-восстановительных реакций (привести примеры).
Окислительно-восстановительные реакции, также редокс— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2-х атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окислении вещества в результате отдачи электронов увеличивается его степени окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель +e− ↔ сопряжённый восстановитель.
Восстановление — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель -e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Последнее изменение этой страницы: 2017-02-05; Нарушение авторского права страницы
Свойства кислот, оснований и солей
Рис. 78. Прибор для сравнения силы различных кислот по скорости выделения водорода
В предыдущих параграфах мы познакомились с теорией электролитической диссоциации. Рассмотрим теперь в свете этой теории свойства тех веществ — кислот, оснований и солей, которые являются электролитами в водных растворах.
1. Кислоты. Как известно, для кислот характерны следующие свойства:
б) способность изменять цвета многих индикаторов, в частности окрашивать лакмус в красный цвет;
в) способность растворять некоторые металлы с выделением водорода;
г) способность взаимодействовать с основаниями, с образованием солей.
Все эти свойства кислоты проявляют только в растворах, и притом почти исключительно в водных растворах. Так, например, сухой хлористый водород или раствор его в бензоле совсем не обладает кислотными свойствами, даже не окрашивает лакмусовую бумажку в красный цвет, а раствор его в воде — соляная кислота — одна из наиболее типичных кислот; точно так же безводная серная кислота совершенно не действует на цинк при обыкновенной температуре, тогда как ее водный раствор энергично реагирует с цинком, выделяя водород.
Но в водных растворах, как мы теперь знаем, присутствуют не молекулы кислот, а главным образом свободные ионы. Понятно, что и свойства таких растворов должны зависеть от свойств отдельных ионов, а не целых молекул.
Так как при диссоциации любой кислоты обязательно образуются водородные ионы, то все свойства, которые являются общими для водных растворов кислот, мы должны приписать водородным ионам, или, точнее, ионам гидроксония. Это они окрашивают лакмус в красный цвет, они вступают в реакцию с металлами, сообщают кислотам кислый вкус и т. д. С устранением водородных ионов, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в водных растворах с образованием ионов водорода и не дающие никаких других положительно заряженных ионов. Последнее добавление необходимо потому, что некоторые кислые соли, как, например, КН2РО4, NaHSО4, также отщепляют в водных растворах ионы водорода, но наряду с ними образуют и положительно заряженные ионы металлов .
Кислоты, у которых ярко проявляются перечисленные выше свойства, называются сильные и кислотами. Так как носителями кислотных свойств являются ионы водорода, то, конечно, кислота будет тем сильнее, чем больше концентрация ионов водорода в ее растворе при данном разбавлении, т. е. чем лучше кислота диссоциирует. Сильными являются, например, соляная и азотная кислоты, которые, вероятно, диссоциированы целиком, но вследствие электрического взаимодействия между ионами их кажущаяся степень диссоциации в 0 ,1 н. растворе равна примерно 92%. Наоборот, такие кислоты, степень диссоциации которых не велика, как, например, уксусная, угольная и др., считаются слабыми.
Таким образом, мерой силы кислот служит степень их диссоциации.
О силе кислот можно судить по различным реакциям. В качестве примера укажем на скорость выделения водорода из различных кислот при взаимодействии их с металлами.
Произведем следующий опыт. Нальем в три маленькие колбочки нормальные растворы соляной, фосфорной и уксусной кислот. Бросив в колбочки по одинаковому кусочку цинка или магния, быстро закупорим их пробками с газоотводными трубками, концы которых подведены под отверстия бюреток, опрокинутых в ванну с водой (рис. 78).
Быстрее всего водород выделяется из соляной кислоты, значительно медленнее из фосфорной и очень медленно из уксусной. Таким образом, если судить о силе кислот по скорости выделения водорода, то наиболее сильной из взятых кислот оказывается соляная, а наименее сильной — уксусная, что вполне согласуется со степенью их диссоциации.
Различие в силе кислот по мере разбавления их растворов водой постепенно сглаживается, так как с увеличением разбавления степень диссоциации всех электролитов растет, приближаясь степень диссоциации и концентрация водородных ионов в растворах HCl к 100%. При очень большом разбавлении все кислоты и основания диссоциированы почти нацело, т. е. одинаково сильны. Отсюда не следует, однако, делать вывода, что чем более разбавлена кислота, тем энергичнее она действует. Дело в том, что действие кислоты определяется концентрацией находящихся в ее растворе ионов водорода, которая, в свою очередь, зависит как от степени диссоциации, так и от общей концентрации кислоты. Хотя с разбавлением раствора степень диссоциации увеличивается, но общая концентрация кислоты уменьшается, и притом обыкновенно быстрее, чем растет первая. Поэтому в разбавленных растворах концентрация водородных ионов всегда меньше, чем в концентрированных. В сказанном легко убедиться хотя бы на примере соляной кислоты (табл. 13).
2. Основания. Водные растворы оснований обладают следующими общими свойствами:
а) своеобразным «мыльным» вкусом;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты, например окрашивать лакмус в синий цвет;
в) способностью взаимодействовать с кислотами с образованием солей.
Так как общим для всех растворов оснований является присутствие в них гидроксильных ионов, то ясно, что носителем щелочных свойств является ион гидроксила. Поэтому с точки зрения ионной теории основания — это электролиты, диссоциирующие в водных растворах с отщеплением гидроксильных ионов .
Сила оснований, как и сила кислот, зависит от степени их диссоциации. Наиболее сильные основания — едкий натр и едкое кали, которые в водных растворах, вероятно, диссоциируют полностью, хотя кажущаяся степень их диссоциации в 0,1 н. растворах составляет около 90%. Большинство оснований являются слабыми электролитами.
3. Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от ионов гидроксила. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не
| Концентрация НCl | Степень диссоциации в % | Концентрация водородных ионов в г-ион/л |
| 10 н. 0,1 н. | 12 92 | 1,2 обладают общими свойствами. Как правило, соли хорошо диссоциированы, и тем лучше, чем меньше валентность образующих соль ионов. Вы читаете, статья на тему Свойства кислот, оснований и солей Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.Кислоты. Для кислот характерны следующие общие свойства:
Константы диссоциации некоторых сильных кислот в водных растворах при 25 °С Константа диссоциации К |
- в) способность изменять цвета индикаторов, в частности вызывать красную окраску лакмуса;
- г) кислый вкус.
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т.д. C устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее.
Из сравнения данных, приведенных в табл. 12 и 14, видно, что величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации H2SO4 — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале IO -4 —10“ 2 , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
- а) способностью взаимодействовать с кислотами с образованием солей;
- б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
- в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, очевидно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
а при взаимодействии с гидроксидом натрия — цинкат натрия:
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами. К таким гидроксидам, кроме гидроксида цинка, относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно выразить схемой:
Таким образом, в растворе амфотерного электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионов, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы H + . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН
. Например, при растворении хлорида гидроксомагния диссоциация протекает согласно уравнениям:
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима. В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства оснований. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в неводных средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теорий кислот и оснований принадлежит протонная теория, созданная в 1923 г.
Согласно протонной теории, кислотой является донор протона, т.е. частица (молекула или ион), которая способна отдавать ион водорода — протон, а основанием — акцептор протона, т.е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Связанные этим соотношением основание и кислота называются сопряженными. Например, ион НСО4 является основанием, сопряженным кислоте H2SO4.
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион Cl — — основание, сопряженное кислоте НС1, а ион NH4 — кислота, сопряженная основанию NH3.
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду NH3-H2O-HF эта энергия максимальна для NH3 и минимальна для HF. Поэтому в смеси с NH3 вода функционирует как кислота, а в смеси с HF — как основание:
Урок «Свойства оксидов и оснований с составе ТЭД и процессов ОВ»
за привлеченного слушателя на курсы профессиональной переподготовки
Урок 5 Тема Свойства оксидов и оснований в составе ТЭД, и процессов ОВ.
Цель урок: Формирование понятия об оксидах и основаниях как классе электролитов, о классификации в-в по различным признакам; об их химических свойствах; развитие умений сравнивать, анализировать, делать выводы, развитие навыков работы с химическими реактивами и химическим оборудованием, совершенствование умений написания формул веществ, уравнений химических реакций.
Давайте вспомним, что оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Следовательно, оксиды – это бинарные соединения.
По агрегатному состоянию
Жидкими- вода, твердого оксида SiO 2 ( IV ), кварц
газообразных оксидов являются CO , CO 2 , SO 3
По химическим свойствам оксиды делятся
Солеобразующие несолеобразующие. не реагируют с
кислотами и основаниями не образуют
солей CO , N 2 O , NO .
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов I и II A группы, а также оксиды металлов с небольшими степенями окисления (+1, +2). Кроме того, все основные оксиды являются твёрдыми веществами.
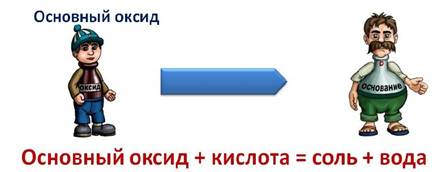
Основные оксиды + кислота + соль и вода. CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
Основные оксиды + кислотными оксидами = соли.
Основные оксиды + водой = щелочей. (искл нерастворимое основание CaO + H 2 O = Ca ( OH ) 2
CaO + H 2 O = Ca 2+ + 2 OH —
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Кислотные оксиды + основания, = соль и вода. CO 2 + Ca(OH) 2 = CaCO 3 ↓ + H 2 O
CO 2 + Ca 2+ + 2OH — = CaCO 3 ↓ + H 2 O
Кислотные оксиды + основными оксидами= соли.
кислотные оксиды + водой = кислота, только если оксид растворим в воде
Основания — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. Т.е – это электролиты, при диссоциации которых в качестве аниона образуется гидроксид-анион
Основания : растворимые (щелочи) и нерастворимые
В зависимости от степени электролитической диссоциации различают сильные основания , к ним относятся щёлочи, степень диссоциации этих оснований стремиться к единице. К слабым основаниям относятся основания, степень диссоциации которых стремиться к нулю, к таким основаниям относятся нерастворимые в воде основания, водный раствор аммиака (NH 3 · H 2 O).
По числу гидроксогрупп основания делятся на однокислотные , у которых одна группа ОН — , например, NaOH, KOH, LiOH. Двукислотные , у которых две группы ОН — , например, Ca(OH) 2 , Mg(OH) 2 , Cu(OH) 2 .
Все основания по агрегатному состоянию являются твёрдыми веществами , имеющими различную окраску. Исключение составляет только раствор аммиака в воде , представляющий собой всем известный нашатырный спирт . Это основание, в отличие от других, содержит не катион металла, а катион аммония (NH 4 + ) и существует только в растворе. Он легко разлагается на аммиак и воду.
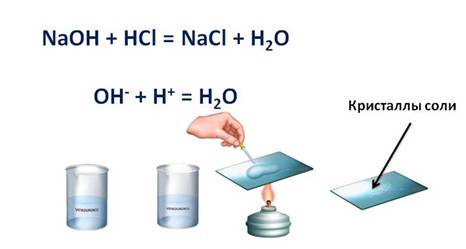
Основания + кислота = соль и вода. NaOH + HCl = NaCl + H2O
нерастворимые основания + кислотами= соль (в осадке) вода
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но при этом, должны выполняться определённые условия, т.е. должен образоваться осадок или слабый электролит.
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду.
— Какие вещества называются оксидами, основаниями?
— Какие группы оксидов, оснований вам известны?
— Дайте определение оксидов каждой группы.
— Какие химические свойства оксидов вам известны? К каким классам веществ относятся образованные при этом вещества?
— Какие химические свойства оснований вам известны? К каким классам веществ относятся образованные при этом вещества?
1. Из предложенного списка выпишите кислотные и основные оксиды и назовите их: NaOH , CO 2 , HNO 3 , А l 2 O 3 , NaCl , SO 2 , NO 2 , K 2 O , CuCl 2 .
2. Запишите формулы оксидов, соответствующих следующим кислотам: H 2 SO 4 , H 2 CO 3 , H 2 SiO 3 , HNO 3 . Назовите оксиды.
3. Предложите уравнения реакций, с кислотными оксидами, щелочами, нерастворимыми основаниями
Рефлексия и подведение итогов:
1. Что нового об оксидах и основаниях вы сегодня узнали?
2. Как бы вы оценили свой уровень знаний по теме урока?
а) высокий; б) средний; в) низкий.
Домашнее задание: повторить записи в тетради
Свойства оксидов, кислот, оснований и солей в свете ТЭД и процессов окисления-восстановления
Урок 4. Химия 9 класс
Конспект урока «Свойства оксидов, кислот, оснований и солей в свете ТЭД и процессов окисления-восстановления»
Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления-восстановления.
Сегодня мы с вами повторим химические свойства оксидов, кислот, оснований и солей.
Оксиды всегда состоят из двух элементов, один из которых – обязательно кислород. В состав оксида может входить как металл, так и неметалл. Если в состав оксида входит неметалл, то тогда он чаще всего является кислотным, если в составе оксида металл с валентностью меньше четырёх, то тогда оксид считается основным. А вот если валентность металла высокая, то тогда этот оксид будет не основным, а кислотным.
А амфотерные оксиды могут быть и кислотным и основным, в зависимости от того, с чем они вступает в реакцию. Если они вступает в реакцию с кислотой или кислотным оксидом, то тогда проявляют основные свойства, а если они реагирует с основными оксидами или основаниями, то тогда проявляют кислотные свойства.
У амфотерных, кислотных и основных оксидов много общего, ведь они являются солеобразующими оксидами. А вот такие оксиды, как оксид углерода (II) – CO, оксид азота (I) – N2O, оксид азота (II) – NO и оксид кремния (II) – SiO являются несолеобразующими, они не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей.
Основным оксидам соответствуют основания. Они вступают в реакции обмена с кислотами. При этом образуется соль и вода.
Например, если поместить в пробирку немного порошка оксида меди (II), он чёрного цвета, и в эту пробирку налить раствора серной кислоты и слегка нагреть, то постепенно проходит реакция, т.к. порошок начинает растворяться. Чтобы убедиться в том, что в результате реакции образуется соль, несколько капель содержимого пробирки поместим на предметное стекло и выпарим, после чего на стекле появляются кристаллы соли.
CuO + 2H + = Cu 2+ + H2O
Кроме этого, они вступают в реакции соединения с кислотными оксидами, при этом образуются соли.
Например, при взаимодействии оксида натрия (Na2O) с оксидом фосфора (V) (P2O5) образуется соль – фосфат натрия (Na3PO4), в результате взаимодействия оксида магния (MgO) с оксидом серы (VI) (SO3) образуется соль – сульфат магния (MgSO4), а при взаимодействии оксида кальция (CaO) с оксидом углерода (IV) (CO2) образуется соль – карбонат кальция (CaCO3).
Они вступают в реакции соединения с водой с образованием щелочей. Если образуется нерастворимое основание, то такая реакция не идёт.
Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция (CaO), а в другую оксид меди (II) (CuO), то реакция у нас идёт только в первой пробирке. Так как образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.
CaO + H2O = Ca 2+ + 2OH —
Кислотным оксидам соответствуют кислоты.
Они вступают в реакции обмена с основаниями, при этом образуется соль и вода.
Если через пробирку с известковой водой (Ca(OH)2) пропустить углекислый газ (CO2) , то известковая вода мутнеет, следствие образования соли – карбоната кальция (CaCO3).
А также они реагируют с основными оксидами, при этом образуются соли. Например, в результате взаимодействия оксида серы (IV) (SO2) и оксида калия (K2O) образуется соль – сульфит калия (K2SO3), в результате взаимодействия оксида кремния (IV) (SiO2 ) с оксидом натрия (Na2O) при нагревании, образуется соль – силикат натрия (Na2SiO3), при взаимодействии оксида азота (V) (N2O5) с оксидом бария (BaO), образуется соль – нитрат бария (Ba(NO3)2).
Кроме этого, они вступают в реакции соединения с водой, при этом образуются кислоты, однако эти реакции возможные, если оксиды растворимы в воде. Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в другую – раствор углекислого газа (СО2) (газированной воды). В первую пробирку добавим оксида кремния (IV) (SiO2). А затем в каждую из пробирок добавим несколько капель лакмуса. В первой пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит во второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что оксид кремния (IV) (SiO2) не растворим в воде.
А вот оксид цинка (ZnO) реагирует и с кислотами и с основаниями. Например, в реакции с соляной кислотой (HCl) он образует соль – хлорид цинка (ZnCl2), а в реакции с раствором гидроксида натрия (NaOH) образую комплексную соль – тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), а при сплавлении с гидроксидом натрия он образует цинкат натрия (Na2ZnO2). Но с водой он не реагирует. Зато, он реагирую и с основными оксидами и с кислотными оксидами и образует при этом соли. Например, в реакции с оксидом калия (K2O), он проявляет кислотные свойства т.е. свойства кислотного оксида, в результате реакции образуется соль – цинкат калия (K2ZnO2), а в реакции с оксидом серы (VI) (SO3), он проявляет свойства основного оксида, в результате образуется соль – сульфат цинка (ZnSO4).
Кислоты всегда начинается с водорода, окрашивают лакмус и метиловый оранжевый в красный цвет, ведь в их составе есть ион водорода (H + ), который всегда образуется при диссоциации.
Так, при диссоциации соляной кислоты (HCl), образуется ион водорода и хлорид-ион (Cl — ), при диссоциации азотной кислоты (HNO3), тоже ион водорода и нитрат-ион (NO3 — ), при диссоциации азотистой кислоты (HNO2) – ион водорода и нитрит-ион (NO2 — ).
Именно поэтому, кислоты окрашивают лакмус и метиловый оранжевый в красный цвет.
Они реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия (NaOH) добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты (HCl), то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
Аналогично они реагируют с нерастворимыми основаниями. Но для этого, сначала необходимо его получить, например, получим нерастворимое основание – гидроксид железа (III) (Fe(OH)3). Для этого, в раствор сульфата железа (III) (Fe2(SO4)3) добавим несколько капель гидроксида калия (КOH), при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты (HCl), осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III) (FeCl3).
Кислоты также вступают в реакции обмена с оксидами металлов. В результате реакции образуется соль и вода. Эта реакция вам уже знакома, наверняка оксиды, вам уже всё рассказали об этом.
Кислота + оксид металла = соль + вода
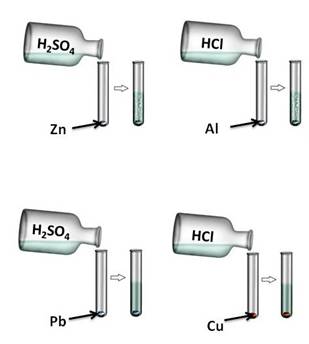
Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для протекания данных реакций необходимо выполнение ряда условий:
· металл находиться в ряду напряжений до водорода
· должна получиться растворимая соль
· если кислота нерастворимая, то она не может вступить в реакцию с металлами.
Давайте, попробуем проверить. Поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую – алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты (H2SO4), во вторую и четвёртую – раствора соляной кислоты (HCl). Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn 0 + 2H + = Zn 2+ + H2 0 ↑
2Al 0 + 6H + = 2Al 3+ + 3H2 0 ↑
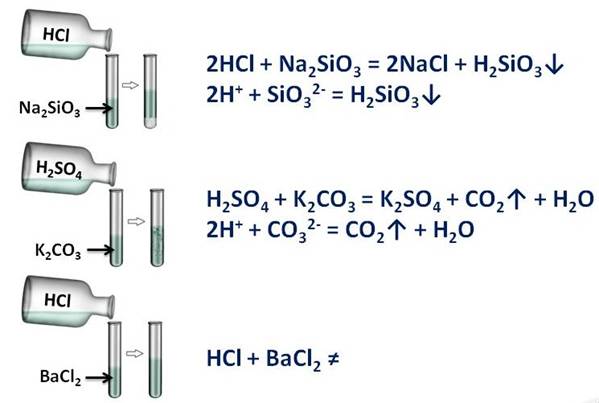
Кислоты вступаем в реакции обмена с солями, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Соляна (HCl) и серная кислоты (H2SO4), вам покажут это: в первой пробирке будет соляная кислота и силикат натрия (Na2SiO3), во второй – серная кислота и карбоната калия (K2CO3), в третьей – опять соляной кислоты и хлорида бария (BaCl2). Посмотрим за изменениями. В первой пробирке мы наблюдаем образование студенистого осадка (H2SiO3), во второй – выделение газа (CO2), а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
В составе оснований всегда есть гидроксигруппа (ОН — ), лакмус окрашивают они в синий цвет, метиловый оранжевый – в жёлтый, а фенолфталеин – в малиновый. При диссоциации оснований образуется катион металла (Ме n + ) и анион гидроксогруппы (ОН — ).
Щёлочи — растворимые в воде основания, реагируют с кислотами, об этой реакции нейтрализации вы уже знаете. А также реагируют с кислотными и амфотерными оксидами. При этом образуются соли. Отличительной их особенностью является то, что они реагируем и с амфотерными основаниями, но тогда они ведут себя, как кислоты. Например, реакция гидроксида натрия (NaOH) и гидроксида цинка (Zn(OH)2).
В этой реакции образуется комплексная соль – тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), а если эта реакция идёт при нагревании, то тогда образуется цинкат натрия (Na2ZnO2).
Щёлочи вступаем в реакцию обмена с солями, при этом образуется новая соль и новое основание, но для этого нужно, чтобы образовался осадок или слабый электролит. Если в одну пробирку с гидроксида натрия добавить хлорида аммония (NH4Cl), во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III) (Fe2(SO4)3), а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2) и содержимое первой пробирки нагреем, то в результате появляется резкий запах аммиака (NH3). Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло.
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Нальём в пробирку раствора сульфата меди (II) (CuSO4), затем сюда же добавим несколько капель гидроксида натрия. Образуется осадок голубого цвета. Это гидроксид меди (II) (Cu(OH)2).
Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II) (CuO).
А вот соли – особый класс. Они тоже диссоциируют, но при этом образуют катион металла (Ме n + ) и анион кислотного остатка (Кисл.ост. n — ).
МеКисл.ост. = Ме n + + Кисл.ост. n —
В реакциях солей с солями образуются новые соли, в реакциях с кислотой – образуется новая кислота, в реакциях с основаниями образуется новая соль и новое основание.
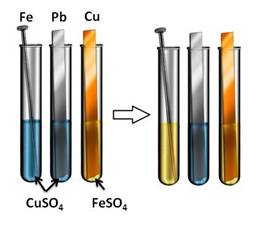
Они вступают в реакции замещения с металлами. Но нужно быть внимательным и обязательно пользоваться рядом активности металлов. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в этом ряду.
При этом должны соблюдаться условия:
· обе соли (и реагирующая, и образующаяся) должны быть растворимыми
· металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).
Посмотрим, как это происходит: в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II) (CuSO4), а в третью – раствор сульфата железа (II) (FeSO4). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe 0 + Cu 2+ = Fe 2+ + Cu 0 ↓
А теперь, вам несложно будет отгадать,
о каком классе соединений идёт речь.
Известны ли вам дети
Какие есть оксиды на планете?
У оксидов пристрастия разные
То кислоты им нравятся праздные
То к воде их душа склоняется –
скажите, как они называются? (Основные оксиды)
А эти спешат к основаниям,
Растворимые, очень желанные,
Но с водой дружбу водят не все
Назовите оксиды теперь. (Кислотные оксиды.)
- http://studfiles.net/preview/2180772/page:8/
- http://infopedia.su/17x4d38.html
- http://znaesh-kak.com/x/x/%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B9-%D0%B8-%D1%81%D0%BE%D0%BB%D0%B5%D0%B9
- http://bstudy.net/634904/estestvoznanie/svoystva_kislot_osnovaniy_soley_tochki_zreniya_teorii_elektroliticheskoy_dissotsiatsii
- http://infourok.ru/urok-svoystva-oksidov-i-osnovaniy-s-sostave-ted-i-processov-ov-3181202.html
- http://videouroki.net/video/4-svoistva-oksidov-kislot-osnovanii-i-soliei-v-svietie-ted-i-protsiessov-okislieniia-vosstanovlieniia.html