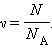2. В чем отличие реальной жидкости от идеальной?
3. Объясните молекулярно-кинетический механизм вязкости.
4. В каких единицах измеряется коэффициент вязкости?
5. От чего зависит коэффициент вязкости?
6. Каким уравнением описывается сила внутреннего трения между слоями жидкости, движущимися с разными скоростями?
7. Сформулируйте законы Стокса и Пуазейля.
8. Применимы ли уравнения переноса, полученные для газа и для жидкости?
9. Каков физический смысл коэффициента вязкости?
10. Знать порядок выполнения работы.
В в е д е н и е
Рассмотрим механизм возникновения внутреннего трения (вязкости) в жидкостях. Молекулы в жидкостях, интенсивно взаимодействуя между собой, находятся на значительно меньших расстояниях относительно друг друга, чем молекулы газа.
Характер теплового (хаотического) движения молекул в жидкостях существенно отличается от теплового движения молекул газа. Молекулы жидкости большую часть времени колеблются около своего положения равновесия. Вследствие хаотичности движения скорости и амплитуды колебаний соседних молекул различны, и время от времени соседние молекулы расходятся настолько, что некоторые из них оказываются на расстояниях порядка диаметра молекул (перескакивают) и начинают колебаться около нового положения равновесия.

Из молекулярно-кинетической теории следует, что существование внутреннего трения связано с переносом количества движения молекулами из слоя в слой вследствие теплового движения. В газах перенос количества движения происходит при переходе молекул из одного слоя в другой, что и определяет внутреннее трение между слоями. В жидкостях молекулы большую часть времени находятся около положения равновесия и этот механизм играет незначительную роль. Основной причиной возникновения сил трения в жидкостях является сильное взаимодействие между молекулами отдельных слоев. Движущийся слой жидкости увлекает соседние слои в основном за счет сил сцепления. Коэффициент вязкости жидкости зависит от природы жидкости и от температуры. С ростом температуры коэффициент вязкости жидкости уменьшается (у газов возрастает). Зависимость его от температуры жидкости дается формулой Френкеля:
= Bexp(
здесь B — константа, k — постоянная Больцмана, Е — энергия активации: минимальная энергия, необходимая молекуле для преодоления сил взаимодействия с ближайшим окружением и перескока в новое положение равновесия. Величина Е
(2-3)*10 -20 Дж, поэтому при нагревании жидкости на 10 градусов вязкость падает на 20-30%. В таблице 1 приведены некоторые характерные значения вязкости.
Читайте также:
- I. Теория моментов
- II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
- Labeling — теория стигматизации
- V. Очистка жидкостей перегонкой
- V1:Теория
- Vi ТЕОРИЯ ЭКОНОМИЧЕСКОГО АНАЛИЗА
- А. МАСЛОУ И ТЕОРИЯ САМОАКТУАЛИЗАЦИИ
- Аналитическая теория личности
- АНГЛИЙСКИЙ ЛИБЕРАЛИЗМ. ТЕОРИЯ УТИЛИТАРИЗМА И.БЕНТАМА. ДЖ.МИЛЛЬ О СВОБОДЕ
- Атомно-молекулярное учение
- Атомно-молекулярное учение. Атом. Молекула. Химический элемент. Простое и сложное вещество. Относительная атомная и молекулярная масса. Моль
- Бихевиористская теория Дж. Уотсона
Вещество находится в жидком состоянии, если средняя кинетическая энергия теплового движения его молекул примерно равна средней потенциальной энергии их взаимодействия.
До настоящего времени законченной количественной теории жидкого состояния нет, на качественном же уровне МКТ может объяснять явления, происходящие с жидкостями.
1. Из-за того, что расстояние между молекулами жидкости малы, увеличиваются силы притяжения молекул друг к другу, поэтому жидкости в отличие от газов обладают собственным объёмом, практически несжимаемы, плотность жидкостей при обычных условиях в сотни и тысячи раз больше плотности газов.
2. Вблизи каждой молекулы другие молекулы располагаются в определённом порядке, в целом в жидкости именно такой порядок не сохраняется, поэтому говорят, что в расположении молекул жидкости имеется ближний порядок и отсутствует дальний порядок.
3. Молекулы жидкости совершают хаотическое движение вблизи некоторого положения равновесия (колебания), изредка переходя в новое состояние равновесия (совершают перескоки), которые происходят случайным образом. Если на жидкость действует сила, например, сила тяжести, то перескоки происходят в направлении силы. Этим объясняется текучесть жидкости.
4. На границе с газом жидкость образует свободную поверхность. Поверхностный слой жидкости – резкая граница, отделяющая жидкость от газа над ней, существует из-за большого различия плотностей жидкости и газа (например, .
Поверхностный слойпредставляет собой подобие упругой плёнки из самой жидкости (можно положить осторожно, не нарушая слоя, иголку или лезвие бритвы на поверхность воды). Благодаря существованию поверхностного слоя возможно образование капли, мыльного пузыря, движение насекомых (водомерки) по поверхности воды.
Основное свойство поверхностного слоя: он стремится сократиться и принять наименьшую площадь поверхности при данном объёме. Из всех тел при данном объёме наименьшая площадь поверхности у шара, вот почему капля жидкости, мыльный пузырь в невесомости имеют форму шара.
МКТ объясняет существование поверхностного слоя так: молекулы на поверхности жидкости находятся в особых условиях по сравнению с молекулами её внутренних слоёв. Внутри жидкости результирующая сила притяжения, действующая на молекулу со стороны соседних молекул, равна нулю. У «поверхностных» молекул соседних молекул «сверху» меньше, чем «снизу». Молекулы поверхностного слоя под действием результирующей силы, втягиваются внутрь жидкости. В результате они оказывают молекулярное давление на жидкость, стягивая её поверхность до минимума. Этот эффект называется поверхностным натяжением.
Поверхностное натяжение обуславливает наличие у молекул поверхностного слоя дополнительной потенциальной энергии – поверхностной энергии.
Дополнительнаяпотенциальная энергия равна той работе, которуюнужно было бы совершить, чтобы молекулам из глубиныподняться к поверхности, преодолевая силу молекулярного давления на поверхности жидкости.
— поверхностная энергия, ,
где — площадь поверхностного слоя, — коэффициент поверхностного натяжения.
Все тела стремятся к положению устойчивого равновесия, которое определяется минимумом потенциальной энергии. Условием устойчивого равновесия жидкости является минимум потенциальной поверхностной энергии. Уменьшение поверхностной энергии достигается сокращением площади поверхностности жидкости, этим объясняется основное свойство поверхностного слоя.
В поверхностном слое действует сила поверхностного натяжения– сила, которая действует вдоль поверхности жидкости, перпендикулярно линии, ограничивающей поверхность и стремящаяся сократить её до минимума.
Например, поверхность жидкости в стакане цилиндрической формы (вид сверху):
— сила поверхностногонатяжения
Опыт показывает, что сила поверхностного натяжения пропорциональна длине линии, ограничивающей поверхность жидкости – .
, где — коэффициент поверхностного натяжения или поверхностное натяжение
Поверхностное натяжение зависит:
1. от природы граничащих сред, для двух граничащих сред величина постоянная, поскольку чаще всего жидкости граничат с воздухом, то поверхностное натяжение зависит от рода жидкости;
2. с повышением температуры поверхностное натяжение уменьшается, т.к. уменьшается плотность жидкости;
3. можно изменить, поменяв химический состав поверхности, например, капнуть на поверхность другую жидкость.
Чем меньше поверхностное натяжение, тем легче жидкость проникает в ткань. Высокая проникающая способность мыльного раствора, позволяющая очищать ткани, объясняется его малым поверхностным натяжением.
Смачивание
Капля воды на стекле растекается, вода смачивает стекло, но не смачивает парафин, промасленную бумагу, воск.
Капля ртути на стекле не растекается и стремится стянуться в шар, ртуть не смачивает стекло, но смачивает медь и цинк.
В сосуде поверхность жидкости искривляется. Мениск —форма поверхности жидкости в сосуде.
У смачивающей жидкости мениск вогнутый:
У не смачивающей жидкости мениск выпуклый:
Смачивание объясняется тем, что молекулы жидкости друг к другу притягиваются слабее, чем к молекулам твёрдого тела.
Не смачивание объясняется тем, что молекулы жидкости друг к другу притягиваются сильнее, чем к молекулам твёрдого тела.
Смачивание –это явление, возникающее вследствие взаимодействия молекул жидкости с молекулами твёрдого тела и приводящее к искривлению поверхности жидкости.
Смачивание поверхности твёрдого тела жидкостью используют, например, при крашении, склеивании, пайке.
Не смачивание учитывают, например, при изготовлении тканей для зонтов, плащей, упаковочного материала для жидких продуктов.
Дата добавления: 2014-11-18 ; Просмотров: 1745 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Молекулярно-кинетическая теория
Молекулярная физика – это раздел физики, в котором законы механики применяются не к каждой отдельной частице вещества, а к их совокупности. При этом используются усреднённые физические величины.
Молекулярно-кинетическая теория (МКТ) – это теория, которая рассматривает строение вещества с точки зрения трёх основных положений.
Основные положения молекулярно-кинетической теории
1. Все вещества состоят из частиц (молекул, атомов);
Атом – наименьшая частица химического элемента, которая обладает его свойствами.
Молекула – наименьшая частица вещества, которая обладает его химическими свойствами.
В состав молекулы может входить различное число атомов. Так, молекулы углерода и инертных газов одноатомны, молекулы таких веществ, как водород и азот – двухатомны, воды – трехатомны и т.д. Молекулы наиболее сложных веществ – высших белков и нуклеиновых кислот – построены из сотни тысяч атомов. При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико.
Молекула определенного вещества имеет иные физические свойства нежели само вещество. Такие свойства, как температура плавления и кипения, механическая прочность и твердость, определяются прочностью связи между молекулами в данном веществе при данном его агрегатном состоянии . Поэтому применение подобных понятий к отдельной молекуле не имеет смысла.
Плотность – это свойство, которым отдельная молекула обладает и которое можно вычислить. Однако плотность молекулы всегда больше плотности вещества (даже в твердом состоянии), потому что в любом веществе между молекулами всегда имеется некоторое свободное пространство.
Электрическая проводимость, теплоемкость, определяются не свойствами молекул, а структурой веществ в целом. Эти свойства сильно изменяются при изменении агрегатного состояния вещества, тогда как молекулы при этом не претерпевают глубоких изменений. Таким образом, понятия о некоторых физических свойствах не применимы к отдельной молекуле, но сами эти свойства по своей величине различны для молекулы и вещества в целом.
Не во всех случаях частицы, образующие вещество, представляют собой молекулы. Многие вещества в твердом и жидком состоянии, например, большинство солей, имеют не молекулярную, а ионную структуру. Некоторые вещества имеют атомное строение. В веществах, имеющих ионное или атомное строение, носителем химических свойств являются не молекулы, а те комбинации ионов или атомов, которые образуют данное вещество.
Доказательства положения:
1. Фотографии поверхности физического тела, сделанные с помощью туннельного микроскопа (был создан в середине 80-х годов сотрудниками знаменитой компьютерной фирмы IBM (г. Цюрих) Г. Биннингом и Г. Рорером, удостоенными за его изобретение Нобелевской премии);
2. Закон постоянных отношений Джона Дальтона.
Первое убедительное, хотя и косвенное, доказательство существования атомов и молекул было получено английским химиком Д. Дальтоном (1766—1844). Дальтон объяснил закон постоянных отношений. Согласно этому закону при образовании любых химических соединений массы реагирующих веществ находятся в строго определенных отношениях. Так, например, при образовании воды из водорода и кислорода отношение масс прореагировавших газов водорода и кислорода всегда равно 1:8. Этот факт становится понятным лишь в том случае, если допустить, что при образовании мельчайшей частички воды — молекулы — некоторое определенное число атомов водорода соединяется с определенным числом атомов кислорода. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Поэтому отношение масс водорода и кислорода при образовании воды должно быть равно отношению удвоенной массы атома водорода к массе атома кислорода. Это отношение не может измениться ни при каких условиях.
2. Молекулы (атомы) вещества находятся в беспрерывном хаотическом (тепловом) движении;
Характер движения зависит от агрегатного состояния вещества, а скорость – от температуры.
Доказательства положения:
Явление диффузии, броуновское движение, осмос.
Диффузия – процесс проникновения молекул одного вещества в межмолекулярные промежутки другого вследствие теплового движения частиц этих веществ.
Осмос – односторонняя диффузия через полупроницаемую перегородку (мембрану), которая отделяет раствор от чистого растворителя или раствора меньшей концентрации.
Обусловлен стремлением системы к термодинамическому равновесию и выравнивания концентрации раствора с обеих сторон мембраны. Характеризуется осмотическим давлением, которое равно избыточному внешнему давлению, которое необходимо создать со стороны раствора, чтобы прекратить осмос. Играет важную роль физиологических процессах, используется при исследовании полимеров, биологических структур. Благодаря осмосу питательные вещества и вода из пищеварительного тракта проникают в организм и непосредственно в клетки живых существ, вода из почвы проникает в корни растений и т.д.
3. Молекулы (атомы) взаимодействуют между собой, между частицами действуют силы притяжения и отталкивания;
Эти силы действуют одновременно.
На определённом расстояния между молекулами (r) эти силы равны между собой. На расстояниях r r – притяжения.
Доказательства положения:
Существование жидкостей и твердых тел. Силами притяжения и отталкивания молекул объясняются упругость и прочность твердых тел.
Относительная молекулярная (атомная) масса химического элемента
Для определения масс отдельных атомов принята особая единица, которая равна 1/12 массы атома Карбона (углерода). Поскольку атомы одного и того же химического элемента отличаются массой (изотопы), поэтому в таблице Менделеева значения относительных молекулярных (атомных) масс нецелые.
Относительная молекулярная (атомная) масса химического элемента Мr – это число, которое показывает, во сколько раз средняя масса его молекулы m (атома) больше чем 1/12 массы атома Карбона m0C, то есть
Количество вещества
Количество вещества (ν) определяется числом N структурных частиц (атомов, молекул или других частиц) в образце. [ν] = 1 моль.
Моль – это количество вещества, которое содержит столько же структурных частиц данного вещества, сколько атомов Карбона содержится в 12 г углерода.
NА = 6,02·10 23 (моль -1 ) – постоянная Авогадро (количество атомов или молекул в 1 моле любого вещества).
Установлено, что в 12 г углерода содержится 6·10 23 атомов, таким образом, 1 моль води – это 6·10 23 молекул води, 1 моль Сульфура – это 6·10 23 атомов серы).
Согласно закону Авогадро 1 моль идеального газа занимает при нормальных условиях объём 22,4 л/моль.
Молярная масса
Молярная масса М вещества – это величина, которая равна отношению его массы m к соответствующему количеству вещества ν; или молярная масса вещества – это масса одного моля вещества. [М] = 1 г/моль. Тогда
Масса молекулы m вещества связана с его молярной массой соотношением
Масса тела можно выразить через массу одной молекулы и число молекул:
Числовое значение молярной массы вещества совпадает с числовым значением относительной молекулярной (атомной) массой элемента.
Пример, М(CuSO4) = 64 + 32 + 4·16 = 160 г/моль; Мr (CuSO4) = 160
Добавить комментарий Отменить ответ
Для отправки комментария вам необходимо авторизоваться.
Строение жидких, твёрдых и газообразных тел с точки зрения молекулярно-кинетической теории.
Твёрдые тела являются полной противоположностью газам. В них не происходит свободного передвижения частиц. Молекулы находятся в узлах кристаллической решётки. То есть существует строгий периодический порядок в расположении частиц, составляющих твёрдое тело.
3. Жидкости, в отличие от твёрдых тел, обладают ближним порядком в расположении частиц вещества.
Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории
Характеристика тепловых явлений в молекулярной физике. Рассмотрение основных положений молекулярно-кинетической теории. Основной порядок взаимодействия молекул. Изучение строения газообразных, жидких и твердых тел. Описание Броуновского движения.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 16.01.2015 |
| Размер файла | 358,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ГБОУ НПО АО «Профессиональное училище № 1»
РЕФЕРАТ НА ТЕМУ:
«Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории»
Выполнил: Акишин Дмитрий Андреевич
Проверил: Жубрева Лидия Николаевна
1. Тепловые явления в молекулярной физике
2. Основные положения молекулярно-кинетической теории
3. Взаимодействие молекул
4. Строение газообразных, жидких и твердых тел
5. Броуновское движение
1. Тепловые явления в молекулярной физике
тепловой броуновский кинетический твердый
Тепловые явления привлекали внимание людей с древних времён. Умение добывать и поддерживать огонь сделало человека относительно независимым от колебаний температуры окружающей среды. Это было одним из величайших изобретений человечества. Изменение температуры оказывает влияние на все свойства тел. Кроме механических свойств, при изменении температуры меняются и другие свойства тел, например сопротивление электрическому току, магнитные свойства и др. Так, если сильно нагреть постоянный магнит, то он перестанет притягивать железные предметы. Все перечисленные выше и многие другие тепловые явления подчиняются определённым законам. Открытие законов тепловых явлений позволяет с максимальной пользой применять эти явления на практике и в технике. Молекулярно-кинетическая теория. Ещё философы древности догадывались о том, что теплота — это вид внутреннего движения. Но только в ХVIII в. Начала развиваться последовательная молекулярно — кинетическая теория. Цель молекулярно-кинетической теории — объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, беспорядочно движущихся частиц. Большой вклад в развитие молекулярно-кинетической теории был сделан М.В. Ломоносовым. Он рассматривал теплоту как вращательное движение частиц, составляющих тела.
2. Основные положения молекулярно-кинетической теории
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Каждое утверждение строго доказано с помощью опытов. Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или ещё более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в реальности молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займёт всю поверхность, если сосуд велик. Нельзя заставить капельку объёмом 1 мм(в кубе) расплыться так, чтобы она заняла площадь поверхности более 0,6 м(в квадрате). Объём V слоя масла равен произведению его площади поверхности S на толщину d слоя, т.е V=Sd. Следовательно, размер молекулы оливкового масла равен: d = ? 1,7 Ч см.
При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно, объёмом 1.
Диаметр молекулы воды равен примерно 3 Ч . Считая, что каждая молекула воды при плотной упаковке молекул занимает объём капли (1 на объём, приходящийся на одну молекулу:
Размеры атома надо запомнить: D ?см ? м.
3. Взаимодействие молекул
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел. Молекула- это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими.
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличиваются, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул.
При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и между молекулами возникают быстро нарастающие силы отталкивания.
4. Строение газообразных, жидких и твердых тел
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга.
Молекулы с огромными скоростями — сотни метров в секунду -движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т.е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12-10-13 с). С повышением температуры время оседлой жизни молекул уменьшается. Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И. Френкелем, позволяет понять основные свойства жидкостей. Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.8.8). Вот почему жидкость течет и принимает форму сосуда.
Атомы или молекулы твёрдых тел колеблются около определённых положений равновесия, поэтому твёрдые тела сохраняют не только объём ,но и форму
Если соединить центр равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристалической
Кристаллы — это твёрдые тела, атомы или молекулы которых занимают определённое, порядочное положение в пространстве. Поэтому кристаллы имеют плоские грани. Например крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное- это зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Зависимость физических свойств от направления внутри кристалла называют анизотропией. Все кристаллические тела анизотропны.
Монокристаллы и поликристаллы.
Кристаллическую структуру имеют металлы. Если взять большой кусок металла, то на первый взгляд его кристаллическое строении никак не проявляется ни во внешнем виде куска, ни в его физических свойствах
Обычно металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению к друг другу беспорядочно. В результате в объеме, значительно превышающем объем отдельных кристалликов, все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллическим. Одиночные кристаллы называют монокристаллами.
5. Броуновское движение
Броуновское движение- это тепловое движение взвешенных в жидкости( или газе) частиц.
Наблюдения броуновского движения. Английский ботаник Р.Броун (1773-1858) впервые наблюдал это явление 1827 г. Рассматривая в микроскоп взвешенные в воде споры плауна. Позже он рассматривал и другие мельчайшие частицы, в том числе частички камня египетских пирамид. Сейчас для наблюдения броуновского движения используют частички краски гуммируют, которая нерастворима в воде. Эти частички совершают беспорядочное движение. Броуновское движение — тепловое движение, и оно не может прекратиться. С увеличением температуры интенсивность его растёт. Положения частиц, отмеченные точками, определены через равные промежутки времени — 30 с. Броуновское движение можно наблюдать и в газе. Его совершают взвешенные в воздухе частицы пыли или дыма.
Газы — агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек.
Жидкость — агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д.
Твёрдое тело — одно из четырёх агрегатных состояний вещества, отличающееся от др. агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует
1. Физика 10 класс Г. Я Мякишев М. «Просвещение» 2007.
2. Арцимович Л. А., Элементарная физика плазмы, 3 изд., М., 2002;
3. Франк-Каменецкий Д. А., Лекции по физике состояний вещества, М., 2003 (переиздание);
4. Френкель Я. И., Собрание избранных трудов, т. 3, М., 2001;
5. Фишер И.3., Статистическая теория жидкостей, М., 2003;
6. Физика простых жидкостей. Экспериментальные исследования, пер. с англ., М., 2002
Размещено на Allbest.ru
Подобные документы
Основные положения атомно-молекулярного учения. Закономерности броуновского движения. Вещества атомного строения. Основные сведения о строении атома. Тепловое движение молекул. Взаимодействие атомов и молекул. Измерение скорости движения молекул газа.
презентация [226,2 K], добавлен 18.11.2013
Анализ теорий, устанавливающих связи между измеряемыми на опыте величинами и свойствами молекул. Идеальный газ как газ, взаимодействие между молекулами которого пренебрежимо мало. Причины возникновения давления газа в молекулярно-кинетической теории.
презентация [151,4 K], добавлен 08.01.2015
Определения молекулярной физики и термодинамики. Понятие давления, основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Уравнение состояния идеального газа (Менделеева — Клапейрона).
презентация [972,4 K], добавлен 06.12.2013
Основные понятия и определения молекулярной физики и термодинамики. Основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Состояние идеального газа (уравнение Менделеева-Клапейрона).
презентация [1,1 M], добавлен 13.02.2016
Вычисление скорости молекул. Различия в скоростях молекул газа и жидкости. Экспериментальное определение скоростей молекул. Практические доказательства состоятельности молекулярно-кинетической теории строения вещества. Модуль скорости вращения.
презентация [336,7 K], добавлен 18.05.2011
Содержание молекулярно-кинетической теории газов. Химический состав жидкости. Особенности межмолекулярного взаимодействия в данном агрегатном состоянии. Механические и тепловые свойства твердых тел. Практическое применение плазмы — ионизованного газа.
контрольная работа [26,0 K], добавлен 27.10.2010
Характеристика законов Бойля-Мариотта, Бойля-Мариотта, Авогадро. Парциальное давление как давление, которое оказывал бы каждый газ смеси, если бы он один занимал объем, равный объему смеси. Знакомство с положениями молекулярно-кинетической теории газа.
презентация [625,5 K], добавлен 06.12.2016
Изучение корпускулярной концепции описания природы, сущность которой в том, что все вещества состоят из молекул — минимальных частиц вещества, сохраняющих его химические свойства. Анализ молекулярно-кинетической теории газа. Законы для идеальных газов.
контрольная работа [112,2 K], добавлен 19.10.2010
Особенности определения давления газа на стенку сосуда с использованием второго закона Ньютона. Связь этой величины со средней кинетической энергией молекул и их концентрацией. Специфика схематичного вывода основного уравнения упрощенным методом.
презентация [316,6 K], добавлен 19.12.2013
Молекулярная физика как раздел физики, в котором изучаются свойства вещества на основе молекулярно-кинетических представлений. Знакомство с основными особенностями равновесной термодинамики. Общая характеристика молекулярно-кинетической теории газов.
курсовая работа [971,8 K], добавлен 01.11.2013
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Проверено экспертом
твердые : сохраняют форму и объем: молекулы сильно притягиваются , колеблются возле своих мест, упорядоченость в расположении
жидкости : сохраняют объем , но имеют форму сосуда — молекулы способны перескакивать , колебаться , притягиваются слабее , расположены близко , но четкого порядка нетлабо притягиваются
газы : не сохраняют ни формы ни объема, молекулы беспорядочно двигаются , расположены далеко , с
Модель строения жидкости в молекулярно-кинетической теории.
Жидкость — вещество в состоянии, промежуточном между твердым и газообразным. Это агрегатное состояние вещества, в котором молекулы (или атомы) связаны между собой настолько, что это позволяет ему сохранять свой объем, но недостаточно сильно, чтобы сохранять и форму.
Свойства жидкостей.
Жидкости легко меняют свою форму, но сохраняют объем. В обычных условиях они принимают форму сосуда, в котором находятся.
Поверхность жидкости, не соприкасающаяся со стенками сосуда, называется свободной поверхностью. Она образуется в результате действия силы тяжести на молекулы жидкости.
Строение жидкостей.
Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул. Объяснение поведения жидкостей на основе характера молекулярного движения жидкости было дано советским ученым Я. И. Френкелем. Оно заключается в следующем. Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удается совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей. Время оседлой жизни молекулы воды, т. е. время колебания около одного положения равновесия при комнатной температуре, равно в среднем 10 -11 с. Время одного колебания значительно меньше — 10 -12 – 10 -13 с.
Поскольку расстояния между молекулами жидкости малы, то попытка уменьшить объем жидкости приводит к деформации молекул, они начинают отталкиваться друг от друга, чем и объясняется малая сжимаемость жидкости. Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задает их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда.
Строение жидкостей с точки зрения мкт
Молекулярная физика и термодинамика – это по существу две разные по своим подходам, но тесно связанные науки, занимающиеся одним и тем же – изучением макроскопических свойств физических систем, но совершенно разными методами.
В основе молекулярной физики или молекулярно-кинетической теории лежат определенные представления о строении вещества. Для установления законов поведения макроскопических систем, состоящих из огромного числа частиц, в молекулярной физике используются различные модели вещества, например, модели идеального газа.
Молекулярная физика является статистической теорией, т. е. теорией, которая рассматривает поведение систем, состоящих из огромного числа частиц (атомов, молекул), на основе вероятностных моделей. Она стремится на основе статистического подхода установить связь между экспериментально измеренными макроскопическими величинами (давление, объем, температура и т.д.) и микроскопическими характеристиками частиц, входящих в состав системы (масса, импульс, энергия и т.д.).
В отличие от молекулярно-кинетической теории, термодинамика при изучении свойств макроскопических систем не опирается ни на какие представления о молекулярной структуре вещества. Термодинамика является наукой феноменологической . Она делает выводы о свойствах вещества на основе законов, установленных на опыте, таких, как закон сохранения энергии. Термодинамика оперирует только с макроскопическими величинами (давление, температура, объем и т.п.), которые вводятся на основе физического эксперимента.
Оба подхода – термодинамический и статистический – не противоречат, а дополняют друг друга. Только совместное использование термодинамики и молекулярно-кинетической теории может дать наиболее полное представление о свойствах систем, состоящих из большого числа частиц.
Молекулярно-кинетическая теория
3.1. Основные положения МКТ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
 | |||||||
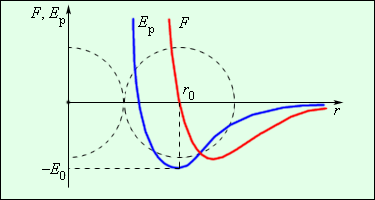
| Рисунок 3.1.1. Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение . Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис. 3.1.1). Теория броуновского движения была создана А. Эйнштейном в 1905 г. Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена, проведенных в 1908–1911 гг. Главный вывод теории А. Эйнштейна состоит в том, что квадрат смещения броуновской частицы от начального положения, усредненный по многим броуновским частицам, пропорционален времени наблюдения . Это соотношение выражает так называемый диффузионный закон . Как следует из теории коэффициент пропорциональности монотонно возрастает с увеличением температуры. Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии . Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O2 и водород H2, то после удаления перегородки начинается процесс взаимопроникновения газов друг в друга, приводящий к образованию взрывоопасной смеси – гремучего газа. Этот процесс идет и в том случае, когда легкий газ (водород) находится в верхней половине сосуда, а более тяжелый (вислород) – в нижней. Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях. В реальных условиях диффузия в жидкостях и газах маскируется более быстрыми процессами перемешивания, например, из-за возникновения конвекционных потоков. Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла. Диффузия и броуновское движение – родственные явления. Взаимопроникновение соприкасающихся веществ друг в друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул. Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы и потенциальной энергии взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис. 3.1.2. При некотором расстоянии сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии , нужно сообщить им дополнительную энергию . Величина называется глубиной потенциальной ямы или энергией связи .
|
- http://studopedia.su/12_63000_molekulyarno--kineticheskaya-teoriya-zhidkostey.html
- http://www.easyphysics.in.ua/10class/molecular_physics/%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE-%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D1%8F/
- http://otvet.mail.ru/question/190715991
- http://revolution.allbest.ru/physics/00507166_0.html
- http://znanija.com/task/2078741
- http://www.calc.ru/Model-Stroyeniya-Zhidkosti-V-Molekulyarnokineticheskoy-Teori.html
- http://physics.ru/courses/op25part1/content/chapter3/section/paragraph1/theory.html