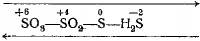Реакции, которые сопровождаются изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Процесс отдачи электронов атомами, ионами или молекулами, который сопровождается повышением степени окисления, называется окислением.
Вещества, в состав которых входят атомы, молекулы или ионы, способные отдавать электроны, называются восстановителями. В процессе отдачи электронов восстановители окисляются.
Процессы окисления выражаются электронными уравнениями:
Zn о — 2e- = Zn 2+ ; 2Cl Ї — 2e- = Cl2 о ;
Fe 2+ — 1e- = Fe 3+ ; MnO4 2 — — 1e- = MnO4-.
Процесс принятия электронов атомами, молекулами или ионами, который сопровождается понижением степени окисления, называется восстановлением. реакция окисление восстановление уравнение
Вещества, в состав которых входят атомы, молекулы или ионы, способные принимать электроны, называются окислителями. В процессе принятия электронов окислители восстанавливаются.
Процессы восстановления также выражаются электронными уравнениями:
S о + 2e- = S 2 -; Cl2 о + 2e- = 2Cl Ї ;
Fe +6 + 3e- = Fe 3+ ; 2H + + 2e- = H2 о .
Окисление и восстановление — это одновременно протекающие процессы, неразделимые во времени. Элементы, которые находятся в низшей степени окисления, могут только окисляться, так как их атомы способны только отдавать электроны. Элементы, которые находятся в высшей степени окисления, могут только восстанавливаться, так как их атомы могут только принимать электроны. Вещества, которые содержат атомы элементов в промежуточных степенях окисления, обладают окислительно-восстановительной двойственностью. Они способны как принимать электроны, в зависимости от партнера и от условий проведения процесса, так и отдавать.
Окислительно-восстановительные процессы
Окислительно-восстановительные процессы (ОВП) играют важную роль в жизнедеятельности организма, поскольку именно в процессах окисления происходит выделение и запас энергии, а восстановительные процессы связаны с биосинтезом белков, нуклеиновых кислот, полисахаридов в организме. Окислительно-восстановительные реакции – это реакции, идущие с переносом электронов и изменением степени окисления элементов.
ОВП состоят из двух одновременно протекающих и противоположно направленных процессов — окисления и восстановления. Окисление – это процесс отдачи электронов, в ходе которого происходит увеличение степени окисления элементов. Восстановление — это процесс присоединения электронов, в ходе которого происходит уменьшение степени окисления элементов. Окислитель – это вещество, атом которого принимает электроны, тем самым уменьшая степень окисления. Восстановитель – это вещество, атом которого отдает электроны, тем самым увеличивая степень окисления. ОВП подразделяются на три типа.
1. Межмолекулярные, в которых окислитель и восстановитель находятся в разных молекулах, например:
окислитель — Mn +7 , восстановитель — N +3 .
2. Внутримолекулярные, в которых окислитель и восстановитель находятся в одной молекуле, но являются разными элементами, например:
2KCl +5 O3 -2 = 2KCl -1 + 3O4 0
окислитель — Cl +5 , восстановитель — O -2 .
3. Диспропорционирования (самоокисления — самовосстановления), в которых окислителем является один и тот же элемент в одной и той же степени окисления, например:
3Cl2 0 + 6KOH = 5КСl -1 + KCl +5 O3 + 3H2O
окислитель — Cl 0 , восстановитель — Cl 0 .
В ходе окислительно-восстановительных процессов между частями системы происходит перераспределение зарядов. Возникающая разность зарядов между частями системы носит название потенциал. Существует несколько видов потенциалов, связанных с прохождением различных процессов.
Одним из них является электродный потенциал, который возникает в том случае, когда пластинку металла погружают в раствор его соли (например, пластинку цинка в раствор сульфата цинка). При этом возможно прохождение двух процессов, которые определяются активностью металла и концентраций его катиона в растворе (рис.1).
Ме Ме
+ _ + _ _
Ме n+ + _ + Ме n+ _ + _
+ _ + _ + _
рис. 1 Виды электродных процессов
Первый процесс происходит в том случае, когда активность металла высока, а концентрация его катиона невелика. В этом случае (см. рис. 1) ионы металла, находящиеся в узлах кристаллической решетки металла, вследствие гидратации будут переходить в раствор, заряжая его положительно; электроны, входящие в состав «электронного газа» (особенности металлической связи) остаются на куске металла, придавая ему отрицательный заряд.
В случае низкой активности металла и высокой концентрации его катиона процесс может идти в другом направлении (см. рис. 2). Катионы металла могут перейти на пластинку, достраивая кристаллическую решетку металла и придавая ей положительный заряд; анионы соли остаются в растворе, заряжая его отрицательно. В обоих процессах между пластинкой металла и раствором его соли возникает разность зарядов, называемая электродным потенциалом Е. Независимо от механизма возникновения электродного потенциала, он определяется окислительно-восстановительным процессом, а его величина — уравнением Нернста:
Me Me n+ + ne —
Zn Zn 2+ + 2e —
где: Е — потенциал системы,
Е 0 — стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
Т — абсолютная температура,
n — число электронов, участвующих в процессе,
R = 8,31 Дж/моль * К,
F = 96500 Кл/моль
[Ме п+ ] — равновесная концентрация соли данного металла.Подставляя постоянные при 25 0 С, получим:
По величине стандартного электродного потенциала все металлы выстраиваются в электрохимический ряд напряжений.
Одним из основных является окислительно-восстановительный потенциал. Его возникновение связано с обратимостью окислительно-восстановительных процессов. Одно и то же вещество в зависимости от условий может находиться либо в окисленной (Oх), либо восстановленной (Red) форме. Между этими двумя формами идут процессы взаимного перехода, сопровождающиеся изменением заряда системы. Процесс взаимного перехода идет до тех пор, пока между двумя формами не установится равновесие:
Red Ox + ne
Fe 2+ Fe 3+ + e
После установления равновесия в системе возникает избыточный заряд, называемый окислительно-восстановительным или редокс-потенциалом. Его величина определяется уравнением Нернста:
где: Е — потенциал системы,
Е 0 — стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
[Red], [Ох] — равновесные концентрации восстановленной и окисленной форм.Любой окислительно-восстановительный процесс можно представить как взаимодействие двух редокс-систем — системы окислителя и системы восстановителя. Направление ОВП будет определяться величинами редокспотенциалов систем.
При этом можно выделить следующие закономерности:
1. Одна и та же редокс-система может являться как окислителем, так и восстановителем — это зависит от соотношения величин потенциалов;
2. Системы с более отрицательным потенциалом будут восстанавливать системы с более положительным потенциалом;
3. После прохождения ОВП потенциалы редокс-систем выравниваются.
Возникновение разности зарядов между частями системы может быть и не связано с прохождением ОВП. Так, в ходе процесса диффузии между частями раствора, вследствие различной подвижности ионов, возникает разность зарядов, называемая диффузным потенциалом. Диффузный потенциал существует недолго и исчезает по окончании процесса диффузии.
Если два раствора разделить полупроницаемой мембраной, то на сторонах мембраны возникает разность зарядов, называемая мембранным потенциалом. Возникновение мембранного потенциала связано с тем, что вследствие различного размера ионов они могут проходить или не проходить через мембрану.
В живых организмах, вследствие наличия многочисленных мембран, направленного транспорта веществ и прохождения различных ОВП между его частями, возникает разность зарядов, называемая биопотенциалами. По своей природе биопотенциалы могут быть диффузными, мембранными и редокспотенциалами. Биопотенциалы играют важнейшую роль в направленном транспорте веществ, работе мембранных систем, процессах биосинтеза, выделение и запасание энергии. Выделение и запасание организмом энергии тесно связано с процессами окисления и восстановления.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8019 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
С точки зрения процессов окисления и восстановления
Опубликовано 13.06.2017 по предмету Химия от Гость >>
Ответ оставил Гость
S(0) + K(+1)Mn(+7)O(-2)4=K(+1)H(+1)S(+6)O(-2)3+Mn(+4)O(-2)2+K(+1)O(-2)H(+1)
Mn(+7)+3e=Mn(+4) !3! !2 восстановление
! !6!
S(0)-6e=S(+6) !6! !1 окисление
S+2KMnO4+H2O=KHSO3+2MnO2+KOH
Если ответа нет или он оказался неправильным по предмету Химия, то попробуй воспользоваться поиском на сайте или задать вопрос самостоятельно.
Если же проблемы возникают регулярно, то возможно Вам стоит обратиться за помощью. Мы нашли великолепную онлайн школу, которую без всяких сомнений можем порекомендовать. Там собраны лучшие преподаватели, которые обучили множество учеников. После обучения в этой школе, Вы сможете решать даже самые сложные задачи.
Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления: 2KMnO4 = K2MnO4 + MnO2 + O2.
Внимание! Решения предоставлены обычными людьми, поэтому в решениях могут быть ошибки или неточности. Используя решения, не забудьте их перепроверить!
- Вконтакте
- Комментарии ( 0 )
Нет комментариев. Ваш будет первым!
| Добавить комментарий |
Разные решения одинаковых (или похожих) задач, собранные с одного ресурса. И будет бесплатно.
Чтобы помочь понять, или хотя бы списать решение на основе решений составить своё, правильное.
Окисление и восстановление
Что такое окисление и восстановление и их связь с периодическим законом Д. И. Менделеева
Все химические реакции, встречающиеся в неорганической химии, можно разделить на два типа:
1) Реакции, протекающие без изменения валентности реагирующих элементов. Сюда относятся реакции, подчиняющиеся правилу: реакции между ионами в растворах электролитов идут практически до конца в сторону образования газов, осадков, слабых электролитов или комплексных соединений (ионов).
1. 2Na • + S» + 2Н • + 2Сl» = ↑H2S + 2Na • + 2Cl‘
Рис. Прибор для осуществления реакции между цинком и свинцовой солью на расстоянии.
В таких реакциях ионы, переходя из одних соединений в другие, не меняют своей валентности, т. е. в таких реакциях конечные продукты состоят из тех же самых ионов, что и исходные, только находящиеся в другой перегруппировке (комбинации). Это зависит от направляющей, или ведущей, реакции. Направляющей, или ведущей, реакцией называется реакция, которая смещает равновесие в одну сторону, т. е. в сторону образования газа, осадка, слабого электролита или комплексного иона.
2) Реакции, протекающие с изменением валентности реагирующих элементов. К данному типу относятся реакции окисления-восстановления.
Окислительно-восстановительные процессы имеют исключительно большое значение в теории и практике.
Получение в технике и лабораторной практике простых веществ (металлов и неметаллов): железа, хрома, марганца, никеля, кобальта, вольфрама, меди, серебра, цинка, серы, хлора, йода и т. д. — основано на восстановлении или окислении их соответствующих соединений. В основе получения ценных химических продуктов, как, например, аммиака, щелочей, сернистого газа, азотной, серной и других кислот, также лежат окислительно-восстановительные реакции. На процессах окисления-восстановления в аналитической химии основаны методы объёмного анализа: перманганатометрия, йодометрия, броматометрия и другие, играющие особо важную роль в контроле за правильным ведением процесса как на производстве, так и при выполнении научных работ. Окисление-восстановление есть один из важнейших процессов живой и мёртвой природы. Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и протекание целого ряда биологических процессов в основе своей представляют те или иные окислительно-восстановительные реакции.
Окисление и восстановление для человека давно стало применимо на практике, вначале не понимая их сущности.
С течением времени (XVII век) развитие металлургии поставило вопрос о необходимости создания теории, которая смогла бы объяснить процессы окисления-восстановления. Вначале была выдвинута (Шталем в 1723 г.) теория флогистона (от греческого слова «флогистос», что значит горючий). Согласно этой теории, все тела, способные гореть и окисляться, содержали особое вещество — флогистон, который из них удалялся при горении или окислении.
Например, при накаливании железа на воздухе флогистон удалялся, а металл превращался в «землистое вещество» — окалину: железо = железная окалина + флогистон.
Добавляя к окисленному веществу (окалине) флогистон, содержащиеся в богатом им материале, например угле, можно получить чистый металл: железная окалина + флогистон = железо.
В эпоху флогистонной теории подробному изучению были подвергнуты различные металлы, окислы и соли, открыто большинство газов. Она привела в систему большинство фактов, известных в то время химикам.
Основным недостатком этой теории было то обстоятельство, что получаемая при прокаливании окалина (окисленный металл) весит больше, чем исходный металл (неокисленный).
Увеличение веса сторонники флогистонной теории пытались объяснить тем, что якобы флогистон имеет «отрицательный вес». Но такое объяснение являлось неправдоподобным и необоснованным. Всё большее число новых открытий либо нельзя было объяснить с точки зрения этой теории, либо они противоречили ей. Поэтому теория флогистона к концу своего почти столетнего господства из фактора прогресса науки превратилась в её тормоз.
Она должна была уступить место новой, более прогрессивной кислородной теории. Первым, кто доказал несостоятельность флогистонной теории, был наш великий русский учёный М. В. Ломоносов.
На основании своих опытов по прокаливанию металлов в присутствии воздуха в запаянных сосудах он доказал, что при окислении металлов частички воздуха соединяются с обжигаемым телом и увеличивают его вес. «Без пропущения внешнего воздуха вес сожжённого металла остаётся в одной мере» (М. В. Ломоносов).
Из опытов Ломоносова вытекало, что увеличение веса при сжигании металлов не может быть объяснено потерей ими флогистона. Затем было установлено, что окисление металла есть не отдача им какого-то флогистона, а соединение металла с кислородом, находящимся в воздухе:
металл + кислород = окись металла (окалина).
К концу XVIII века получила завершение кислородная теория, согласно которой окисление — это процесс соединения вещества с кислородом: 2Сu + O2 = 2СuО, восстановление— отнятие от него кислорода: СuО + Н2 = Сu + Н2O.
Несколько позже под окислением стали разуметь не только присоединение кислорода, но также и отнятие водорода. В свою очередь, и восстановлением стали считать не только отнятие кислорода, но также и присоединение водорода.
Ещё позднее под окислением стали понимать увеличение валентности по кислороду или уменьшение валентности по водороду, и наоборот: под восстановлением — уменьшение валентности по кислороду или увеличение валентности по водороду. Например, сера восстанавливается,
Кислородная теория сыграла огромную роль в химии. В частности, она позволила использовать точные количественные методы в промышленности.
Однако с развитием науки накопилось много фактов, которые нельзя было объяснить и кислородной теорией. Сюда относится огромное число окислительно-восстановительных процессов, протекающих при электролизе, соединение металлов с хлором, бромом, серой и подобными им элементами, восстановление металлов из их бескислородных соединений, как, например:
К концу XIX и началу XX века на смену кислородной теории пришла более совершенная — электронная теория окислительно-восстановительных процессов. Эта теория объяснила окисление и восстановление как процессы, обусловливаемые переходом электронов. Поэтому теперь термину «окисление-восстановление» придают более широкое и глубокое значение. В химических реакциях, протекающих с изменением валентности, происходит переход электронов от одних атомов, молекул или ионов к другим.
Электронно-ионную теорию процессов окисления-восстановления разработали русские учёные Л. В. Писаржевский, Я. И. Михайленко, А. М. Беркенгейм и С. В. Дайн.
Электронно-ионную теорию составляют следующие основные положения:
1. Окислением называется процесс отдачи атомом, молекулой или ионом электронов. Если атом отдаёт свои электроны, то он из нейтрального атома становится положительно заряженным ионом, например S 0 —4ē→S +4 . Если отрицательно заряженный ион теряет электроны, то он переходит либо в нейтральный атом: S —2ē→S 0 , либо в положительно заряженный ион: S -2 — 6ē→S +4 . Если теряет электроны положительно заряженный ион, то величина его положительного заряда увеличивается соответственно числу теряемых им электронов: S +4 — 2ē→S +6 .
2. Восстановлением называется процесс присоединения атомом, молекулой или ионом электронов. Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион: S 0 + 2ē → S -2 . Если положительно заряженный ион принимает электроны, то он переходит либо в положительно заряженный ион низшей зарядности: S +6 + 2ē→S +4 , либо в нейтральный атом: S +6 + 6ē→ 5°, либо в отрицательно заряженный ион: S +6 + 8ē → S -2 .
3. Окислителями служат: нейтральный атом, молекула или ион, принимающие электроны.
4. Восстановителями служат: нейтральный атом, молекула или ион, отдающие электроны.
Для дальнейшего освещения вопроса несущественно, переходят ли электроны с одного атома на другой полностью, т. е. возникает ли чисто ионная связь, или электроны оттягиваются частично к одному из них. Для простоты мы будем говорить только о присоединении или об отдаче электронов.
Окислитель во время реакции сам восстанавливается, а восстановитель окисляется. Окисление невозможно без одновременно протекающего с ним восстановления, и наоборот: восстановление одного вещества невозможно без одновременного окисления другого. Поэтому каждая реакция, сопровождающаяся переходом электронов, является единством двух противоположных процессов: окисления и восстановления. Все такие реакции в настоящее время принято называть окислительно-в осстановительными.
Для того чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, от каких из участвующих в реакции атомов, молекул или ионов и к каким атомам, молекулам или ионам переходят электроны и в каком количестве.
Ответ на поставленные вопросы можно получить, прежде всего руководствуясь периодическим законом Д. И. Менделеева ), а также ионизационными потенциалами.
Статья на тему Окисление и восстановление
Подготовка к ЕГЭ по химии и олимпиадам
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионыметаллов или неметаллов с высокими положительными (как правило, высшими) степенями окисления : кислоты (H N +5 O3, H Cl +7 O4), соли (K N +5 O3, K Mn +7 O4), оксиды ( S +6 O3, Cr +6 O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb 4+ , Fe 3+ , Au 3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn 2+ , Fe 2+ , Cr 2+ ), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S +4 O3) 2– , (НР +3 O3) 2– , в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
К восстановителям , которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления .
2 Al 0 + Fe +3 2O3 → Al +3 2O3 + 2 Fe 0 ,
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
2 Na N +5 O -2 3 → 2 Na N +3 O2 + O 0 2↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, которыйиз разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2 S -2 + S +4 O2 = 3 S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается , а восстановитель окисляется .
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса .
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K + 2 S -2 + 2K + Mn +7 O -2 4 = 2K + 2 Mn +6 O -2 4 + S 0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S -2 -2e = S 0
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций .
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn +7 в кислой среде восстанавливается до Mn +2 , а в щелочной — до Mn +6 );
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N +5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N -3 );
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например , при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстановливается азот N +5 .
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества . Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn 2+ . Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны . В нейтральном растворе марганец восстанавливается до степени окисления +4 , с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6 . Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты . Манганаты придают раствору зеленую окраску .
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S 0 .
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5 ;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P -3 , As -3 = P +5 , As +5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде .
Восстанавливаются соединения хрома (VI) до соединений хрома (III) . Соединения хрома Cr +3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3 , и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6] .
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5 ;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О -2 ). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2 .
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород .
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь) , то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород . Оксид металла образует также при разложении нитрат лития .
Например , разложение нитрата цинка:
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов , расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N +5 , участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород .
Например , разложение нитрата серебра:
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Это пример реакции контрдиспропорционирования .
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N +3 и восстановителя N -3
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании.
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород , в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N +4 ); оксид азота (II) NO (N +2 ); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3 . Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты . При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются .
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например , взаимодействие цинка с очень разбавленной азотной кислотой:
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe . При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами иметаллами средней активности азотная кислота восстанавливается до оксида азота (IV)NO2 ;
Например , окисление меди концентрированной азотной кислотой:
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота(I) N2O ;
Например , окисление натрия концентрированной азотной кислотой:
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO ;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например , взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H + , которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S +4 O2, молекулярная сера S либо сероводород H2S -2 , в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентированная серная кислота восстанавливается до оксида серы (IV).
Например , медь окисляется концентрированной серной кислотой :
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Например , взаимодействие концентрированной серной кислоты с цинком :
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :
- http://studopedia.ru/4_93117_okislitelno-vosstanovitelnie-protsessi.html
- http://shkolniku.com/himiya/task2425290.html
- http://v-gdz.com/himiya/5-9/rassmotrite-zapisannyu-reakciu-s-tochki-zreniya-processov-okisleniya-vosstanovleniya-2kmno4-k2mno4-mno2-o2.html
- http://znaesh-kak.com/x/v/%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5-%D0%B8-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5
- http://chemege.ru/materials/ovr/