Всем нам практически ежедневно приходится сталкиваться с тем или иным проявлением процессом горения. В нашей статье мы хотим более подробно рассказать какие особенности включает в себя данный процесс с научной точки зрения.
Горение является основной составляющим процессом на пожаре. Пожар начинается с возникновения горения, его интенсивность развития как правило путь пройденный огнем, то есть скорость горения, а тушение заканчивается прекращением горения.
Под горением обычно понимают экзотермическую реакцию между горючим и окислителем, сопровождающуюся, по крайней мере, одним из трех следующих факторов: пламенем, свечением, дымообразованием. Из-за сложности процесса горения указанное определение не является исчерпывающим. В нем не учтены такие важнейшие особенности горения, как быстрое протекание лежащей в его основе экзотермической реакции, ее самоподдерживающийся характер и способность к самораспространению процесса по горючей смеси.
Различие между медленной экзотермической окислительно-восстановительной реакцией (коррозия железа, гниение) и горением заключается в том, что последняя протекает настолько быстро, что теплота производится быстрее, чем рассеивается. Это приводит к повышению температуры в зоне реакции на сотни и даже тысячи градусов, к видимому свечению и образованию пламени. По сути так образуется пламенное горение.Если происходит выделение тепла но пламя при это отсутствует, то этот процесс называется тлением.И в том и в другом процессе происходит образование дыма – аэрозоля полного или неполного сгорания веществ. Стоит отметить, что при горении некоторых веществ пламени не видно, а также отсутствует и выделение дыма, к таким веществам относится водород. Слишком быстрые реакции (взрывчатое превращение) также не входят в понятие горения.
Необходимым условием для возникновения горения является наличие горючего вещества, окислителя (при пожаре его роль выполняет кислород воздуха) и источника зажигания. Для непосредственного возгорания необходимо наличие критических условий по составу горючей смеси, геометрии и температуре горючего материала, давлению и др. После возникновения горения в качестве источника зажигания выступает уже само пламя или зона реакции.
Например, метан способен окисляться кислородом с выделением тепла до метилового спирта и муравьиной кислоты при 500-700 К. Однако, чтобы реакция продолжилась, необходимо пополнение теплоты за счет внешнего подогрева. Горением это не является. При нагревании реакционной смеси до температуры выше 1000 К скорость окисления метана возрастает настолько, что выделяющегося тепла становится достаточно для дальнейшего продолжения реакции, необходимость в подводе теплоты извне исчезает, начинается горение. Таким образом, реакция горения, возникнув, способна сама себя поддерживать. Это главная отличительная особенность процесса горения. Другая, связанная с ней особенность — способность пламени, являющегося зоной химической реакции, самопроизвольно распространяться по горючей среде или горючему материалу со скоростью, определяемой природой и составом реакционной смеси, а также условиями процесса. Это основной механизм развития пожара.
Типичная модель горения построена на реакции окисления органических веществ или углерода кислородом воздуха. Множество физических и химических процессов сопровождают горение. Физика это перенос тепла в систему. Окислительные и восстановительные реакции это составляющая природы горения со стороны химии. Отсюда из понятия горение вытекают самые разные химические превращения, включая разложение исходных соединений, диссоциации и ионизации продуктов.
Совокупность горючего вещества или материала с окислителем представляет собой горючую среду. В результате разложения горючих веществ под воздействием источника зажигания происходит образование газопаровоздушной реакционной смеси. Горючие смеси, которые по составу (соотношению компонентов горючего и окислителя) отвечают уравнению химической реакции, называются смесями стехиометрического состава. Они наиболее опасны в пожарном отношении: легче воспламеняются, интенсивнее горят, обеспечивая полное сгорание вещества, в результате чего выделяют максимальное количество теплоты.
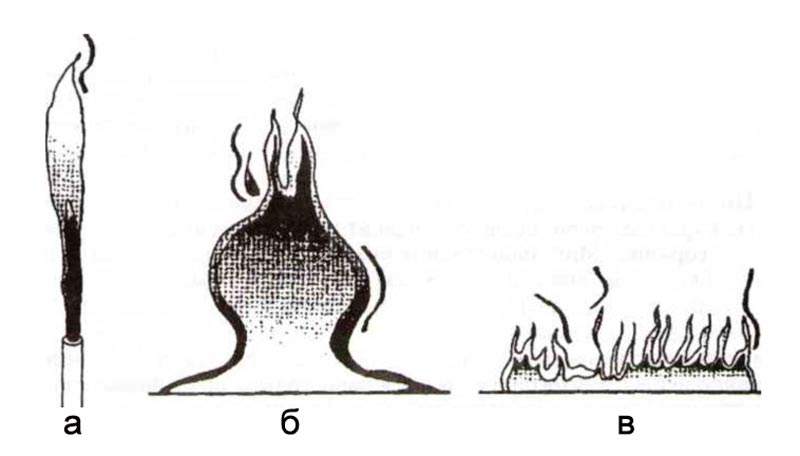
Рис. 1. Формы диффузионных пламен
а – горение реактивной струи, б – горение разлитой жидкости, в – горение лесной подстилки
По соотношению количества горючего материала и объема окислителя различают бедные и богатые смеси: бедные содержат в изобилии окислитель, богатые — горючий материал. Минимальное количество окислителя, необходимое для полного сгорания единицы массы (объема) того или иного горючего вещества, определяется по уравнению химической реакции. При горении с участием кислорода требуемый (удельный) расход воздуха для большинства горючих веществ находится в пределах 4-15 м 3 /кг. Горение веществ и материалов возможно только при обусловленном содержании в воздухе их паров или газообразных продуктов, а также при концентрации кислорода не ниже заданного предела.
Так, для картона и хлопка самопотухание наступает уже при 14 об. % кислорода, а полиэфирной ваты — при 16 об. %. В процессе горения, как и в других химических процессах, обязательны два этапа: создание молекулярного контакта между реагентами и само взаимодействие молекул горючего с окислителем с образованием продуктов реакции. Если скорость превращения исходных реагентов определяется диффузионными процессами, т.е. скоростью переноса (пары горючих газов и кислорода переносятся в зону реакции за счет градиента концентраций в соответствии с законами диффузии Фика), то такой режим горения называется диффузионным. На рис. 1 приведены различные формы диффузионных пламен. При диффузионном режиме зона горения размыта, и в ней образуется значительное количество продуктов неполного сгорания. Если же скорость горения зависит только от скорости химической реакции, которая значительно выше скорости диффузии, то режим горения называется кинетическим. Ему свойственны более высокие скорости и полнота сгорания и как следствие высокие скорости тепловыделения и температура пламени. Этот режим имеет место в предварительно перемешанных смесях горючего и окислителя. Отсюда, если реагенты в зоне химической реакции находятся в одинаковой (обычно газовой) фазе, то такое горение называют гомогенным, при нахождении горючего и окислителя в зоне реакции в разных фазах — гетерогенным. Гомогенным является горение не только газов, но и жидкостей, а также большинства твердых веществ и материалов. Объясняется это тем, что в зоне реакции горят не сами материалы, а их пары и газообразные продукты разложения. Наличие пламени является отличительным признаком гомогенного горения.
Примерами гетерогенного горения служат горение углерода, углистых остатков древесины, нелетучих металлов, которые даже при высоких температурах остаются в твердом состоянии. Химическая реакция горения в этом случае будет происходить на поверхности раздела фаз (твердой и газообразной). Отметим, что конечными продуктами горения могут быть не только оксиды, но и фториды, хлориды, нитриды, сульфиды, карбиды и др.
Характеристики процесса горения разнообразны. Их можно подразделить на следующие группы: форма, размер и структура пламени; температура пламени, его излучательная способность; тепловыделение и теплота сгорания; скорость горения и концентрационные пределы устойчивого горения и др.
Всем известно, что при горении образуется свечение которое сопровождает пламя продукта горения.
Рассмотрим две системы:
- газообразная система
- конденсированная система
В первом случае при возникновении горения весь процесс будет происходить в пламени, во втором же случае часть реакций будет происходить в самом материале, либо его поверхности. Как упоминалось выше существуют газы которые могут гореть без пламени, но если рассматривать твердые вещества существуют также группы металлов которые также способны гореть без проявления пламени.
Часть пламени с максимальным значением, где происходят интенсивные превращения, называется фронтом пламени.
Теплообменные процессы и диффузия активных частиц из зоны горения которые являются ключевыми механизмами движения фронта пламени по горючей смеси.
Скорость распространения пламени принято разделять на:
- дефлаграционное (нормальное), протекающее с дозвуковыми скоростями (0,05-50 м/с)
- детонационное, когда скорости достигают 500-3000 м/с.
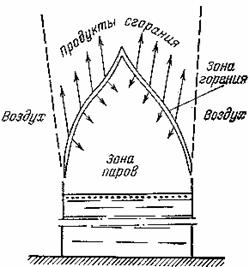
Рис. 2. Ламинарное диффузионное пламя
В зависимости от характера скорости движения газового потока, создающего пламя, различают ламинарные и турбулентные пламена. В ламинарном пламени движение газов происходит в разных слоях, все процессы тепло-, массоообмена происходят путем молекулярной диффузии и конвекции. В турбулентных пламенах процессы тепло-, массообмена осуществляются в основном за счет макроскопического вихревого движения. Пламя свечи — пример ламинарного диффузионного пламени (рис. 2). Любое пламя высотой более 30 см будет уже обладать случайной газовой механической неустойчивостью, которая проявляется видимыми завихрениями дыма и пламени.
Рис. 3. Переход ламинарного потока в турбулентный
Очень наглядным примером перехода ламинарного потока в турбулентный является струйка сигаретного дыма (рис. 3), которая, поднявшись на высоту около 30 см, приобретает турбулентность.
При пожарах пламена имеют диффузионный турбулентный характер. Присутствие турбулентности в пламени усиливает перенос тепла, а смешивание влияет на химические процессы. В турбулентном пламени выше также скорости горения. Это явление делает затруднительным перенос поведения мелкомасштабных пламен на крупномасштабные, имеющих большую глубину и высоту.
Экспериментально доказано, что температура горения веществ в воздухе гораздо ниже температуры горения в атмосферной кислородной среде
В воздухе температура будет колебаться от 650 до 3100 °С, а в кислородной показатели температуры возрастут на 500-800 °С.
Некоторые основные определения
Количество атомов и молекул удобно выражать в терминах количества вещества либо количества молей вещества. Один моль вещества соответствует 6,023∙10 23 частиц (атомов и молекул). Число NА = 6,023 ∙10 23 моль -1 носит название числа Авогадро. Мольная доля хiкомпонента i представляет собой отношение числа молей ni компонента i к полному числу молей n =∑ ni смеси (хi = ni /n ).
Масса m является фундаментальным свойством вещества (единица измерения в системе СИ — килограмм). Массовая доля Wi — это отношение массы mi компонента i к полной массе смеси m = ∑mi (Wi = mi /m).
Молекулярная масса (или молекулярный вес) Mi(г/моль) компонента I — это масса одного моля данного компонента. Так, для атомарного углерода, молекулярного водорода, кислорода и метана имеем: Mc = 12 г/моль, Мн2 = 2 г/моль, Мо2 = 32 г/моль, Мсн4 = 16 г/моль. Средняя молярная масса смеси M (г/моль) может быть выражена через мольные доли компонентов (М = ∑xiMi).
Определение процессов горения
Горение – это сложный физико-химический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с окислителем (кислородом воздуха), превращаясь в продукты горения, и который сопровождается интенсивным выделением тепла и световым излучением.
Условия, необходимые для возникновения процесса горения:
— наличие горючего вещества (Г.В.);
— наличие окислителя (О.) — кислорода воздуха;
— наличие источника зажигания (И.З.).
— горючее вещество должно быть нагрето до определенной температуры, при которой начнется процесс окисления;
— чтобы нагреть горючее вещество до определенной температуры, необходима определенная мощность источника зажигания;
— чтобы поддерживать процесс горения, необходимы определенные концентрации горючего и окислителя.
Важнейшие процессы при горении — тепло- и массоперенос. Наиболее общее свойство горения — это возникновение пламени и перемещение его по всей горючей смеси путем передачи тепла или диффузии активных частиц из зоны горения в свежую горючую смесь.
Пламя — это видимое проявление горения. Его называют также зоной горения. Это та часть пространства, где происходит превращение горючей смеси в продукты полного и неполного сгорания.
Главными параметрами процесса горения, приводящими к гибели людей и наносящими материальный ущерб, являются:
— большое количество тепла;
— токсичный состав продуктов горения.
Процесс горения с позиций молекулярно-кинетической теории газов
Рис. 2.1. Доля активных молекул в зависимости от температуры: Т2>Т1
При нагревании газовой горючей смеси в ней увеличивается избыточная энергия.
Разность между средним уровнем запаса энергии молекул в активном состоянии и средним уровнем неактивном состоянии, называется энергией активации. Это можно представить графически (рис. 2).
Рис. 2.2. Энергетическая диаграмма хода реакции Г.В. + О. ® П.Г.: Еакт – энергия активации; Qх.р – тепловой эффект реакции горения
Энергия, выделившаяся в результате взаимодействия «первых» прореагировавших молекул передается соседним молекулам. Они возбуждаются, процесс повторяется вокруг прореагировавших молекул с большой частотой и интенсивностью. Начинается самоподдерживающийся, самоускоряющийся на всю реакционную смесь (2Н2 + О2) процесс химического взаимодействия, сопровождающийся образованием молекул воды и выделением в окружающую среду тепла и сопровождающийся свечением, т.е. возникает и распространяется процесс горения.
Чем выше численное значение Еакт, тем труднее заставить данную пару компонентов вступить в химическое взаимодействие. Поэтому величина Еакт является косвенным показателем степени пожарной опасности данной химической системы.
Виды и режимы горения
Горение можно классифицировать по следующим параметрам:
1. По условию смесеобразования горючих компонентов:
а) кинетическое – горение предварительно перемешанных газо- или паровоздушных смесей. Так как смесь горючего и окислителя готова к горению до момента ее воспламенения, то суммарная скорость процесса горения зависит только от скорости химической реакции горения. Если такое горение будет происходить в замкнутом или ограниченном объеме, то тогда может произойти взрыв. Так как энергия, выделяющаяся при сгорании смеси, не успевает отводиться за пределы данного объема, за счет увеличения давления возможно разрушение конструкций;
б) диффузионное, диффузионным горением называется горение, когда образование горючей среды (смешение горючего и окислителя) происходит перед зоной горения или в зоне горения.
2. По интенсивности поступления горючих компонентов в зону химической реакции:
а) ламинарное, при этом компоненты горючей смеси поступают в зону горения сравнительно спокойно. При этом численное значение критерия Рейнольдса, который характеризует термодинамический режим, будет значительно меньше критического (Re
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Процесс горения с точки зрения физики
Огонь свечи, огонь костра,
Огонь могучего пожара.
Огни – они все мастера
Ниспосланного людям дара.
Он может родиться, окрепнуть и вырасти. Может ослабнуть и умереть. Может быть трепетным и ласковым или жестоким и жадным. Он набрасывается, пожирает, поглощает. С ним можно бороться и он отступит побежденным. Он может спасти или обернуться жуткой трагедией.
«Огонь!» — это как возглас надежды заплутавшего, так и суровая команда, несущая смерть врагам.
Огненные волосы, горящие глаза, испепеляющий взгляд. Вспышка гнева, взрыв смеха. Играть с огнем, загореться мыслью, пылать энтузиазмом, гореть страстью. «Искра мала велик пламень родит», «Огонь да вода все сокрушат», «В огне и железо плавко», «Огонь – друг и враг человека».
Достаточно примеров. Они лишь должны напомнить, какую роль играет этот подарок природы в нашей жизни. Наш язык наделил его чертами живого существа и, наоборот, внешность и эмоции человека часто связывают со свойствами пламени.
Огонь издавна является неотъемлемой частью жизни людей. Можно ли представить наше существование без огня? Разумеется, нет. С процессами горения современный человек сталкивается ежедневно.
Цель работы: изучить процесс горения с разных точек зрения.
Изучить литературу и интернет ресурсы, связанные с темой горения;
Познакомиться с историей овладения огнем;
Найти информацию и точные инструкции по проведению опытов, связанных с процессами горения.
Горение – это первая химическая реакция, с которой познакомился человек.
По легенде огонь, замёрзшим и несчастным людям, принёс титан Прометей, не смотря на запрет Зевса. Но, скорее всего, первобытные человекоподобные особи столкнулись с огнём во время пожаров, вызванных ударами молний и извержением вулканов. Они не умели добывать его сами, но могли переносить и поддерживать его. Первые свидетельства использования людьми огня относятся к таким археологическим стоянкам древнего человека, как Чесованья в Восточной Африке, Сварткранс в Южной Африке, Чжоукоудянь и Сихоуду в Китае и Триниль, на острове Ява. Были найдены кострища, зола и древесные угли, датируемые 1,5-2 млн лет назад, обгоревшие орудия труда первобытных людей и кости млекопитающих.
Когда человек стал добывать огонь самостоятельно было доподлинно не известно до 2008 года, когда группа израильских археологов назвала относительно точную дату 790 тыс. лет назад. Такой вывод учёные сделали на основании результатов раскопок на известной раннепалеолитической стоянке Гешер-Бнот-Яаков. Согласно отчёту в журнале «Quaternary Science Reviews» они обнаружили следы применения примитивных средств для добывания огня, использовавшихся на протяжении жизни почти двенадцати поколений, заселявших данную местность. Так же выводы делались на основе более детальных исследований камней и каменных орудий, найденных здесь же ранее.
Первым способом самостоятельной добычи огня человеком было трение. Этот способ изредка используется и в наше время, например в походных условиях.
Постепенно, по мере накопления человечеством практического опыта и новых знаний об окружающем мире, на смену пришёл другой способ добывания огня, основанный на высекании искры. Он заключается в том, что при резком ударе камнем по некоторым минералам из их поверхности вылетают мельчайшие частицы, которые тут же воспламеняются и, попадая на горючий материал, поджигают его. К таким относится, например, пирит (дисульфид железа (II) – FeS2). Известны и другие минералы с таким же свойством. С течением времени этот способ был усовершенствован: огонь стали получать, высекая искры из более распространенного и доступного минерала кремния железным кресалом. Горючими веществами были трут или пережженная пакля. Для получения огня таким способом в Европе вплоть до середины XIX в. Использовалось устройство, получившее в России название «огниво».
Ещё один интересный способ использовался с древности до середины ХХ века племенами островов Суматра, Ява, Калимантан и Сулавеси: добыча огня путем резкого сжатия воздуха в специальных приспособлениях.
В настоящее время, с процессами горения человек сталкивается постоянно. Это может быть горение газа в газовой плите, микровзрывы топлива в дизельных двигателях автомобилей, системы отопления в частных домах или работа тепловой электростанции и т. д. В военном деле под огнем понимается стрельба из огнестрельного оружия.
Огонь глазами ученого
Что же такое огонь? С точки зрения химии — это зона протекания экзотермической реакции окисления, иногда сопровождающейся пиролизом (термическим разложением органических и многих неорганических соединений). С точки зрения физики — испускание света нагретыми веществами из зоны такой реакции.
Почему мы видим огонь? Частички горючего материала и продукты горения светятся, потому что имеют высокую температуру (обычное излучение абсолютно черного тела). Высокая температура позволяет атомам перемещаться на некоторое время в более высокие энергетические состояния, а потом, по возвращении в исходное состояние, излучать свет определённой частоты, которая соответствует структуре электронных оболочек данного элемента.
В чем разница между «огнем» и «горением»? Огонь – это быстрая форма горения, при которой выделяются и свет и тепло. Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций. Для процесса горения необходимы:
— горючее вещество (топливо);
— окислитель (чаще всего кислород);
— источник зажигания (не всегда)
Окислитель и горючее вещество вместе составляют горючую систему. Она может быть однородной и неоднородной:
Однородными являются системы, в которых горючее вещество и окислитель равномерно перемешаны друг с другом (смеси горючих газов, паров). Горение таких систем называют горением кинетическим. При определенных условиях такое горение может носить характер взрыва.
Неоднородные — системы, в которых горючее вещество и воздух не перемешаны друг с другом и имеют поверхности раздела (твердые горючие материалы и не распылённые жидкости). В процессе горения неоднородных горючих систем кислород воздуха проникает сквозь продукты горения к горючему веществу и вступает с ним в реакцию. Такое горение называют диффузионным горением. В роли окислителя могут выступать кислород, хлор, фтор, бром и другие вещества.
Огонь основная (свободно горящая) фаза горения, это явление физико-химическое, значит, рассматривать его только с точки зрения химии неразумно. С точки зрения физики огонь – совокупность раскалённых газов, выделившихся в результате:
произвольного или непроизвольного нагревания топлива (горючего вещества) до определённой температуры при наличии окислителя;
химической реакции (например, взрыва);
протекания электрического тока в среде (электрическая дуга, электросварка)
Процесс горения делится на определенные стадии (фазы):
1. Начальная фаза (стадия роста),
2. Свободно горящая фаза (полностью развитая стадия),
3. Тлеющая фаза (стадия распада).
В первой – начальной – фазе расход приточного кислорода увеличивается, затем начинает уменьшаться. Вырабатывается некоторое количество тепла и это количество увеличивается в процессе горения. Пламя может нагреться до температуры более 5370°C, но температура в помещении на данном этапе может быть небольшая.
Во время второй – свободно – горящей фазы богатый кислородом воздух вовлечен в пламя, так как конвекция несет высокую температуру к верхнему слою ограниченного пространства. Горячие газы распространяются сверху вниз, вынуждая более прохладный воздух искать более низкие уровни, и, в конечном счете, зажигают весь горючий материал в верхних уровнях комнаты. На данном этапе температура в верхних слоях может превысить 7000°C. Огонь продолжает потреблять свободный кислород, пока он не достигнет точки, где недостаточно кислорода, чтобы реагировать с топливом. Пламя уменьшается до тлеющей фазы и нуждается только в поступлении кислорода, чтобы быстро вспыхнуть.
В третьей фазе пламя может прекратиться, если область горения воздухонепроницаема. В этом случае горение уменьшается до тлеющих угольков. Выделяется плотный дым и газы, возникает избыточное давление. Угли продолжают тлеть, помещение полностью заполнится плотным дымом и газами сгорания при температуре 5370°C. Сильный жар выпарит более легкие топливные составляющие, такие как водород и метан, от горючего материала в комнате. Эти топливные газы будут совместно с производными огня и далее увеличат опасность повторного возгорания и создадут возможность обратной тяги.
Вспышка — это быстрое сгорание горючей смеси, не сопровождающееся образованием сжатых газов.
Возгорание — возникновение горения под воздействием источника зажигания.
Ярким примером возгорания является «фокус» древнеиндийских жрецов: в древней Индии, при совершении священных обрядов, в полумраке храмов внезапно вспыхивали и рассыпались искрами таинственные красные огни, наводившие суеверный страх на молящихся. Разумеется, могучий Будда здесь был ни при чем, зато его верные служители, жрецы, пугали и обманывали верующих с помощью бенгальских огней. Соли стронция, придававшие пламени красный цвет, смешивались с углем, серой и хлоратом калия (бертолетовой солью). В нужный момент смесь поджигалась.
Самовозгорание — это явление резкого увеличения скорости экзотермических реакций, приводящее к возникновению горения веществ (материала, смеси) при отсутствии источника зажигания.
Тепловое самовозгорание вещества возникает в результате самонагревания под воздействием скрытого или внешнего источника нагрева. Самовоспламенение возможно только в том случае, если количество тепла, выделяемого в процессе самоокисления, будет превышать отдачу тепла в окружающую среду.
Примером теплового самовозгорания может служить самовозгорание летучих эфирных масел в жаркую погоду. Всем известная легенда о неопалимой купине, или Моисеевом кусте, имеет вполне научное объяснение: учёные полагают, что это был кустарник диптам, выделяющий эфирные масла, которые загораются под действием солнечных лучей. В безветренную погоду вокруг куста увеличивается концентрация летучих эфирных масел, выделяемых растением, которые воспламеняются по достижении определенной температуры. Уравнение химической реакции самовоспламенения эфира:
Тепловым самовоспламенением также объясняется появление кладбищенских огоньков. При разложении органических остатков выделяется бесцветный, ядовитый газ фосфин (РН3), имеющий свойство самовозгораться на воздухе, т.е. при наличии кислорода. Если этот газ выходит из земли, с разлагающимися в ней органическими остатками, происходит самовоспламенение, образуются небольшие вспышки, которыми раньше церковники пугали суеверных людей. Такое явление можно наблюдать только в теплое время года, так как температура самовоспламенения фосфина = 38°C. Уравнение химической реакции самовоспламенения фосфина:
Самовозгорание может происходить и под воздействием жизнедеятельности микроорганизмов в массе вещества (материала, смеси).
Склонностью к микробиологическому самовозгоранию обладают горючие материалы, особенно увлажненные, служащие питательной средой для микроорганизмов, жизнедеятельность которых связана с выделением теплоты (торф, древесные опилки). При этом температура самонагревания не превышает обычных значений температуры окружающей среды и может быть отрицательной.
Поэтому большинство пожаров и взрывов происходит при хранении сельскохозяйственных продуктов (силос, увлажненное сено) в элеваторах. Наиболее часто используемый способ избежать самонагревания и самовоспламенения сена (и подобных материалов) сводится к тому, чтобы при складировании этих материалов не происходило их увлажнение.
Существует различие между процессами возгорания и самовозгорания: для того чтобы возникло возгорание, необходимо внести в горючую систему тепловой импульс, имеющий температуру, превышающую температуру самовоспламенения вещества.
Температура самонагревания — минимальная температура среды, выше которой при благоприятных условиях возможно развитие экзотермического процесса самонагревания, связанного с термическим разложением и окислением определенного объема (массы) горючего вещества.
Температура самовоспламенения — это самая низкая температура вещества, при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся возникновением пламенного горения.
Взрыв — это чрезвычайно быстрое химическое превращение вещества, сопровождающееся быстрым выделением тепловой энергии и образованием сжатых газов, способных производить механическую работу.
Без этого типа горения так же сложно представить современный мир, так как механический взрыв топлива лежит в основе работы большинства автомобильных двигателей. Также взрывы небольших масштабов используются в пиротехнических устройствах. Пиротехника (др. греч. πῦρ — огонь, жар; τεχνικός — искусство, мастерство) — отрасль техники, связанная с технологиями приготовления горючих составов и сжигания их для получения определённого эффекта. Делится на:
военную (сигнальные ракетницы, дымовые шашки)
специализированную (киносъемочные спецэффекты, гражданские сигнальные средства)
развлекательную (пиротехнические изделия — петарды, бенгальские огни, хлопушки, салюты.
В ходе процесса горения образуются продукты сгорания. Они могут быть жидкими, твёрдыми и газообразными. Их состав зависит от состава горящего вещества и от условий его горения. Органические и неорганические горючие вещества состоят, главным образом, из углерода, кислорода, водорода, серы, фосфора и азота. Из них углерод, водород, сера и фосфор способны окисляться при температуре горения и образовывать продукты горения: СО, CO2, SO2, P2O5. Азот при температуре горения не окисляется и выделяется в свободном состоянии, а кислород расходуется на окисление горючих элементов вещества. Все указанные продукты сгорания (за исключение угарного газа СО) гореть в дальнейшем не способны.
При неполном сгорании органических веществ в условиях низких температур и недостатка воздуха образуются более разнообразные продукты – оксид углерода(II), спирты, альдегиды, кислоты и другие сложные химические соединения. Эти продукты образуют едкий и ядовитый дым. Кроме того, продукты неполного горения сами способны гореть и образовывать с воздухом взрывчатые смеси. Такие взрывы бывают при тушении пожаров в подвалах, сушилках и в закрытых помещениях с большим количеством горючего материала.
Способность примесей окрашивать пламя в различные цвета используется не только в пиротехнике, но и в аналитической химии: пирохимический анализ — метод обнаружения некоторых химических элементов (например, в минералах) по различному окрашиванию пламени.
что такое пламя с точки зрения физики что есть пламя, чему оно подвержено, как происходит процесс горения в-ва
Физика процесса;
Характерная черта явлений горения — способность к пространственному распространению, вследствие передачи тепла или диффузии активных частиц.
В первом случае говорят о тепловом, во втором — о диффузионном механизме распространения пламени. Другая характерная особенность горения — наличие критических условий, то есть определенных, характерных для данной горючей системы областей значений параметров (состав смеси, давление, содержание примесей, начальная температура смеси и так далее), вне которых реакция горения протекает стационарно, а внутри области — самоускоряется.
Теория горения находится внутри теории цепных реакций.
Н. Н. Семенов за эту теорию получил Нобелевскую премию.
За простецкое объяснение таких наград не дают.
Горение и взрывы: что такое огонь с точки зрения физики?
Научный термин для обозначения сжигания — «горение». Известно множество видов горения, но в большинстве случаев все очень просто. Кислород воздуха должен вступить во взаимодействие с каким-либо материалом, который может гореть.
В результате выделяется тепло. Если процесс протекает быстро, мы наблюдаем пламя или тление или просто чувствуем, что происходит такая реакция — например, при взрыве. Когда дерево или бумага вступают в реакцию с кислородом, мы наблюдаем огонь. Но подобное сжигание происходит и в автомобильном двигателе. Бензин сгорает при соприкосновении с кислородом из окружающего воздуха.
В автомобильном двигателе сгорание происходит так быстро, что мы называем этот процесс взрывом. И наоборот, существует сгорание, которое протекает так медленно, что мы годами его не замечаем. Например, при ржавлении металла мы имеем дело с процессом горения!
При медленном горении, если выделяемое тепло не попадает в воздух, температура может достичь такого уровня, когда начнется возгорание. Это называется «спонтанным загоранием». Спонтанное возгорание может начаться в куче промасленных тряпок, оставленных в закрытом помещении. Масло будет медленно окисляться, что приведет к выделению тепла. Если для него не будет выхода, оно будет аккумулироваться. Постепенно его станет достаточно, чтобы загорелись тряпки.
Кислород, необходимый для горения, широко распространен в природе. В окружающем нас воздухе содержится примерно 21 % кислорода. Кислород всегда готов начать процесс горения.
Тем не менее, для того, чтобы этот процесс начался, помимо кислорода, необходимо наличие «горючих» материалов. Горючие материалы, которые специально используются для сжигания, называются «топливо». Например, дерево, уголь, кокс, керосин, некоторые газы являются топливом, или горючим.
В процессе горения два атома кислорода из окружающего воздуха соединяются с одним атомом углерода топлива, в результате получается двуокись углерода. А тебе известно, что в результате процесса горения в нашем организме, необходимого для производства тепла и энергии, также выделяется двуокись углерода, который мы выдыхаем?
Что такое огонь с точки зрения физики? Имеет ли он массу? Можно ли его потрогать?
Огонь — это светящиеся в потоке горячего воздуха раскаленные микроскопические частицы гари и пепла. Ряд химически чистых веществ (например авиационный керосин) горят бесцветным пламенем, т.к. в них содержится недостаточное количество примесей, которые могли бы неполностью сгореть и достаточно раскалиться. Поэтому в осветительном керосине содержится большое количество ароматических углеводородов, они позволяют сравнительно большую часть энергии горения переводить в видимый свет.
Для формирования пламени нужна интенсивная экзотермическая реакция, не обязательно реакция окисления веществ кислородом. Например, реакция взаимодействия фтора с водородом дает бесцветное пламя и температуру до 4500 С.
Массу огонь, как и любая другая материя имеет. Потрогать его можно, но небезопасно для здоровья, это по сути просто очень горячий поток воздуха.
Глава 2 горение и средства тушения пожаров
2.1. Понятие о процессе горения
Горением называют физико-химический процесс, характеризующийся следующими признаками: химическими превращениями, выделением тепла и света. Для того чтобы возникло устойчивое горение, необходимо наличие трех факторов: горючего вещества (материала, смеси), окислителя и источника зажигания.
Химическая реакция горения, идущая с выделением значительного количества тепла, почти всегда сопровождается различного рода физическими явлениями. Так, в процессе горения происходит перенос тепла реагирующих веществ и продуктов горения из одного места в другое. Все процессы, происходящие в зоне реакции горения, взаимосвязаны — скорость химических реакций определяется уровнем теплопередачи и скоростью диффузии вещества и, наоборот, физические параметры (температура, давление, скорость переноса вещества) зависят от скорости химической реакции.
Горючее вещество. Все вещества и материалы, обращающиеся в производстве, используемые в качестве сырья, полуфабрикатов, строительных конструктивных элементов, подразделяются на три группы: негорючие, трудногорючие и горючие.
Негорючими называются вещества и материалы, не способные к горению в воздухе нормального состава. Негорючие вещества и материалы составляют значительную группу. К ним относятся все естественные и искусственные неорганические вещества и материалы, применяемые в строительстве металлы, а также гипсовые или гипсо-волокнистые плиты при содержании органической массы до 8%, минерало-ватные плиты на синтетической, крахмальной или битумной связке при содержании ее по массе до 6%.
Трудногорючими называются вещества (материалы), способные загораться под действием источника зажигания, но не способные самостоятельно гореть после его удаления. К ним относятся вещества и материалы, состоящие из негорючих и горючих составляющих, например: асфальтобетон, гипсовые и бетонные материалы, содержащие более 8% по массе органического заполнителя; минерало-ватные плиты на битумной связке при содержании ее от 7 до 15%; глиносоломенные материалы объемной массой не менее 900 кг/м 3 ; войлок, пропитанный глиняным раствором; древесина, подвергнутая глубокой пропитке антипиренами; цементный фибролит; отдельные виды конструкционных пластмасс и т. п.
Горючими называются вещества (материалы, смеси), способные к самостоятельному горению в воздухе нормального состава. К ним относятся все вещества и материалы, не отвечающие требованиям, предъявляемым к негорючим и трудногорючим веществам и материалам, например: авиационные топлива, спирты, органические и неорганические масла, декоративно-отделочные материалы на основе пластмасс, текстильные материалы, магний, натрий, сера и другие материалы и химические вещества.
В свою очередь, все горючие вещества и материалы подразделяются на три подгруппы: легковоспламеняющиеся, средней воспламеняемости, трудновоспламеняющиеся.
Легковоспламеняющимися называются вещества (материалы, смеси), способные воспламеняться от кратковременного воздействия пламени спички, искры, накаленного электрического провода и тому подобных источников зажигания с низкой энергией.
Среднюю воспламенимость имеют вещества (материалы, смеси), способные воспламеняться от длительного воздействия источника зажигания с низкой энергией.
Трудновоспламеняющимися называются вещества (материалы, смеси), способные воспламеняться только под воздействием мощного источника зажигания, который нагревает значительную часть вещества до температуры воспламенения.
К подгруппе легковоспламеняющихся веществ и материалов в первую очередь относятся газы и легковоспламеняющиеся жидкости.
К легковоспламеняющимся жидкостям (ЛВЖ) из всех жидкостей, обращающихся в производстве, относятся горючие жидкости с температурой вспышки, не превышающей + 61° С в закрытом тигле. Они делятся на три разряда:
I — особо опасные ЛВЖ с температурой вспышки до — 18° С;
II — постоянно опасные ЛВЖ с температурой вспышки от — 18 до 23° С;
III — ЛЖВ, опасные при повышенной температуре воздуха или жидкости с температурой вспышки от 23° до 61° С.
Температурой вспышки называется самая низкая (в условиях специальных испытаний) температура горючего вещества, при которой над его поверхностью образуются пары или газы, способные вспыхивать в воздухе от источника зажигания, но скорость их образования еще недостаточна для устойчивого горения. Для ЛВЖ температура вспышки на 1 —5° С ниже температуры воспламенения.
Температурой воспламенения называется температура горючего вещества, при которой оно выделяет горючие пары и газы с такой скоростью, что после воспламенения их от источника зажигания возникает устойчивое горение.
Практически все горючие и трудногорючие вещества и материалы горят в паровой или газовой фазе, исключение составляют титан, алюминий, антрацит и ряд других. Горючие вещества и материалы могут различаться по химическому составу, агрегатному состоянию другим свойствам, исходя из чего процессы подготовки их к горению протекают по-разному. Газы вступают в реакцию горения If Практически без каких-либо изменений, так как их перемешивание с окислителем (кислородом воздуха) происходит при любых температурах среды и не требует значительных дополнительных затрат f энергии. Жидкости должны сначала испариться и перейти в парообразное состояние, на что затрачивается определенное количество тепловой энергии, и только в паровой фазе перемешиваются с окислителем и горят. Твердые вещества и материалы при своей подготовке к горению требуют значительно большее количество энергии, так как сначала они должны либо расплавиться, либо разложиться. Расплавленные или разложившиеся вещества и материалы должны испариться и перемешаться с окислителем, после чего под воздействием источника зажигания возникает процесс горения. Каучук, резина и другие пластические материалы, а также магний и его, сплавы перед воспламенением плавятся и испаряются (при этом пластмассы разлагаются). Такие материалы, как бумага, древесина, хлопчатобумажные ткани и отдельные виды конструкционных пластмасс при нагревании разлагаются с образованием газообразных продуктов и твердого остатка (как правило, угля).
Окислитель. Окислителем обычно служит кислород воздуха. Воздух по своему составу представляет собой смесь многих газов, основными из которых являются: азот (N2)— 78,2% по объему и 75,5% по массе; кислород (О2) — 20,9% по объему и 23,2% по массе; инертные газы (Не, Ne, Аг, Кг) — 0,9% по объему и 1,3% по массе. Помимо данных газов в воздушном объеме всегда присутствует незначительное количество углекислого газа, водяных паров и пыли. Все эти составляющие воздуха, кроме кислорода, при горении органических веществ и материалов в реакцию горения практически не вступают. Кислород, азот и инертные газы считаются постоянными составными частями воздуха. Содержание же углекислого газа, водяных паров и пыли непостоянно и может изменяться в зависимости от условий, в которых протекает тот или иной процесс горения.
Источник зажигания. Им может быть горящее или накаленное тело, а также электрический разряд, обладающие запасом энергии и температурой, достаточными для возникновения горения других веществ.
На практике существуют или возникают различные явления, повышающие температуру веществ и материалов, находящихся в производстве или на хранении, что в большинстве случаев приводит к возникновению процесса горения как локально, так и во всем объеме горючего вещества или материала. К источникам зажигания относятся: искры, образующиеся при ударах металла о металл или другие твердые материалы; искры и капли расплавленного металла при коротких замыканиях в электрооборудовании и при производстве сварочных и других огневых работ; нагрев электрических проводов при перегрузках электрических сетей; механический нагрев трущихся деталей машин, биологический нагрев при окислении растительных масел и ветоши, смоченной этими маслами; горящие спич, окурки и т. п. Характер воздействия этих источников зажигания неодинаков. Так, искры, образующиеся при ударах металлических предметов, как источник зажигания имеют весьма малую мощность и способны воспламенить только газопаровоздушные смеси: метано-воздушную, ацетиленовоздушную, сероуглеродно-воздушную и др. Искры, возникающие при коротких замыканиях в электрооборудовании или при электросварке, обладают мощной воспламеняющей способностью и могут вызвать горение практически всех горючих веществ и материалов независимо от их агрегатного состояния.
Горючая среда. При возникновении и протекании процесса горения горючее вещество и окислитель являются реагирующими веществами и представляют собой горючую среду, а источник зажигания является стартером процесса горения. При установившемся горении источником зажигания еще не горящих веществ и материалов служит теплота, выделяющаяся из зоны реакции горения.
Горючие среды могут быть физически однородными (гомогенными) и неоднородными (гетерогенными). К первым относятся среды, в которых горючее вещество и окислитель (воздух) равномерно перемешаны: смеси горючих газов, паров и пылей с воздухом. Примерами горения однородной среды могут служить: горение паров, поднимающихся со свободной поверхности жидкости (разлитого авиатоплива ТС-1 при авиационном происшествии); горение газа, вытекающего из поврежденного баллона или трубопровода; взрывы газо-, паро- и пылевоздушных смесей. К гетерогенным относятся среды, в которых горючее вещество (материал) и окислитель не перемешаны и имеют поверхность раздела: твердые горючие вещества и материалы, струи горючих газов и жидкостей, поступающие в воздух под высоким давлением, и т. п. Примером горения неоднородной среды является горение титана, алюминия, антрацита или нефтяных и газовых фонтанов, когда нефть и газ поступают, в зону горения под большим давлением и имеют весьма значительные скорости истечения.
Пламя. Пространство, в котором сгорают пары, газы и взвеси, называется пламенем. Пламя может быть кинетическим или диффузионным в зависимости от того, горит ли заранее подготовленная смесь паров, газов или пыли с воздухом или такая смесь образуется непосредственно в зоне пламени в процессе горения. Процессы, протекающие в кинетическом пламени, характеризуются высокими скоростями протекания реакции горения (линейная скорость распространения пламени может превышать 1000 м/с) и, как правило, представляют собой взрыв горючей среды, сопровождающийся высоким уровнем тепловыделения и резким повышением давления в зоне горения.
В условиях пожара практически все газы, пары, жидкости и твердые вещества и материалы горят диффузионным пламенем. Структура данного пламени существенно зависит от сечения потока горючих паров или газов и его скорости. По характеру этого потока различают ламинарное и турбулентное диффузионное пламя. Первое возникает при малых сечениях потока горючих паров или газов, движущихся с небольшой скоростью (пламя свечи, спички, газа в горелке домашней плиты и т. п.). На пожарах при горении различных веществ и материалов образуется турбулентное диффузионное пламя, минарное и турбулентное пламя представляет собой зону реакции горения, которая окружает зону паров или газов, последняя практически занимает весь объем зоны горения. Зона реакции горения иффузионном пламени представляет очень тонкий (всего несколько микрометров) слой, в котором происходит выделение тепла и светурбулентное пламя в отличие от ламинарного характеризуется I, что не имеет четких очертаний, постоянных сечений и положений фронта пламени.
Температура в зоне паров значительно ниже, чем в зоне реакции.
В пламени авиационных топлив температура потока паров около поверхности жидкости приближается к температуре ее кипения (для авиатоплива ТС-1 эта температура лежит в пределах 150 — 280° С). По мере движения потока паров к зоне реакции их температура повышается сначала за счет теплового излучения пламени, а затем — диффузии из зоны реакции нагретых продуктов сгорания. В результате нагрева происходит термическое разложение (диссоциация) парообразных веществ, и образующиеся свободные атомы и радикалы совместно с продуктами сгорания поступают непосредственно в зону реакции, т. е. в пламя. Атомы углерода, поступая в зону реакции горения, нагреваются и начинают светиться, образуя так называемое светящееся пламя. Температура зоны реакции горения меняется по высоте пламени. В нижней части пламени температура снижается за счет расхода значительного количества тепла на нагрев массы холодного воздуха, поступающего в зону горения, и является минимальной для каждого вида горения. Наибольшая температура развивается в средней части пламени, поскольку в верхней скорость реакции уменьшается за счет падения концентрации реагирующих компонентов (выгорания), в связи с чем падает уровень тепловыделения и снижается температура.
Парциальное давление кислорода воздуха в нормальных условиях равно 228,72 кПа, а в зоне реакции горения — 0, поэтому в результате разности парциальных давлений кислород из окружающего воздуха диффундирует (фильтруется, просачивается) через слой продуктов сгорания к зоне реакции. Поступление же в зону реакции горения горючих компонентов практически ничем не ограничивается. Таким образом, скорость реакции горения при развившемся процессе зависит в основном только от количества кислорода, поступающего в зону реакции, т. е. от скорости его диффузии. В случае горения неоднородной среды проникновению кислорода в зону реакции также препятствуют продукты сгорания, выделяющиеся в пространство, примыкающее к зоне реакции.
Отсутствие достаточного количества кислорода в зоне реакции горения тормозит скорость ее протекания. Если бы этого торможения не происходило, то все реакции горения, происходящие в атмосфере, протекали бы с постоянно возрастающей скоростью и заканчивались взрывом реагирующих веществ. Процессы горения, как и все химические процессы, протекают с различными скоростями, зависящими от условий, в которых они протекают, от природы реагирующих веществ, от их агрегатного состояния. Например, взрывчатые вещества разлагаются в тысячные доли секунды, а химические процессы в земной коре длятся сотни и тысячи лет. Взаимодействие веществ в газовой и паровой фазах протекают значительно быстрее, чем в жидком, а тем более твердом состоянии. Так, разлитое авиационное топливо ТС-1 сгорает относительно медленно, образуя коптящее пламя (неполное сгорание), а подготовленная паровоздушная смесь этого топлива с воздухом сгорает со взрывом. Скорость взаимодействия твердых веществ и материалов с окислителем резко изменяется в зависимости от степени их измельченное. Например, алюминий и титан, медленно горящие в слитках, при наличии особых условий могут образовывать в пылевидном состоянии взрывоопасные пылевоздушные смеси, развивающие при горении давления взрыва соответственно в 0,62 и 0,49 МПа.
Горение как химический процесс во всех случаях происходит одинаково. Однако как физический процесс оно отличается по характеру протекания реакции горения, поэтому процессы горения в начальной стадии делятся на следующие виды: самовозгорание, воспламенение и самовоспламенение.
Самовозгорание. Отдельные вещества (материалы, смеси) при хранении и в процессе эксплуатации технологического оборудования способны самовозгораться. Самовозгорание — это явление резкого увеличения скорости экзотермических реакций, приводящее к возникновению горения вещества в отсутствии источника загорания. К веществам, способным самовозгораться, относятся растительные и жирные масла, тряпки и ветошь, смоченные растительными маслами, сульфиды железа и другие индивидуальные химические вещества. Растительные и жирные масла (подсолнечное, льняное, конопляное, кукурузное, животные жиры и т. п.) относятся к классу жиров и представляют собой смесь глицеридов высокомолекулярных жирных кислот. Молекулы этих кислот имеют ненасыщенные (двойные) связи, способствующие при определенных условиях самовозгоранию данных веществ. Согласно перекисной теории А. Н. Баха окисление может происходить за счет присоединения кислорода к метиленовой группе, находящейся в положении по отношению к двойной связи, с образованием гидроперекиси. Как известно, все перекиси и гидроперекиси — нестойкие химические соединения. При их распаде образуются свободные радикалы, полимеризующиеся в более крупные органические молекулы. При полимеризации всегда выделяется определенное количество тепла, что в конечном результате может привести к самовозгоранию окисляющегося органического вещества. Самовозгорание органических веществ возникает при определенных условиях. К ним относятся: содержание в масле или жире глицеридов высокомолекулярных кар боковых кислот не ниже определенного минимального количества; наличие большой поверхности контакта с окислителем и малой теплоотдачи; определенное соотношение жиров и масел я пропитанного ими пористого или волокнистого материала.
Сульфиды железа FeS, Fe2S3 могут образовываться в технологическом оборудовании складов службы ГСМ авиапредприятий. Они способны самовозгораться на воздухе, особенно в присутствии горючиx паров и газов. Рассмотрим механизм соединения сульфидов железа с кислородом воздуха на примере реакции окисления природного соединения пирита FeS2:
Помимо сульфидов железа могут самовозгораться такие материалы, как бурый уголь, торф, продукты растительного происхождения: сено, солома, силосная масса и др.
Наиболее опасным является самовозгорание индивидуальных, химических веществ при их неправильном хранении, поскольку этот процесс может привести к пожару на объекте, где хранятся данные вещества. Эти вещества по своим химическим свойствам делятся на три группы: самовозгорающиеся при контакте с воздухом, с водой и друг с. другом.
Вещества, относящиеся к первой группе, мы не рассматриваем, поскольку они практически не встречаются в технологии авиапредприятий.
Ко второй группе относится ряд веществ, из которых наибольший интерес представляют карбид кальция СаС2 и окись кальция СаО. При взаимодействии с водой карбида кальция происходит выделение ацетилена, являющегося горючим газом, и значительного количества тепла. При относительно малом количестве воды система карбид кальция — вода может разгореться до 920 К, что может вызвать взрыв ацетиленовоздушной смеси:
Помимо карбида кальция, способностью разогреваться до температуры свечения при попадании на нее небольших количеств воды обладает окись кальция СаО, что также может привести к загоранию тары и сгораемых конструктивных элементов помещения склада:
К третьей группе относятся сильные окислители, индивидуальные Химические вещества, а также органические вещества и материалы. Например, нельзя совместно хранить такие вещества, как перманганат калия и глицерин; концентрированную азотную кислоту со скипидаром, этиловым спиртом и сероводородом; галогены с горючими ,газами и легковоспламеняющимися жидкостями; серную кислоту с селитрами, хлоратами, перхлоратами, так как в этом случае между ними возможна химическая реакция, идущая с выделением большого количества тепла.
Воспламенение. Помимо самовозгорания возможно просто возгорание, т. е. возникновение горения под воздействием источника зажигания. Возгорание, сопровождающееся появлением пламени, называется воспламенением. При этом происходит нагрев объема, прилегающего к точке теплового воздействия. В результате повышения температуры в указанном объеме происходит распространение тепла на граничащие с ним участки (объемы) горючей среды. Чем большее количество горючего вещества (материала, смеси) вовлекается в процесс горения, тем больше тепла выделяется в окружающее пространство. Таким образом, процесс горения развивается самопроизвольно. Источник зажигания в данном случае первоначально нагревает только малый объем горючей смеси, в то время как температура всего объема горючей среды может оставаться неизменной.
Процесс воспламенения различается по своему характеру в зависимости от вида горючей смеси. Наиболее опасными являются газовоздушные смеси. Однако и для них минимальная энергия источника воспламенения зависит от многих параметров, основными из которых являются процентный состав смеси, вид горючего вещества, давление смеси, поскольку от этих величин зависят температура воспламенения, нормальная скорость распространения пламени и температура горения. Помимо этого на минимальную температуру источника воспламенения оказывает влияние продолжительность его контакта с горючей средой.
Воспламенение жидкостей возможно лишь в том случае, если температура окружающей среды или самой жидкости достаточна для испарения такого количества паров, которое необходимо для возникновения устойчивого горения. Для различных горючих жидкостей эта температура неодинакова. При температурах ниже температуры воспламенения горение невозможно, так как скорость испарения той или иной жидкости в данном случае слишком мала. С ростом температуры наружного воздуха или самой горючей жидкости при прочих равных условиях испаряемость жидкостей растет и количество паров становится достаточным для возникновения устойчивого горения.
Самовоспламенение. Им называется самовозгорание, сопровождающееся появлением пламени. Помимо процессов самовозгорания и воспламенения в практике встречается также процесс самовоспламенения различных горючих сред. По своей химической природе все эти три процесса не отличаются друг от друга. Разница между ними лежит в физической сущности процесса горения, так как в отличие от процессов самовозгорания и воспламенения процесс самовоспламенения идет сразу во всем объеме реагирующей горючей среды. С точки зрения физики, это кинетический процесс горения уже перемешанной и подготовленной смеси, идущий с высокими скоростями распространения пламени. При горении паро-, пыле- и газовоздушных смесей это, как правило, скорости взрыва. Для возникновения процесса самовоспламенения необходимо, чтобы весь объем горючей смеси имел температуру самовоспламенения данной смеси. Под температурой самовоспламенения понимают самую низкую температуру вещества (материала, смеси), при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся возникновением пламенного горения. Температура самовоспламенения горючего вещества не является постоянной величиной. Она зависит от скоростей тепловыделения и теплоотвода, которыё в свою очередь зависят от объема смеси, концентрации, давления и других факторов. Температура самовоспламенения смесей горючих паров и газов с воздухом изменяется в зависимости от их процентного состава. Самая низкая температура самовоспламенения у стехиометрической смеси или смесей, близких к ней по концентрациям реагирующих веществ. Температура самовоспламенения твердых веществ или материалов находится в обратной зависимости от степени их измельчения: чем выше степень измельченности вещества, тем ниже его температура самовоспламенения. Это связано с тем, что с измельчением веществ и материалов резко возрастает площадь контактной поверхности этих горючих компонентов и окислителя.
- http://zdamsam.ru/a74001.html
- http://school-science.ru/2/13/30684
- http://otvet.mail.ru/question/185963226
- http://intofact.ru/gorenie-i-vzryivyi-chto-takoe-ogon-s-tochki-zreniya-fiziki/
- http://thequestion.ru/questions/216888/chto-takoe-ogon-s-tochki-zreniya-fiziki-imeet-li-on-massu-mozhno-li-ego-potrogat
- http://studfiles.net/preview/6154100/page:8/