6.4.1. Световые микроскопы
Наиболее универсальными и потому наиболее распространенными являются биологические микроскопы (серии MULTISCOPE™, LABOROSCOPE™, INVERTOSCOPE™, производимые на ЛОМО). Современный биологический микроскоп имеет несколько сменных объективов и окуляров, а также фотоокуляры и проекционные окуляры, предназначенные для фотографирования изображения или его проецирования на экран. В таких микроскопах предоставляется возможность применять различные методы наблюдения (светлое поле, темное поле, метод фазового контраста).
Кроме микроскопов для биологических исследований, выпускаются и различные специализированные микроскопы.
Микроскопы сравнения обеспечивают визуальное сопоставление двух препаратов. Изображение каждого занимает половину поля зрения микроскопа, что позволяет проводить сравнительное изучение объектов.
Контактные микроскопы дают возможность проводить исследования микроскопических структур отдельных участков тканей, прижимая объектив к объекту исследования. LOMO производит серию микроскопов METAM™ для наблюдения, измерения, микрофотографии микроструктур металлов и других непрозрачных экземпляров.
Стереомикроскопы (серии SF™ и MX™) обеспечивают исследование объекта под разными углами зрения. При этом создается стереоскопический эффект, и наблюдаемое изображение воспринимается объемно.
Ультрафиолетовый и инфракрасный микроскопы предназначены для исследования объектов в ультрафиолетовом или инфракрасном участке светового спектра. Они снабжены флуоресцентным экраном, на котором формируется изображение исследуемого препарата, фотокамерой с чувствительным к этим излучениям фотоматериалом или электронно-оптическим преобразователем.
Поляризационный микроскоп (серия POLAM™) позволяет выявлять неоднородности (анизотропию) структуры при изучении строения тканей и образований в организме в поляризованном свете. Поляризационный микроскоп широко используют в медико-биологических исследованиях при изучении препаратов крови, шлифов зубов, костей и т.п.
Интерференционный микроскоп дает возможность исследовать объекты с низкими показателями преломления света и чрезвычайно малой толщины. В отличие от фазово-контрастного устройства, в интерференционном микроскопе луч света, входящий в микроскоп, раздваивается. Часть проходит через исследуемый объект, а другая – мимо. В окулярной части оба луча соединяются и интерферируют, что позволяет увидеть исследуемую структуру.
Принцип действия люминесцентного микроскопа (серия LUMAM™). основан на использовании люминесценции биологических объектов, возникающей под действием ультрафиолетового излучения. Наблюдая или фотографируя препараты в отраженном свете, можно судить о структуре исследуемого образца, что используется в микробиологии и в иммунологических исследованиях. Прямое окрашивание люминесцентными красителями позволяет выявлять такие структуры клеток, которые трудно рассмотреть в световом микроскопе.
Операционный микроскоп (серии MIKO™, MX™) используется для проведения микрохирургических операций в офтальмологии, нейрохирургии и других областях микрохирургии. Микроскоп имеет волоконнооптическую систему освещения операционного поля, демонстрационное визуальное устройство, фотоприставку; возможно подключение к нему киноаппаратуры для съемки операции и телевизионного наблюдения.
6.4.2. Электронные микроскопы
Электронный микроскоп построен на таком же принципе получения изображения, как и оптический, но вместо видимого света в нем используется пучок электронов.
Роль линз в электронном микроскопе играет совокупность электрических и магнитных полей. Поскольку электронные пучки не воспринимаются непосредственно глазом, в электронном микроскопе изображение либо фотографируется, либо проецируется на экран. Еще одно принципиальное отличие электронного микроскопа от оптического заключается в том, что в электронном микроскопе контраст создается за счет разного рассеяния электронов от соседних участков.
Длина волны электрона, как известно, во много раз меньше длины волны видимого света. Предел разрешения электронного микроскопа можно вычислить из выражения (6.11) при длине волны 0.005 нм. Даже при апертуре A=0.01 предел разрешения электронного микроскопа составит , что в 1000 раз меньше, чем в обычном оптическом микроскопе.
Однако, хотя предел разрешения электронного микроскопа несравнимо меньше, чем оптического, у электронного микроскопа есть свои недостатки, в частности, невозможность изучения живых биологических объектов, которые под воздействием пучка электронов мгновенно сгорят.
6.4.3. Сканирующие микроскопы
Сканирующие микроскопы основаны на другом принципе получения изображения, который позволяет преодолеть дифракционный предел разрешения. Принцип действия таких микроскопов основан на сканировании объекта сверхмалым зондом. Прошедший или отраженный сигнал регистрируется и используется для формирования трехмерной топографии поверхности образца с помощью ЭВМ.
Сканирующие микроскопы в зависимости от принципа взаимодействия зонда и образца разделяют на электронные, атомно-силовые и ближнепольные.
Наиболее интересен ближнепольный растровый сканирующий микроскоп (БРОМ), который работает в видимом излучении. Среди возможных механизмов формирования контраста в БРОМ можно отметить поглощение, поляризацию, отражение, люминесценцию и другие. Эти возможности отсутствуют в электронной и атомно-силовой микроскопии. Кроме того, световой микроскоп является сравнительно дешевым и неразрушающим инструментом исследования и позволяет работать с биологическими и медицинскими препаратами в естественных условиях.
Принцип действия ближнепольного растрового микроскопа заключается в сканировании объекта оптическим зондом на расстоянии меньше длины волны от объекта (в ближнем поле). Роль светового зонда в этом микроскопе выполняют светоизлучающие острия с выходными отверстиями, радиус которых в 10-20 раз меньше длины волны света.В результате ближнепольный растровый сканирующий микроскоп обеспечивает получение изображения с разрешением в десятки раз выше, чем в обычном микроскопе.
1. На препарате представлена стенка мелкого кровеносного сосуда, образованного тремя видами клеток. Назовите сосуд и клетки, образующие его стенку.
2. Внутреннюю оболочку кровеносного сосуда импрегнировали солями серебра. Были обнаружены клетки с неровными, извилистыми границами. Назовите эти клетки и источник их развития.
3. На препарате представлены два сосуда одинакового диаметра (20 мкм). Стенка одного из них образована тремя видами клеток, другого – двумя. Какие это сосуды? Назовите клетки, образующие их стенки.
4. На препарате хорошо видна густая сеть капилляров, расположенных между двумя артериолами. Дайте название этой структуре. В каком органе можно обнаружить эту сеть?
5. Представлены два гистологических препарата. На одном из них хорошо видна капиллярная сеть, расположенная между двумя артериолами, на втором – между двумя венами. Дайте название капиллярным сетям. В каких органах они находятся?
6. На препарате видны кровеносные сосуды, диаметр которых варьирует от 20 до 30 мкм. Как называются эти сосуды? В каких органах они находятся?
7. Известно, что И.М. Сеченов образно называл артериолы “кранами кровеносной системы организма”. Какие гистологические и функциональные особенности артериол явились поводом для такого сравнения?
8. На препарате представлены кровеносные сосуды, вокруг которых в прилегающей соединительной ткани большое скопление мигрированных из них клеток крови. Как называются эти сосуды? Какие клетки крови мигрировали?
9. При изучении препарата в поле зрения светового микроскопа видны артерия мышечного типа и одноименная вена, окрашенные орсеином. Какие структурные элементы сосудов будут окрашены этим красителем? По каким признакам можно безошибочно определить артерию?
10. Стенки артерий и вен состоят из трех оболочек. При описании одной из оболочек было указано, что она содержит «сосуды сосудов». Какая эта оболочка?
11. На препарате видны микроскопические сосуды, по которым кровь, минуя капилляры, изливается из артериол в венулы. Как называются эти сосуды?
12. На серии электронограмм видно, как форменные элементы крови, образующиеся в красном костном мозге, проходят черев стенки кровеносных капилляров и попадают в ток крови. К какому типу капилляров можно отнести сосуды красного костного мозга, пропускающие зрелые форменные элементы крови?
13. При сильном охлаждении кожа бледнеет. С какими гистофункциональными особенностями сосудистой системы это связано?
Эталоны ответов на ситуационные задачи
1. Артериола. Эндотелиоциты, гладкомышечные клетки, адвентициальные клетки.
2. Эндотелий. Мезенхима.
3. Первый – артериола. Ее стенка образована: эндотелием, гладкомышечными и адвентициальными клетками.
Второй – венула. Ее стенка образована: эндотелием и адвентициальными клетками.
4. Сеть капилляров между двумя артериолами называется «чудесная сеть». Такая сеть находится в почках.
5. На первом препарате капиллярная сеть носит название «чудесная сеть» или «первичная капиллярная сеть». Такая сеть имеет в почках. На втором препарате капиллярная сеть называется «вторичная капиллярная сеть», располагается в передней доле гипофиза.
6. Такие сосуды называются синусоидные капилляры. Они встречаются в кроветворных органах, в печени, в эндокринных органах.
7. Артериолы регулируют приток к органам, благодаря сокращениям спиральнонаправленных гладкомышечных клеток.
8. Это капилляры. Из них в соединительную ткань мигрируют: лимфоциты, моноциты, нейтрофилы, базофилы, эозинофилы.
9. Эластические волокна. По наличию внутренней и наружной эластических мембран.
10. Наружная или адвентициальная.
11. Артериоловенулярные анастомозы.
12. К синусоидному типу капилляров.
13. С сокращением гладкомышечных клеток в стенке артериол, набуханием эндотелия и перицитов гемокапилляров, что приведет к уменьшению кровотока в сосудах микроциркуляторного русла.
ПРАВИЛА РАБОТЫ С МИКРОСКОПОМ
Министерство здравоохранения ЛНР
Государственное учреждение
«Луганский государственный медицинский университет»
Проректор по научно-педагогической работе, доцент__________ Бибик В.В.
«____» _______________ 20_ год
МЕТОДИЧЕСКИЕ РАЗРАБОТКИ
К практическим занятиям
(лабораторным занятиям, семинарам)
Для студентов
По дисциплине (курсу)
«БИОЛОГИЯ»
Факультет: Медицинский
Специальность(и) Лечебное дело
Курс I
Методические разработки рекомендованы к утверждению на заседании кафедры биологии «28» августа 2015 г., протокол №1.
Заведующий кафедрой, д.б.н., профессор Федченко С.Н.
Методические разработки согласованы на заседании ЦМК по гуманитарным дисциплинам «1» сентября 2015 г., протокол №1.
Председатель ЦМК по гуманитарным дисциплинам Кащенко С.А.
Методические разработки пересмотрены и рекомендованы к утверждению на заседании кафедры биологии
«____» _______ 20___ г., протокол №___.
Заведующий кафедрой, д.б.н., профессор Федченко С.Н.
Методические разработки пересмотрены и согласованы на заседании ЦМК по гуманитарным дисциплинам «___» _______________ 20___ г., протокол №___.
Председатель ЦМК по гуманитарным дисциплинам Кащенко С.А.
Методические разработки пересмотрены и рекомендованы к утверждению на заседании кафедры биологии «____» ____________ 20___ г., протокол №___.
Заведующий кафедрой, д.б.н., профессор Федченко С.Н.
Методические разработки пересмотрены и согласованы на заседании ЦМК по гуманитарным дисциплинам «___» _______________ 20___ г., протокол №___.
Председатель ЦМК по гуманитарным дисциплинам Кащенко С.А.
ТЕМАТИКА ЗАНЯТИЙ:
Тема №1: Вступление в курс медицинской биологии. Уровни организации живого. Оптические системы в биологических исследованиях. Клеточный уровень организации биологических систем. (2ч)
Тема №2: Общий план строения клетки. Структурно-функциональная характеристика цитоплазмы. Цитоскелет. Межклеточные контакты. Транспорт веществ через плазмалемму. (2ч)
Тема №3: Молекулярная организация ядра. (2ч)
Тема №4: Организации наследственного аппарата у прокариот и эукариот. Структурно-функциональная классификация генов. (2ч)
Тема №5: Передача генетической информации в клетке. Биосинтез белка. (2ч)
Тема №6: Регуляция биосинтеза белка. Геном человека. Геномные технологии. Геномика. (3 ч)
Тема №7: Организация клетки во времени. Клеточный цикл, его периодизация. Деление клеток. Молекулярные механизмы клеточной пролиферации. Гибель клеток. (2 ч)
Тема №8 Рубежный рейтинг №1. Коллоквиум. Компьютерное тестирование. Сдача практических навыков. (3ч)
Тема:«Вступление в курс медицинской биологии. Уровни организации живого. Оптические системы в биологических исследованиях. Клеточный уровень организации биологических систем»
1. Актуальность темы:
Учение о клетке или цитология составляет один из важнейших разделов общей биологии. Клетка является основной структурной и функциональной единицей жизни. На клеточном уровне проявляются основные свойства живого: самообновление, самовоспроизведение, саморегуляция. Знание закономерностей процессов, происходящих в клетке, и назначение строения и функций тех или иных структур клетки необходимы для выявления характера патологических изменений в органе, для формирования диалектико – материалистического понимания сущности патологических процессов, происходящих в организме.
2. Учебные цели занятия:
— основные свойства живого: самообновление, самовоспроизведение, саморегуляция
— отличительные признаки про- и эукариотических клеток
— строение светового микроскопа
-правила работы со световым микроскопом.
— пользоваться световым микроскопам для изучения микроскопического строения эукариотической клетки
3. Цели развития личности: профессиональные
4. Оснащение:а)методический материал,таблицы; б) световые микроскопы, в) постоянные микропрепараты (митоз в клетках корешка лука, политенные хромосомы, амитоз),контролирующие компьютерные программы, мультимедийные презентации
5. Материалы для самоподготовки:
5.1. Вспомогательный учебный материал
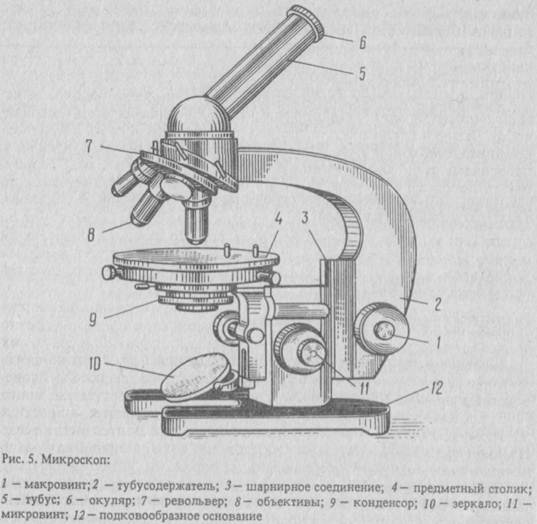
УСТРОЙСТВО МИКРОСКОПА
Микроскоп состоит из трех основных частей: механической, оптической и осветительной. К механической части относятся: штатив с основанием, предметный столик, тубус, тубусодержатель, револьвер, макрометрический и микрометрический винты (рис.).
Штатив состоит из массивного основания прямоугольной формы, которое имеет снизу четыре опорные площадки, обеспечивающие устойчивое положение микроскопа на рабочей поверхности стола. От основания вверх идет колонка штатива, к которой крепится кронштейн конденсора и предметный столик с отверстием в центре, тубусодержатель. На столик помещают изучаемые объекты, поэтому называют его предметным. Для фиксации препарата на столике имеются зажимы или клеммы. Через отверстие в столике приходит пучок света, т.к. объекты в данном типе световых микроскопов изучаются в проходящем свете.
Рис. Микроскоп студенческий – БИОЛАМ – Р11.
1 – основание штатива; 2 – колонка штатива; 3 – макровинт (кремальера); 4 – микровинт; 5 — предметный столик; 6 – тубусодержатель; 7 — тубус; 8 – револьвер; 9 — объектив; 10 – окуляр; 11 – конденсор; 12 – диафрагма; 13 — зеркало; 14 – винт конденсора.
На боковых сторонах тубусодержателя находятся два макро-метрических винта (кремальеры), служащие для фокусировки микроскопа при малом увеличении.
Микрометрический винт вмонтирован в основание штатива и служит для тонкой фокусировки при большом увеличении. Вращать микрометрический винт можно только на пол-оборота в обе стороны.
Осветительная часть микроскопа состоит из зеркала, конденсора и диафрагмы. Зеркало укреплено на штативе с помощью подвижной вилки ниже предметного столика. Оно имеет две поверхности: вогнутую и плоскую. Вогнутая поверхность сильнее концентрирует световые лучи и используется при более слабом освещении. Зеркало можно вращать в любом направлении, что дает возможность использовать источники света, расположенные в различных направлениях от микроскопа, и направлять пучок света на объект через отверстие в предметном столике. Конденсор находится под предметным столиком. Он состоит из двух линз, заключенных в цилиндрическую гильзу. Пучок света, направляемый зеркалом, проходит через систему линз конденсора. Меняя положение конденсора (выше, ниже), изменяют интенсивность освещения объекта, его контрастность. Перемещения конденсора производят винтом, расположенным с правой стороны микроскопа, на кронштейне конденсора. Конденсор микроскопа снабжен ирисовой диафрагмой, которая открывается и закрывается с помощью рукоятки (рычажка) и дополнительной откидной линзой, применяющейся при работе с объективами малого увеличения. Диафрагма состоит из ряда пластинок, расположенных по кругу и частично перекрывающих друг друга таким образом, что в центре остается отверстие для прохождения светового пучка. Увеличивая или уменьшая отверстие, регулируют освещенность.
Оптическая система микроскопа представлена окулярами и объективами. Окуляр находится в верхней части тубуса и обращен к глазу исследователя. Он представляет собой систему линз, заключенных в цилиндрическую гильзу. На верхней поверхности окуляра находятся цифры, указывающие на кратности его увеличения (х7; х10; х15; х20).
На противоположной стороне тубуса находится вращающаяся пластина — револьвер, с гнездами для объективов. Объектив (как и окуляр) представляет собой систему линз, заключенных в металлическую гильзу. Объективы имеют различную кратность увеличения, которая обозначается цифрой на его оправе. Модели студенческих микроскопов С-11, Р-11 комплектуются объективами: малого увеличения (х8), большого увеличения (х40) и иммерсионными (х60, х90). Объективы ввинчиваются в гнезда револьвера и заменяются при работе вращением револьвера. Общее увеличение микроскопа равно произведению кратности увеличения объектива на кратность увеличения окуляра.
ПРАВИЛА РАБОТЫ С МИКРОСКОПОМ
| Вид деятельности | Система действий |
| I. ПОДГОТОВКА МИКРОСКОПА К РАБОТЕ. | 1. Установить микроскоп слева, предметным столиком от себя. 2. Поднять конденсор до уровня предметного столика. 3. Открыть диафрагму поворотом ее рычага по часовой стрелке. 4. Поворотом револьвера установить объектив малого увеличения в рабочее (фиксированное) положение над отверстием предметного столика. 5. Опустить объектив малого увеличения на 8 мм над предметным столиком. 6. Глядя в окуляр и вращая зеркало в сторону источника света, добиться яркого и равномерного освещения поля зрения. (Не пользуйтесь прямыми солнечными лучами. ) 7. Положить на предметный столик микропрепаратпокровным стеклом вверх. |
| II. ПОЛУЧЕНИЕ ИЗОБРАЖЕНИЯ ПРИ МАЛОМ УВЕЛИЧЕНИИ. | 1. Глядя в окуляр, плавно вращайте макровинт на себя до получения четкого изображения объекта. 2. Установите объект в центре поля зрения, перемещая препарат на предметном столике в нужном направлении. 3. Если объект не появляется в поле зрения, необходимо осуществить его поиск. Для этого получите изображение одного из углов покровного стекла, а затем перемещайте препарат последовательно (сверху вниз и слева направо) до обнаружения искомого объекта. Установите его в центре поля зрения. |
| III. ПОЛУЧЕНИЕ ИЗОБРАЖЕНИЯ ПРИ БОЛЬШОМ УВЕЛИЧЕНИИ. | 1. Поворотом револьвера установите над препаратом объектив большого увеличения. 2. Посмотрите в окуляр. Если изображение объекта не четкое, то вращением микровинта добейтесь четкого изображения объекта. 3. Если в поле зрения объект не виден, то под контролем зрения со стороны опустите объектив почти до соприкосновения с покровным стеклом. Затем, глядя в окуляр, вращайте макровинт на себя до получения изображения. 4. Вращая микровинт на пол-оборота на себя и от себя рассмотрите объект на глубину. 5. Окончив микроскопию, переведите микроскоп на малое увеличение и уберите препарат со столика. |
| IV. УСТРАНЕНИЕ ОШИБОК, ВСТРЕЧАЮЩИХСЯ ПРИ РАБОТЕ С МИКРОСКОПОМ. | 1. При наведении света: а) часть поля зрения затенена, так как объектив не зафиксирован на оптической оси микроскопа. Для устранения затенения повернуть револьвер до щелчка; б) в поле зрения видны предметы окружающей обстановки: переплеты оконных рам, светильники). Для устранения помех опустить конденсор до исчезновения изображения предметов. 2. При переходе с малого увеличения на большое: а) объектив упирается в предметное стекло препарата. Причина – препарат лежит на предметном столике покровным стеклом вниз; б) микроскоп не фокусируется на большом увеличении. Проверить, переведя микроскоп на малое увеличение: -не сместился ли объект из центра поля зрения; -не положен ли препарат покровным стеклом вниз. Устранить ошибки и перейти на работу с объективом большого увеличения. |
| V. ЗАВЕРШЕНИЕ РАБОТЫ С МИКРОСКОПОМ. | 1. Перевести микроскоп на малое уве-личение. 2. Убрать препарат с предметного сто-лика. 3. Опустить конденсор. 4. Опустить объектив малого увеличения до уровня предметного столика. 5. Поставить микроскоп под колпак. |
1.Поддержка жизни на каком-либо уровне связано с явлением репродукции. На каком уровне организации, репродукция осуществляется на основе матричного синтеза
Д. На уровне организма
2. Установлено, что в клетках организмов отсутствуют мембранные органеллы и их наследственный материал не имеет нуклеосомной организации. Что это за организмы?
3. На занятии по биологии преподаватель попросил указать в лабораторной работе степень увеличения микроскопа, которая использовалась при изучении микропрепаратов. Один из студентов не смог самостоятельно справиться с поставленной задачей. Как правильно подсчитать этот показатель?
А. Умножить показатели, указанные на всех объективах микроскопа
Б. Разделить показатель объектива с меньшим увеличением на показатель объектива с большим увеличением
В. Умножить показатели увеличения объектива и окуляра
Г. Разделить показатели увеличения объектива на показатель окуляра
Д. Вычесть показатели, указанные на всех объективах микроскопа, из значения увеличения окуляра
4. При изучении микропрепарата студент после его фиксации на предметном столике и достижения оптимальной освещённости поля зрения установил объектив «х40» и посмотрел в объектив. Преподаватель остановил студента и сказал, что при работе допущена принципиальная ошибка. Какая ошибка была допущена?
А. Не стоило фиксировать микропрепарат
Б. Изучение микропрепарата нужно было начать с помощью объектива с малым увеличением
В. Освещение регулируется в последнюю очередь
Г. Фиксация препарата производится перед завершением исследования
Д. Все манипуляции стоило проводить в обратном порядке
5. Существование жизни на всех уровнях определяется структурой более низкого уровня. Какой уровень организации предшествует и обеспечивает существование жизни на клеточном уровне:
Задачи для контроля знаний:
1. При попытке изучения микропрепарата с помощью светового микроскопа исследователь обнаружил, что всё поле зрения затемнено. Что может быть причиной этого явления? Как устранить эту проблему?
2. При попытке изучения микропрепарата с помощью светового микроскопа исследователь обнаружил, что освещена только половина поля зрения. Что может быть причиной этого явления? Как устранить эту проблему?
3. Какие манипуляции необходимо провести в случае, если при использовании светового микроскопа наблюдаемый объект виден нечётко?
4. Расчитать кратность увеличения светового микроскопа:
А) если на окуляре есть обозначение «х15», а на объективе «х8»
Б) если кратность увеличения линзы окуляра «х10» , а объектива «х40»
6. Материалы для разбора с преподавателем и контроля его усвоения:
6.1. Разбор с преподавателем узловых вопросов для освоения темы занятия.
6.2. Демонстрация преподавателем методик практических приемов по теме.
6.3. Материал для контроля усвоения материала:
Вопросы для разбора с преподавателем:
1. Медицинская биология как наука об основах жизнедеятельности человека, изучающая закономерности наследственности, изменчивости, индивидуального и эволюционного развития, а также вопросы морфофизиологической и социальной адаптации человека к условиям окружающей среды в связи с его биосоциальной сущностью.
2. Современный этап развития общей и медицинской биологии. Место биологии в системе медицинского образования.
3. Сущность жизни. Свойства живого. Формы жизни, ее фундаментальные свойства и атрибуты.
4. Эволюционно обусловленные структурные уровни организации жизни; элементарные структуры уровней и основные биологические явления, их характеризующие.
5. Значение представлений об уровнях организации живого для медицины.
6. Особое место человека в системе органического мира.
7. Соотношение физико-химических, биологических и социальных явлений в жизнедеятельности человека.
8. Оптические системы в биологических исследованиях. Строение светового микроскопа и правила работы с ним.
9. Техника изготовления временных микропрепаратов, их изучение и описание. Методы изучения структуры клетки
Практическая часть
1. Используя методические указания изучить строение микроскопа и правила работы с ним.
2. Отработать навыки работы с микроскопом и изготовления временных препаратов волокон ваты, чешуек крыла бабочки. Изучить микропрепараты: кожица луковицы, лист элодеи, мазок крови лягушки, изучить типографский шрифт.
3. Занести в протокол граф логической структуры “Строение микроскопа”.
4. Занести в протокол “Правила работы с микроскопом”
5. Заполнить таблицу «Уровни организации и исследования многоклеточного организма».
Изучение устройства микроскопа.
Ознакомление с микроскопированием мазков.
Для изучения морфологии микроорганизмов используют микроскопы. Биологический микроскоп (рис. 1) представляет собой оптический прибор, увеличивающий предметы в 1000-15000 раз, и состоит из механической, оптической и осветительной систем.
К механической системе относятся подковообразная ножка, тубусодержатель, тубус, предметный столик, винты. Оптическая система включает объективы и окуляр. Осветительная система состоит из конденсора с диафрагмой и зеркала.
Тубусодержатель и подковообразное основание (ножка) соединены между собой подвижно шарниром. Тубус — зрительная труба микроскопа. В верхнюю часть тубуса вставлен окуляр, в нижнюю — вращающийся вокруг своей оси револьвер, в который ввинчены объективы. Тубус передвигается вверх и вниз при помощи макрометрического и микрометрического винтов. Один оборот микрометрического винта передвигает тубус на 0,1 мм. Поэтому микровинтом пользуются для более точной наводки, а для предварительной — макровинтом. Предметный столик предназначен для размещения исследуемого материала. Столик можно передвигать в различных направлениях с помощью винтов.
Конденсор состоит из линз, собирающих отраженные от зеркала лучи в сильный световой пучок, и направляет его через отверстие предметного столика на препарат. При определении подвижности неокрашенных препаратов конденсор должен быть несколько опущен.
Диафрагма находится между зеркалом и конденсором и служит для регулирования количества света, поступающего в конденсор.
Объектив состоит из системы линз, заключенных в металлическую оправу. Передняя линза служит для увеличения предмета, остальные — для коррекции изображения. Объектив дает действительное, увеличенное, обратное изображение.
Современные биологические микроскопы имеют не менее трех объективов. Сухие объективы увеличивают в 8 и 40 раз (между объективами и препаратом находится слой воздуха), иммерсионные — в 90 раз. На оправу каждого объектива нанесена цифра, указывающая увеличение. При микроскопии окрашенных препаратов пользуются иммерсионным объективом, погружая переднюю линзу в каплю кедрового масла, нанесенного на предметное стекло с окрашенными бактериями. Благодаря этому все лучи от осветителя, не изменяя своего направления, попадают в объектив и получается четкое изображение.
Окуляр состоит из верхней — глазной и нижней — собирательной линз. На верхней части окуляра имеется цифра, указывающая увеличение (7, 10, 15). Окуляр увеличивает только изображение. Общее увеличение микроскопа складывается из произведения увеличения объектива на увеличение окуляра.
Принцип действия люминесцентного микроскопа основан на способности отдельных объектов и красителей светиться при освещении их ультрафиолетовыми лучами. Люминесцентные микроскопы снабжены источником ультрафиолетового света и набором светофильтров. У бактерий очень слабо выражена собственная флюоресценция. Поэтому необходимо их обработать флюоресцирующими красками (флюорохромами), которые окрашивают структурные’ элементы клетки в различные цвета.
Принцип действия электронного микроскопа основан на использовании вместо световых лучей потока электронов, получаемых из электронной пушки. Все оптические линзы заменены электромагнитными катушками, создающими электромагнитное поле, которое управляет движением электронов. Электронный микроскоп увеличивает предмет в 50-200 тыс. раз. Препараты для исследования готовят на тонких пленках коллодия. На пути потока электронов ставят исследуемый объект, который отражается на люминесцирующем экране. Изображение объекта можно сфотографировать аппаратом, вмонтированным в микроскоп. С помощью электронной микроскопии можно детально изучать строение бактерий, вирусов, бактериофага.
Рабочий стол для микроскопирования препаратов желательно размещать у окна. Микроскоп устанавливают на рабочий стол тубусодержателем к себе примерно на 7-10 см от края. Вначале проводят настройку освещения, для чего зеркалом направляют пучок света от источника освещения в объектив с увеличением в 8 раз.
При правильной настройке освещения поле зрения микроскопа должно быть в виде равномерно освещенного круга. После этого на предметный столик помещают исследуемый препарат, который закрепляют клеммами и рассматривают под микроскопом, пользуясь объективами с увеличением в 8, 40 или 90 раз.
При работе с объективами 8 и 40 тубус микроскопа осторожно опускают с помощью макрометрического винта, приближают объектив почти вплотную к препарату, но не касаются его. Наблюдают в окуляр, слегка приподнимая тубус тем же винтом до получения изображения. С помощью микрометрического винта проводят точную установку объектива до получения четкого изображения предмета.
При работе с иммерсионным объективом (увеличение в 90 раз) на препарат предварительно наносят каплю иммерсионного масла, а затем под контролем глаза макрометрическим винтом опускают объектив в каплю масла. Точную установку препарата в фокус объектива проводят с помощью микрометрического винта, который можно вращать на пол-оборота.
По окончании работы исследуемый материал снимают с предметного столика. Мягкой тканью, смоченной в спирте или эфире, удаляют иммерсионное масло с объектива, слегка опускают конденсор, устанавливают объектив и убирают микроскоп в футляр или хранят его под стеклянным колпаком, предохраняющим его от пыли и сырости.
Методы микроскопии в микробиологии: световая, темнопольная, фазовоконтрастная, люминесцентная. Их практическое применение.
Размеры микробов, имеющих клеточное строение, составляют 0,2–20 мкм и они легко обнаруживаются в иммерсионном микроскопе. Вирусы во много раз меньше. Диаметр самых больших из них, например вируса натуральной оспы, около 300 нм, а у самых мелких составляет 20–30 нм. Ввиду этого для выявления вирусов используются электронные микроскопы.
В микробиологических исследованиях применяют световые и электронные микроскопы; методы оптической и электронной микроскопии.
Оптический микроскоп. Наиболее важной оптической частью микроскопа являются объективы, которые делятся на сухие и иммерсионные.
Сухие объективы с относительно большим фокусным расстоянием и слабым увеличением применяются для изучения микроорганизмов, имеющих крупные размеры (более 10–20 мкм), иммерсионные (лат. immersio – погружение) с фокусным расстоянием – при исследовании более мелких микробов.
При микроскопии иммерсионным объективом х90 обязательным условием является его погружение в кедровое, персиковое или в вазелиновое масло, показатели преломления света у которых близки предметному стеклу, на котором делают препараты. В этом случае падающий на препарат пучок света не рассеивается и, не меняя направления, попадает в иммерсионный объектив. Разрешающая способность иммерсионного микроскопа находится в пределах 0,2 мкм, а максимальное увеличение объекта достигает 1350.
При использовании иммерсионного объектива вначале центрируют оптическую часть микроскопа. Затем поднимают конденсор до уровня предметного столика, открывают диафрагму, устанавливают объектив малого увеличения и при помощи плоского зеркала освещают поле зрения. На предметное стекло с окрашенным препаратом наносят каплю масла, в которую под контролем глаза осторожно погружают объектив, затем, поднимая тубус, смотрят в окуляр и вначале макро–, а потом микровинтом устанавливают четкое изображение объекта. По окончании работы удаляют салфеткой масло с фронтальной линзы объектива.
Микроскопия в темном поле зрения проводится при боковом освещении и обычно применяется при изучении подвижности бактерий или обнаружении патогенных спирохет, поперечник которых может быть меньше 0,2 мкм. Чтобы получить яркое боковое освещение, обычный конденсор заменяют специальным параболоидом–конденсором, в котором центральная часть нижней линзы затемнена, а боковая поверхность зеркальная. Этот конденсор задерживает центральную часть параллельного пучка лучей, образуя темное поле зрения. Краевые лучи проходят через кольцевую щель, попадают на боковую зеркальную поверхность конденсора, отражаются от нее и концентрируются в его фокусе. Если на пути луча нет каких–либо частиц, он преломляется, падая на боковую зеркальную поверхность, отражается от нее и выходит из конденсора. Когда луч встречает на своем пути микробы, свет отражается от них и попадает в объектив – клетки ярко светятся. Так как для бокового освещения необходим параллельный пучок света, применяется только плоское зеркало микроскопа. Обычно исследование в темном поле зрения проводится под сухой системой. При этом небольшую каплю материала помещают на предметное стекло и накрывают покровным, не допуская образования пузырьков воздуха.
Фазово–контрастная и аноптральная микроскопия основаны на том, что оптическая длина пути света в любом веществе зависит от показателя преломления. Это свойство используют с целью увеличить контрастность изображения прозрачных объектов, какими являются микробы, т. е. для изучения деталей их внутреннего строения. Световые волны, проходя через оптически более плотные участки объекта, отстают по фазе от световых волн, не проходящих через них. При этом интенсивность света не меняется, а только изменяется фаза колебания, не улавливаемая глазом и фотопластинкой. Для повышения контрастности изображения фазовые колебания при помощи специальной оптической системы превращаются в амплитудные, хорошо улавливаемые глазом. Препараты в световом поле зрения становятся более контрастными – положительный контраст; при отрицательном фазовом контрасте на темном фоне виден светлый объект. Вокруг изображений нередко возникает ореол.
Большей четкости изображения малоконтрастных живых микробов (даже некоторых вирусов) достигают в аноптральном микроскопе. Одной из важнейших его деталей является линза объектива, расположенная вблизи «выходного» зрачка, на которую нанесен слой копоти или меди, поглощающий не менее 10 % света. Благодаря этому фон поля зрения приобретает коричневый цвет, микроскопируемые объекты имеют различные оттенки – от белого до золотисто–коричневого.
Люминесцентная микроскопия основана на способности некоторых клеток и красителей светиться при попадании на них ультрафиолетовых и других коротковолновых лучей света. Люминесцентные микроскопы представляют собой обычные световые микроскопы, снабженные ярким источником света и набором светофильтров, которые выделяют коротковолновую часть спектра, возбуждающую люминесценцию. Между зеркалом микроскопа и источником света устанавливают сине–фиолетовый светофильтр (УФС–3, ФС–1 и пр.). На окуляр надевают желтый светофильтр (ЖС–3 или ЖС–18).
Различают собственную (первичную) флюоресценцию и наведенную (вторичную). Так как большая часть микробов не обладает собственной флюоресценцией, они обрабатываются красителями, способными флюоресцировать (вторичная люминесценция). В качестве флюорохромов используют аурамин (для обработки микобактерий туберкулеза), акридин желтый (гонококки), корифосфин (коринебактерии дифтерии), флюоресцеинизотиоцианат (для мечения антител).
Люминесцентная микроскопия отличается рядом преимуществ: дает цветное изображение и значительную контрастность; позволяет обнаружить живые и погибшие микроорганизмы, прозрачные и непрозрачные объекты; установить локализацию бактерий, вирусов и их антигенов в пораженных клетках организма.
Электронный микроскоп. В электронном микроскопе вместо света используется поток электронов в безвоздушной среде, на пути которых находится анод. Источником электронов является электронная пушка (вольфрамовая нить, разогреваемая до 2500–2900 °С). Оптические линзы заменены электромагнитами. Между вольфрамовой нитью и анодом возникает электрическое поле в 30 000–50 000 Вт, что сообщает электронам большую скорость, и они, проходя через отверстие анода, попадают в первую электромагнитную линзу (конденсор). Электронные лучи на выходе из конденсора собираются в плоскости исследуемого объекта. Они отклоняются под разными углами за счет различной толщины и плотности препарата и попадают в объективную электромагнитную линзу, снабженную диафрагмой. Электроны, незначительно отклонившиеся при встрече с объектом, проходят через диафрагму, а отклонившиеся под большим углом – задерживаются, благодаря чему обеспечивается контрастность изображения. Линза объектива дает промежуточное увеличение изображения, которое наблюдается через смотровое окно. Проекционная линза может увеличивать изображение во много раз. Это изображение принимается на флюоресцирующий экран и фотографируется. Разрешающая способность электронных микроскопов равна 1,0 –0,14нм
Стерилизация. Методы стерилизации и стерилизационная аппаратура. Режимы стерилизации и контроль качества стерилизации в автоклаве.
Стерилизация – полное уничтожение всех микроорганизмов. Стерилизуют посуду, инструменты, питательные среды, лекарственные препараты, перевязочные средства, медицинское белье, эндоскопические аппараты и другие объекты. Для их стерилизации применяются в основном физические и механические методы.
Стерилизация в пламени проводится для обеззараживания бактериальных петель, игл, предметных и покровных стекол, пинцетов.
Стерилизация горячим воздухом проводится в электрических сухожаровых шкафах, имеющих различную форму и размеры, снабженных хорошей тепловой изоляцией. Необходимая температура автоматически поддерживается терморегулятором. Cтерилизуют лабораторную посуду и шприцы при температуре 180°С в течение 1 ч. Чашки Петри, пастеровские и градуированные пипетки помещают в специальные металлические пеналы или заворачивают в бумагу по несколько штук. Пробирки и колбы закрывают ватными пробками.
Стерилизация паром проводится двумя способами: насыщенным паром под давлением и текучим паром.
СТЕРИЛИЗАЦИЮ ПАРОМ ПОД ДАВЛЕНИЕМ осуществляют в автоклаве, который представляет собой толстостенный котел цилиндрической формы, покрытый снаружи кожухом и герметически закрывающийся крышкой, бывают горизонтальные и вертикальные. Пар поступает в рабочую камеру из маленького котла, воду в котором нагревают электротоком. Давление измеряют манометром.
Не изменяющиеся под действием высокой температуры и давления питательные среды (МПА, МПБ), растворы или посуду с заразным материалом стерилизуют при 1 атм (121°С) 15–20 мин; среды с углеводами и нативными белками – при 0,5 атм (110°С) 5–10 мин; материал и посуду, содержащие бациллы сибирской язвы, обеззараживают при 1 атм в течение 2ч.
Контроль за соблюдением режимных параметров работы автоклава проводится с помощью максимального термометра. В отдельных случаях в автоклав помещают бензойную кислоту или бензонафтол с точками плавления 120°С и 110°С.
СТЕРИЛИЗАЦИЯ ТЕКУЧИМ ПАРОМ проводится троекратно (дробно) в течение трех дней по 30–60 мин в автоклаве при незавинченной крышке и открытом выпускном кране или в спец аппарате, который представляет собой металлический цилиндр, покрытый теплоизоляционным материалом с отверстием в конической крышке для выхода пара, краном и указательной трубкой в донной части. Внутри аппарата имеется подставка для стерилизуемых материалов. Залитую в него воду подогревают любым источником тепла. В текучепаровом аппарате стерилизуют питательные среды, изменяющие свои свойства при температуре выше 100°С: молоко, желатину, картофель и среды с углеводами. Вегетативные формы микроорганизмов при такой стерилизации погибают, а споры сохраняются. Спустя сутки при комнатной температуре часть из них прорастает и повторное воздействие пара их уничтожает. Прогреванием на третьи сутки полностью обезвреживают всю спороносную микрофлору, которая к этому времени завершает вегетацию.
Свертывание (уплотнение) сыворотки и яичных сред производят в двустенном свертывателе с электрическим нагревом. Аппарат покрыт теплоизоляционным материалом и имеет стеклянную и металлическую крышки. Воду в свертыватель наливают через имеющееся в его верхней части отверстие, которое закрывается пробкой с вмонтированным термометром. Пробирки со средами укладывают на дно свертывателя в наклонном положении. Прогревают среды однократно или дробно при температуре 80–90°С в течение 1 ч.
Фильтрование как механический способ стерилизации может быть использовано для обеспложивания жидких веществ, которые нежелательно подвергать действию высокой температуры, например сывороток, антибиотиков. Для этого изготовляют мелкопористые фильтры с точно градуированными порами, которые задерживают микроорганизмы.
В быту используется стерилизация кипячением для обработки игл и шприцев. Кипятят их в стерилизаторах 30–45 мин. Для повышения точки кипения и устранения жесткости воды добавляют 1 % соды. Этот метод не обеспечивает полного уничтожения микробов, так как споры бактерий и некоторые вирусы выдерживают кипячение в течение нескольких часов.
Дата добавления: 2015-04-01 ; просмотров: 3094 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
При изучении препарата в поле зрения светового микроскопа
Микроскоп и микроскопические методы исследования
Световая микроскопия
Для обнаружения и исследования микроорганизмов применяют микроскопы. Световые микроскопы предназначены для изучения микроорганизмов, которые имеют размеры не менее 0,2 мкм (бактерии, простейшие и т. п.) a электронные для изучения более мелких микроорганизмов (вирусы) и мельчайших структур бактерий.
Современные световые микроскопы — это сложные оптические приборы, обращение с которыми требует определенных знаний, навыков и большой аккуратности.
Световые микроскопы подразделяются на студенческие, рабочие, лабораторные и исследовательские, различающиеся по конструкции и комплектации оптикой. Отечественные микроскопы (Биолам», «Бимам», «Микмед») имеют обозначения, указывающие, к какой группе они относятся (С — студенческие, Р — рабочие, Л — лабораторные, И — исследовательские), комплектация обозначается цифрой.
В микроскопе различают механическую и оптическую части.
К механической части относятся: штатив (состоящий из основания и тубусодержателя) и укрепленные на нем тубус с револьвером для крепления и смены объективов, предметный столик для препарата, приспособления для крепления конденсора и светофильтров, а также встроенные в штатив механизмы для грубого (макромеханизм, макровинт) и тонкого
(микромеханизм, микровинт) перемещения предметного столика или тубусодержателя.
Оптическая часть микроскопа представлена объективами, окулярами и осветительной системой, которая в свою очередь состоит из расположенных под предметным столиком конденсора Аббе, зеркала, имеющего плоскую и вогнутую сторону, а также отдельного или встроенного осветителя. Объективы ввинчиваются в револьвер, а соответствующий окуляр, через который наблюдают изображение, устанавливают с противоположной стороны тубуса. Различают монокулярный (имеющий один окуляр) и бинокулярный (имеющий два одинаковых окуляра) тубусы.
Принципиальная схема микроскопа и осветительной системы

2. Коллектор;
3. Ирисовая полевая диафрагма;
4. Зеркало;
5. Ирисовая аппертурная диафрагма;
6. Конденбсор;
7. Препарат;
7′. Увеличенное действительное промежуточное изображение препарата, образуемое ; объективом;
7». Увеличенное мнимое окончательное изображение препарата, наблюдаемое в окуляре;
8. Объектив;
9. выходной значок объектива;
10. Полевая диафрагма окуляра;
11. Окуляр;
12. Глаз.
Основную роль в получении изображения играет объектив. Он строит увеличенное, действительное и перевернутое изображение объекта. Затем это изображение дополнительно увеличивается при рассматривании его через окуляр, который аналогично обычной лупе дает увеличенное мнимое изображение.
Увеличение микроскопа ориентировочно можно определить, умножая увеличение объектива на увеличение окуляра. Однако увеличение не определяет качества изображения. Качество изображения, его четкость, определяется разрешающей способностью микроскопа, т. е. возможностью различать раздельно две близко расположенные точки. Предел разрешения — минимальное расстояние, на котором эти точки еще видны раздельно,— зависит от длины волны света, которым освещается объект, и числовой апертуры объектива. Числовая апертура, в свою очередь, зависит от угловой апертуры объектива и показателя преломления среды, находящейся между фронтальной линзой объектива и препаратом. Угловая апертура—это максимальный угол, под которым могут попадать в объектив лучи, прошедшие через объект. Чем больше апертура и чем ближе показатель преломления среды, находящейся между объективом и препаратом, к показателю преломления стекла, тем выше разрешающая способность объектива. Если считать апертуру конденсора равной апертуре объектива, то формула разрешающей способности имеет следующий вид:
где R — предел разрешения; 
Различают полезное и бесполезное увеличение. Полезное увеличение обычно равно числовой апертуре объектива, увеличенной в 500—1000 раз. Более высокое окулярное увеличение не выявляет новых деталей и является бесполезным.
В зависимости от среды, которая находится между объективом и препаратом, различают «сухие» объективы малого и среднего увеличения (до 40 х) и иммерсионные с максимальной апертурой и увеличением (90—100 х). «Сухой» объектив — это такой объектив, между фронтальной линзой которого и препаратом, находится воздух.
Особенностью иммерсионных объективов является то, что между фронтальной линзой такого объектива и препаратом помещают иммерсионную жидкость, имеющую показатель преломления такой же, как стекло (или близкий к нему), что обеспечивает увеличение числовой апертуры и разрешающей способности объектива. В качестве иммерсионной жидкости для объективов водной иммерсии используют дистиллированную воду, а для объективов масляной иммерсии—кедровое масло или специальное синтетическое иммерсионное масло. Использование синтетического иммерсионного масла предпочтительнее, поскольку его параметры более точно нормируются, и оно в отличие от кедрового, не засыхает на поверхности фронтальной линзы объектива. Для объективов, работающих в ультрафиолетовой области спектра, в качестве иммерсионной жидкости используют глицерин. Ни в коем случае нельзя пользоваться суррогатами иммерсионного масла и, в частности, вазелиновым маслом.
**Изображение, полученное с помощью линз, обладает различными недостатками: сферической и хроматической аберрациями, кривизной поля изображения и др. В объективах, состоящих из нескольких линз, эти недостатки в той или иной мере исправлены. В зависимости от степени исправления этих недостатков различают объективы ахроматы и более сложные апохроматы. Соответственно объективы, в которых исправлена кривизна поля изображения, называются планахроматами и планапохроматами. Использование этих объективов позволяет получить резкое изображение по всему полю, тогда как изображение, полученное с помощью обычных объективов, не имеет одинаковой резкости в центре и на краях поля зрения. Все характеристики объектива обычно выгравированы на его оправе: собственное увеличение, апертура, тип объектива (АПО — апохромат и т. п.); объективы водной иммерсии имеют обозначение ВИ и белое кольцо вокруг оправы в нижней ее части, объективы масляной иммерсии—обозначение МИ и черное кольцо.
Все объективы рассчитаны для работы с покровным стеклом толщиной 0,17мм.
Толщина покровного стекла особенно влияет на качество изображения при работе с сильными сухими системами (40 х). При работе с иммерсионными объективами нельзя пользоваться покровными стеклами толще 0,17 мм потому, что толщина покровного стекла может оказаться больше, чем рабочее расстояние объектива, и в этом случае, при попытке сфокусировать объектив на препарат, может быть повреждена фронтальная линза объектива.
Окуляры состоят из двух линз и тоже бывают нескольких типов, каждый из которых применяется с определенным типом объектива, дополнительно устраняя недостатки изображения. Тип окуляра и его увеличение обозначены на его оправе.
Конденсор предназначен для того, чтобы сфокусировать на препарате свет от осветителя, направляемый зеркалом микроскопа или осветителя (в случае использования накладного или встроенного осветителя). Одной из деталей конденсора является апертурная диафрагма, которая имеет важное значения для правильного освещения препарата.
Осветитель состоит из низковольтной лампы накаливания с толстой нитью, трансформатора, коллекторной линзы и полевой диафрагмы, от раскрытия, которой зависит диаметр освещенного поля на препарате. Зеркало направляет свет от осветителя в конденсор. Для того чтобы сохранить параллельность лучей, идущих от осветителя в конденсор, необходимо использовать только плоскую сторону зеркала.
Настройка освещения н фокусировка микроскопа
Качество изображения в значительной мере зависит также от правильного освещения. Существует несколько различных способов освещения препарата при микроскопии. Наиболее распространенным является способ установки света по Келеру, который заключается в следующем:
1) устанавливают осветитель против зеркала микроскопа;
2) включают лампу осветителя и направляют свет на плоское (!) зеркало микроскопа;
3)помещают препарат на предметный столик микроскопа;
4) закрывают зеркало микроскопа листком белой бумаги и фокусируют на нем изображение нити лампы, передвигая патрон лампы в осветителе;
5) убирают лист бумаги с зеркала;
6) закрывают апертурную диафрагму конденсора. Перемещая зеркало и слегка передвигая патрон лампы, фокусируют изображение нити на апертурной диафрагме. Расстояние осветителя от микроскопа должно быть таким, чтобы изображение нити лампы было равно диаметру апертурной диафрагмы конденсора (наблюдать апертурную диафрагму можно с помощью плоского зеркала, помещенного с правой стороны основания микроскопа).
7)открывают апертурную диафрагму конденсора, уменьшают отверстие полевой диафрагмы осветителя и значительно уменьшают накал лампы;
8) при малом увеличении (10х), глядя в окуляр, получают резкое изображение препарата;
9)слегка поворачивая зеркало, переводят изображение полевой диафрагмы, которое имеет вид светлого пятна, в центр поля зрения. Опуская и поднимая конденсор, добиваются получения резкого изображения краев полевой диафрагмы в плоскости препарата (вокруг них может быть видна цветная каемка);
10) раскрывают полевую диафрагму осветителя до краев поля зрения, увеличивают накал нити лампы и слегка (на 1/3) уменьшают раскрытие апертурной диафрагмы конденсора;
11)при смене объектива необходимо проверить настройку света.
После окончания настройки света по Келеру нельзя изменять положение конденсораf раскрытие полевой и апертурной диафрагмы. Освещенность препарата можно регулировать только нейтральными светофильтрами или изменением накала лампы с помощью реостата. Излишнее открытие апертурной диафрагмы конденсора может привести к значительному снижению контраста изображения, а недостаточное — к значительному ухудшению качества изображения (появлению диффракционных колец). Для проверки правильности раскрытия апертурной диафрагмы необходимо удалить окуляр и, глядя в тубус, открыть ее таким образом, чтобы она закрывала светящееся поле на одну треть. Для правильного освещения препарата при работе с объективами малого увеличения (до 10х) необходимо отвинтить и снять верхнюю линзу конденсора.
Внимание! При работе с объективами, дающими большое увеличение — с сильными сухими (40х) и иммерсионными (90х) системами, чтобы не повредить фронтальную линзу, при фокусировке пользуются следующим приемом: наблюдая сбоку, опускают объектив макровинтом почти до соприкосновения с препаратом, затем, глядя в окуляр, макровинтом очень медленно поднимают объектив до появления изображения и с помощью микровинта производят окончательную фокусировку микроскопа.
Уход за микроскопом
При работе с микроскопом нельзя применять большие усилия. Нельзя касаться пальцами поверхности линз, зеркал и светофильтров.
Чтобы предохранить внутренние поверхности объективов, а также призмы тубуса от попадания пыли, необходимо всегда оставлять окуляр в тубусе. При чистке внешних поверхностей линз нужно удалить с них пыль мягкой кисточкой, промытой в эфире. Если необходимо, осторожно протирают поверхности линз хорошо выстиранной, не содержащей остатков мыла, полотняной или батистовой тряпочкой, слегка смоченной чистым бензином, эфиром или специальной смесью для чистки оптики. Не рекомендуется протирать оптику объективов ксилолом, так как это может привести к их расклеиванию.
С зеркал, имеющих наружное серебрение, можно только удалять пыль, сдувая ее резиновой грушей. Протирать их нельзя. Нельзя также самостоятельно развинчивать и разбирать объективы — это приведет к их порче. По окончании работы на микроскопе необходимо тщательно удалить остатки иммерсионного масла с фронтальной линзы объектива указанным выше способом. Затем опустить предметный столик (или конденсор в микроскопах с неподвижным столиком) и накрыть микроскоп чехлом.
Для сохранения внешнего вида микроскопа необходимо периодически протирать его мягкой тряпкой, слегка пропитанной бескислотным вазелином и затем сухой мягкой чистой тряпкой.
Помимо обычной световой микроскопии существуют методы микроскопии, позволяющие изучать неокрашенные микроорганизмы: фазово-контрастная, темнопольная и люминесцентная микроскопия. Для изучения микроорганизмов и их структур, размер которых меньше разрешающей способности светового микроскопа используют электронную микроскопию.
- http://studfiles.net/preview/543788/page:6/
- http://poisk-ru.ru/s21378t6.html
- http://veterinarua.ru/laboratornye-raboty/470-mikroskop-i-tekhnika-mikroskopirovaniya.html
- http://helpiks.org/3-313.html
- http://nsau.edu.ru/images/vetfac/images/ebooks/microbiology/stu/bacter/microscop.htm


















