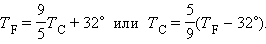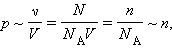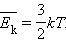Молекулярно-кинетическое определение Температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы. Связь между кинетической энергией, массой и скоростью выражается следующей формулой: Ek = 1 /2m • v 2 Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру. Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана: Eср = i/2kT где: i — число степеней свободы k = 1.380 6505(24) × 10 -23 Дж/K — постоянная Больцмана T — температура; Термодинамическое определение Температура — величина, обратная изменению энтропии (степени беспорядка) системы при добавлении в систему единичного количества теплоты: 1/T = ΔS/ΔQ. История термодинамического подхода: Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами. В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Если в системе два тела имеют одинаковую температуру, то между ними не происходит передачи кинетической энергии частиц (тепла). Если же существует разница температур, то тепло переходит от тела с более высокой температурой к телу с более низкой, потому что суммарная энтропия при этом возрастает. Температура связана также с субъективными ощущениями «тепла» и «холода», связанными с тем, отдает ли живая ткань тепло или получает его. Некоторые квантовомеханические системы могут находится в состоянии, при котором энтропия не возрастает, а убывает при добавлении энергии, что формально соответствует отрицательной абсолютной температуре. Однако такие состояния находятся не «ниже абсолютного нуля», а «выше бесконечности», поскольку при контакте такой системы с телом, обладающим положительной температурой, энергия передается от системы к телу, а не наоборот (подробнее см. Квантовая термодинамика). Свойства температуры изучает раздел физики — термодинамика. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также химию и биологию.
Физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Т. одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом.
Температура является количественной мерой «нагретости» тела. Понятие температуры занимает особое место в ряду физических величин, определяющих состояние системы. Температура не только характеризует состояние теплового равновесия данного тела. Она является также тем параметром, который принимает одинаковое значение для любых двух или большего числа тел, находящихся в тепловом равновесии друг с другом, т.е. характеризует тепловое равновесие системы тел. Это значит, что если два или несколько тел, имеющих разные температуры, привести в контакт, то в результате взаимодействия между молекулами эти тела примут одинаковое значение температуры.
Молекулярно-кинетическая теория позволяет выяснить физический смысл температуры. Сравнивая выражения (2.4) и (2.7), видим, что они совпадают, если положить
(2.8)
(2.9)
Эти соотношения называют вторыми основными уравнениями молекулярно-кинетической теории газов. Они показывают, что абсолютная температура есть величина, определяющая среднюю кинетическую энергию поступательного движения молекул; она является мерой энергии поступательного движения молекул, а тем самым и интенсивности теплового движения молекул. В этом состоит молекулярно-кинетический смысл абсолютной температуры. Как видим, процесс нагревания тела непосредственно связан с увеличением средней кинетической энергии частиц тела. Из (2.9) видно, что абсолютная температура – величина положительная: Значение называется абсолютным нулем температуры. Согласно (2.8) при абсолютном нуле должно полностью прекращаться поступательное движение частиц ( ). Следует, однако, отметить, что при низких температурах газ переходит в конденсированное состояние. Следовательно, теряют смысл и все выводы, сделанные на основе кинетической теории газов. И при абсолютном нуле температуры движение не исчезает. Движение электронов в атомах, движение свободных электронов в металлах полностью сохраняются и при температуре абсолютного нуля. Кроме того, даже при абсолютном нуле сохраняется некоторое колебательное движение атомов внутри молекул и атомов в узлах кристаллической решетки. Существование этих колебаний связано с наличием нулевой энергии у квантового гармонического осциллятора ( ), в качестве которого можно рассматривать указанные выше колебания атомов. Эта энергия не зависит от температуры, а значит, не обращается в нуль и при . При низких температурах классические представления о движении перестают выполняться. В этой области действуют квантовые законы, в соответствии с которыми движение частиц не прекращается, даже если понизить температуру тела до абсолютного нуля. Но скорость этого движения уже не зависит от температуры и это движение не является тепловым. Это подтверждается и принципом неопределенности. Если бы частицы тела покоились, то их положения (координаты x, y, z) и импульсы (проекции импульса px, py, pz) были бы точно определены и т.д., а это противоречит соотношениям неопределенностей и т.д. Абсолютный нуль не достижим. Ниже будет показано, что абсолютный нуль температуры означает такое состояние системы, при котором система находится в состоянии с наименьшей энергией, и поэтому дальнейшее уменьшение интенсивности движения ее частиц за счет отдачи его энергии окружающим телам не возможно.
Формулу (2.7) можно записать в виде.
Эта формула может служить определением понятия абсолютной температуры для одноатомного газа. Температуру любой другой системы можно определить как величину, равную температуре одноатомного газа, находящегося в тепловом равновесии с этой системой. Определение температуры с помощью этой формулы верно вплоть до температур, при которых уже нельзя пренебречь вероятностью возникновения электронно-возбужденных состояний атомов газа.
Соотношение (2.8) позволяет ввести так называемую среднюю квадратичную скорость молекулы , определив ее как
Понятие абсолютной температуры можно более строго ввести в статистической физике, где ее можно рассматривать как модуль статистического распределения частиц по энергиям. Отметим также, что поскольку температура, так же как и давление, как видно из формул (2.7) и (2.8), определяется средней кинетической энергией молекулы идеального газа, то тони представляют собой статистические величины и, следовательно, бессмысленно говорить о температуре или давлении одной или небольшого числа молекул.
Не нашли то, что искали? Воспользуйтесь поиском:
42. Давление и температура с точки зрения молекулярно кинетической теории.
Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой.
Тепловое или термодинамическое равновесие — такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия.
Температура — физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Абсолютный нуль температуры — предельная температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении.
Давление — это явление когда частицы (молекулы) «давят» на сосуд (под действием внутренней энергии и теплового беспорядочного движения ударяются в стенки сосуда). Чем больше кинетическая энергия частицы тем больше сила удара об стенку приходящаяся на единицу площади, тем больше давление.
43.Среднеквадратичная скорость молекул газа.
Среднеквадратичная скорость молекул равна квадратному корню из среднего квадрата скорости молекул: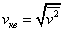
Вычислим среднеквадратичную скорость из средней кинетической энергии молекул, которую мы легко можем сосчитать:
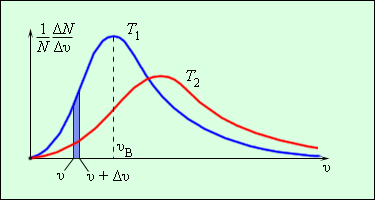
Оказывается у молекул есть средняя скорость (по модулю), которая зависит от температуры, и основная часть молекул имеет модуль скорости близкий к ней. Эту скорость мы не можем вычислить, но можем легко посчитать среднеквадратичную скорость движения молекул газа, которая отличается от средней скорости коэффициентом порядка 1.
44.Уравнение изобарного процесса. Его график в координатах pv, pt, vt.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе 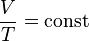
Работа, совершаемая газом при расширении или сжатии газа, равна 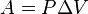
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: 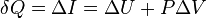
Молекулярно-кинетический смысл температуры
Как было установлено выше изменение давления Δp пропорционально изменению 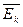
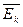
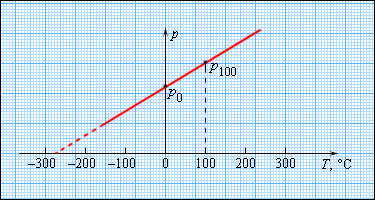
Опытным путем установлено, что давление разреженного газа в сосуде постоянного объема V изменяется прямо пропорционально его абсолютной температуре: p
T. С другой стороны, опыт показывает, что при неизменных объеме V и температуре T давление газа изменяется прямо пропорционально отношению количества вещества ν в данном сосуде к объему V сосуда
где N – число молекул в сосуде, NA – постоянная Авогадро, n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда). Объединяя эти соотношения пропорциональности, можно записать:
где k – некоторая универсальная для всех газов постоянная величина. Ее называют постоянной Больцмана, в честь австрийского физика Л. Больцмана (1844–1906 гг.), одного из создателей молекулярно-кинетической теории. Постоянная Больцмана – одна из фундаментальных физических констант.
Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить:
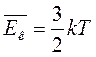
Средняя кинетическая энергия хаотического движения молекул газа прямо пропорциональна абсолютной температуре.
Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул.
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
Для измерения температуры используются физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо физического параметра. В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании).
Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении. По температурной шкале Цельсия точке плавления льда приписывается температура 0 °С, а точке кипения воды – 100 °С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0 °С и 100 °С принимается равным 1 °С. В ряде стран (США) широко используется шкала Фаренгейта (TF), в которой температура замерзающей воды принимается равной 32 °F, а температура кипения воды равной 212 °F. Следовательно,
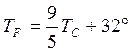
Английский физик У. Кельвин (Томсон) в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы (шкала Кельвина). В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута:
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. Например, комнатная температура TС = 20 °С по шкале Кельвина равна TК = 293,15 К.
Уравнение состояния идеального газа или уравнение Менделеева — Клапейрона является обобщением законов идеального газа, открытых экспериментально до создания МКТ. Однако, из основного уравнения МКТ, можно получить уравнение состояния идеального газа. Для этого используем уравнение в виде
Так как 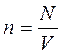
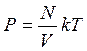
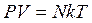
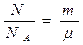
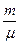
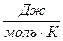
Уравнение состояния газа часто удобно использовать в записи, предложенной Клапейроном, если количество вещества не изменяется, то
или
Последнее уравнение часто называют обобщённым газовым законом. Тот факт, что из основного уравнения молекулярно-кинетической теории идеального газа можно вывести уравнение состояния идеального газа, подтверждает верность молекулярно-кинетической теории вещества.
Дата добавления: 2017-01-08 ; просмотров: 3893 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Понятие температуры с молекулярно кинетической точки зрения
Температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражается следующей формулой:
Ek = 1 /2m • v 2
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
Eср = i/2kBT
где:
i — число степеней свободы kB = 1.380 6505(24) × 10 −23 Дж/K — постоянная Больцмана T — температура;
Термодинамическое определение
Температура — величина, обратная изменению энтропии (степени беспорядка) системы при добавлении в систему единичного количества теплоты: 1/T = ΔS/ΔQ.
История термодинамического подхода
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами.
В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Если в системе два тела имеют одинаковую температуру, то между ними не происходит передачи кинетической энергии частиц (тепла). Если же существует разница температур, то тепло переходит от тела с более высокой температурой к телу с более низкой, потому что суммарная энтропия при этом возрастает.
Температура связана также с субъективными ощущениями «тепла» и «холода», связанными с тем, отдает ли живая ткань тепло или получает его.
Некоторые квантовомеханические системы могут находится в состоянии, при котором энтропия не возрастает, а убывает при добавлении энергии, что формально соответствует отрицательной абсолютной температуре. Однако такие состояния находятся не «ниже абсолютного нуля», а «выше бесконечности», поскольку при контакте такой системы с телом, обладающим положительной температурой, энергия передается от системы к телу, а не наоборот (подробнее см. Квантовая термодинамика).
Свойства температуры изучает раздел физики — термодинамика. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также химию и биологию.
Измерение температуры
Для измерения температуры выбирается некоторый термодинамический параметр термометрического вещества. Изменение этого параметра однозначно связывается с изменением температуры.
На практике для измерения температуры используют
Единицы и шкала измерения температуры
Из того, что температура — это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Шкала температур Кельвина
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что приблизительно равно −273.15 °C.
Шкала температур Кельвина — температурная шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Используемые в быту температурные шкалы — как Цельсия, так и Фаренгейта (используемая, в основном, в США), — не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды, из-за чего температуру приходится выражать отрицательным числом. Для таких случаев были введены абсолютные шкалы температур.
Одна из них называется шкалой Ранкина, а другая — абсолютной термодинамической шкалой (шкалой Кельвина); температуры по ним измеряются, соответственно, в градусах Ранкина (°Ra) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля. Различаются они тем, что кельвин равен градусу Цельсия, а градус Ранкина — градусу Фаренгейта.
Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K. Число градусов Цельсия и кельвинов между точками замерзания и кипения воды одинаково и равно 100. Поэтому градусы Цельсия переводятся в кельвины по формуле K = °C + 273,15.
Шкала Цельсия
В быту используется шкала Цельсия, в которой за 0 принимают точку замерзания воды, а за 100° точку кипения воды при нормальном атмосферном давлении. Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15° C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку связана с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием в 1742 г.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), 1 °F = 9/5 °С + 32. Предложена Г. Фаренгейтом в 1724.
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному. Газ превращается в жидкость и затем кристаллизуется в твёрдое тело (гелий и при абсолютном нуле остается в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решётки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка 1×10 6 м/с.
Температура, при которой частицы вещества имеют минимальное количество движения, сохраняющееся только благодаря квантовомеханическому движению, — это температура абсолютного нуля (Т = 0К).
Температуры абсолютного нуля достичь невозможно. Наиболее низкая температура (450±80)x10 -12 К конденсата Бозе-Эйнштейна атомов натрия была получена в 2003 г. исследователями из МТИ. При этом пик теплового излучения находится в области длин волн порядка 6400 км, то есть примерно радиуса Земли.
Температура с термодинамической точки зрения
Существует множество различных шкал температур. Когда-то температура определялась очень произвольно. Мерой температуры служили метки, нанесённые на равных расстояниях на стенах трубочки, в которой при нагревании расширялась вода. Потом решили измерить температуру ртутным термометром и обнаружили, что градусные расстояния не одинаковы. В термодинамике дается определение температуры, не зависящее от каких-либо частных свойств вещества.
Введем функцию f(T) , которая не зависит от свойств вещества. Из термодинамики следует, что если какая-то тепловая машина, поглощая количество теплоты Q1 при T1 выделяет тепло Qs при температуре в один градус, а другая машина, поглотив тепло Q2 при T2 , выделяет то же самое тепло Qs при температуре в один градус, то машина, поглощающая Q1 при T1 должна при температуре T2 выделять тепло Q2 .
Конечно, между теплом Q и температурой T существует зависимость и тепло Q1 должно быть пропорционально Qs . Таким образом, каждому количеству тепла Qs , выделенного при температуре в один градус, соответствует количество тепла, поглощённого машиной при температуре T , равное Qs , умноженному на некоторую возрастающую функцию f температуры:
Поскольку найденная функция возрастает с температурой, то можно считать, что она сама по себе измеряет температуру, начиная со стандартной температуры в один градус. Это означает, что можно найти температуру тела, определив количество тепла, которое поглощается тепловой машиной, работающей в интервале между температурой тела и температурой в один градус. Полученная таким образом температура называется абсолютной термодинамической температурой и не зависит от свойств вещества. Таким образом, для обратимой тепловой машины выполняется равенство:
Для системы, в которой энтропия S может быть функцией S(E) её энергии E , термодинамическая температура определяется как:
Температура и излучение
При повышении температуры растёт энергия, излучаемая нагретым телом. Энергия излучения абсолютно чёрного тела описывается законом Стефана — Больцмана
Шкала Реомюра
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
Переходы из разных шкал
| в\из | Кельвин | Цельсий | Фаренгейт |
|---|---|---|---|
| Кельвин (K) | = K | = С + 273,15 | = (F + 459,67) / 1,8 |
| Цельсий (° C) | = K − 273,15 | = C | = (F − 32) / 1,8 |
| Фаренгейт (°F) | = K · 1,8 − 459,67 | = C · 1,8 + 32 | = F |
Сравнение температурных шкал
| Описание | Кельвин | Цельсий | Фаренгейт | Ранкин | Делиль | Ньютон | Реомюр | Рёмер |
|---|---|---|---|---|---|---|---|---|
| Абсолютный ноль | −273.15 | −459.67 | 559.725 | −90.14 | −218.52 | −135.90 | ||
| Температура таяния смеси Фаренгейта (соль и лёд в равных количествах) | 255.37 | −17.78 | 459.67 | 176.67 | −5.87 | −14.22 | −1.83 | |
| Температура замерзания воды (Нормальные условия) | 273.15 | 32 | 491.67 | 150 | 7.5 | |||
| Средняя температура человеческого тела ¹ | 310.0 | 36.6 | 98.2 | 557.9 | 94.5 | 12.21 | 29.6 | 26.925 |
| Температура кипения воды (Нормальные условия) | 373.15 | 100 | 212 | 671.67 | 33 | 80 | 60 | |
| Плавление титана | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Поверхность Солнца | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹ Нормальная средняя температура человеческого тела — 36.6 ° C ±0.7 ° C, или 98.2 °F ±1.3 °F. Приводимое обычно значение 98.6 °F — это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения 37 ° C. Однако это значение не входит в диапазон нормальной средней температуры тела человека, поскольку температура разных частей тела разная [1] .
Некоторые значения в этой таблице были округлены.
Характеристика фазовых переходов
Для описания точек фазовых переходов различных веществ используют следующие значения температуры:
Понятие температуры с молекулярно кинетической точки зрения
§ 8. Понятие о температуре
Если два тела, имеющие различные температуры, находятся в тепловом контакте, то между ними происходит теплообмен, т. е. обмен внутренними энергиями без совершения работы. Теплообмен протекает до тех пор, пока не наступит тепловое равновесие, т. е. состояние системы, в которой при постоянных внешних условиях все параметры (t°, p, V, m) остаются неизменными сколь угодно долго.
Выясним с точки зрения молекулярной кинетической теории сущность теплового равновесия, а также смысл понятия температуры. Молекулы в теле движутся с различными скоростями, поэтому не исключена возможность, что ряд молекул тела с меньшей температурой имеет большую скорость, а следовательно, и кинетическую энергию, чем ряд молекул тела с большей температурой. При соударении молекулы более холодного тела отдают часть своей энергии молекулам более горячего тела. И из этого еще нельзя сделать заключение, в каком направлении будет идти теплообмен. Требуется статистический подход, к решению вопроса, а именно надо знать, в каком из тел средняя кинетическая энергия молекулы больше, а в каком — меньше. В более нагретом теле молекулы движутся быстрее, а следовательно, их средняя кинетическая энергия больше. Поэтому и теплообмен идет от более нагретого тела к менее нагретому до наступления теплового равновесия (рис. 9).
Рис. 9. Схема передачи энергии молекул горячих газов молекулам металла кастрюли, а последними — молекулам воды
Таким образом, процесс теплового равновесия сводится к уравниванию средних кинетических энергий поступательного движения молекул тел, участвующих в теплообмене. Наступление этого процесса сводится к уравниванию температур тел, что означает выравнивание средних кинетических энергий поступательного движения молекул тел. Следовательно, температура является мерой средней кинетической энергии хаотического движения молекул. Поэтому по температуре тела и судят об этой энергии молекул тела. Внешне изменение ее проявляется в изменении температуры тела.
Температура — понятие статистическое, т. е. средняя кинетическая энергия 100 или 1000 молекул не дает представления о температуре тела. Надо брать среднюю кинетическую энергию многих миллиардов молекул, а такой подсчет можно сделать только статистическим методом.
Температура измеряется термометрами, действие которых ? основано на изменении таких величин, как объем, давление, сопротивление току и т. д. Чаще в термометрах используется изменение объема ртути или спирта при их тепловом контакте с телами.
Шведский ученый Цельсий предложил тепловое состояние тел сравнивать с тепловым состоянием тающего льда при нормальном давлении. Если при тепловом контакте резервуара термометра с таким льдом теплообмен между ними не происходит, о чем свидетельствует постоянство объема ртути в термометре, то они находятся в тепловом равновесии. В этом случае положение ртути в трубке отмечается нулем и считается гем тепловым состоянием, с которым сравнивается тепловое состояние других тел. Если при контакте термометра с телом объем ртути изменяется, то это указывает на то, что тепловое состояние данного тела отличается от теплового состояния льда.
Для того чтобы оценить степень отклонения тел от теплового равновесия, введена температура. Поместив термометр в пары кипящей воды при нормальном давлении, Цельсий отметил положение ртути в трубке термометра числом 100. Разделив длину трубки между отметками 0 и 100 на сто частей, он получил термометрическую шкалу, в которой цена одного деления принята за 1°С. При таком условии температура таяния льда 0°С, а кипения воды 100° С.
Чем выше температура, тем больше скорость поступательного движения молекул. А если это так, то можно подумать, что при 0°С поступательное движение молекул прекращается, так как их скорость становится равной нулю. Теоретически было доказано, что поступательное движение молекул прекращается не при 0°С, а при -273,15° С. Эта температура называется абсолютным нулем.
Рис. 10. К понятию абсолютного нуля
Температурная шкала, в которой за начало отсчета температуры принят абсолютный нуль, называется абсолютной шкалой, или шкалой Кельвина. По шкале Кельвина (рис. 10) (округленно) температура таяния льда 273° К, кипения воды — 373° К.
Как видно из рисунка, между температурой по шкале Цельсия и по шкале Кельвина имеется такая зависимость:
Если тела А и В имеют одинаковую температуру,. например 40° С, то каждое из них будет находиться в тепловом равновесии с термометром, когда он будет показывать 40° С.
Двойкам нет
Молекулярная физика — это один из разделов физики, который изучает физические свойства тел в различных агрегатных состояниях, а также их молекулярное строение, силы взаимодействия между частицами, из которых состоят тела, и характер теплового движения этих частиц.
Молекулярно-кинетическая теория (МКТ) — это раздел молекулярной физики, где объясняется строение и свойства тел за счет движения и взаимодействия частиц, из которых состоят эти тела.
Три положения молекулярно-кинетической теории:
- все тела состоят из частиц, таких как атомы, молекулы, ионы;
- частицы из которых состоят тела, имеют хаотическое (беспорядочное) движение;
- взаимодействие тел друг с другом происходит силами притяжения и отталкивания.
Молекула — это самая наименьшая частица вещества, которая имеет все его химические свойства.
Атом — это самая наименьшая частица химического элемента. Молекула состоит из равного количества положительно и отрицательно заряженных частиц, поэтому она электрически нейтральна.
Молекула состоит из атомов, которые соединены химическими связями.
Макромолекула — это такая молекула, которая имеет тысячи повторяющихся групп атомов.
Относительная атомная или молекулярная масса — это величина, которая равна отношению массы молекулы (атома) к 1/12 массы атома изотопа углерода:
Количество вещества — это такая величина, которая характеризует число структурных элементов, из которых состоит система.
Структурные элементы — это атомы, молекулы, ионы и другие частицы.
Количество вещества определяется формулой:
Число Авогадро (постоянная Авогадро) — это число структурных элементов, содержащихся в одном моле вещества:
В Международной системе единиц единицей количества вещества является моль.
Молярная масса — это величина, которая равна отношению массы однородного вещества к количеству вещества:
В Международной системе единиц единицей молярной массы является килограмм на моль (кг/моль).
Изотермический процесс — это такой процесс, при котором происходит изменение состояния термодинамической системы, если температура не меняется.
Изотерма — это линия на диаграмме состояния, которая является гиперболой, показывает процесс изменения состояния термодинамической системы.
Изобарный процесс — это процесс, при котором происходит изменение состояния термодинамической системы, если давление не меняется.
Изобара — это линия на диаграмме состояния, которая показывает изменения состояния термодинамической системы при изобарном процессе.
Изохорный процесс — это процесс, при котором происходит изменение состояния термодинамической системы, если объем не меняется.
Изохора — это линия на диаграмме состояния, которая показывает изменения состояния термодинамической системы при изохорном процессе.
Смесь идеальных газов — совокупность нескольких разнохарактерных газов, которые при рассматриваемых условиях не вступают друг с другом в химические реакции.
Парциальное давление — это такое давление газа, которое является одним из составляющих газовой смеси, которое он бы оказывал, если бы при той же температуре один занимал объем, равный объему смеси.
Понятие температуры с молекулярно кинетической точки зрения
Простейшей моделью, рассматриваемой молекулярно-кинетической теорией, является модель идеального газа . В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура).
В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
Используя модель идеального газа, вычислим давление газа на стенку сосуда . В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция скорости, параллельная стенке, остается неизменной (рис. 3.2.1).
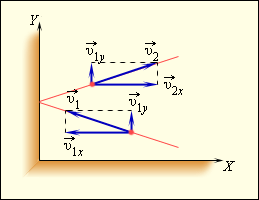 | |||||||||||||||||||||||||||
| Рисунок 3.2.1. Поэтому изменение импульса молекулы будет равно , где – масса молекулы. Выделим на стенке некоторую площадку (рис. 3.2.2). За время с этой площадкой столкнутся все молекулы, имеющие проекцию скорости , направленную в сторону стенки, и находящиеся в цилиндре с основанием площади и высотой .
|
- http://studopedia.ru/16_44681_molekulyarno-kineticheskiy-smisl-absolyutnoy-temperaturi.html
- http://studfiles.net/preview/436427/page:3/
- http://poznayka.org/s80053t1.html
- http://dic.academic.ru/dic.nsf/ruwiki/172029
- http://physiclib.ru/books/item/f00/s00/z0000051/st009.shtml
- http://xn----7sbfhivhrke5c.xn--p1ai/%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE-%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D1%8F/
- http://physics.ru/courses/op25part1/content/chapter3/section/paragraph2/theory.html
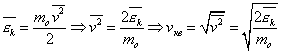
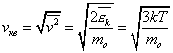
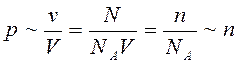
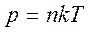
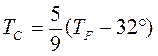
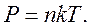
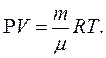
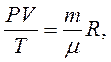
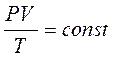
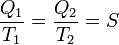
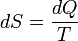
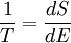
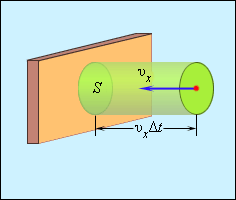
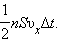 Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину , то полное изменение импульса всех молекул, столкнувшихся за время с площадкой , равно
Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину , то полное изменение импульса всех молекул, столкнувшихся за время с площадкой , равно 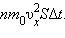 По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы , где – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке . Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку . Поэтому можно записать:
По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы , где – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке . Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку . Поэтому можно записать: 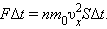
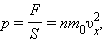
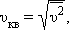 где
где 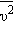 – среднее значение квадрата скорости.
– среднее значение квадрата скорости. Каждая группа молекул вносит свой вклад
Каждая группа молекул вносит свой вклад 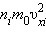 в давление газа. В результате соударений со стенкой молекул с различными значениями проекций скоростей возникает суммарное давление
в давление газа. В результате соударений со стенкой молекул с различными значениями проекций скоростей возникает суммарное давление 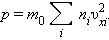
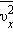 квадрата проекции
квадрата проекции 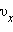 скорости молекул:
скорости молекул: 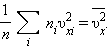
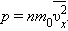
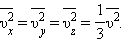
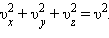
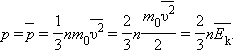
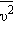 и средней кинетической энергией
и средней кинетической энергией 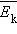 поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.
поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.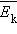 поступательного движения. Если предположить, что газ находится в сосуде неизменного объема , то
поступательного движения. Если предположить, что газ находится в сосуде неизменного объема , то 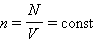 ( – число молекул в сосуде). В этом случае изменение давления пропорционально изменению
( – число молекул в сосуде). В этом случае изменение давления пропорционально изменению 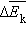 средней кинетической энергии.
средней кинетической энергии.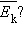 Опыт показывает, что такой величиной является температура .
Опыт показывает, что такой величиной является температура .