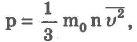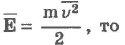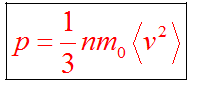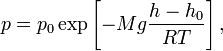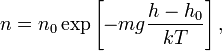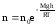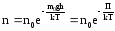Идеальный газ. Идеальный газ с точки зрения молекулярно-кинетической теории простейшая физическая модель реального газа.
Под моделью в физике понимают не увеличенную или уменьшенную копию реального объекта. Физическая модель – это создаваемая учеными общая картина реальной системы или явления, которая отражает наиболее существенные, наиболее характерные свойства системы.
В физической модели газа принимаются во внимание лишь те основные свойства молекул, учет которых необходим для объяснения главных закономерностей поведения реального газа в определенных интервалах давления и температуры.
В молекулярно-кинетической теории идеальным газом называют газ, состоящий из молекул, взаимодействие между которыми пренебрежимо мало. Иными словами, предполагается, что средняя кинетическая энергия молекул идеального газа во много раз больше потенциальной энергии их взаимодействия.
Реальные газы ведут себя подобно идеальному газу при достаточно больших разрежениях, т. е. когда среднее расстояние между молекулами во много раз больше их размеров. В этом случае силами притяжения между молекулами можно полностью пренебречь. Силы же отталкивания проявляются лишь на ничтожно малых интервалах времени при столкновениях молекул друг с другом.
В простейшей модели газа молекулы рассматривают как очень маленькие твердые шарики, обладающие массой. Движение отдельных молекул подчиняется законам механики Ньютона. Конечно, нет никакой гарантии, что с помощью такой модели можно объяснить все процессы в разреженных газах. Ведь известно, что молекулы отличаются не только массами. Они имеют сложное строение.
Но сейчас мы поставим и будем решать достаточно узкую задачу: вычислим давление газа с помощью молекулярно-кинетической теории . Для этой задачи простейшая модель газа оказывается удовлетворительной. Она приводит к результатам, которые подтверждаются опытом.
Давление газа в молекулярно-кинетической теории. Пусть газ находится в закрытом сосуде. Манометр показывает давление газа p0. (Напомним: давление определяется отношением модуля F силы, действующей перпендикулярно поверхности, к площади поверхности S: . Давление выражается в паскалях или миллиметрах ртутного столба: 1 Па = 1 Н/м² = 7,5 · 10 – ³ мм рт. ст.) Но как возникает это давление? Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку сила, действующая со стороны всех молекул на единицу площади стенки, т. е. давление, будет быстро меняться со временем примерно так, как показано на рисунке 18. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади его чувствительного элемента – мембраны. Несмотря на небольшие изменения давления, среднее значение давления p0 практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.
Давление газа будет тем больше, чем больше молекул ударяется о стенку за некоторый интервал времени и чем больше скорости соударяющихся со стенкой молекул.
Возникновение давления газа можно пояснить с помощью простой механической модели. Возьмем диск (он играет роль мембраны манометра) и закрепим его на стержне так, чтобы он располагался вертикально и мог поворачиваться вместе со стержнем вокруг вертикальной оси (рис. 19). С помощью наклонного желоба на диск направим струйку мелкой дроби (дробинки играют роль молекул). В результате многочисленных ударов дробинок на диск будет действовать некоторая средняя сила, вызывающая поворот стержня и изгиб упругой пластины П. Эффект же от ударов отдельных дробинок не заметен.
Тепловое движение молекул. С самого начала нужно отказаться от попыток проследить за движением всех молекул, из которых состоит газ. Их слишком много, и из-за столкновений друг с другом они движутся очень сложно. Нам и не нужно знать, как движется каждая молекула. Мы должны выяснить, к какому результату приводит совокупное движение всех молекул.
Характер же движения всей совокупности молекул газа известен из опыта (см. § З). Молекулы участвуют в хаотическом (тепловом) движении. Это означает, что скорость любой молекулы может оказаться как очень большой, так и очень малой, а направление движении молекул беспрестанно меняется при их столкновениям друг с другом.
Скорости отдельных молекул могут быть любыми, однако среднее значение модуля их скорости вполне определенное. Точно так же рост учеников в классе не одинаков. Но среднее значение роста – определенная величина. Чтобы ее найти, надо сложить вместе рост учеников и разделить эту сумму на количество учеников.
Среднее значение квадрата модуля скорости. В дальнейшем нам понадобится среднее значение не самой скорости, а квадрата скорости, от которого зависит средняя кинетическая энергия молекул.
Обозначим модули скоростей отдельных молекул через v1, v2, v3, …, vN. Среднее значение квадрата скорости определится следующей формулой:
Действительно, для каждой молекулы справедливо выражение (1.9). Сложив эти выражения для отдельных молекул и разделив обе части полученного уравнения на число молекул N, мы придем к формуле (1.10).
Так как направления Ox, Oy и Oz вследствие хаотичности движения молекул равноправны, средние значения квадратов проекций скорости равны друг другу:
т.е. средний квадрат проекции скорости равен 1/3 среднего квадрата самой скорости. Множитель 1/3 появляется вследствие трехмерности пространства и, соответственно, существования трех проекций у любого вектора.
Молекулярно-кинетическая теория газов рассматривает идеальный газ:
а) молекулы не притягиваются и не отталкиваются;
б) молекулы взаимодействуют только при упругих столкновениях;
в) молекулы представляют собой материальные точки, т.е. обладают массой, но не имеют объёма.
В качестве критерия идеальности газов принято считать соотношение α/L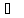
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в паскалях по имени французского учёного и математика
Блеза Паскаля (1623-1662). 1Па = 1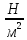
Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р) – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является термодинамическим параметром состояния.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
Термодинамическая температура Т всегда положительна. При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
Т = t + 273,15 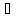
Ro= 8,314 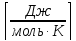
Удельный объем – отношение объема вещества к его массе 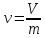
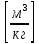
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
1.3. Универсальное уравнение состояния идеального газа
Уравнение состояния идеального газа Клапейрона – Менделеева:
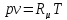
где р – давление, Па,

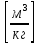
Rμ=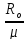
Например, для кислорода 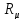
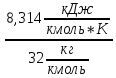

Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для любого процесса 1-2:, p1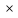
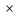
p2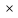

Разделив левую часть первого уравнения на левую часть второго уравнения, а правую часть первого уравнения на правую часть второго уравнения и сократив Rμ, получим:
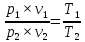
1.4. Смесь идеальных газов
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
Состав смеси задается долями объемными r, r1= 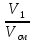

массовыми g g1= и мольными r1′ : r1′ =
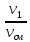
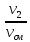
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
Молярная масса смеси: μсм= μ1r1+ μ2r2. μсм= 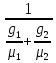
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь между объемными и массовыми долями: g1= r1∙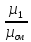
Двойкам нет
Молекулярная физика — это один из разделов физики, который изучает физические свойства тел в различных агрегатных состояниях, а также их молекулярное строение, силы взаимодействия между частицами, из которых состоят тела, и характер теплового движения этих частиц.
Молекулярно-кинетическая теория (МКТ) — это раздел молекулярной физики, где объясняется строение и свойства тел за счет движения и взаимодействия частиц, из которых состоят эти тела.
Три положения молекулярно-кинетической теории:
- все тела состоят из частиц, таких как атомы, молекулы, ионы;
- частицы из которых состоят тела, имеют хаотическое (беспорядочное) движение;
- взаимодействие тел друг с другом происходит силами притяжения и отталкивания.
Молекула — это самая наименьшая частица вещества, которая имеет все его химические свойства.
Атом — это самая наименьшая частица химического элемента. Молекула состоит из равного количества положительно и отрицательно заряженных частиц, поэтому она электрически нейтральна.
Молекула состоит из атомов, которые соединены химическими связями.
Макромолекула — это такая молекула, которая имеет тысячи повторяющихся групп атомов.
Относительная атомная или молекулярная масса — это величина, которая равна отношению массы молекулы (атома) к 1/12 массы атома изотопа углерода:
Количество вещества — это такая величина, которая характеризует число структурных элементов, из которых состоит система.
Структурные элементы — это атомы, молекулы, ионы и другие частицы.
Количество вещества определяется формулой:
Число Авогадро (постоянная Авогадро) — это число структурных элементов, содержащихся в одном моле вещества:
В Международной системе единиц единицей количества вещества является моль.
Молярная масса — это величина, которая равна отношению массы однородного вещества к количеству вещества:
В Международной системе единиц единицей молярной массы является килограмм на моль (кг/моль).
Изотермический процесс — это такой процесс, при котором происходит изменение состояния термодинамической системы, если температура не меняется.
Изотерма — это линия на диаграмме состояния, которая является гиперболой, показывает процесс изменения состояния термодинамической системы.
Изобарный процесс — это процесс, при котором происходит изменение состояния термодинамической системы, если давление не меняется.
Изобара — это линия на диаграмме состояния, которая показывает изменения состояния термодинамической системы при изобарном процессе.
Изохорный процесс — это процесс, при котором происходит изменение состояния термодинамической системы, если объем не меняется.
Изохора — это линия на диаграмме состояния, которая показывает изменения состояния термодинамической системы при изохорном процессе.
Смесь идеальных газов — совокупность нескольких разнохарактерных газов, которые при рассматриваемых условиях не вступают друг с другом в химические реакции.
Парциальное давление — это такое давление газа, которое является одним из составляющих газовой смеси, которое он бы оказывал, если бы при той же температуре один занимал объем, равный объему смеси.
Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории
Характеристика тепловых явлений в молекулярной физике. Рассмотрение основных положений молекулярно-кинетической теории. Основной порядок взаимодействия молекул. Изучение строения газообразных, жидких и твердых тел. Описание Броуновского движения.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 16.01.2015 |
| Размер файла | 358,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ГБОУ НПО АО «Профессиональное училище № 1»
РЕФЕРАТ НА ТЕМУ:
«Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории»
Выполнил: Акишин Дмитрий Андреевич
Проверил: Жубрева Лидия Николаевна
1. Тепловые явления в молекулярной физике
2. Основные положения молекулярно-кинетической теории
3. Взаимодействие молекул
4. Строение газообразных, жидких и твердых тел
5. Броуновское движение
1. Тепловые явления в молекулярной физике
тепловой броуновский кинетический твердый
Тепловые явления привлекали внимание людей с древних времён. Умение добывать и поддерживать огонь сделало человека относительно независимым от колебаний температуры окружающей среды. Это было одним из величайших изобретений человечества. Изменение температуры оказывает влияние на все свойства тел. Кроме механических свойств, при изменении температуры меняются и другие свойства тел, например сопротивление электрическому току, магнитные свойства и др. Так, если сильно нагреть постоянный магнит, то он перестанет притягивать железные предметы. Все перечисленные выше и многие другие тепловые явления подчиняются определённым законам. Открытие законов тепловых явлений позволяет с максимальной пользой применять эти явления на практике и в технике. Молекулярно-кинетическая теория. Ещё философы древности догадывались о том, что теплота — это вид внутреннего движения. Но только в ХVIII в. Начала развиваться последовательная молекулярно — кинетическая теория. Цель молекулярно-кинетической теории — объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, беспорядочно движущихся частиц. Большой вклад в развитие молекулярно-кинетической теории был сделан М.В. Ломоносовым. Он рассматривал теплоту как вращательное движение частиц, составляющих тела.
2. Основные положения молекулярно-кинетической теории
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Каждое утверждение строго доказано с помощью опытов. Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или ещё более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в реальности молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займёт всю поверхность, если сосуд велик. Нельзя заставить капельку объёмом 1 мм(в кубе) расплыться так, чтобы она заняла площадь поверхности более 0,6 м(в квадрате). Объём V слоя масла равен произведению его площади поверхности S на толщину d слоя, т.е V=Sd. Следовательно, размер молекулы оливкового масла равен: d = ? 1,7 Ч см.
При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно, объёмом 1.
Диаметр молекулы воды равен примерно 3 Ч . Считая, что каждая молекула воды при плотной упаковке молекул занимает объём капли (1 на объём, приходящийся на одну молекулу:
Размеры атома надо запомнить: D ?см ? м.
3. Взаимодействие молекул
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел. Молекула- это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими.
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличиваются, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул.
При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и между молекулами возникают быстро нарастающие силы отталкивания.
4. Строение газообразных, жидких и твердых тел
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга.
Молекулы с огромными скоростями — сотни метров в секунду -движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т.е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12-10-13 с). С повышением температуры время оседлой жизни молекул уменьшается. Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И. Френкелем, позволяет понять основные свойства жидкостей. Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.8.8). Вот почему жидкость течет и принимает форму сосуда.
Атомы или молекулы твёрдых тел колеблются около определённых положений равновесия, поэтому твёрдые тела сохраняют не только объём ,но и форму
Если соединить центр равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристалической
Кристаллы — это твёрдые тела, атомы или молекулы которых занимают определённое, порядочное положение в пространстве. Поэтому кристаллы имеют плоские грани. Например крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное- это зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Зависимость физических свойств от направления внутри кристалла называют анизотропией. Все кристаллические тела анизотропны.
Монокристаллы и поликристаллы.
Кристаллическую структуру имеют металлы. Если взять большой кусок металла, то на первый взгляд его кристаллическое строении никак не проявляется ни во внешнем виде куска, ни в его физических свойствах
Обычно металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению к друг другу беспорядочно. В результате в объеме, значительно превышающем объем отдельных кристалликов, все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллическим. Одиночные кристаллы называют монокристаллами.
5. Броуновское движение
Броуновское движение- это тепловое движение взвешенных в жидкости( или газе) частиц.
Наблюдения броуновского движения. Английский ботаник Р.Броун (1773-1858) впервые наблюдал это явление 1827 г. Рассматривая в микроскоп взвешенные в воде споры плауна. Позже он рассматривал и другие мельчайшие частицы, в том числе частички камня египетских пирамид. Сейчас для наблюдения броуновского движения используют частички краски гуммируют, которая нерастворима в воде. Эти частички совершают беспорядочное движение. Броуновское движение — тепловое движение, и оно не может прекратиться. С увеличением температуры интенсивность его растёт. Положения частиц, отмеченные точками, определены через равные промежутки времени — 30 с. Броуновское движение можно наблюдать и в газе. Его совершают взвешенные в воздухе частицы пыли или дыма.
Газы — агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек.
Жидкость — агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д.
Твёрдое тело — одно из четырёх агрегатных состояний вещества, отличающееся от др. агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует
1. Физика 10 класс Г. Я Мякишев М. «Просвещение» 2007.
2. Арцимович Л. А., Элементарная физика плазмы, 3 изд., М., 2002;
3. Франк-Каменецкий Д. А., Лекции по физике состояний вещества, М., 2003 (переиздание);
4. Френкель Я. И., Собрание избранных трудов, т. 3, М., 2001;
5. Фишер И.3., Статистическая теория жидкостей, М., 2003;
6. Физика простых жидкостей. Экспериментальные исследования, пер. с англ., М., 2002
Размещено на Allbest.ru
Подобные документы
Основные положения атомно-молекулярного учения. Закономерности броуновского движения. Вещества атомного строения. Основные сведения о строении атома. Тепловое движение молекул. Взаимодействие атомов и молекул. Измерение скорости движения молекул газа.
презентация [226,2 K], добавлен 18.11.2013
Анализ теорий, устанавливающих связи между измеряемыми на опыте величинами и свойствами молекул. Идеальный газ как газ, взаимодействие между молекулами которого пренебрежимо мало. Причины возникновения давления газа в молекулярно-кинетической теории.
презентация [151,4 K], добавлен 08.01.2015
Определения молекулярной физики и термодинамики. Понятие давления, основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Уравнение состояния идеального газа (Менделеева — Клапейрона).
презентация [972,4 K], добавлен 06.12.2013
Основные понятия и определения молекулярной физики и термодинамики. Основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Состояние идеального газа (уравнение Менделеева-Клапейрона).
презентация [1,1 M], добавлен 13.02.2016
Вычисление скорости молекул. Различия в скоростях молекул газа и жидкости. Экспериментальное определение скоростей молекул. Практические доказательства состоятельности молекулярно-кинетической теории строения вещества. Модуль скорости вращения.
презентация [336,7 K], добавлен 18.05.2011
Содержание молекулярно-кинетической теории газов. Химический состав жидкости. Особенности межмолекулярного взаимодействия в данном агрегатном состоянии. Механические и тепловые свойства твердых тел. Практическое применение плазмы — ионизованного газа.
контрольная работа [26,0 K], добавлен 27.10.2010
Характеристика законов Бойля-Мариотта, Бойля-Мариотта, Авогадро. Парциальное давление как давление, которое оказывал бы каждый газ смеси, если бы он один занимал объем, равный объему смеси. Знакомство с положениями молекулярно-кинетической теории газа.
презентация [625,5 K], добавлен 06.12.2016
Изучение корпускулярной концепции описания природы, сущность которой в том, что все вещества состоят из молекул — минимальных частиц вещества, сохраняющих его химические свойства. Анализ молекулярно-кинетической теории газа. Законы для идеальных газов.
контрольная работа [112,2 K], добавлен 19.10.2010
Особенности определения давления газа на стенку сосуда с использованием второго закона Ньютона. Связь этой величины со средней кинетической энергией молекул и их концентрацией. Специфика схематичного вывода основного уравнения упрощенным методом.
презентация [316,6 K], добавлен 19.12.2013
Молекулярная физика как раздел физики, в котором изучаются свойства вещества на основе молекулярно-кинетических представлений. Знакомство с основными особенностями равновесной термодинамики. Общая характеристика молекулярно-кинетической теории газов.
курсовая работа [971,8 K], добавлен 01.11.2013
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газаустанавливает связь между макроскопической величиной — давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
где р — давление, m— масса молекулы, п — концентрация (число молекул в единице объема), v 2 — средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).
Изопроцессы — равновесные процессы, в которых один из основных параметров сохраняется.
ИЗОБАРНЫЙ ПРОЦЕСС- термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа. (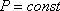
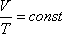
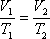
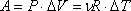

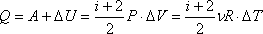
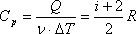
ИЗОХОРНЫЙ ПРОЦЕСС (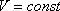
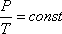
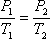
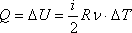
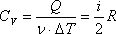
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС (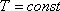
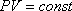
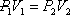
Работа газа при изотермическом расширении: 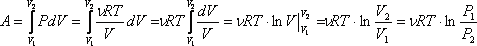
Основное уравнение МКТ. Статистическое толкование температуры. Барометрическая формула. Распределения Максвелла и Больцмана.
Основное уравнение мкт имеет вид
Определение температуры в статистической физике в статистической физике температура определяется как производная от энергии системы по её энтропии:
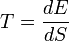
где S — энтропия, E — энергия термодинамической системы. Введённая таким образом величина T является одинаковой для различных тел при термодинамическом равновесии. При контакте двух тел тело с большим значением T будет отдавать энергию другому.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального газа, имеющего постоянную температуру 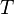
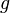
где 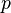
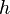
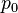
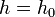
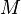
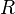
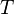
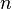
где 
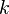
Данное выражение называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты, или высоту, если известно давление.
Закон Больцмана о распределении частиц во внешнем потенциальном поле.
Если воспользоваться выражением р = nkT, то можно привести барометрическую формулу к виду:
здесь n – концентрация молекул на высоте h, n – то же у поверхности Земли. Так как М = mNA , где m – масса одной молекулы, а R = k NA, то мы получим П = mgh – это потенциальная энергия одной молекулы в поле тяготения. Поскольку kT
‹εпост›, то концентрация молекул на определенной высоте зависит от соотношения П и ‹εпост›
Полученное выражение называется распределением Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа (с которой связана концентрация) больше там, где меньше потенциальная энергия его молекул.
- http://studfiles.net/preview/5276108/page:2/
- http://xn----7sbfhivhrke5c.xn--p1ai/%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE-%D0%BA%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D1%8F/
- http://revolution.allbest.ru/physics/00507166_0.html
- http://studfiles.net/preview/2030992/page:3/