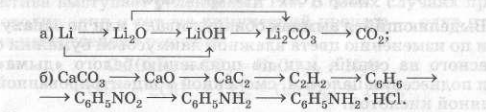Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблукови В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения.
Основные положения ТЭД (Теории электролитической диссоциации):
Молекулы распадаются на положительно и отрицательно заряженные ионы (простые и сложные).
Под действием электрического тока катионы (положительно заряженные ионы движутся к катоду(-), а анионы (отрицательно заряженные ионы) к аноду(+)
Степень диссоциации зависит от природы вещества и растворителя, концентрации, температуры.
Если степень диссоциации зависит от природы вещества, то можно судить, что существует разграничение между определёнными группами веществ.
Большая степень диссоциации присуща сильным электролитам (большинству оснований, солям, многим кислотам). Стоит учесть, что распад на ионы – обратимая реакция. Так же стоит сказать, что в данной теме не будут разобраны примеры диссоциации двойных и основных солей, их диссоциация описана в теме “соли”.
Примеры сильных электролитов:
NaOH, K2SO4, HClO4
Уравнения диссоциации:
NaOH⇄Na + +OH —
Количественной характеристикой силы электролитов является степень диссоциации (α) – отношение молярной концентрации продиссоциировавшего электролита к его общей молярной концентрации в растворе.
Степень диссоциации выражается в долях единицы или в процентах. Интервал значений – от 0 до 100%.
α = 0% относится к неэлектролитам (диссоциация отсутствует)
У каждой ступени диссоциации своя степень диссоциации.
Например, диссоциация солей CuCl2, HgCl2:
CuCl2⇄Cu 2+ +2Cl — диссоциация протекает полностью
А в случае с хлоридом ртути диссоциация идёт неполностью и то не до конца.
Возвращаясь же к раствору серной кислоты, стоит сказать, что степень диссоциации обеих ступеней разбавленной кислоты гораздо больше, чем у концентрированной. При диссоциации концентрированного раствора очень много молекул вещества и большая концентрация гидроанионов HSO4 — .
У многоосновных кислот и многокислотных оснований диссоциация идёт в несколько ступеней (в зависимости от основности).
Перечислим сильные и слабые кислоты и приступим к уравнениям ионного обмена:
Сильные кислоты ( HCl, HBr, HI, HClO3, HBrO3, HIO3, HClO4, H2SO4, H2SeO4,HNO3, HMnO4, H2Cr2O7)
Химические реакции в растворах и расплавах электролитов протекают с участием ионов. В таких реакциях степени окисления элементов не изменяются, и сами реакции называются реакциями ионного обмена.
Реакции ионного обмена будут протекать до конца (необратимо) , если образуются малорастворимые или практически нерастворимые вещества (они выпадают в осадок), летучие вещества (выделяются в виде газов) или слабые электролиты (например, вода).
Реакции ионного обмена принято писать в три стадии:
1. Молекулярное уравнение
2. Полное ионное уравнение
3. Сокращенное ионное уравнение
При написании обязательно указывать осадки и газы, а так же руководствоваться таблицей растворимости.
Реакции, где все реагенты и продукты получились растворимые в воде, не протекают.
Сокращённое ионное уравнение получается с помощью вычёркивания одинаковых ионов из обеих частей полного ионного уравнения.
Если реакция ионного обмена идёт между двумя солями с образованием осадка, то следует брать два хорошо растворимых реагента. То есть, реакция ионного обмена пойдёт если растворимость реагентов будет выше, чем у одного из продуктов.
Иногда при написании реакций ионного обмена пропускают полное ионное уравнение и сразу пишут сокращенное.
Для получения осадка малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты в их концентрированных растворах.
Например:
2KF+FeCl2→FeF2↓+2KCl
Данные правила подбора реагентов для осаждения продуктов справедливы только для солей.
Вопросы:
1) Дайте определение понятия «основания», исходя из их состава.
2) Дайте определение понятия «основания» с точки зрения теории электролитической диссоциации.
3) На какие группы делят основания по изученным вами признакам классификации этих веществ?
4) Исходя из изученных признаков классификации оснований, дайте полную характеристику гидроксида бария Ва(ОН)2 и анилина C6H5NH2.
5) Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
6) В 200 мл воды растворили 48 г гидроксида натрия, содержащего 5% примесей. Найдите массовую долю щелочи в полученном растворе.
7) При взаимодействии 585 г 20%-го раствора хлорида аммония с необходимым количеством гидроксида кальция было получено 33,6 л аммиака (н. у.). Сколько это составляет процентов от теоретически возможного?
8) Вычислите массу анилина, который можно получить реакцией Зинина из 930 кг нитробензола, если выход анилина составляет 85% от теоретически возможного.
9) В любой домашней и автомобильной аптечке обязательно содержится пузырек или ампула с нашатырным спиртом — 10%-м раствором аммиака в воде. Сколько миллилитров газообразного аммиака (н. у.) и граммов воды содержится в одной ампуле, масса раствора нашатырного спирта в которой равна 2 г?
Электролиты и неэлектролиты.
Проводимость веществами электрического тока или отсутствие проводимости можно наблюдать с помощью простого прибора.
Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара ,то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли.
К неэлектролитам относятся большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи .
Электролиты — проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Различают сильные и слабые электролиты.
Сильные электролиты при растворении вводе полностью диссоциируют на ионы.
К ним относятся:
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся:
1) почти все органические кислоты;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH 3∙H 2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Основные положения теории электролитической диссоциации.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na + и хлорид-ионы Cl — .
Вода образует ионы водорода Н + и гидроксид-ионы ОН — лишь в очень незначительных количествах.
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации . В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современное содержание этой теории можно свести к следующим трем положениям :
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это
( Na + , Mg 2+ , Аl 3+ и т.д.) — или из нескольких атомов — это
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами , вторые — анионами .
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы ( диссоциация ) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А — в общем виде записывается так:
Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Степень диссоциации.
Одним из важнейших понятий теории электролитической диссоциации Аррениуса является понятие
о степени диссоциации.
Степенью диссоциации (а) называется отношение числа молекул, распавшихся на ионы (n’), к общему числу растворенных молекул (n):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые.
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита — уксусной кислоты:
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, — степень диссоциации кислоты возрастает. Наоборот, при упаривании раствора равновесие смещается в сторону образования молекул кислоты — степень диссоциации уменьшается.
Из этого выражения очевидно, что α может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации часто выражают в процентах. Степень диссоциации электролита может быть определена только экспериментальным путем, например по измерению температуры замерзания раствора, по электропроводности раствора и т. д.
Механизм диссоциации
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются
, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами — к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы:
Диссоциация полярных молекул может быть полной или частичной.
Таким образом , электролитами являются соединения с ионной или полярной связью — соли , кислоты и основания . И диссоциировать на ионы они могут в полярных растворителях.
Константа диссоциации.
Константа диссоциации. Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как:
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой — от 10 -16 до 10 15 . Например, высокое значение К для реакции
означает, что если в раствор, содержащий ионы серебра Ag + ,внести металлическую медь, то в момент достижения равновесия концентрация ионов меди [Cu 2+ ] намного больше, чем квадрат концентрации ионов серебра [Ag + ] 2 . Напротив, низкое значение Кв реакции
говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.
Обратите особое внимание на форму записи выражений для константы равновесия.
Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия
(такие константы обозначаются К 1 ).
Так, для реакции меди с серебром неправильным будет выражение:
Правильной будет следующая форма записи:
Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.
Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI
Произведение растворимости. Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимости соответствующих веществ (обозначается ПР).
Для реакции диссоциации воды
выражение константы будет:
, а не
Объясняется это тем, что концентрация воды во время реакций в водных растворах изменяется очень незначительно. Поэтому принимается, что концентрация [Н2О] остается постоянной и вводится в константу равновесия.
Кислоты, основания и соли с позиций электролитической диссоциации.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Диссоциация многоосновной кислоты протекает главным образом по первой ступени , в меньшей степени по второй и лишь в незначительной степени — по третьей . Поэтому в водном растворе , например , фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО 2- 4, НРО 2- 4 и РО 3- 4
НРО 2- 4 ↔ Н+ PО З- 4 (третья ступень)
Основностъ кислоты определяется числом катионов водорода, которые образуются при диссоциации.
Так , НCl, HNO3 — одноосновные кислоты — образуется один катион водорода;
Н3 РО4, Н3 АsО4 — трехосновные , так как образуются соответственно два и три катиона водорода.
Из четырех атомов водорода, содержащихся в молекуле уксусной кислоты СН3СООН , только один , входящий в карбоксильную группу — СООН, способен отщепляться в виде катиона Н + , — уксусная кислота одноосновная.
Двух — и многоосновные кислоты диссоциируют ступенчато (постепенно).
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Основания,растворимые в воде называются щелочами . Их немного . Это основания щелочных и щелочноземельных металлов : LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН . Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп ( гидроксогрупп ). Например, NН4ОН — однокислотное основание , Са(ОН)2— двухкислотное , Fе(ОН)3 — трехкислотное и т . д . Двух- и многокислотные основания диссоциируют ступенчато
Ca(ОН)2 ↔ Са(ОН) + + OH — (первая ступень)
Ca(OH) + ↔ Ca 2+ + OH — (вторая ступень)
Однако имеются электролиты , которые при диссоциации одновременно образуют катионы водорода, и гидроксид — ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н + и ОН — (в незначительных количествах):
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н + , и щелочные свойства, обусловленные наличием ионов ОН — .
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH4) и анионы кислотных остатков
Так диссоциируют средние соли . Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы .
Эквивалентная (Нормальная) концентрация
это число эквивалентов в 1 литре раствора. Обозначают символом Сн
0,1 нормальный раствор — децинормальный.
Мольная доля — это величина, характеризующая отношение количества молей данного вещества к общему количеству молей всех веществ, находящихся в смеси или растворе. Для того чтобы определить мольные доли веществ, необходима лишь таблица Менделеева и элементарное умение совершать вычисления.
Чтобы определить мольную долю того или иного вещества, вам понадобится сначала вычислить количество молей и этого вещества и всех других веществ, содержащихся в смеси (растворе), потом подставить эти величины в следующую формулу:Х = n1/Σn , где Х – мольная доля интересующего нас вещества, n1 – количество его молей, а Σn – сумма количества молей всех имеющихся веществ.
Электролитическая диссоциация. Влияние природы вещества на его способность к электролитической диссоциации в водном растворе. Гидратация ионов в растворе. Основания и кислоты с точки зрения теории электролитической диссоциации. Ион гидроксония. Амфотерные гидроксиды. Кислотно-основной характер диссоциации. Диссоциация средних, кислых и основных солей.
Под электролитической диссоциацией понимают распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов. Например, молекула уксусной кислоты так диссоциирует в водном растворе:
CH3COOH === + СО
Процесс диссоциации во всех случаях является обратимым, поэтому при надписи уравнений диссоциации применяется знак обратимости(стрелочки –туда и обратно).
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Гидратация ионов во многом определяет их поведение в растворе — она влияет на скорость передвижения ионов, на условия их взаимного сближения и адсорбции на разделах фаз. Чем больше и устойчивей гидратная оболочка, тем труднее перемещаться ионам в воде и сближаться друг с другом или адсорбироваться.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
NаОН « Na+ + OH-; Ва(ОН)2 « Ba2+ + 2OH-; NH3·H2O « NH4+ + OH-.
С точки зрения теории электролитической диссоциации кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+,
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
СН3СООН = Н+ + СН3СОО-.
Гидроксо́ний (оксоний, гидроний) НзО+ — комплексный ион, соединение протона с молекулой воды.
Амфоте́рные гидрокси́ды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или осно́вных гидроксидов.
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:
При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:
При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:
Соли – это электролиты, которые диссоциируют в растворе на катионы металлов (и NH4+) и анионы кислотных остатков. Соли по своему составу бывают кислые, основные и средние. Кислые соли характерны для слабых многоосновных кислот, основные – для слабых многокислотных оснований, а средние соли могут быть образованы как сильными, так и слабыми кислотами и основаниями. Однако независимо от состава, соли первично диссоциируют на катион металла и кислотный остаток.
Средняя соль AICI3 Û AI+3 + 3CI- , ZnSO4 Û Zn+2 + SO42-.
Кислая соль KHCO3 Û K+ + HCO3- NaH2PO4 Û Na+ + H2PO4
Основная соль— ZnOHCI Û ZnOH+ + CI- Cr(OH)2NO3 Û Cr(OH)2+ + NO3-
Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации. Основные представления теории сильных электролитов. Истинная и кажущаяся степень диссоциации в растворах сильных электролитов. Концентрация ионов в растворе и активность.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита: α = п/N ,
где α— степень диссоциации; п — количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α K2 > K3 = 8 · 10-3 > 6 · 10-8>10-12
Суммарному равновесию: H3PO4 ↔ 3H+ + PO43- отвечает суммарная константа диссоциации: K = K1· K2 ·K3
Закон разбавления Оствальда. Степень диссоциации определяется константой диссоциации и концентрацией слабого электролита в растворе.
Рассмотрим равновесные молярные концентрации исходного слабого электролита и образовавшихся катионов и анионов в состоянии химического равновесия:
| Молярные концентрации веществ В начальный момент времени (τ0) К моменту достижения равновесия (τравн.) | MA с0 [MA] = (1−α )с0 | M+ [M+] = αс0 | A− [A−] = αс0 |
Данное выражение было впервые выведено немецким физико-химиком В. Оствальдом (закон разбавления Оствальда). Закон разбавления показывает, что степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации. Последняя в данном растворителе и для данного электролита зависит только от температуры.
При очень низкой степени диссоциации (α о С), она называется ионным произведением воды KW:
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100 о С значения 10 -13 .
В чистой воде при 25 о С концентрации ионов водорода и гидроксила равны между собой:
[H + ] = [OH — ] = 10 -7 моль/лРастворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными.
Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10 -7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10 -14 . Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации
ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H + ] = 10 -3 моль/л, то [OH — ] = KW/[H + ] = 10 -14 /10 -3 = 10 -11 моль/л, или, если [OH — ] = 10 -2 моль/л, то [H + ] = KW/[OH — ] = 10 -14 /10 -2 = 10 -12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды.
На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями.
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
Легко показать, прологарифмировав ионное произведение воды, что
Если рН среды равен 7 — среда нейтральная, если меньше 7 — кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 8447 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Сущность теории электролитической диссоциации. Понятие об электролитах.
Водные растворы солей, кислот и оснований обладают рядом особенностей по сравнению с растворами других веществ. Шведский ученый Сванте Аррениус в 1887 г. предложил теорию ионизации, согласно которой при растворении кислот, оснований и солей в воде происходит расщепление молекул на ионы.
Вещества,распадающиеся на ионы в растворахили расплавах и поэтому проводящие электрический ток, называются электролитами.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией (ТЭД).
Сущность теории Аррениуса сводится к следующим трем положениям:
1.Электролиты при растворении в воде распадаются (диссоциируют) на ионы. Ио́н (др.-греч. ἰόν — идущее) — одноатомная или многоатомная электрически заряженная частица.
2.Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду иназываются катионами;отрицательно заряженные — к аноду, они называютсяанионами.
3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация). Общая запись этих двух процессов:
где КА – электролит, К + — катион, А — — анион.
Диссоциация кислот, солей, оснований в водных растворах.
С помощью ТЭД дают определения и описывают свойства кислот, оснований и солей.
Кислоты – электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Многоосновные кислоты диссоциируют ступенчато.
Основания – электролиты, при диссоциации которых в качестве анионов образуются гидроксид-ионы.
Соли – электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Поскольку диссоциация процесс обратимый, то в растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой — αальфа).
Степень диссоциации – это отношение числа распавшихся на ионы молекул N Ι к общему числу растворенных молекул N:
N Ι
α= ———(в долях единицы или в процентах)
N
Еслиα =1 или 100%, электролит полностью распадается на ионы.
Еслиα = 0, диссоциация отсутствует.
Если α = 0,5 или 50%, то это означает, что из каждых 100 молекул данного электролита 50 находятся в состоянии диссоциации.
Различают сильные и слабые электролиты.
Сильные электролиты в водном растворе диссоциированы практически полностью. В растворах сильных электролитов молекулы отсутствуют. К сильным электролитам относятся:
1) почти все соли;
2) многие минеральные кислоты: H2S04, HN03, HCl, НСIO4, HBr, HI, HMn04;
3) основания щелочных металлов, например: NaOH и КОН, а также Ва(ОН)2, Са(ОН)2.
Слабые электролиты в водных растворах диссоциируют лишь частично. В растворе имеется большое количество недиссоциированных молекул. К слабым электролитам относятся:
2) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH;
Кислоты Н3РО4, H2S03 и HF являются кислотами средней силы.
Понятие о константе химического равновесия.
Слабые электролиты в водных растворах диссоциируют только частично, поэтому в растворе устанавливается динамическое равновесие между молекулами и ионами. Следовательно, к процессу диссоциации слабого электролита мы можем применить законы химического равновесия.
Для уравнения реакции диссоциации (1)
константу равновесия можно выразить уравнением:
[К + ] [ А — ]
[К А ]
[KA] — концентрация недиссоциированного соединения в растворе; [K+] — концентрация катионов в растворе; [A−] — концентрация анионов в растворе.Константу равновесия применительно к реакции диссоциации называют константой диссоциации.
Например, для диссоциации азотистой кислоты:
выражение константы диссоциации имеет следующий вид:
Установлено, что константа диссоциации для слабых электролитов не меняется с изменением концентрации раствора и является постоянной величиной при постоянной температуре.
Закон действия масс.
Закон действия масс: чем больше константа диссоциации, тем больше ионов в растворе.
КА К + + А —
[К + ] [ А — ]
[К А ]
Теория электролитической диссоциации справедлива лишь в отношении растворов слабых электролитов, так как только ионизация слабых электролитов приводит к химическому равновесию, которое характеризуется константой ионизации.Процесс диссоциации сильных электролитов необратим, вследствие этого растворы сильных электролитов и не подчиняются закону действия масс.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
18.Характеристики кислот, оснований и солей с точки зрения теории электролитической диссоциации. Амфотерность гидроксидов.
Диссоциация оснований. Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-ионы OH : NaOH Na + + OH ; Ca(OH)2 CaOH + + OH ; CaOH + Ca 2+ + OH .
Ступенчатость диссоциации обусловливает возможность образования основных и кислых (см. ниже) солей.
Диссоциация кислот. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода H + . HCl H + + Cl ; HNO3 H + + NO3 ; H2SO4 H + + HSO4 — ; HSO4 H + + SO4 2 ; H3PO4 H + + H2PO4 ; H2PO4 H + + HPO4 2 ; HPO4 2 H + + PO4 3 .
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды дис-социируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H + и гидроксид-анионы OH : H + + MeO ⇄ MeOH ⇄ Me + + OH .
К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома Cr(OH)3, свинца Pb(OH)2 и др.
1. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка. Напри-мер, Na2SO4 2 Na + + SO4 2 ; Ca3(PO)4 3 Ca 2+ + 2 PO4 3 .
2.Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода и кислотного остатка: KHSO3 K + + HSO3 ( = 1).
Сложный анион диссоциирует частично: HSO3 ⇄ H + + SO3 2 ( : Al(OH)2Cl Al(OH)2 + + Cl ( = 1).
Сложный катион диссоциирует частично: Al(OH)2 + ⇄ AlOH 2+ + OH ( 2+ ⇄ Al 3+ + OH ( + + Al 3+ + 2 SO4 2 ;
Сложные соли диссоциируют на катион металла и анионы кислотных остатков. Например, ZnClNO3 Zn 2+ + Cl + NO3 ;
19. Окислительно-восстановительные реакции (овр). Степень окисления атомов Основные окислители и восстановители. Составление уравнений овр методами электронного и электронно-ионного баланса.
ОВР-реакции, протекающие с изменением степени окисления.
Окисление – это процесс отдачи электронов при этом происходит понижение степени окисления.
Восстановление – это процесс присоединения электронов, при этом происходит понижение степени окисления.
Реакции, в кот. ок-ль. и восст-ль предс. собой различные ве-ва наз. межмолеклярными. Если ок-ль и восс-ль атомы одной молекулы — внутримолекулярные.
Под степенью окисления (окислительным числом) понимают условный заряд атома в соединении, вычисленный из предположения, что в молекуле все связи ионные. Степень окисления указывает, сколько электронов оттянуто от атома (положительная степень окисления) или притянуто к нему от другого атома (отрицательная степень окисления). Мера удаления или приближения электронов к атому в степени окисления не отражена.Восстановители
а) Металлы как простые вещества: K 0 , Na 0 , Ca 0 , Al 0 и др.
б) Простые анионы неметаллов: S 2 , Cl , J , Br , Se 2 и др.
в) Сложные анионы и молекулы, содержащие электроположитель-ные элементы в промежуточной степени окисления: S +4 O3 2 , N +3 O2 , As +3 O3 3 , Cr +3 O2 , [Fe +2 (CN)6] 4 , C +2 O, N +2 O, S +4 O2 и др.
г) Простые катионы в низшей степени окисления: Fe 2+ , Sn 2+ , Cr 3+ , Cu + , Mn 2+ , As 3+ и др.
д) Некоторые простые вещества:
е) Катод при электролизе.
а) Неметаллы как простые вещества с большой электроотрицательностью: F2, O2, Cl2 и др.
б) Простые катионы в высокой степени окисления: Sn 4+ , Fe 3+ , Cu 2+ и др., а также H + .
г) Сложные ионы и молекулы, содержащие атомы неметаллов в положительной степени окисления: H2S +6 O4, S +6 O3, HOCl +1 , HCl +5 O3,
д) Анод при электролизе.
В соединениях, когда атомы находятся в промежуточной степени окисления, последние могут проявлять как восстановительные, так и окислительные свойства (окислительно-восстановительная двойствен-ность):
Применяют два метода составления уравнений реакций окисления-восстановления:
ОСНОВАНИЯ, КИСЛОТЫ И СОЛИ В ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Читайте также:
- A-аминокислоты. Пептиды
- I. МЕХАНИКА И ЭЛЕМЕНТЫ СПЕЦИАЛЬНОЙ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ
- I. МЕХАНИКА И ЭЛЕМЕНТЫ СПЕЦИАЛЬНОЙ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ
- III. Методы исследования в области теории исторической науки
- N В этом случае образуется больше ксантина и, следовательно, мочевой кислоты
- N Оценивается базальная и стимулированная секреция соляной кислоты (стимулируют пантагастрином)
- А. Изучение конкурентоспособности производителя исходя из теории равновесия
- А. Теории трансакционного спроса на деньги.
- Австрийская школа экономической теории
- Аксиоматический способ построения теории
- АКСИОМЫ ТЕОРИИ ВЕРОЯТНОСТЕЙ
- Альтернативные (современные) теории мировой торговли
Основания. Название «основания» первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Водные растворы таких оснований, как NаОН, КОН и Ва(ОН)2, обладают сильнощелочными свойствами, поэтому эти вещества и некоторые другие называют щелочами.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов ОН — .
В общем виде уравнение электролитической диссоциации основания имеет вид:
NаОН « Na + + OH — ; Ва(ОН)2 « Ba 2+ + 2OH — ; NH3·H2O « NH4 + + OH — .
Гидроксиды металлов типа NаОН и Ва(ОН)2, представляющие собой ионные кристаллы, являются сильными электролитами, а гидрат аммиака (ковалентное соединение) — это слабое основание.
Некоторые из щелочей аналогично диссоциируют и при плавлении, например КОН.
Большинство же основных гидроксидов разлагаются при нагревании на оксиды и воду еще до плавления.
Основания — гидроксиды металлов — могут быть получены при взаимодействии неблагородных металлов с водой или основных оксидов с водой: 2Nа + 2Н2О = 2 NаОН + Н2, СаО + Н2О = Са(ОН)2.
Оксиды металлов, которые подобным путем образуют основания, раньше называли основными ангидридами.
Типичные свойства оснований по Аррениусу связаны с тем, что они поставляют в водный раствор гидроксид-ионы ОН — . На этом основано обнаружение щелочей с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами щелочей в синий цвет.
Кислоты. Кислоты исторически получили такое название из-за кислого вкуса водных растворов таких веществ, как хлороводород или уксусная кислота.
С точки зрения теории электролитической диссоциации
кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н + ,
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Таким образом, характеристической составной частью всех кислот является водород, способный диссоциировать в водный раствор.
кислота — это водородсодержащее соединение, водород которого может быть замещен на металл с образованием соли: Мg + Н2SO4 = МgSO4 + Н2
Следует различать кислородсодержащие кислоты и бескислородные кислоты.
Все кислоты являются потенциальными электролитами в водном растворе. Под воздействием полярных молекул воды они отщепляют катионы водорода, которые мгновенно гидратируются водой и образуют катионы оксония Н3О + , так как простые катионы водорода Н + , являющиеся по существу индивидуальными протонами р + , не способны к существованию в водном растворе. Среди кислот есть как сильные электролиты (Н2SО4, НМО3, НС1), так и слабые (Н2СO3, Н2S).
Кислородсодержащие кислоты могут быть получены взаимодействием кислотных оксидов с водой: СО2 + Н2О = Н3СО3; SО3 + Н2О = Н2SО4.
Ранее такие оксиды неметаллов называли кислотными ангидридами. Многим неметаллам, ввиду многообразия их степеней окисления, отвечает несколько кислородсодержащих кислот. Для хлора известны: НСlO4 — хлорная кислота, НСlO2 — хлористая кислота, НС1О3 — хлорноватая кислота, НСlO — хлорноватистая кислота.
Металлы, которые проявляют несколько степеней окисления, также могут образовывать кислотные оксиды и кислоты.
Многоосновные кислоты, содержащие в молекулах по два или несколько атомов водорода, способных замещаться на атомы металла, обычно являются слабыми электролитами и диссоциируют ступенчато, причем каждая следующая стадия протекает в значительно меньшей степени, чем предыдущая: Н3PO4 « н + + н2РО4 —
Типичные свойства кислот по Аррениусу связаны с тем, что они поставляют в водный раствор катионы водорода Н + (Н3О + ). На этом основано обнаружение кислот с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами кислот в красный цвет.
Соли. С точки зрения теории электролитической диссоциации соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка: BaС12 = Ba 2+ + 2С1.
Дата добавления: 2014-01-07 ; Просмотров: 1669 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Определение понятия основания с точки зрения теории электролитической диссоциации
Объясните с точки зрения теории электролитической диссоциации сущность химических реакций, протекающих в водной среде.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями.
Ионные реакции в водных растворах могут протекать необратимо и обратимо.
Если в результате реакции в растворах электролитов протекает с образованием нерастворимого или газообразного, или малодиссоциирующего вещества, то такая реакция протекает необратимо.
Например, реакция между хлоридом бария и сульфатом калия протекает необратимо, т. к. образуется нерастворимый сульфат бария:
Молекулярное уравнение:
BaCl2 + K2SO4 → BaSO4↓ + 2KCl
Краткое ионное уравнение:
Ba 2+ + SO4 2- → BaSO4↓
Сокращенное ионное уравнение показывает, что реакция свелась к взаимодействию ионов Ba 2+ и SO4 2- , в результате которого образовалось вещество BaSO4 — слабый электролит. При этом неважно, в состав каких веществ входили эти ионы до их взаимодействия, например, это могли быть соли Ba(NO3)2 и Na2SO4. Краткие ионные реакции, в необратимых реакциях, проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
Если в результате реакции не образуются слабые электролиты, то такая реакция всегда протекает обратимо, т. е. в растворе образуется смесь ионов.
Например реакция между хлоридом натрия и перхлоратом калия:
Молекулярное уравнение:
NaCl + KClO4 ⇄ NaClO4 + KCl
Краткое ионное уравнение:
Na + + Cl — + K + + ClO4 — ⇄ Na + + ClO4 — + K + + Cl —
- http://vopvet.ru/news/dajte_opredelenie_ponjatija_osnovanija/2014-12-29-393
- http://examchemistry.com/content/lesson/himreakcii/eldissociaciya.html
- http://studopedia.ru/4_120003_ekvivalentnaya-normalnaya-kontsentratsiya.html
- http://cyberpedia.su/8xb522.html
- http://studfiles.net/preview/2180772/page:8/
- http://studopedia.su/9_81279_osnovaniya-kisloti-i-soli-v-teorii-elektroliticheskoy-dissotsiatsii.html
- http://chemer.ru/reshebniki/11-klass/rudzitis-i-feldman/17-18/zadanie-1.html