Сокращение мышц — это сложный процесс, состоящий из целого ряда этапов. Главными составляющими здесь являются миозин, актин, тропонин, тропомиозин и актомиозин, а также ионы кальция и соединения, которые обеспечивают мышцы энергией. Рассмотрим виды и механизмы мышечного сокращения. Изучим, из каких этапов они состоят и что необходимо для цикличного процесса.
Мышцы объединяются в группы, у которых одинаковый механизм мышечных сокращений. По этому же признаку они и разделяются на 3 вида:
- поперечно-полосатые мышцы тела;
- поперечно-полосатые мышцы предсердий и сердечных желудочков;
- гладкие мышцы органов, сосудов и кожи.
Поперечно-полосатые мышцы входят в опорно-двигательный аппарат, являясь его частью, так как помимо них сюда входят сухожилия, связки, кости. Когда реализуется механизм мышечных сокращений, выполняются следующие задачи и функции:
- тело передвигается;
- части тела перемещаются друг относительно друга;
- тело поддерживается в пространстве;
- вырабатывается тепло;
- кора активируется посредством афферентации с рецептивных мышечных полей.
Из гладких мышц состоит:
- двигательный аппарат внутренних органов, в который входят бронхиальное дерево, легкие и пищеварительная трубка;
- лимфатическая и кровеносная системы;
- система мочеполовых органов.
Как и у всех позвоночных животных, в человеческом организме выделяют три самых важных свойства волокон скелетных мышц:
- сократимость — сокращение и изменение напряжения при возбуждении;
- проводимость — движение потенциала по всему волокну;
- возбудимость — реагирование на раздражитель посредством изменения мембранного потенциала и ионной проницаемости.
Мышцы возбуждаются и начинают сокращаться от нервных импульсов, идущих от центров. Но в искусственных условиях используют электростимуляцию. Мышца тогда может раздражаться напрямую (прямое раздражение) или через нерв, иннервирующий мышцу (непрямое раздражение).
Виды сокращений
Механизм мышечных сокращений подразумевает преобразование химической энергии в механическую работу. Этот процесс можно измерить при эксперименте с лягушкой: ее икроножную мышцу нагружают небольшим весом, а затем раздражают легкими электроимпульсами. Сокращение, при котором мышца становится короче, называется изотоническим. При изометрическом сокращении укорачивания не происходит. Сухожилия не позволяют при развитии мышцей силы укорачиваться. Еще один ауксотонический механизм мышечных сокращений предполагает условия интенсивных нагрузок, когда мышца укорачивается минимальным образом, а сила развивается максимальная.
Структура и иннервация скелетных мышц
В поперечно-полосатые скелетные мышцы входит множество волокон, находящихся в соединительной ткани и крепящихся к сухожилиям. В одних мышцах волокна расположены параллельно длинной оси, а в других они имеют косой вид, прикрепляясь к центральному тяжу сухожильному и к перистому типу.
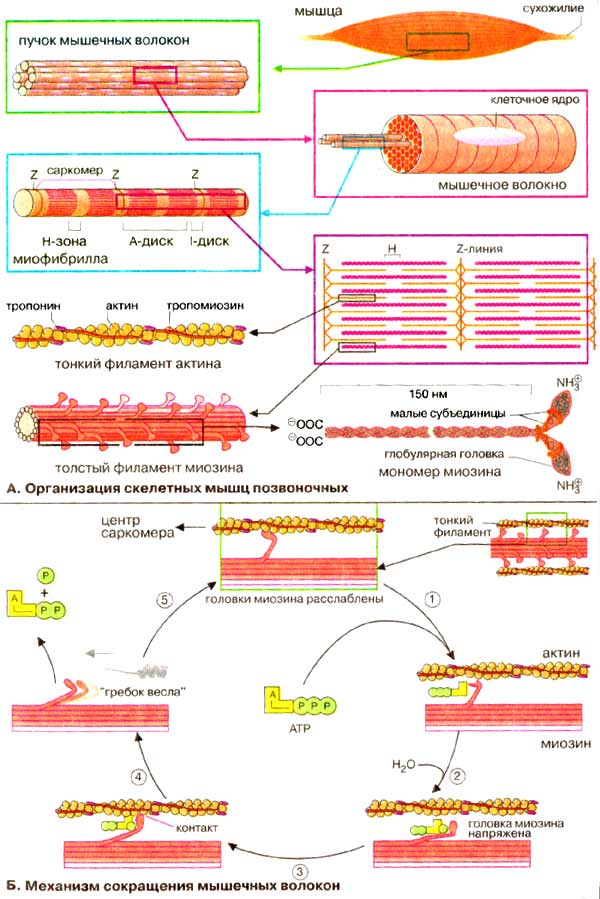
Главная особенность волокна заключается в саркоплазме массы тонких нитей — миофибрилл. В них входят светлые и темные участки, чередующиеся друг с другом, а у соседних поперечно-полосатые волокна находятся на одном уровне — на поперечном сечении. Благодаря этому получается поперечная полосатость по всему волокну мышц.
Саркомером является комплекс из темного и двух светлых дисков, и он отграничивается Z-образными линиями. Саркомеры — это сократительный аппарат мышцы. Получается, что сократительное мышечное волокно состоит из:
- сократительного аппарата (системы миофибрилл);
- трофического аппарата с митохондриями, комплексом Гольджи и слабой эндоплазматической сетью;
- мембранного аппарата;
- опорного аппарата;
- нервного аппарата.
Мышечное волокно разделяется на 5 частей со своими структурами и функциями и является целостной частью ткани мышц.
Иннервация
Этот процесс у поперечно-полосатых мышечных волокон реализуется посредством нервных волокон, а именно аксонов мотонейронов спинного мозга и головного ствола. Один мотонейрон иннервирует несколько волокон мышц. Комплекс с мотонейроном и иннервируемыми мышечными волокнами называют нейромоторной (НМЕ), или двигательной единицей (ДЕ). Среднее число волокон, которые иннервирует один мотонейрон, характеризует величину ДЕ мышцы, а обратную величину называют плотностью иннервации. Последняя является большой в тех мышцах, где движения небольшие и «тонкие» (глаза, пальцы, язык). Малое ее значение будет, напротив, в мышцах с «грубыми» движениями (например, туловище).
Иннервация может быть одиночной и множественной. В первом случае она реализуется компактными моторными окончаниями. Обычно это характерно для крупных мотонейронов. Мышечные волокна (называющиеся в этом случае физическими, или быстрыми) генерируют ПД (потенциалы действий), которые распространяются на них.
Множественная иннервация встречается, к примеру, во внешних глазных мышцах. Здесь не генерируется потенциал действия, так как в мембране нет электровозбудимых натриевых каналов. В них распространяется деполяризация по всему волокну из синаптических окончаний. Это необходимо для того, чтобы привести в действие механизм мышечного сокращения. Процесс здесь происходит не так быстро, как в первом случае. Поэтому его называют медленным.
Структура миофибрилл
Исследования мышечного волокна сегодня проводятся на основе рентгеноструктурного анализа, электронной микроскопии, а также гистохимическими методами.
Рассчитано, что в каждую миофибриллу, диаметр которой составляет 1 мкм, входит примерно 2500 протофибрилл, то есть удлиненных полимеризованных молекул белков (актина и миозина). Актиновые протофибриллы в два раза тоньше миозиновых. В покое эти мышцы находятся так, что актиновые нити кончиками проникают в промежутки между миозиновыми протофибриллами.
Узкая светлая полоса в диске А свободна от актиновых нитей. А мембрана Z скрепляет их.
На миозиновых нитях есть поперечные выступы длиной до 20 нм, в головках которых находится порядка 150 молекул миозина. Они отходят биополярно, и каждая головка соединяет миозиновую с актиновой нитью. Когда происходит усилие актиновых центров на нитях миозина, актиновая нить приближается к центру саркомера. В конце миозиновые нити доходят до линии Z. Тогда они занимают собой весь саркомер, а актиновые находятся между ними. При этом длина диска I сокращается, а в конце он исчезает полностью, вместе с чем линия Z становится толще.
Так, по теории скользящих нитей, объясняется сокращение длины волокна мышцы. Теория, получившая название «зубчатого колеса», была разработана Хаксли и Хансоном в середине двадцатого века.
Механизм мышечного сокращения волокна
Главным в теории является то, что не нити (миозиновые и актиновые) укорачиваются. Длина их остается неизменной и при растяжении мышц. Но пучки тонких нитей, проскальзывая, выходят между толстыми нитями, уменьшается степень их перекрытия, таким образом происходит сокращение.
Молекулярный механизм мышечного сокращения посредством скольжения актиновых нитей заключается в следующем. Миозиновые головки соединяют протофибриллу с актиновой. При их наклонах происходит скольжение, двигающее актиновую нить к центру саркомера. За счет биполярной организации миозиновых молекул на обеих сторонах нитей создаются условия для скольжения актиновых нитей в разные стороны.
При расслаблении мышц миозиновая головка отходит от актиновых нитей. Благодаря легкому скольжению расслабленные мышцы растяжению сопротивляются гораздо меньше. Поэтому они пассивно удлиняются.
Этапы сокращения
Механизм мышечного сокращения кратко можно подразделить на следующие этапы:
- Мышечное волокно стимулируется, когда потенциал действия поступает от мотонейронов из синапсов.
- Потенциал действия создается на мембране мышечного волокна, а затем распространяется к миофибриллам.
- Совершается электромеханическое сопряжение, представляющее собой преобразование электрического ПД в механическое скольжение. В этом обязательно участвуют ионы кальция.
Ионы кальция
Для лучшего понимания процесса активации волокна ионами кальция удобно рассмотреть структуру актиновой нити. Длина ее составляет порядка 1 мкм, толщина — от 5 до 7 нм. Это пара закрученных ниток, которые напоминают мономер актина. Примерно через каждые 40 нм здесь находятся сферические тропониновые молекулы, а между цепями — тропомиозиновые.
Когда ионы кальция отсутствуют, то есть миофибриллы расслабляются, длинные тропомиозиновые молекулы блокируют крепление актиновых цепей и мостиков миозина. Но при активизации ионов кальция тропомиозиновые молекулы опускаются глубже, и участки открываются.
Тогда миозиновые мостики прикрепляются к актиновым нитям, а АТФ расщепляется, и сила мышц развивается. Это становится возможным за счет воздействия кальция на тропонин. При этом молекула последнего деформируется, проталкивая тем самым тропомиозин.
Когда мышца расслаблена, в ней на 1 грамм сырого веса содержится больше 1 мкмоль кальция. Соли кальция изолированы и находятся в особых хранилищах. В противном случае мышцы бы все время сокращались.
Хранение кальция происходит следующим образом. На разных участках мембраны клетки мышцы внутри волокна имеются трубки, через которые происходит соединение со средой вне клеток. Это система поперечных трубочек. А перпендикулярно ей находится система продольных, на концах которых — пузырьки (терминальные цистерны), расположенные в непосредственной близости к мембранам поперечной системы. Вместе получается триада. Именно в пузырьках хранится кальций.
Так ПД распространяется внутрь клетки, и происходит электромеханическое сопряжение. Возбуждение проникает в волокно, переходит в продольную систему, высвобождает кальций. Таким образом осуществляется механизм сокращения мышечного волокна.
3 процесса с АТФ
При взаимодействии обеих нитей при наличии ионов кальция немалая роль отводится АТФ. Когда реализуется механизм мышечного сокращения скелетной мышцы, энергия АТФ применяется для:
- работы насоса натрия и калия, который поддерживает постоянную концентрацию ионов;
- этих веществ по разные стороны мембраны;
- скольжения нитей, укорачивающих миофибриллы;
- работы насоса кальция, действующего для расслабления.
АТФ находится в клеточной мембране, нитях миозина и мембранах ретикулума саркоплазматического. Фермент расщепляется и утилизируется миозином.
Потребление АТФ
Известно, что миозиновые головки взаимодействуют с актином и содержат элементы для расщепления АТФ. Последняя активизируется актином и миозином при наличии ионов магния. Поэтому расщепление фермента происходит при прикреплении миозиновой головки к актину. При этом чем больше поперечных мостиков, тем скорость расщепления будет выше.
Механизм АТФ
После завершения движения молекула АФТ обеспечивает энергией для разделения участвующих в реакции миозина и актина. Миозиновые головки разделяются, АТФ расщепляется до фосфата и АДФ. В конце подсоединяется новая АТФ-молекула, и цикл возобновляется. Таковым является механизм мышечного сокращения и расслабления на молекулярном уровне.
Активность поперечных мостиков будет продолжаться лишь до тех пор, пока происходит гидролиз АТФ. При блокировке фермента мостики не станут снова прикрепляться.
С наступлением смерти организма уровень АТФ в клетках падает, и мостики остаются устойчиво прикрепленными к актиновой нити. Так происходит стадия трупного окоченения.
Ресинтез АТФ
Ресинтез возможно реализовать двумя путями.
Посредством ферментативного переноса от креатинфосфата фосфатной группы на АДФ. Так как запасов в клетке креатинфосфата намного больше АТФ, ресинтез реализуется очень быстро. В то же время посредством окисления пировиноградной и молочной кислот ресинтез будет осуществляться медленно.
АТФ и КФ могут исчезнуть полностью, если ресинтез будет нарушен ядами. Тогда и кальциевый насос прекратит работу, вследствие чего мышца необратимо сократится (то есть настанет контрактура). Таким образом, нарушится механизм мышечного сокращения.
Физиология процесса
Подытоживая вышесказанное, отметим, что сокращение волокна мышцы состоит в укорочении миофибрилл в каждом из саркомеров. Нити миозина (толстые) и актина (тонкие) связаны концами в расслабленном состоянии. Но они начинают скользящие движения друг навстречу к другу, когда реализуется механизм мышечного сокращения. Физиология (кратко) объясняет процесс, когда под влиянием миозина выделяется необходимая энергия для преобразования АТФ в АДФ. При этом активность миозина будет реализована лишь при достаточном содержании ионов кальция, накапливающихся в саркоплазматической сети.
Строение мышцы и механизм мышечного сокращения
Все мышцы делятся на 2 типа:
- Гладкая мускулатура, которая имеется во внутренних органах и стенках сосудов.
- Поперечнополосатая – а) сердечная, б) скелетная
Скелетная (поперечнополосатая) мускулатура выполняет следующие функции:
- перемещение тела в пространстве
- перемещение частей тела относительно друг друга
- поддержание позы
Структурно-функциональной единицей поперечно-полосатой мышцы является нейромоторная единица (НМЕ). Она представлена аксоном мотонейрона, его разветвлениями и мышечными волокнами, которые иннервируются ими.
Структура мышечного волокна
Каждая мышца состоит из мышечных волокон, расположенных продольно, которые представляют собой многоядерные клетки. Снаружи они покрыты базальной мембраной и плазмолеммой, между которыми располагаются камбиальные клетки (миосателлиоциты). На плазмолемме во многих местах имеются пальцеобразные вдавления – Т-тубулы. Они связывают сарколемму с саркоплазматическим ретикулюмом (СПР). Внутри имеется обычный набор органелл: многочисленные ядра, занимающие периферическое положение, митохондрии и т.д. СПР – это система связанных между собой канальцев с высоким содержанием Ca+
Центральную часть цитоплазмы занимают специфические органеллы – миофибриллы – сократительные элементы, расположенные продольно.
Рис.10. Строение саркомера
Структурной единицей миофибрилл является саркомер. Это постоянно повторяющаяся часть миофибриллы, заключенная между двумя Z-мембранами (телофрагмами). Посредине саркомера имеется линия М – мезофрагма. К мезофрагме крепятся нити миозина – сократительного белка, а к телофрагме – актин (тоже сократительный белок).
Чередование этих сократительных белков составляет поперечную исчерченность (Рис.10). В саркомере выделяют анизотропный диск (А) – диск с двойным лучепреломлением (миозин + концы актина), Н-зону – только нити миозина (входит в состав диска А) и I-диск – только нити актина.
При сокращении саркомера происходит укорочение диска I и уменьшение светлой зоны Н.
Сокращение всей мышцы определяется укорочением саркомера, а его длина сокращается за счет образования акто-миозиновых комплексов.
Миозин – толстая белковая молекула, которая располагается по ценру саркомера и состоит из двух цепей – легкого и тяжелого меромиозина. На поперечном сечении миозин имеет вид ромашки – центральная часть и отвисающие головки. Головка легкого меромиозина обладает АТФ-азной активностью, которая проявляется лишь в момент контакта с активным участком актина.
Актин – глобулярный белок, состоит из двух цепей, переплетенных между собой в виде бус. На каждой глобуле имеются активные участки, которые закрыты тропомиозином, и его положение регулируется тропонином. В состоянии покоя активные участки актина не взаимодействуют с головкой миозина, так как они прикрыты в виде крышки тропомиозином (Рис.11).
Механизм мышечного сокращения.
При возбуждении мотонейрона импульсы подходят к мионевральной пластинке (место контакта аксона и плазмолеммы). Из пресинаптической мембраны выделяется ацетилхолин (АХ), который проходит синаптическую щель и действует на плазмолемму (в этом месте ее можно назвать постсинаптической), находит рецепторы к АХ и взаимодействие с ними отражается на проницаемости мембраны для ионов натрия. Проницаемость мембраны для натрия повышается, возникает деполяризация, что приводит к возникновению ПД. Он распространяется вдоль мембраны и передается на Т-тубулы, которые тесно связаны с СПР. ПД в области Т-тубул вызывает повышение проницаемости мембраны СПР для кальция, и он выбрасывается в цитоплазму квантами (порциями) в зависимости от частоты импульса.
Кальций запускает механизм укорочения саркомера. От концентрации кальция зависит насколько сократится саркомер (и мышца в целом).
Выброшенный в цитоплазму кальций находит белок тропонин, взаимодействует с ним и вызывает его конформационные изменения (то есть меняет пространственное расположение белка).
Конформационные изменения тропонина сдвигают тропомиозин со своего места, при этом открывается активный (реактивный) участок актина.
В этот открытый участок встраивается головка миозина. При этом контакте активируются ферментативные системы, расположенные последовательно. И этот контакт двух белков по типу зубчатой передачи механически передвигает нить актина к центру саркомера. Возникает актиновый шаг.
Чем больше возникает актиновых шагов, тем сильнее укорачивается саркомер.
В момент контакта головки миозина и реактивного участка актина головка приобретает АТФ-азную активность.
На что расходуется энергия АТФ:
— на гребкообразное движение и разрыв связей между актином и миозином;
— на работу кальциевого насоса;
— на работу натрий-калиевого насоса.
Таким образом, чем больше выделяется кальция, тем больше образуется акто-миозиновых комплексов, тем больше гребков делает миозин, тем сильнее укорачивается саркомер.
Как только мотонейрон перестает посылать импульсы к мембране мышечного волокна, и в СПР перестает поступать ПД от Т-тубул, выброс кальция из СПР прекращается, и усиливается работа кальциевого насоса, разрываются акто-миозиновые мостики, Z-мембрана возвращается на место и происходит расслабление саркомера (и мышцы в целом).
Фазы мышечного сокращения.
Мышечное сокращение можно зарегистрировать на кимографе. Для этого мышца крепится к штативу, а к другому концу – писчик, который записывает мышечное сокращение (Рис.12).
В мышечном сокращении выделяют следующие фазы:
— латентная (0,01 сек) – от начала действия раздражителя до видимой ответной реакции;
— фаза сокращения (0,04 сек);
— фаза расслабления (0,05 сек).
Таким образом, одиночное мышечное сокращение занимает 0,1 сек. В период мышечного сокращения меняется возбудимость ткани, то есть ее способность к повторной ответной реакции при действии высокочастотных раздражителей.
При относительно низких частотах ответная реакция будет выглядеть как серия одиночных мышечных сокращений (до 10 импульсов в секунду).
Тетанусы. Оптимум и пессимум частоты.
Если увеличить частоту наносимых раздражителей, то можно подобрать такую частоту, при которой каждый последующий раздражитель подействует в фазу расслабления. При этом мышца сократится из неполностью расслабленного состояния, и ответной реакцией будет зубчатый тетанус. Для икроножной мышцы лягушки зубчатый тетанус возникает при частоте больше 10, но меньше 20 импульсов (каждый последующий импульс приходит через 0,09 – 0,06 сек)
При дальнейшем увеличении частоты более 20 импульсов в секунду (до 50) регистрируется гладкий тетанус, так как каждый импульс попадает в период сокращения, и мышца сокращается из сокращенного состояния (каждый последующий импульс приходит через 0,02 – 0,05 сек).
Зубчатый тетанус выше, чем одиночное мышечное сокращение, а гладкий еще выше. В основе тетануса лежит суммация (суперпозиция) сокращений и высокая концентрация кальция, выброшенного из СПР. При увеличении частоты раздражителя увеличивается выброс кальция из СПР, который выделяется квантами и не успевает вернуться обратно.
Но не всякие высокочастотные раздражители вызывают оптимальное сокращение. Чаще всего оптимальное сокращение вызывает гладкий тетанус.
Оптимум частоты – максимальная ответная реакция на действие высокочастотных раздражителей.
Раздражители очень высокой частоты могут уменьшать ответную реакцию, и тогда возникает пессимум частоты. При частоте 100 импульсов в секунду раздражитель попадает в конец латентной фазы (каждый последующий импульс приходит через 0,01 сек), и в ответ возникает одиночное мышечное сокращение. При частоте 200 имп/сек (каждый последующий импульс приходит через 0,005 сек) возникает либо одиночное мышечное сокращение, либо реакция отсутствует.
Уменьшение ответной реакции в период пессимума связано с действие раздражителя в период либо абсолютной, либо относительной рефрактерности. Абсолютная рефрактерность занимает 0,005 сек. Затем, в период относительной рефрактерности, возбудимость ниже 100%. Возбудимость восстанавливается через 0,01 сек. (Рис.13).
Строение и механизм сокращения скелетных мышц.
3. Механизм мышечного сокращения и расслабления.
Подвижность является характерным свойством всех форм жизни. Направленное движение имеет место при расхождении хромосом в процессе клеточного деления, активном транспорте молекул, перемещении рибосом в ходе белкового синтеза, сокращении и расслаблении мышц. Мышечное сокращение – наиболее совершенная форма биологической подвижности. В основе любого движения, в том числе и мышечного, лежат общие молекулярные механизмы.
У человека различают несколько видов мышечной ткани. Поперечно-полосатая мышечная ткань составляет мышцы скелета (скелетные мышцы, которые мы можем сокращать произвольно). Гладкая мышечная ткань входит в состав мышц внутренних органов: желудочно-кишечного тракта, бронхов, мочевыводящих путей, кровеносных сосудов. Эти мышцы сокращаются непроизвольно, независимо от нашего сознания.
В данной лекции мы рассмотрим строение и процессы сокращения и расслабления скелетных мышц, поскольку именно они представляют наибольший интерес для биохимии спорта.
Механизм мышечного сокращения до настоящего времени раскрыт не полностью.
Достоверно известно следующее.
1. Источником энергии для мышечного сокращения являются молекулы АТФ.
2. Гидролиз АТФ катализируется при мышечном сокращении миозином, обладающим ферментативной активностью.
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов кальция в саркоплазме миоцитов, вызываемое нервным двигательным импульсом.
4. Во время мышечного сокращения между тонкими и толстыми нитями миофибрилл возникают поперечные мостики или спайки.
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
Гипотез объясняющих механизм мышечного сокращения много, но наиболее обоснованной является так называемая гипотеза (теория) «скользящих нитей» или «гребная гипотеза».
В покоящейся мышце тонкие и толстые нити находятся в разъединенном состоянии.
Под воздействием нервного импульса ионы кальция выходят из цистерн саркоплазматической сети и присоединяются к белку тонких нитей – тропонину. Этот белок меняет свою конфигурацию и меняет конфигурацию актина. В результате образуется поперечный мостик между актином тонких нитей и миозином толстых нитей. При этом повышается АТФазная активность миозина. Миозин расщепляет АТФ и за счет выделившейся при этом энергии миозиновая головка подобно шарниру или веслу лодки поворачивается, что приводит к скольжению мышечных нитей навстречу друг другу.
Совершив поворот, мостики между нитями разрываются. АТФазная активность миозина резко снижается , прекращается гидролиз АТФ. Однако при дальнейшем поступлении нервного импульса поперечные мостики вновь образуются, так как процесс, описанный выше, повторяется вновь.
В каждом цикле сокращения расходуется 1 молекула АТФ.
В основе мышечного сокращения лежат два процесса:
спиральное скручивание сократительных белков;
циклически повторяющееся образование и диссоциация комплекса между цепью миозина и актином.
Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва, где выделяется нейрогормон ацетилхолин, функцией которого является передача импульсов. Сначала ацетилхолин взаимодействует с ацетилхолиновыми рецепторами, что приводит к распространению потенциала действия вдоль сарколеммы. Все это вызывает увеличение проницаемости сарколеммы для катионов Na + , которые устремляются внутрь мышечного волокна, нейтрализуя отрицательный заряд на внутренней поверхности сарколеммы. С сарколеммой связаны поперечные трубочки саркоплазматического ретикулума, по которым распространяется волна возбуждения. От трубочек волна возбуждения передается мембранам пузырьков и цистерн, которые оплетают миофибриллы на участках, где происходит взаимодействие актиновых и миозиновых нитей. При передаче сигнала на цистерны саркоплазматического ретикулума, последние начинают освобождать находящийся в них Са 2+ . Высвобожденный Са 2+ связывается с Тн-С, что вызывает конформационные сдвиги, передающиеся на тропомиозин и далее на актин. Актин как бы освобождается из комплекса с компонентами тонких филаментов, в котором он находился. Далее актин взаимодействует с миозином, и результатом такого взаимодействия является образование спайки, что делает возможным движение тонких нитей вдоль толстых.
Генерация силы (укорочение) обусловлена характером взаимодействия между миозином и актином. На миозиновом стержне имеется подвижный шарнир, в области которого происходит поворот при связывании глобулярной головки миозина с определенным участком актина. Именно такие повороты, происходящие одновременно в многочисленных участках взаимодействия миозина и актина, являются причиной втягивания актиновых филаментов (тонких нитей) в Н-зону. Здесь они контактируют (при максимальном укорочении) или даже перекрываются друг с другом, как это показано на рисунке.
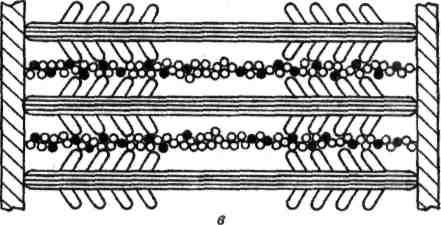
Рисунок. Механизм сокращения: а – состояние покоя; б – умеренное сокращение; в – максимальное сокращение
Энергию для этого процесса поставляет гидролиз АТФ. Когда АТФ присоединяется к головке молекулы миозина, где локализован активный центр миозиновой АТФазы, связи между тонкой и толстой нитями не образуется. Появившийся катион кальция нейтрализует отрицательный заряд АТФ, способствуя сближению с активным центром миозиновой АТФазы. В результате происходит фосфорилирование миозина, т. е. миозин заряжается энергией, которая используется для образования спайки с актином и для продвижения тонкой нити. После того как тонкая нить продвинется на один «шаг», АДФ и фосфорная кислота отщепляются от актомиозинового комплекса. Затем к миозиновой головке присоединяется новая молекула АТФ, и весь процесс повторяется со следующей головкой молекулы миозина.
Затрата АТФ необходима и для расслабления мышц. После прекращения действия двигательного импульса Са 2+ переходит в цистерны саркоплазматического ретикулума. Тн-С теряет связанный с ним кальций, следствием этого являются конформаци-онные сдвиги в комплексе тропонин-тропомиозин, и Тн-I снова закрывает активные центры актина, делая их неспособными взаимодействовать с миозином. Концентрация Са 2+ в области сократительных белков становится ниже пороговой, и мышечные волокна теряют способность образовывать актомиозин.
В этих условиях эластические силы стромы, деформированной в момент сокращения, берут верх, и мышца расслабляется. При этом тонкие нити извлекаются из пространства между толстыми нитями диска А, зона Н и диск I приобретают первоначальную длину, линии Z отдаляются друг от друга на прежнее расстояние. Мышца становится тоньше и длиннее.
Скорость гидролиза АТФ при мышечной работе огромна: до 10 мк моль на 1 г мышцы за 1 мин. Общие запасы АТФ невелики, поэтому для обеспечения нормальной работы мышц АТФ должна восстанавливаться с той же скоростью, с какой она расходуется.
Расслабление мышцы происходит после прекращения поступления длительного нервного импульса. При этом проницаемость стенки цистерн саркоплазматической сети уменьшается, и ионы кальция под действием кальциевого насоса, используя энергию АТФ, уходят в цистерны. Удаление ионов кальция в цистерны ретикулума после прекращения двигательного импульса требует значительных энерготрат. Так как удаление ионов кальция происходит в сторону более высокой концетрации, т.е. против осмотического градиента, то на удаление каждого иона кальция затрачивается две молекулы АТФ. Концентрация ионов кальция в саркоплазме быстро снижается до исходного уровня. Белки вновь приобретают конформацию характерную для состояния покоя.
Таким образом, и процесс мышечного сокращения и процесс мышечного расслабления – это активные процессы, идущие с затратами энергии в виде молекул АТФ,
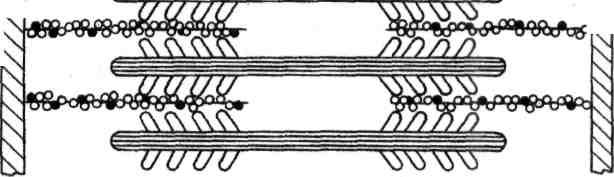
В гладких мышцах нет миофибрилл, которые состоят из нескольких сотен саркомеров. Тонкие нити присоединяются к сарколемме, толстые находятся внутри волокон. Ионы кальция также играют роль в сокращении, но поступают в мышцу не из цистерн, а из внеклеточного вещества, поскольку в гладких мышцах отсутствуют цистерны с ионами калькия. Этот процесс медленный и поэтому медленно работают гладкие мышцы.
—
—
—
—
—
Рисунок. Схема расположения толстых и тонких нией в гладких мышечных волокнах.
Механизм мышечного сокращения
Мышечное сокращение является сложным механо-химическим процессом, в ходе которого происходит преобразование химической энергии гидролитического расщепления АТФ в механическую работу, совершаемую мышцей.
В настоящее время этот механизм еще полностьюне раскрыт. Но достоверно известно следующее:
1. Источником энергии, необходимой для мышечной работы является АТФ;
2. Гидролиз АТФ, сопровождающийся выделением энергии, катализируется миозином, который как уже отмечалось, обладает ферментативной активностью;
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов Са 2+ в саркоплазме миоцитов, вызываемое двигательным нервным импульсом;
4. Во время мышечного сокращения между толстыми и тонкими нитями миофибрилл возникают поперечные мостики или спайки;
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
Имеется много гипотез, пытающихся объяснить молекулярный механизм мышечного сокращения. Наиболее обоснованной в настоящее время является гипотеза«весельной лодки » или «гребная гипотеза » Х. Хаксли. В упрощенном виде её суть заключается в следующем.
В мышце, находящейся в состоянии покоя, толстые и тонкие нити миофибрилл друг с другом не соединены, так как участки связывания на молекулах актина закрыты молекулами тропомиозина.
Мышечное сокращение происходит под воздействием двигательного нервного импульса, представляющего собою волну повышенной мембранной проницаемости, распространяющуюся по нервному волокну[1]. Эта волна повышенной проницаемости передается через нервно-мышечный синапс на Т-систему саркоплазматической сети и в конечном итоге достигает цистерн, содержащих ионы кальция в большой концентрации. В результате значительного повышения проницаемости стенки цистерн (это тоже мембрана!) ионы кальция выходят из цистерн и их концентрация в саркоплазме за очень короткое время (около 3 мс) возрастает примерно в 1000 раз. Ионы кальция, находясь в высокой концентрации, присоединяются к белку тонких нитей — тропонину и меняют его пространственную форму (конформацию). Изменение конформации тропонина, в свою очередь, приводит к тому, что молекулы тропомиозина смещаются вдоль желобка фибриллярного актина, составляющего основу тонких нитей, и освобождают тот участок актиновых молекул, который предназначен для связывания с миозиновыми головками. В результате этого между миозином и актином (т.е. между толстыми и тонкими нитями) возникает поперечный мостик, расположенный под углом 90º. Поскольку в толстые и тонкие нити входит большое число молекул миозина и актина (около 300 в каждую). то между мышечными нитями образуется довольно большое количество поперечных мостиков или спаек. На электронной микрофотографии (рис. 15) хорошо видно, что между толстыми и тонкими нитями имеется большое количество поперечно расположенных мостиков.
Рис. 15. Электронная микрофотография продольногосреза
участка миофибриллы (увеличение 300000 раз) (Л.Страйнер, 1985)
Образование связи между актином и миозином сопровождается повышением АТФ-азной активности последнего (т.е. актин действует подобно аллостерическим активаторам ферментов). в результате чего происходит гидролиз АТФ:
Глава 1. ВОЗБУДИМЫЕ ТКАНИ
ФИЗИОЛОГИЯ МЫШЕЧНОЙ ТКАНИ
Скелетные мышцы
Механизм мышечного сокращения
Скелетная мышца представляет собой сложную систему, преобразующую химическую энергию в механическую работу и тепло. В настоящее время хорошо исследованы молекулярные механизмы этого преобразования.
Структурная организация мышечного волокна. Мышечное волокно является многоядерной структурой, окруженной мембраной и содержащей специализированный сократительный аппарат — миофибриллы. Кроме этого, важнейшими компонентами мышечного волокна являются митохондрии, системы продольных трубочек — саркоплазматическая сеть (ретикулум) и система поперечных трубочек — Т-система. Функциональной единицей сократительного аппарата мышечной клетки является саркомер (рис. 2.20,А); из саркомеров состоит миофибрилла. Саркомеры отделяются друг от друга Z-пластинками. Саркомеры в миофибрилле расположены последовательно, поэтому сокращение саркомеров вызывает сокращение миофибриллы и общее укорочение мышечного волокна.
Изучение структуры мышечных волокон в световом микроскопе позволило выявить их поперечную исчерченность. Электронно-микроскопические исследования показали, что поперечная исчерченность обусловлена особой организацией сократительных белков миофибрилл — актина (молекулярная масса 42 000) и миозина (молекулярная масса около 500 000). Актиновые филаменты представлены двойной нитью, закрученной в двойную спираль с шагом около 36,5 нм. Эти филаменты длиной 1 мкм и диаметром 6—8 нм, количество которых достигает около 2000, одним концом прикреплены к Z-пластинке. В продольных бороздках актиновой спирали располагаются нитевидные молекулы белка тропомиозина. С шагом, равным 40 нм, к молекуле тропомиозина прикреплена молекула другого белка — тропонина. Тропонин и тропомиозин играют важную роль в механизмах взаимодействия актина и миозина. В середине саркомера между нитями актина располагаются толстые нити миозина длиной около 1,6 мкм. В поляризационном микроскопе эта область видна в виде полоски темного цвета (вследствие двойного лучепреломления) — анизотропный А-диск. В центре его видна более светлая полоска Н. В ней в состоянии покоя нет актиновых нитей. По обе стороны А-диска видны светлые изотропные полоски — I-диски, образованные нитями актина. В состоянии покоя нити актина и миозина незначительно перекрывают друг друга таким образом, что общая длина саркомера составляет около 2,5 мкм. При электронной микроскопии в центре Н-полоски обнаружена М-ли-ния — структура, которая удерживает нити миозина. На поперечном срезе мышечного волокна можно увидеть гексагональную организацию миофиламента: каждая нить миозина окружена шестью нитями актина (рис. 2.20, Б).
При электронной микроскопии видно, что на боковых сторонах миозиновой нити обнаруживаются выступы, получившие название поперечных мостиков. Они ориентированы по отношению к оси миозиновой нити под углом 120°. Согласно современным представлениям, поперечный мостик состоит из головки и шейки. Головка приобретает выраженную АТФазную активность при связывании с актином. Шейка обладает эластическими свойствами и представляет собой шарнирное соединение, поэтому головка поперечного мостика может поворачиваться вокруг своей оси.
Использование микроэлектродной техники в сочетании с интерференционной микроскопией позволило установить, что нанесение электрического раздражения на область Z-пластинки приводит к сокращению саркомера, при этом размер зоны диска А не изменяется, а величина полосок Н и I уменьшается. Эти наблюдения свидетельствовали о том, что длина миозиновых нитей не изменяется. Аналогичные результаты были получены при растяжении мышцы — собственная длина актиновых и миозиновых нитей не изменялась. В результате этих экспериментов выяснилось, что изменялась область взаимного перекрытия актиновых и миозиновых нитей. Эти факты позволили Н. Huxley и A. Huxley предложить независимо друг от друга теорию скольжения нитей для объяснения механизма мышечного сокращения. Согласно этой теории, при сокращении происходит уменьшение размера саркомера вследствие активного перемещения тонких актиновых нитей относительно толстых миозиновых. В настоящее время выяснены многие детали этого механизма и теория получила экспериментальное подтверждение.
Механизм мышечного сокращения. В процессе сокращения мышечного волокна в нем происходят следующие преобразования:
А. Электрохимическое преобразование:
2. Распространение ПД по Т-системе.
3. Электрическая стимуляция зоны контакта Т-системы и саркоплазматического ретикулума, активация ферментов, образование инозитолтрифосфата, повышение внутриклеточной концентрации ионов Са2+.
Б. Хемомеханическое преобразование:
4. Взаимодействие ионов Са2+ с тропонином, освобождение активных центров на актиновых филаментах.
5. Взаимодействие миозиновой головки с актином, вращение головки и развитие эластической тяги.
6. Скольжение нитей актина и миозина относительно друг друга, уменьшение размера саркомера, развитие напряжения или укорочение мышечного волокна.
Передача возбуждения с двигательного мотонейрона на мышечное волокно происходит с помощью медиатора ацетилхолина (АХ). Взаимодействие АХ с холинорецептором концевой пластинки приводит к активации АХ-чувствительных каналов и появлению потенциала концевой пластинки, который может достигать 60 мВ. При этом область концевой пластинки становится источником раздражающего тока для мембраны мышечного волокна и на участках клеточной мембраны, прилегающих к концевой пластинке, возникает ПД, который распространяется в обе стороны со скоростью примерно 3—5 м/с при температуре 36 oС. Таким образом, генерация ПД является первым этапом мышечного сокращения.
Вторым этапом является распространение ПД внутрь мышечного волокна по поперечной системе трубочек, которая служит связующим звеном между поверхностной мембраной и сократительным аппаратом мышечного волокна. Т-система тесно контактирует с терминальными цистернами саркоплазматической сети двух соседних саркомеров. Электрическая стимуляция места контакта приводит к активации ферментов, расположенных в месте контакта и образованию инозитолтрифосфата. Инозитолтрифосфат активирует кальциевые каналы мембран терминальных цистерн, что приводит к выходу ионов Са2+ из цистерн и повышению внутриклеточной концентрации Са2+ с 107до 105 M. Совокупность процессов, приводящих к повышению внутриклеточной концентрации Са2+ составляет сущность третьего этапа мышечного сокращения. Таким образом, на первых этапах происходит преобразование электрического сигнала ПД в химический — повышение внутриклеточной концентрации Са2+, т. е. электрохимическое преобразование.
При повышении внутриклеточной концентрации ионов Са2+ тропомиозин смещается в желобок между нитями актина, при этом на актиновых нитях открываются участки, с которыми могут взаимодействовать поперечные мостики миозина. Это смещение тропомиозина обусловлено изменением конформации молекулы белка тропонина при связывании Са2+. Следовательно, участие ионов Са2+ в механизме взаимодействия актина и миозина опосредовано через тропонин и тропомиозин.
Существенная роль кальция в механизме мышечного сокращения была доказана в опытах с применением белка экворина, который при взаимодействии с кальцием излучает свет. После инъекции экворина мышечное волокно подвергали электрической стимуляции и одновременно измеряли мышечное напряжение в изометрическом режиме и люминесценцию экворина. Обе кривые полностью коррелировали друг с другом (рис. 2.21). Таким образом, четвертым этапом электромеханического сопряжения является взаимодействие кальция с тропонином.
Следующим, пятым, этапом электромеханического сопряжения является присоединение головки поперечного мостика к актиновому филаменту к первому из нескольких последовательно расположенных стабильных центров. При этом миозиновая головка поворачивается вокруг своей оси, поскольку имеет несколько активных центров, которые последовательно взаимодействуют с соответствующими центрами на актиновом филаменте. Вращение головки приводит к увеличению упругой эластической тяги шейки поперечного мостика и увеличению напряжения. В каждый конкретный момент в процессе развития сокращения одна часть головок поперечных мостиков находится в соединении с актиновым филаментом, другая свободна, т. е. существует последовательность их взаимодействия с актиновым филаментом. Это обеспечивает плавность процесса сокращения. На четвертом и пятом этапах происходит хемомеханическое преобразование.
Последовательная реакция соединения и разъединения головок поперечных мостиков с актиновым филаментом приводит к скольжению тонких и толстых нитей относительно друг друга и уменьшению размеров саркомера и общей длины мышцы, что является шестым этапом. Совокупность описанных процессов составляет сущность теории скольжения нитей
Первоначально полагали, что ионы Са2+ служат кофактором АТФазной активности миозина. Дальнейшие исследования опровергли это предположение. У покоящейся мышцы актин и миозин практически не обладают АТФазной активностью. Присоединение головки миозина к актину приводит к тому, что головка приобретает АТФазную активность.
Гидролиз АТФ в АТФазном центре головки миозина сопровождается изменением конформации последней и переводом ее в новое, высокоэнергетическое состояние. Повторное присоединение миозиновой головки к новому центру на актиновом филаменте вновь приводит к вращению головки, которое обеспечивается запасенной в ней энергией. В каждом цикле соединения и разъединения головки миозина с актином расщепляется одна молекула АТФ на каждый мостик. Быстрота вращения определяется скоростью расщепления АТФ. Очевидно, что быстрые фазические волокна потребляют значительно больше АТФ в единицу времени и сохраняют меньше химической энергии во время тонической нагрузки, чем медленные волокна. Таким образом, в процессе хемомеханического преобразования АТФ обеспечивает разъединение головки миозина и актинового филамента и энергетику для дальнейшего взаимодействия головки миозина с другим участком актинового филамента. Эти реакции возможны при концентрации кальция выше 106М.
Описанные механизмы укорочения мышечного волокна позволяют предположить, что для расслабления в первую очередь необходимо понижение концентрации ионов Са2+. Экспериментально было доказано, что саркоплазматическая сеть имеет специальный механизм — кальциевый насос, который активно возвращает кальций в цистерны. Активация кальциевого насоса осуществляется неорганическим фосфатом, который образуется при гидролизе АТФ, а энергообеспечение работы кальциевого насоса также за счет энергии, образующейся при гидролизе АТФ. Таким образом, АТФ является вторым важнейшим фактором, абсолютно необходимым для процесса расслабления. Некоторое время после смерти мышцы остаются мягкими вследствие прекращения тонического влияния мотонейронов (см. главу 4). Затем концентрация АТФ снижается ниже критического уровня и возможность разъединения головки миозина с актиновым филаментом исчезает. Возникает явление трупного окоченения с выраженной ригидностью скелетных мышц.
Механизм мышечного сокращения
Все мышцы организма делят на гладкие и поперечнополосатые. Поперечнополосатые мышцы подразделяются на два типа: скелетные мышцы и миокард.
Строение мышечного волокна
Мембрана мышечных клеток, называемая сарколеммой, электровозбудима и способна проводить потенциал действия. Эти процессы в мышечных клетках происходят по тому же принципу, что и в нервных. Потенциал покоя мышечного волокна составляет приблизительно -90 мВ, то есть ниже, чем у нервного волокна (-70 мВ); критическая деполяризация, по достижении которой возникает потенциал действия, такая же, как у нервного волокна. Отсюда: возбудимость мышечного волокна несколько ниже возбудимости нервного, так как мышечную клетку требуется деполяризировать на большую величину.
Ответом мышечного волокна на возбуждение является сокращение. которое совершает сократительный аппарат клетки – миофибриллы. Они представляют собой тяжи, состоящие из двух видов нитей: толстых – миозиновых. и тонких – актиновых. Толстые нити (диаметром 15 нм и длиной 1,5 мкм) имеют в своем составе только один белок – миозин. Тонкие нити (диаметром 7 нм и длиной 1 мкм) содержат три вида белков: актин, тропомиозин и тропонин.
Актин представляет собой длинную белковую нить, которая состоит из отдельных глобулярных белков, сцепленных между собой таким образом, что вся структура представляет собой вытянутую цепь. Молекулы глобулярного актина (G-актина) имеют боковые и концевые центры связывания с другими такими же молекулами. В результате они объединяются таким образом, что образуют структуру, которую часто сравнивают с двумя нитками бус, соединенных вместе. Образованная из молекул G-актина лента закручена в спираль. Такая структура называется фибриллярным актином (F-актином). Шаг спирали (длина витка) составляет 38 нм, на каждый виток спирали приходится 7 пар G-актина. Полимеризация G-актина, то есть образование F-актина, происходит за счет энергии АТФ, и, наоборот, при разрушении F-актина выделяется энергия.
Рис.1. Объединение отдельных глобул G-актина в F-актин
Вдоль спиральных желобков актиновых филаментов располагается белок тропомиозин, Каждая нить тропомиозина, имеющая длину 41 нм, состоит из двух идентичных α-цепей, вместе закрученных в спираль с длиной витка 7 нм. Вдоль одного витка F-актина расположены две молекулы тропомиозина. Каждая тропомиозиновая молекула соединяется, немного перекрываясь, со следующей, в результате тропомиозиновая нить простирается вдоль актина непрерывно.
Рис.2. Строение тонкой нити миофибриллы
В клетках поперечнополосатых мышц в состав тонких нитей кроме актина и тропомиозина входит ещё и белок тропонин. Этот глобулярный белок имеет сложное строение. Он состоит из трех субъединиц, каждая из которых выполняет свою функцию в процессе сокращения.
Толстая нить состоит из большого числа молекул миозина. собранных в пучок. Каждая молекула миозина длиной 155 нм и диаметром 2 нм состоит из шести полипептидных нитей: двух длинных и четырех коротких. Длинные цепи вместе закручены в спираль с шагом 7,5 нм и образуют фибриллярную часть миозиновой молекулы. На одном из концов молекулы эти цепи раскручиваются и образуют раздвоенный конец. Каждый из этих концов образует комплекс двумя короткими цепями, то есть на каждой молекуле имеются две головки. Это глобулярная часть миозиновой молекулы.
Рис.3. Строение молекулы миозина.
В миозине выделяют два фрагмента: легкий меромиозин (ЛММ) и тяжелый меромиозин (ТММ), между ними находится шарнир. ТММ состоит из двух субфрагментов: S1 и S2. ЛММ и субфрагмент S2 вложены в пучок нитей, а субфрагмент S1 выступает над поверхностью. Этот выступающий конец (миозиновая головка) способен связываться с активным центром на актиновой нити и изменять угол наклона к пучку миозиновых нитей. Объединение отдельных молекул миозина в пучок происходит за счет электростатических взаимодействий между ЛММ. Центральная часть нити не имеет головок. Весь комплекс миозиновых молекул простирается на 1,5 мкм. Это одна из самых больших биологических молекулярных структур, известных в природе.
При рассматривании в поляризационный микроскоп продольного среза поперечнополосатой мышцы видны светлые и темные участки. Темные участки (диски) являются анизотропными: в поляризованном свете они выглядят прозрачными в продольном направлении и непрозрачными – в поперечном, обозначаются буквой А. Светлые участки являются изотропными и обозначаются буквой I. Диск I включает в себя только тонкие нити, а диск А – и толстые, и тонкие. В середине диска А видна светлая полоска, называемая Н-зоной. Она не имеет тонких нитей. Диск I разделен тонкой полосой Z, которая представляет собой мембрану, содержащую структурные элементы, скрепляющие между собой концы тонких нитей. Участок между двумя Z-линиями называется саркомером .
Рис.4. Структура миофибриллы (поперечный срез)
Рис.5. Строение поперечнополосатой мышцы (продольный срез)
Каждая толстая нить окружена шестью тонкими, а каждая тонкая нить – тремя толстыми. Таким образом, в поперечном срезе мышечное волокно имеет правильную гексагональную структуру.
При сокращении мышцы длина актиновых и миозиновых филаментов не изменяется. Происходит лишь их смещение относительно друг друга: тонкие нити задвигаются в промежуток между толстыми. При этом длина диска А остается неизменной, а диск I укорачивается, полоска Н почти исчезает. Такое скольжение оказывается возможным благодаря существованию поперечных мостиков (миозиновых головок) между толстыми и тонкими нитями. При сокращении возможно изменение длины саркомера приблизительно от 2,5 до 1,7 мкм.
Миозиновая нить имеет на себе множество головок, которыми она может связываться с актином. Актиновая же нить, в свою очередь, имеет участки (активные центры), к которым могут прикрепляться головки миозина. В покоящейся мышечной клетке эти центры связывания прикрыты молекулами тропомиозина, что препятствует образованию связи между тонкими и толстыми нитями.
Для того чтобы актин и миозин могли взаимодействовать, необходимо присутствие ионов кальция. В покое они находятся в саркоплазматическом ретикулуме. Эта органелла представляет собой мембранные полости, содержащие кальциевый насос, который за счет энергии АТФ транспортирует ионы кальция внутрь саркоплазматического ретикулума. Его внутренняя поверхность содержит белки, способные связывать Ca 2+. что несколько уменьшает разность концентраций этих ионов между цитоплазмой и полостью ретикулума. Распространяющийся по клеточной мембране потенциал действия активирует близко расположенную к поверхности клетки мембрану ретикулума и вызывает выход Ca 2+ в цитоплазму.
Молекула тропонина обладает высоким сродством к кальцию. Под его влиянием она изменяет положение тропомиозиновой нити на актиновой таким образом, что открывается активный центр, ранее прикрытый тропомиозином. К открывшемуся активному центру присоединяется поперечный мостик. Это приводит к взаимодействию актина с миозином. После образования связи миозиновая головка, ранее расположенная под прямым углом к нитям, наклоняется и протаскивает актиновую нить относительно миозиновой приблизительно на 10 нм. Образовавшийся атин-миозиновый комплекс препятствует дальнейшему скольжению нитей относительно друг друга, поэтому необходимо его разъединение. Это возможно только за счет энергии АТФ. Миозин обладает АТФ-азной активностью, то есть способен вызывать гидролиз АТФ. Выделяющаяся при этом энергия разрывает связь между актином и миозином, и миозиновая головка способна взаимодействовать с новым участком молекулы актина. Работа мостиков синхронизирована таким образом, что связывание, наклон и разрыв всех мостиков одной нити происходит одновременно. При расслаблении мышцы активизируется работа кальциевого насоса, что понижает концентрацию Ca 2+ в цитоплазме; следовательно, связи между тонкими и толстыми нитями уже не могут образовываться. В этих условиях при растяжении мышцы нити беспрепятственно скользят относительно друг друга. Однако такая растяжимость возможна только в присутствии АТФ. Если в клетке отсутствует АТФ, то актин-миозиновый комплекс не может разорваться. Нити остаются жестко сцепленными между собой. Это явление наблюдается при трупном окоченении.
Рис.6. Сокращение саркомера: 1 – миозиновая нить; 2 – активный центр; 3 – актиновая нить; 4 – миозиновая головка; 5 — Z-линия.
а) взаимодействие между тонкими и толстыми нитями отсутствует;
б) в присутствии Ca 2+ миозиновая головка связывается с активным центром на актиновой нити;
в) поперечные мостики наклоняются и протаскивают тонкую нить относительно толстой, вследствие чего длина саркомера уменьшается;
г) связи между нитями разрываются за счет энергии АТФ, миозиновые головки готовы взаимодействовать с новыми активными центрами.
Существует два режима сокращения мышцы: изотоническое (изменяется длина волокна, а напряжение остается неизменным) и изометрическое (концы мышцы неподвижно закреплены, вследствие чего изменяется не длина, а напряжение).
Мощность и скорость сокращения мышцы
Важными характеристиками мышцы являются сила и скорость сокращения. Уравнения, выражающие эти характеристики, были эмпирически получены А.Хиллом и впоследствии подтверждены кинетической теорией мышесного сокращения (модель Дещеревского).
Уравнение Хилла. связывающее между собой силу и скорость сокращения мышцы, имеет следующий вид: (P+a)(v+b) = (P +a)b = a(vmax +b). где v – скорость укорочения мышцы; P – мышечная сила или приложенная к ней нагрузка; vmax — максимальная скорость укорочения мышцы; P — сила, развиваемая мышцей в изометрическом режиме сокращения; a,b — константы. Общая мощность. развиваемая мышцей, определяется по формуле: Nобщ = (P+a)v = b(P -P). КПД мышцы сохраняет постоянное значение ( около 40% ) в диапазоне значений силы от 0,2 P до 0,8 P . В процессе сокращения мышцы выделяется некоторое количество теплоты. Эта величина называетсятеплопродукцией. Теплопродукция зависит только от изменения длины мышцы и не зависит от нагрузки. Константы a и b имеют постоянные значения для данной мышцы. Константа а имеет размерность силы, а b – скорости. Константа b в значительной степени зависит от температуры. Константа а находится в диапазоне значений от 0,25 P до 0,4 P . По этим данным оцениваетсямаксимальная скорость сокращения для данной мышцы: vmax = b•( P / a) .
14. Тонкое строение миофибрилл. Белки толстых и тонких филаментов – строение и функции + (сокращение и состав мышцы 15 вопрос)
Механизм мышечных сокращений. Функции и свойства скелетных мышц
Сокращение мышц — это сложный процесс, состоящий из целого ряда этапов. Главными составляющими здесь являются миозин, актин, тропонин, тропомиозин и актомиозин, а также ионы кальция и соединения, которые обеспечивают мышцы энергией. Рассмотрим виды и механизмы мышечного сокращения. Изучим, из каких этапов они состоят и что необходимо для цикличного процесса.
Мышцы объединяются в группы, у которых одинаковый механизм мышечных сокращений. По этому же признаку они и разделяются на 3 вида:
- поперечно-полосатые мышцы тела;
- поперечно-полосатые мышцы предсердий и сердечных желудочков;
- гладкие мышцы органов, сосудов и кожи.
Поперечно-полосатые мышцы входят в опорно-двигательный аппарат, являясь его частью, так как помимо них сюда входят сухожилия, связки, кости. Когда реализуется механизм мышечных сокращений, выполняются следующие задачи и функции:
- тело передвигается;
- части тела перемещаются друг относительно друга;
- тело поддерживается в пространстве;
- вырабатывается тепло;
- кора активируется посредством афферентации с рецептивных мышечных полей.
Из гладких мышц состоит:
- двигательный аппарат внутренних органов, в который входят бронхиальное дерево, легкие и пищеварительная трубка;
- лимфатическая и кровеносная системы;
- система мочеполовых органов.
Физиологические свойства
Как и у всех позвоночных животных, в человеческом организме выделяют три самых важных свойства волокон скелетных мышц:
- сократимость — сокращение и изменение напряжения при возбуждении;
- проводимость — движение потенциала по всему волокну;
- возбудимость — реагирование на раздражитель посредством изменения мембранного потенциала и ионной проницаемости.
Мышцы возбуждаются и начинают сокращаться от нервных импульсов, идущих от центров. Но в искусственных условиях используют электростимуляцию. Мышца тогда может раздражаться напрямую (прямое раздражение) или через нерв, иннервирующий мышцу (непрямое раздражение).
Виды сокращений
Механизм мышечных сокращений подразумевает преобразование химической энергии в механическую работу. Этот процесс можно измерить при эксперименте с лягушкой: ее икроножную мышцу нагружают небольшим весом, а затем раздражают легкими электроимпульсами. Сокращение, при котором мышца становится короче, называется изотоническим. При изометрическом сокращении укорачивания не происходит. Сухожилия не позволяют при развитии мышцей силы укорачиваться. Еще один ауксотонический механизм мышечных сокращений предполагает условия интенсивных нагрузок, когда мышца укорачивается минимальным образом, а сила развивается максимальная.
Структура и иннервация скелетных мышц
В поперечно-полосатые скелетные мышцы входит множество волокон, находящихся в соединительной ткани и крепящихся к сухожилиям. В одних мышцах волокна расположены параллельно длинной оси, а в других они имеют косой вид, прикрепляясь к центральному тяжу сухожильному и к перистому типу.
Главная особенность волокна заключается в саркоплазме массы тонких нитей — миофибрилл. В них входят светлые и темные участки, чередующиеся друг с другом, а у соседних поперечно-полосатые волокна находятся на одном уровне — на поперечном сечении. Благодаря этому получается поперечная полосатость по всему волокну мышц.
Саркомером является комплекс из темного и двух светлых дисков, и он отграничивается Z-образными линиями. Саркомеры — это сократительный аппарат мышцы. Получается, что сократительное мышечное волокно состоит из:
- сократительного аппарата (системы миофибрилл);
- трофического аппарата с митохондриями, комплексом Гольджи и слабой эндоплазматической сетью ;
- мембранного аппарата;
- опорного аппарата;
- нервного аппарата.
Мышечное волокно разделяется на 5 частей со своими структурами и функциями и является целостной частью ткани мышц.
Иннервация
Этот процесс у поперечно-полосатых мышечных волокон реализуется посредством нервных волокон, а именно аксонов мотонейронов спинного мозга и головного ствола. Один мотонейрон иннервирует несколько волокон мышц. Комплекс с мотонейроном и иннервируемыми мышечными волокнами называют нейромоторной (НМЕ), или двигательной единицей (ДЕ). Среднее число волокон, которые иннервирует один мотонейрон, характеризует величину ДЕ мышцы, а обратную величину называют плотностью иннервации. Последняя является большой в тех мышцах, где движения небольшие и «тонкие» (глаза, пальцы, язык). Малое ее значение будет, напротив, в мышцах с «грубыми» движениями (например, туловище).
Иннервация может быть одиночной и множественной. В первом случае она реализуется компактными моторными окончаниями. Обычно это характерно для крупных мотонейронов. Мышечные волокна (называющиеся в этом случае физическими, или быстрыми) генерируют ПД (потенциалы действий), которые распространяются на них.
Множественная иннервация встречается, к примеру, во внешних глазных мышцах. Здесь не генерируется потенциал действия, так как в мембране нет электровозбудимых натриевых каналов. В них распространяется деполяризация по всему волокну из синаптических окончаний. Это необходимо для того, чтобы привести в действие механизм мышечного сокращения. Процесс здесь происходит не так быстро, как в первом случае. Поэтому его называют медленным.
Структура миофибрилл
Исследования мышечного волокна сегодня проводятся на основе рентгеноструктурного анализа, электронной микроскопии, а также гистохимическими методами.
Рассчитано, что в каждую миофибриллу, диаметр которой составляет 1 мкм, входит примерно 2500 протофибрилл, то есть удлиненных полимеризованных молекул белков (актина и миозина). Актиновые протофибриллы в два раза тоньше миозиновых. В покое эти мышцы находятся так, что актиновые нити кончиками проникают в промежутки между миозиновыми протофибриллами.
Узкая светлая полоса в диске А свободна от актиновых нитей. А мембрана Z скрепляет их.
На миозиновых нитях есть поперечные выступы длиной до 20 нм, в головках которых находится порядка 150 молекул миозина. Они отходят биополярно, и каждая головка соединяет миозиновую с актиновой нитью. Когда происходит усилие актиновых центров на нитях миозина, актиновая нить приближается к центру саркомера. В конце миозиновые нити доходят до линии Z. Тогда они занимают собой весь саркомер, а актиновые находятся между ними. При этом длина диска I сокращается, а в конце он исчезает полностью, вместе с чем линия Z становится толще.
Так, по теории скользящих нитей, объясняется сокращение длины волокна мышцы. Теория, получившая название «зубчатого колеса», была разработана Хаксли и Хансоном в середине двадцатого века.
Механизм мышечного сокращения волокна
Главным в теории является то, что не нити (миозиновые и актиновые) укорачиваются. Длина их остается неизменной и при растяжении мышц. Но пучки тонких нитей, проскальзывая, выходят между толстыми нитями, уменьшается степень их перекрытия, таким образом происходит сокращение.
Молекулярный механизм мышечного сокращения посредством скольжения актиновых нитей заключается в следующем. Миозиновые головки соединяют протофибриллу с актиновой. При их наклонах происходит скольжение, двигающее актиновую нить к центру саркомера. За счет биполярной организации миозиновых молекул на обеих сторонах нитей создаются условия для скольжения актиновых нитей в разные стороны.
При расслаблении мышц миозиновая головка отходит от актиновых нитей. Благодаря легкому скольжению расслабленные мышцы растяжению сопротивляются гораздо меньше. Поэтому они пассивно удлиняются.
Этапы сокращения
Механизм мышечного сокращения кратко можно подразделить на следующие этапы:
- Мышечное волокно стимулируется, когда потенциал действия поступает от мотонейронов из синапсов.
- Потенциал действия создается на мембране мышечного волокна, а затем распространяется к миофибриллам.
- Совершается электромеханическое сопряжение, представляющее собой преобразование электрического ПД в механическое скольжение. В этом обязательно участвуют ионы кальция.
Ионы кальция
Для лучшего понимания процесса активации волокна ионами кальция удобно рассмотреть структуру актиновой нити. Длина ее составляет порядка 1 мкм, толщина — от 5 до 7 нм. Это пара закрученных ниток, которые напоминают мономер актина. Примерно через каждые 40 нм здесь находятся сферические тропониновые молекулы, а между цепями — тропомиозиновые.
Когда ионы кальция отсутствуют, то есть миофибриллы расслабляются, длинные тропомиозиновые молекулы блокируют крепление актиновых цепей и мостиков миозина. Но при активизации ионов кальция тропомиозиновые молекулы опускаются глубже, и участки открываются.
Тогда миозиновые мостики прикрепляются к актиновым нитям, а АТФ расщепляется, и сила мышц развивается. Это становится возможным за счет воздействия кальция на тропонин. При этом молекула последнего деформируется, проталкивая тем самым тропомиозин.
Когда мышца расслаблена, в ней на 1 грамм сырого веса содержится больше 1 мкмоль кальция. Соли кальция изолированы и находятся в особых хранилищах. В противном случае мышцы бы все время сокращались.
Хранение кальция происходит следующим образом. На разных участках мембраны клетки мышцы внутри волокна имеются трубки, через которые происходит соединение со средой вне клеток. Это система поперечных трубочек. А перпендикулярно ей находится система продольных, на концах которых — пузырьки (терминальные цистерны), расположенные в непосредственной близости к мембранам поперечной системы. Вместе получается триада. Именно в пузырьках хранится кальций.
Так ПД распространяется внутрь клетки, и происходит электромеханическое сопряжение. Возбуждение проникает в волокно, переходит в продольную систему, высвобождает кальций. Таким образом осуществляется механизм сокращения мышечного волокна.
3 процесса с АТФ
При взаимодействии обеих нитей при наличии ионов кальция немалая роль отводится АТФ. Когда реализуется механизм мышечного сокращения скелетной мышцы, энергия АТФ применяется для:
- работы насоса натрия и калия, который поддерживает постоянную концентрацию ионов;
- этих веществ по разные стороны мембраны;
- скольжения нитей, укорачивающих миофибриллы;
- работы насоса кальция, действующего для расслабления.
АТФ находится в клеточной мембране, нитях миозина и мембранах ретикулума саркоплазматического. Фермент расщепляется и утилизируется миозином.
Потребление АТФ
Известно, что миозиновые головки взаимодействуют с актином и содержат элементы для расщепления АТФ. Последняя активизируется актином и миозином при наличии ионов магния. Поэтому расщепление фермента происходит при прикреплении миозиновой головки к актину. При этом чем больше поперечных мостиков, тем скорость расщепления будет выше.
Механизм АТФ
После завершения движения молекула АФТ обеспечивает энергией для разделения участвующих в реакции миозина и актина. Миозиновые головки разделяются, АТФ расщепляется до фосфата и АДФ. В конце подсоединяется новая АТФ-молекула, и цикл возобновляется. Таковым является механизм мышечного сокращения и расслабления на молекулярном уровне.
Активность поперечных мостиков будет продолжаться лишь до тех пор, пока происходит гидролиз АТФ. При блокировке фермента мостики не станут снова прикрепляться.
С наступлением смерти организма уровень АТФ в клетках падает, и мостики остаются устойчиво прикрепленными к актиновой нити. Так происходит стадия трупного окоченения.
Ресинтез АТФ
Ресинтез возможно реализовать двумя путями.
Посредством ферментативного переноса от креатинфосфата фосфатной группы на АДФ. Так как запасов в клетке креатинфосфата намного больше АТФ, ресинтез реализуется очень быстро. В то же время посредством окисления пировиноградной и молочной кислот ресинтез будет осуществляться медленно.
АТФ и КФ могут исчезнуть полностью, если ресинтез будет нарушен ядами. Тогда и кальциевый насос прекратит работу, вследствие чего мышца необратимо сократится (то есть настанет контрактура). Таким образом, нарушится механизм мышечного сокращения.
Физиология процесса
Подытоживая вышесказанное, отметим, что сокращение волокна мышцы состоит в укорочении миофибрилл в каждом из саркомеров. Нити миозина (толстые) и актина (тонкие) связаны концами в расслабленном состоянии. Но они начинают скользящие движения друг навстречу к другу, когда реализуется механизм мышечного сокращения. Физиология (кратко) объясняет процесс, когда под влиянием миозина выделяется необходимая энергия для преобразования АТФ в АДФ. При этом активность миозина будет реализована лишь при достаточном содержании ионов кальция, накапливающихся в саркоплазматической сети.
Сравнение безрамочных телефонов BLUBOO S1 и Samsung S8 Ранее специалисты BLUBOO провели сравнение своего безрамочного телефона BLUBOO S1 с Xiao Mi Mix и доказали, что BLUBOO S1 является доступной альтерна.
15 симптомов рака, которые женщины чаще всего игнорируют Многие признаки рака похожи на симптомы других заболеваний или состояний, поэтому их часто игнорируют. Обращайте внимание на свое тело. Если вы замети.
Что форма носа может сказать о вашей личности? Многие эксперты считают, что, посмотрев на нос, можно многое сказать о личности человека. Поэтому при первой встрече обратите внимание на нос незнаком.
10 загадочных фотографий, которые шокируют Задолго до появления Интернета и мастеров «Фотошопа» подавляющее большинство сделанных фото были подлинными. Иногда на снимки попадали поистине неверо.
Как питон «пообедал» дикобразом и чем это для него закончилось Велосипедист, ехавший на озеро Эланд, обнаружил огромную змею, явно съевшую что-то очень большое. Питон, судя по внушительным размерам его «живота», п.
Почему вы никогда не видели птенца голубя? Отправьтесь на любую городскую площадь, и, без сомнения, вы увидите сотни голубей, которые летают возле прохожих. Но, несмотря на такое большое количе.
Строение и механизм сокращения скелетных мышц.
3. Механизм мышечного сокращения и расслабления.
Подвижность является характерным свойством всех форм жизни. Направленное движение имеет место при расхождении хромосом в процессе клеточного деления, активном транспорте молекул, перемещении рибосом в ходе белкового синтеза, сокращении и расслаблении мышц. Мышечное сокращение – наиболее совершенная форма биологической подвижности. В основе любого движения, в том числе и мышечного, лежат общие молекулярные механизмы.
У человека различают несколько видов мышечной ткани. Поперечно-полосатая мышечная ткань составляет мышцы скелета (скелетные мышцы, которые мы можем сокращать произвольно). Гладкая мышечная ткань входит в состав мышц внутренних органов: желудочно-кишечного тракта, бронхов, мочевыводящих путей, кровеносных сосудов. Эти мышцы сокращаются непроизвольно, независимо от нашего сознания.
В данной лекции мы рассмотрим строение и процессы сокращения и расслабления скелетных мышц, поскольку именно они представляют наибольший интерес для биохимии спорта.
Механизм мышечного сокращения до настоящего времени раскрыт не полностью.
Достоверно известно следующее.
1. Источником энергии для мышечного сокращения являются молекулы АТФ.
2. Гидролиз АТФ катализируется при мышечном сокращении миозином, обладающим ферментативной активностью.
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов кальция в саркоплазме миоцитов, вызываемое нервным двигательным импульсом.
4. Во время мышечного сокращения между тонкими и толстыми нитями миофибрилл возникают поперечные мостики или спайки.
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
Гипотез объясняющих механизм мышечного сокращения много, но наиболее обоснованной является так называемая гипотеза (теория) «скользящих нитей» или «гребная гипотеза».
В покоящейся мышце тонкие и толстые нити находятся в разъединенном состоянии.
Под воздействием нервного импульса ионы кальция выходят из цистерн саркоплазматической сети и присоединяются к белку тонких нитей – тропонину. Этот белок меняет свою конфигурацию и меняет конфигурацию актина. В результате образуется поперечный мостик между актином тонких нитей и миозином толстых нитей. При этом повышается АТФазная активность миозина. Миозин расщепляет АТФ и за счет выделившейся при этом энергии миозиновая головка подобно шарниру или веслу лодки поворачивается, что приводит к скольжению мышечных нитей навстречу друг другу.
Совершив поворот, мостики между нитями разрываются. АТФазная активность миозина резко снижается. прекращается гидролиз АТФ. Однако при дальнейшем поступлении нервного импульса поперечные мостики вновь образуются, так как процесс, описанный выше, повторяется вновь.
В каждом цикле сокращения расходуется 1 молекула АТФ.
В основе мышечного сокращения лежат два процесса:
спиральное скручивание сократительных белков;
циклически повторяющееся образование и диссоциация комплекса между цепью миозина и актином.
Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва, где выделяется нейрогормон ацетилхолин, функцией которого является передача импульсов. Сначала ацетилхолин взаимодействует с ацетилхолиновыми рецепторами, что приводит к распространению потенциала действия вдоль сарколеммы. Все это вызывает увеличение проницаемости сарколеммы для катионов Na +. которые устремляются внутрь мышечного волокна, нейтрализуя отрицательный заряд на внутренней поверхности сарколеммы. С сарколеммой связаны поперечные трубочки саркоплазматического ретикулума, по которым распространяется волна возбуждения. От трубочек волна возбуждения передается мембранам пузырьков и цистерн, которые оплетают миофибриллы на участках, где происходит взаимодействие актиновых и миозиновых нитей. При передаче сигнала на цистерны саркоплазматического ретикулума, последние начинают освобождать находящийся в них Са 2+. Высвобожденный Са 2+ связывается с Тн-С, что вызывает конформационные сдвиги, передающиеся на тропомиозин и далее на актин. Актин как бы освобождается из комплекса с компонентами тонких филаментов, в котором он находился. Далее актин взаимодействует с миозином, и результатом такого взаимодействия является образование спайки, что делает возможным движение тонких нитей вдоль толстых.
Генерация силы (укорочение) обусловлена характером взаимодействия между миозином и актином. На миозиновом стержне имеется подвижный шарнир, в области которого происходит поворот при связывании глобулярной головки миозина с определенным участком актина. Именно такие повороты, происходящие одновременно в многочисленных участках взаимодействия миозина и актина, являются причиной втягивания актиновых филаментов (тонких нитей) в Н-зону. Здесь они контактируют (при максимальном укорочении) или даже перекрываются друг с другом, как это показано на рисунке.
- http://alexmed.info/2016/06/11/%D1%81%D1%82%D1%80%D0%BE%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BC%D1%8B%D1%88%D1%86%D1%8B-%D0%BC%D0%B5%D1%85%D0%B0%D0%BD%D0%B8%D0%B7%D0%BC-%D0%BC%D1%8B%D1%88%D0%B5%D1%87%D0%BD%D0%BE%D0%B3%D0%BE/
- http://studfiles.net/preview/5920458/page:3/
- http://pravostoriya.ru/mehanizm-myshechnogo-sokrashheniya/