| Название | Изложения нового материала. Объяснение явления испарения с точки зрения мкт |
| Дата конвертации | 30.03.2013 |
| Размер | 36.83 Kb. |
| Тип | Рассказ |
Урок в 8 классе по теме «Испарение и конденсация»Цели урока:
Тип урока: комбинированный. 1. Зависимость скорости испарении от температуры, движения воздуха. План изложения нового материала.
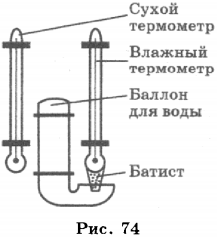
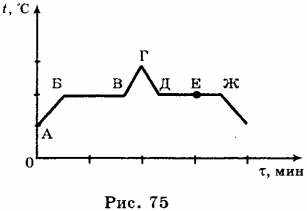
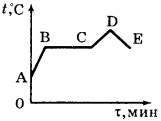
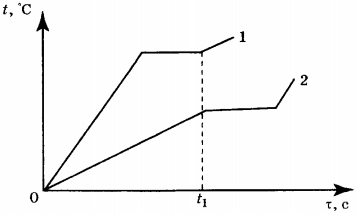
Ход урока 2. Подготовка к усвоению нового материала На столах у вас лежат предметные стеклышки. Подышите на стеклышко. Что вы наблюдается? Как называется наблюдаемое явление? Как и почему можно изменить «картину» на стеклышке? Объявление темы урока: «Испарение и конденсация». Постановка целей и задач урока. 3. Объяснение нового материала. Рассказ о явлении испарения с точки зрения МКТ. Нарисуйте в тетради сосуд, который наполненный жидкостью. Изобразим молекулы этой жидкости в виде шариков, которые расположены довольно плотно друг к другу. Это молекулярная модель жидкости. Изобразите стрелками направления движения некоторых молекул. Каким молекулам легче всего покинуть жидкость? Вывод: поверхностный слой жидкости могут покинуть молекулы находящиеся вблизи поверхности, и которые имеют большую кинетическую энергию равную работе, которую необходимо совершить против сил сцепления, удерживая их внутри жидкости. Признаки явления испарения с помощью видеофильма «Молекулярная физика» Демонстрация — уменьшение количеств вещества при испарении, которое сопровождается понижением температуры испаряющейся жидкости. Вывод: При испарении происходит понижение температуры, т.к. внутренняя энергия испаряющейся жидкости уменьшается. От каких факторов зависит скорость испарения? Демонстрация – зависимость скорости испарения от температуры, движения воздуха с помощью видеофильма «Молекулярная физика» Вывод: Испарение зависит от: а) температуры; Испарение происходит с любой поверхности, в том числе и с поверхности твердого тела. Пример: бельё высыхает и на морозе. Испаряется и нафталин, поэтому мы чувствуем его запах. Этот процесс называют сублимацией. Конденсация — процесс перехода молекул из пара в жидкость. Этот процесс происходит на поверхности жидкости или твердого тела. Конденсация сопровождается выделением энергии. Пример: образование облаков, выпадение росы. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Испарение в природе, технике. а) В естественных условиях испарение является единственным способом передачи влаги с океанов в атмосферу и основной составляющей круговорота воды на земном шаре. Пример: С поверхности земли, ежегодно испаряется 577 000 куб. км воды. С поверхности Мирового океана — 505 000 куб. км; с поверхности рек, озер ….- 74 000 куб. км. Огромное количество воды испаряется растениями. За вегетационный период 1 га пшеницы испаряется около 2 000 куб. м воды. 1 га взрослых лиственных деревьев за лето испаряет до 15 000 куб. м б) в технике применяется испарение как средство для очистки веществ или разделения жидких смесей перегонкой (получение бензина, керосина и т.д.). Процесс испарения лежит в основе двигателей внутреннего сгорания, холодильных установок, а так же для разбрызгивания воды в горячем цеху для охлаждения воздуха, а также в основе всех процессов сушки в сушильных камерах. а) фронтальная беседа по вопросам. 1. Что называют испарением? б) работа в группах 1 группа: В каких случаях понижение температуры при испарении жидкости полезно и что следует сделать, чтобы его ускорить? 2 группа: Когда быстрое испарение вредно, и каким образом его можно замедлить? 3 группа: Почему учителя физкультуры настаивают, чтобы ученики после урока обязательно переодевались? 1 группа: Выйдя в летний жаркий день из реки, вы ощущаете прохладу, это ощущение усиливается в ветреную погоду. Объясните, почему это происходит? 2 группа: Утром на траве появились капельки росы. Какой будет день, холодный или теплый? 3 группа: Какой суп остынет быстрее: жирный или постный? Испарение и конденсация. Кипение жидкости1. Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарения и кипения. Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре. С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар. Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается. Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях. Скорость испарения зависит от температуры жидкости. Иапример, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С. Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости. 2. Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией. Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё. Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным. Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром. Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром. Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся. 3. В воздухе всегда содержится водяной пар, являющийся продуктом испарения воды. Содержание водяного пара в воздухе характеризует его влажность. Абсолютной влажностью воздуха \( (\rho) \) называют массу водяного пара, содержащегося в 1 м 3 воздуха, или плотность водяного пара, содержащегося в воздухе. Если относительная влажность равна 9,41·10 -3 кг/м 3 , то это означает, что в 1 м 3 содержится 9,41·10 -3 кг водяного пара. Для того чтобы судить о степени влажности воздуха, вводят величину, называемую относительной влажностью. Относительной влажностью воздуха \( (\varphi) \) называют величину, равную отношению плотности водяного пара \( (\rho) \) , содержащегося в воздухе (абсолютной влажности), к плотности насыщенного водяного пара \( (\rho_0) \) при этой температуре: Обычно относительную влажность выражают в процентах. При понижении температуры ненасыщенный нар может превратиться в насыщенный. Примером такого превращения является выпадение росы и образование тумана. Так, летним днём при температуре 30 °С плотность водяного пара равна 12,8·10 -3 кг/м 3 . Этот водяной пар является ненасыщенным. При понижении вечером температуры до 15 °С он уже будет насыщенным, и выпадет роса. Температуру, при которой водяной пар, содержащийся в воздухе, становится насыщенным, называют точкой росы. Для измерения влажности воздуха используют прибор, называемый психрометром. Психрометр состоит из двух термометров, один из которых сухой, а другой — влажный (рис. 74). Термометры прикреплены к таблице, в которой по вертикали указана температура, которую показывает сухой термометр, а по горизонтали — разность показаний сухого и влажного термометров. Определив показания термометров, по таблице находят значение относительной влажности воздуха. Например, температура, которую показывает сухой термометр, 20 °С, показание влажного термометра — 15 °С. Разность показаний 5 °С. По таблице находим значение относительной влажности \( \varphi \) = 59%. 4. Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению. Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения. Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает. Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия. На рисунке 75 приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АБ), кипения (БВ), нагревания пара (ВГ), охлаждения пара (ГД), конденсации (ДЕ) и последующего охлаждения (ЕЖ). 5. Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования. Удельной теплотой парообразования \( (L) \) называют величину, равную отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения. Единица удельной теплоты парообразования — \( [L] \) = Дж/кг. Чтобы рассчитать количество теплоты \( Q \) , которое необходимо сообщить веществу массой \( m \) для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования \( (L) \) умножить на массу вещества: \( Q=Lm \) . При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре. ПРИМЕРЫ ЗАДАНИЙ1. Испарение и кипение — два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное 1) только А 2. Испарение и кипение — два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что А. Кипение происходит при определённой температуре, а испарение — при любой температуре. Правильным(-и) является(-ются) утверждение(-я) 1) только А 3. При нагревании вода превращается в пар той же температуры. При этом 1) увеличивается среднее расстояние между молекулами 4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара? 1) изменилась как потенциальная, так и кинетическая энергия молекул пара 5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды? 1) АВ 6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени \( \tau_1 \) ? 1) только в газообразном 7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта? 1) АВ 8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения? 1) 240 Дж 9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см 3 . Во вторник она увеличилась и стала равной 15,4 г/см 3 . Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см 3 ? 1) не выпала ни в понедельник, ни во вторник 10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10 -3 кг/м 3 , а плотность насыщенного пара при этой температуре 30·10 -3 кг/м 3 ? 11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами. ФИЗИЧЕСКИЕ ПОНЯТИЯ ПРИМЕРЫ 12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера. 1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2 13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь. Объясните испарение жидкости с точки зрения мктПарообразование, которое происходит только со свободной поверхности жидкости, граничрщей с газообразной средой или с вакуумом, называется испарением. Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории. Как известно, потенциальная энергия молекул жидкости при увеличении расстояния между ними должна возрастать. Следовательно, чтобы покинуть жидкость, молекула должна выполнить работу за счет уменьшения своей кинетической энергии. Среди хаотически движущихся молекул жидкости в ее поверхностном слое всегда найдутся такие молекулы, которые стремятся еылететь из жидкости. Когда такая молекула выходит за поверхностный слой, то возникает сила, втягивающая молекулу обратно в жидкость (рис. 7.1). Поэтому вылетают из жидкости только те молекулы, у которых кинетическая энергия больше работы, необходимой для преодоления противодействия молекулярных сил в слое толщиной где — радиус молекулярного действия. Покинувшие жидкость молекулы совместно составляют пар над ее поверхностью. Так как из жидкости вылетают молекулы с достаточно большой кинетической энергией, а остаются в ней молекулы с меньшей кинетической энергией, то среднее значение энергии для молекул, остающихся в жидкости, в процессе испарения уменьшается, т. е. жидкость при испарении охлаждается. Этим объясняется ощущение холода при выходе из воды после купанья, охлаждение руки, смоченной эфиром, и т. п. Некоторые молекулы пара при хаотическое движении над поверхностью жидкости залетают обратно в жидкость. Это означает, что наряду с испарением жидкости всегда происходит и конденсация ее паров. Так как молекулы пара, залетающие в жидкость, частично передают свою кинетическую энергию молекулам жидкости, то при этом происходит возрастание Еаост у молекул жидкости, т. е. увеличение внутренней энергии жидкости (нагревание жидкости). Итак, на поверхности жидкости одновременно происходит испарение и конденсация. Когда преобладает процесс испарения, жидкость охлаждается, а когда преобладает конденсация, жидкость нагревается.
Поскольку силы молекулярного взаимодействия зависят от природы молекул, скорость испарения зависит от рода жидкости. Эту зависимость легко обнаружить на опыте. Если в одинаковые открытые сосуды налить равные объемы разных жидкостей, то через некоторое время будет видно, что быстрота испарения этих жидкостей разная. Оказывается, что эфир испаряется быстрее спирта, а спирт — быстрее воды. Опыт показывает, что скорость испарения жидкости зависит от площади ее свободной поверхности. Чем больше эта площадь, тем быстрее испаряется жидкость. (Приведите примеры, подтверждающие эту зависимость, и объясните ее.) Испарение происходит при любой температуре. Поэтому над свободной поверхностью жидкости всегда находится пар этой жидкости. Легко заметить, что с повышением температуры скорость испарения жидкости возрастает. Например, горячая вода испаряется быстрее холодной. Объясняется это тем, что при повышении температуры увеличивается средняя кинетическая энергия молекул жидкости и становится больше таких молекул, которые могут преодолеть противодействие поверхностного слоя жидкости и вылететь за его пределы. Как было отмечено выше, наряду с испарением жидкости всегда происходит и конденсация ее паров, которая уменьшает скорость испарения. При увеличении плотности молекул пара над поверхностью жидкости конденсация пара возрастает и испарение замедляется. Следовательно, чем меньше плотность пара жидкости над ее поверхностью, тем больше скорость испарения. Поэтому откачка паров с поверхности ускоряет ее испарение. Отметим еще, что охлаждение жидкости в процессе ее испарения не всегда заметно. Объясняется это тем, что между жидкостью и окружающими телами существует теплообмен, который компенсирует потери ее энергии, уменьшая охлаждение жидкости. Однако при большой скорости испарения температура жидкости может заметно понизиться. Молекулярно-кинетическая теорияЧитайте также:
|
3.4. Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары window.top.document.title = «3.4. Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары»;
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако превращение газа в жидкость может происходить только при температурах ниже определенной, так называемой критической температуры Tкр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
| Рисунок 3.4.1. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка. |
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (10 6 –10 7 ) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p насыщенного пара определяется по кривой равновесия p(T) для данного вещества.
Давление p насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p(T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p(T) можно определять температуры кипения жидкости при различных давлениях.
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого состояний любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p(T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
| Рисунок 3.4.2. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество. |
Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 10 5 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·10 2 Па. Эта точка используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина (см. §3.2). Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С в твердом состоянии. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Глава 3. Молекулярная физика и термодинамика
Дата добавления: 2014-12-29 ; Просмотров: 525 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Молекулярная физика. Испарение и конденсация.
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Сублимацию, или возгонку, т.е. переход вещества из твердого состояния в газообразное, также называют испарением.
Из повседневных наблюдений известно, что количество любой жидкости (бензина, эфира, воды), находящейся в открытом сосуде, постепенно уменьшается. Жидкость не исчезает бесследно — она превращается в пар. Испарение — это один из видов парообразования. Другой вид — это кипение.
Механизм испарения.
Как происходит испарение? Молекулы любой жидкости находятся в непрерывном и беспорядочном движении, причем, чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии имеет определенную величину. Но у каждой молекулы кинетическая энергия может быть как больше, так и меньше средней. Если вблизи поверхности окажется молекула с кинетической энергией, достаточной для преодоления сил межмолекулярного притяжения, она вылетит из жидкости. То же самое повторится с другой быстрой молекулой, со второй, третьей и т. д. Вылетая наружу, эти молекулы образуют над жидкостью пар. Образование этого пара и есть испарение.
Поглощение энергии при испарении.
Поскольку при испарении из жидкости вылетают более быстрые молекулы, средняя кинетическая энергия оставшихся в жидкости молекул становится все меньше и меньше. Это значит, что внутренняя энергия испаряющейся жидкости уменьшается. Поэтому если нет притока энергии к жидкости извне, температура испаряющейся жидкости понижается, жидкость охлаждается (именно поэтому, в частности, человеку в мокрой одежде холоднее, чем в сухой, особенно при ветре).
Однако при испарении воды, налитой в стакан, мы не замечаем понижения ее температуры. Чем это объяснить? Дело в том, что испарение в данном случае происходит медленно, и температура воды поддерживается постоянной за счет теплообмена с окружающим воздухом, из которого в жидкость поступает необходимое количество теплоты. Значит, чтобы испарение жидкости про исходило без изменения ее температуры, жидкости необходимо сообщать энергию.
Количество теплоты, которое необходимо сообщить жидкости для образования единицы массы пара при постоянной температуре, называется теплотой парообразования.
Скорость испарения жидкости.
В отличие от кипения, испарение происходит при любой температуре, однако с повышением температуры жидкости скорость испарения возрастает. Чем выше температура жидкости, тем больше быстро движущихся молекул имеет достаточную кинетическую энергию, чтобы преодолеть силы притяжения соседних частиц и вылететь за пределы жидкости, и тем быстрее идет испарение.
Скорость испарения зависит от рода жидкости. Быстро испаряются летучие жидкости, у которых силы межмолекулярного взаимодействия малы (например, эфир, спирт, бензин). Если капнуть такой жидкостью на руку, мы ощутим холод. Испаряясь с поверхности руки, такая жидкость будет охлаждаться и отбирать у нее некоторое количество теплоты.
Скорость испарения жидкости зависит от площади ее свободной поверхности. Это объясняется тем, что жидкость испаряется с поверхности, и чем больше площадь свободной поверхности жидкости, тем большее количество молекул одновременно вылетает в воздух.
В открытом сосуде масса жидкости вследствие испарения постепенно уменьшается. Это связано с тем, что большинство молекул пара рассеивается в воздухе, не возвращаясь в жидкость (в отличие от того, что происходит в закрытом сосуде). Но небольшая часть их возвращается в жидкость, замедляя тем самым испарение. Поэтому при ветре, который уносит молекулы пара, испарение жидкости происходит быстрее.
Применение испарения в технике.
Испарение играет важную роль в энергетике, холодильной технике, в процессах сушки, испарительного охлаждения. Например, в космической технике быстроиспаряющимися веществами покрывают спускаемые аппараты. При прохождении через атмосферу планеты корпус аппарата в результате трения нагревается, и покрывающее его вещество начинает испаряться. Испаряясь, оно охлаждает космический аппарат, спасая его тем самым от перегрева.
Конденсация.
Конденсация (от лат. condensatio — уплотнение, сгущение) — переход вещества из газообразного состояния (пара) в жидкое или твердое состояние.
Известно, что при наличии ветра жидкость испаряется быстрее. Почему? Дело в том, что одновременно с испарением с поверхности жидкости идет и конденсация. Конденсация происходит из-за того, что часть молекул пара, беспорядочно перемещаясь над жидкостью, снова возвращается в нее. Ветер же выносит вылетевшие из жидкости молекулы и не дает им возвращаться.
Конденсация может происходить и тогда, когда пар не соприкасается с жидкостью. Именно конденсацией объясняется, например, образование облаков: молекулы водяного пара, поднимающиеся над землей, в более холодных слоях атмосферы группируются в мельчайшие капельки воды, скопления которых и представляют собой облака. Следствием конденсации водяного пара в атмосфере являются также дождь и роса.
При испарении жидкость охлаждается и, став более холодной, чем окружающая среда, начинает поглощать ее энергию. При конденсации же, наоборот, происходит выделение некоторого количества теплоты в окружающую среду, и ее температура несколько повышается. Количество теплоты, выделяющееся при конденсации единицы массы, равно теплоте испарения.
Билет № 6. Испарение и конденсация. Объяснение явления испарения на основе представлений о молекулярном строении вещества
Испарение и конденсация. Объяснение явления испарения на основе представлений о молекулярном строении вещества. Удельная теплота парообразования. Ее единицы.
Явление превращения жидкости в пар называется парообразованием.
Испарение-процесс парообразования, происходящий с открытой поверхности.
Молекулы жидкости движутся с разными скоростями. Если какая-нибудь молекула окажется у поверхности жидкости, она может преодолеть притяжение соседних молекул и вылететь из жидкости. Вылетевшие молекулы образуют пар. У оставшихся молекул жидкости при соударении меняются скорости. Некоторые молекулы при этом приобретают скорость, достаточную для того, чтобы вылететь из жидкости. Этот процесс продолжается, поэтому жидкости испаряются медленно.
*Скорость испарения зависит от рода жидкости. Быстрее испаряются те жидкости, у которых молекул притягиваются с меньшей силой..
*Испарение может происходить при любой температуре. Но при высоких температурах испарение происходит быстрее.
*Скорость испарения зависит от площади ее поверхности.
*При ветре (потоке воздуха) испарение происходит быстрее.
При испарении внутренняя энергия уменьшается, т.к. при испарении жидкость покидают быстрые молекулы, следовательно, средняя скорость остальных молекул уменьшается. Значит, что если нет притока энергии из вне, то температура жидкости уменьшается.
Явление превращения пара в жидкость называется конденсацией. Она сопровождается выделением энергии.
Конденсацией пара объясняется образование облаков. Пары воды, поднимающиеся над землей, образуют в верхних холодных слоях воздуха облака, которые состоят из мельчайших капель воды.
Удельная теплота парообразования – физ. величина, показывающая какое кол-во теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Уд. теплоту парообразования обозначают буквой L и измеряется в Дж/кг
Уд. теплоту парообразования воды:L=2,3×10 6 Дж/кг, спирт L=0,9×10 6
Кол-во теплоты, необходимое для превращения жидкости в пар: Q = Lm
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 7964 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
План изложения нового материала. Объяснение явления испарения с точки зрения мкт
Тема урока: «Испарение и конденсация ВОДЫ»
Вода у тебя нет ни вкуса, ни цвета,
Ни запаха, тебя невозможно описать,
Тобой наслаждаются, не ведая, что ты такое.
Нельзя сказать, что ты необходима для жизни:
Антуан де Сент — Экзюпери
1. Дидактические – создать условия для усвоения нового материала по данной теме, используя элементы проблемного обучения.
2. Образовательные – дать учащимся знания об особенностях физических процессов перехода вещества из жидкого состояния в газообразное состояние и наоборот, научить школьников понимать микромеханизм этих явлений, объяснить эти процессы с точки зрения молекулярно кинетической теории;
3. Развивающие – формировать представление о процессе научного познания развитие логического мышления, отработка практических навыков в понимании законов физики; способствовать развитию познавательного интереса школьников.
4. Воспитательные – сформировать умения применять полученные знания при оказании первой медицинской помощи в экстренных ситуациях.
— рисунки, на которых представлены три агрегатных состояния воды в природе;
Тип урока: комбинированный.
План изложения нового материала .
1. Объяснение явления испарения с точки зрения МКТ.
2. Испарение как физическое явление, его признаки.
3. Факторы, влияющие на скорость испарения.
5. Насыщенный пар.
6. Испарение в природе, технике.
Подготовка к усвоению нового материала
Актуализация опорных знаний
Освоение нового материала
Первичная проверка полученных знаний
Подведение итогов урока (рефлексия)
2. Подготовка к усвоению нового материала
Учитель: На столах у вас лежат предметные стеклышки. Подышите на стеклышко. Что вы наблюдается? Как называется наблюдаемое явление? Как и почему можно изменить «картину» на стеклышке?
Объявление темы урока: «Испарение и конденсация». Постановка целей и задач урока.
3. Объяснение нового материала.
Рассказ о явлении испарения с точки зрения МКТ.
Учитель: Нарисуйте в тетради сосуд, который наполненный жидкостью. Изобразим молекулы этой жидкости в виде шариков, которые расположены довольно плотно друг к другу. Это молекулярная модель жидкости. Изобразите стрелками направления движения некоторых молекул. Каким молекулам легче всего покинуть жидкость?
Вывод: поверхностный слой жидкости могут покинуть молекулы находящиеся вблизи поверхности, и которые имеют большую кинетическую энергию равную работе, которую необходимо совершить против сил сцепления, удерживая их внутри жидкости.
Применение здоровьесберегающих технологий при изучении темы «Испарение»:
Эти знания можно применить при оказании первой медицинской помощи, если мама на работе, а у братика или сестренки поднялась высокая температура, то вы должны сделать следующее:
до прихода врача уложить больного в постель и заставить его раздеться;
взять мягкую тряпочку, воду (капнуть в нее несколько капель уксуса или спирта);
тряпочку намочить в воде, немного отжать и обтереть больного, укрывать не надо, можно немного помахать над ним полотенцем, тогда испарение пойдет быстрее и температура тела понизится;
Если будет необходимость, эту процедуру можно повторить.
От каких факторов зависит скорость испарения?
б) площади поверхности жидкости;
в) рода жидкости;
г) от скорости удаления паров с поверхности жидкости.
Конденсация — процесс перехода молекул из пара в жидкость.
Этот процесс происходит на поверхности жидкости или твердого тела.
Конденсация сопровождается выделением энергии. Пример: образование облаков, выпадение росы.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром.
Испарение в природе, технике.
а) В естественных условиях испарение является единственным способом передачи влаги с океанов в атмосферу и основной составляющей круговорота воды на земном шаре.
Пример: С поверхности земли, ежегодно испаряется 577 000 куб. км воды.
С поверхности Мирового океана — 505 000 куб. км; с поверхности рек, озер ….- 74 000 куб. км.
Огромное количество воды испаряется растениями. За вегетационный период 1 га пшеницы испаряется около 2 000 куб. м воды. 1 га взрослых лиственных деревьев за лето испаряет до 15 000 куб. м
б) в технике применяется испарение как средство для очистки веществ или разделения жидких смесей перегонкой (получение бензина, керосина и т.д.).
Процесс испарения лежит в основе двигателей внутреннего сгорания, холодильных установок, а так же для разбрызгивания воды в горячем цеху для охлаждения воздуха, а также в основе всех процессов сушки в сушильных камерах.
а) фронтальная беседа по вопросам.
1. Что называют испарением?
2. От чего зависит интенсивность испарения?
3. Что называют конденсацией?
б) работа в группах
1 группа: В каких случаях понижение температуры при испарении жидкости полезно и что следует сделать, чтобы его ускорить?
2 группа: Когда быстрое испарение вредно, и каким образом его можно замедлить?
3 группа: Почему учителя физкультуры настаивают, чтобы ученики после урока обязательно переодевались?
1 группа: Выйдя в летний жаркий день из реки, вы ощущаете прохладу, это ощущение усиливается в ветреную погоду. Объясните, почему это происходит?
2 группа: Утром на траве появились капельки росы. Какой будет день, холодный или теплый?
3 группа: Какой суп остынет быстрее: жирный или постный?
1. Что в руках не удержать? (вода).
2. Не снег и не лёд, а серебром деревья уберёт? (иней).
3. День и ночь кричит, а голос не устаёт? (водопад).
4. Я вода да по воде же плаваю? (лёд).
Физические свойства воды:
1. Температура кипения — …
2. Температура плавления — …
3. Плотность воды при температуре 4 градуса- …
4. Температура плавления льда -…
6. Рефлексия. Итог урока.
Учащимся розданы карточки для оценки своей деятельности на уроке. ( Молекула на дне – учащийся не понял тему, на поверхности – частично понял, покинула жидкость – хорошо понял тему)
7. Домашнее задание.
§ 15. Напишите короткий, не более двух тетрадных страниц (и желательно веселый), рассказ — загадку, в основе которого лежали бы явления испарения и конденсации.
Перышкин, А.В., Физика: Учеб. для 8 кл. сред. шк. – 10-е изд., перераб. – М.: Дрофа, 2004. – 175 с.: ил.
Физика: Методические материалы 8 кл. М.: Илекса, 2003
Малафеев, Р.И. Проблемное обучение физике в средней школе: Кн. для учителя. – 2-е изд., дораб. – М.: Просвещение, 1993. – 192 с. – ISBN 5-09-001844-8.
Кирик, Л.А. Физика-8. Методические материалы. М.: Илекса, 2003 – 288 с.
Журнал «Последний звонок» 2006 №12 стр. 3-5
- http://fizi4ka.ru/ogje-2018-po-fizike/isparenie-i-kondensacija-kipenie-zhidkosti.html
- http://lib.sernam.ru/book_t_phis.php?id=57
- http://studopedia.su/14_165130_molekulyarno-kineticheskaya-teoriya.html
- http://www.calc.ru/Molekulyarnaya-Fizika-Ispareniye-I-Kondensatsiya.html
- http://studopedia.ru/8_97003_bilet--.html
- http://uchebana5.ru/cont/3765989.html