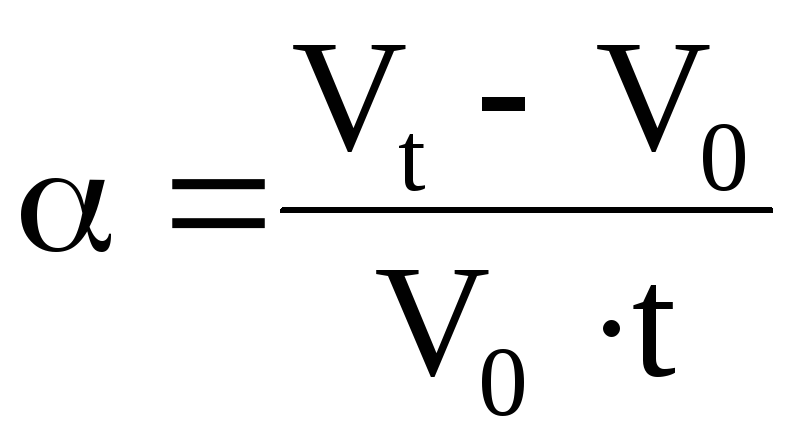Изопроцессы. Газовые законы
Изопроцессами называют термодинамические процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров состояния системы.
1 ˚ Изотермический процесс.
Р.Бойль (англ.), Э. Мариотт (фр.), ХХVII в.
Произведение pV = const для данного количества газа при постоянной температуре.
Объяснение закона Бойля-Мариотта с точки зрения МКТ.
Давление — это обобщенная, усредненная действие молекул (атомов, частиц) на стены. При уменьшении объема в несколько раз во столько же раз увеличивается число молекул в единице объема (концентрация), а значит и число ударов молекул в стенки за единицу времени. Последнее ведет к росту давления.
2 ˚ Изохорный процесс.
Ж. Шарль (фр.), 1787 год.
Давление определенной массы газа при нагревании на 1 ˚ С при постоянном объеме увеличивается на 1/273 часть его давления при 0 ˚ С.
где α = (p — p0) / p0t = 1/273 (K-1) — температурный коэффициент давления.
Tt = T — 273, р = р0 (1 + αt) = р0 + р0 α (T — 273) = p0αT.
Поэтому р = p0αT или р / Т = const при неизменной массе идеального газа.
Объяснение закона Шарля на основе МКТ.
Согласно основным положениям МКТ при росте температуры идеального газа растет средняя скорость движения молекул (атомов, частиц), а потому возрастает частота соприкосновения со стенками сосуда. Это вызывает рост давления молекул на стенки.
3 ˚ Изобарный процесс.
Ж. Гей-Люссак (фр.), 1802 год.
Увеличение температуры газа на 1 ˚ С при постоянном давлении увеличивает его объем на 1/273 часть того объема, который занимает газ при 0 ˚ С.
где β = (V — V0) / V0t — температурный коэффициент объемного расширения газа.
Учитывая, что t = T — 273, закон Гей-Люссака можно представить в следующем виде:
V = V0βt, V / T = const, при неизменной массе идеального газа.
Объяснение закона Гей-Люссака на основе МКТ.
Согласно основным положениям МКТ при росте температуры идеального газа растет средняя скорость движения молекул (атомов, частиц), а потому растет среднее расстояние между молекулами, и вызывает рост объема, который занимает идеальный газ.
Объединенный газовый закон.
Законы Бойля-Мариотта, Шарля и Гей-Люссака, установленные экспериментально, объединяются в одну формулу, которую называют объединенным газовым законом.
Для данной массы идеального газа (m = const) в ходе произвольного равновесного термодинамического процесса величина pV / T остается постоянной:
Если в ходе данного процесса масса газа меняется, то объединенный газовый закон приобретает следующий вид:
Уравнением состояния идеального газа называют соотношение, которое связывает между собой параметры идеального газа в равновесном состоянии: f (p, V, T, m) = 0.
Экспериментально установлено уравнение
называют уравнением состояния или уравнением Клапейрона-Менделеева.
В последнем уравнении R = 8,31 Дж / (моль • К) называют универсальной газовой постоянной, а число ν = m / μ указывает на количество молей вещества, для которых записано уравнение состояния и коре находятся в состоянии термодинамического равновесия.
Объяснение закона бойля мариотта с точки зрения мкт
Автор работы награжден дипломом победителя II степени
1. Введение. ( Введение должно включать в себяформулировку постановки проблемы, отражение актуальности темы, определение целей и задач, поставленных перед исполнителем работы,краткий обзор используемой литературы и источников,степень изученности данного вопроса,характеристику личного вклада автора работы в решение избранной проблемы. )
Исследовать с помощью оборудования лаборатории L -микро изотермический, изохорный и изобарный процессы реального газа (воздуха).
Выяснить, что разряжённые газы с большой степенью точности подчиняются законам идеального газа.
Измерить в ходе работы температурные коэффициенты объёмного расширения и давления газа и сравнить экспериментальные значения с теоретическими.
Убедиться в том, что газовая шкала температур позволяет измерять температуры вне зависимости от рабочего вещества.
2. Основная часть. (Основная часть должна содержать информацию, собранную и обработанную исследователем.)
Теоретическая часть. Изотермический процесс.
Под вакуумную тарелку насоса поместим надутый до размеров яблока воздушный шарик. Откачивая воздух из-под купола насоса, обнаружим увеличение размеров шарика в несколько раз. Процесс откачивания воздуха сопровождается охлаждением воздуха под куполом и внутри шарика. Объём, давление и температура воздуха в шарике изменяются.
Уравнение, определяющее связь температуры, объёма и давления тел, называют уравнением состояния.
1. Определение равновесных и неравновесных процессов.
При медленном протекании процесса в любой момент времени успевает устанавливаться новое состояние равновесия с новыми значениями давления и объёма. Такие медленные процессы называют равновесными. Если после медленного сжатия проводить процесс в обратном направлении, т.е. предоставить газу возможность медленно расширяться, то он пройдёт через ту же последовательность равновесных состояний, что и при сжатии. По этой причине равновесные процессы называются обратимыми.
2. Закон Бойля-Мариотта.
Первый газовый закон был открыт английским учёным Робертом Бойлем в 1662 году и опубликован во втором издании его книги «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменения давления газа в зависимости от объёма при постоянной температуре. Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим (от греческих слов isos – равный, therme – тепло). Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении опыта.
Бойль наблюдал за изменением объёма воздуха, запертого в длинной изогнутой трубке столбом ртути. Вначале уровни ртути в обоих коленах трубки были одинаковыми, и давление воздуха было равно атмосферному, т.е. 760 мм ртутного столба. Доливая ртуть в длинное колено трубки, Бойль заметил, что объём воздуха уменьшился вдвое, когда разность уровней в обоих коленах оказалась равной 760 мм, и, следовательно, давление увеличилось вдвое. Это навело Бойля на мысль о том, что объём данной массы газа и его давление находятся в обратно пропорциональной зависимости. В 1667 году независимо от Бойля этот же закон установил французский физик Эдм Мариотт (1620-1684). Он проделал аналогичные опыты и в 1679 г. описал их в своей работе «Речи о природе воздуха». Поэтому закон, связывающий давление газа и его объём, называется законом Бойля-Мариотта. Согласно этому закону давление данной массы (или количества) газа при постоянной температуре обратно пропорционально объёму газа: p
Герметичный гофрированный сосуд соединён с манометром, регистрирующим давление внутри сосуда. Вращением винта можно изменять объём сосуда. Об объёме можно судить с помощью линейки. Меняя объём и измеряя давление, можно заметить, что выполняется уравнение P * V = const при t = const . Произведение давления данной массы газа на его объём постоянно, если температура не меняется.
Опыт №3. «Экспериментальное определение зависимости давления газа от объёма при постоянной температуре».
Запустить программу L -физика. Выбрать раздел «Газовые законы и свойства насыщенных паров», а в нём – эксперимент «Изотермический процесс». Медленно вращая рукоятку винта, сжимаем газ и переводим поршень в другое предельное положение. Кривые и цифровые индикаторы на экране при этом показывают изменение давления и объёма газа от занимаемого им объёма. На экране монитора учащиеся видят гиперболу.
На втором экране те же самые полученные в эксперименте точки перестраиваются в координатах (1/ V , P ). Для изотермического процесса зависимость 1/ V от Р представляет собой линейную функцию.[3]
Таблица 1. Характеристики изотермического процесса [2]
Связь между другими параметрами
С точки зрения МКТ
(закон Бойля- Мариотта)
P * V = const или
Давление газа зависит
от числа ударов молекул о стенки сосуда.
Число ударов прямо пропорционально концентрации:
Исследовательская часть. Изотермический процесс.
Под вакуумную тарелку насоса поместили надутый до размеров яблока воздушный шарик. Откачивая воздух из-под купола насоса, обнаружили увеличение размеров шарика в несколько раз. Объём, давление и температура воздуха в шарике изменились.
В молекулярно-кинетической теории модель «идеальный газ» удовлетворяет следующим требованиям:
объём всех молекул газа много меньше объёма сосуда;
силами притяжения между молекулами пренебрегают;
молекулы взаимодействуют только при соударении (удар упругий), при этом действуют силы отталкивания;
время столкновения много меньше времени между столкновениями.
Первый газовый закон был открыт английским учёным Робертом Бойлем в 1662 году и опубликован во втором издании его книги «Новые эксперименты, касающиеся воздушной пружины».
Бойль изучал изменения давления газа в зависимости от объёма при постоянной температуре. Мы также исследовали этот процесс.
С помощью программы L-микро был исследован изотермический процесс.
Медленно вращая рукоятку винта, сжимали газ, при этом температура газа оставалась равной температуре окружающей среды.
На первом экране был получен график зависимости P = P ( V ) при T = const , представляющий собой гиперболу,
то есть pV = const
График зелёного цвета описывает состояния воздуха в изотермическом процессе.
График красного цвета описывает состояния идеального газа.
Экспериментально доказано, что состояния разрежённых реальных газов можно описывать с помощью модели идеального газа.
На втором экране те же самые полученные в эксперименте точки были перестроены в координатах (1/V, P).
Для изотермического процесса зависимость Р= P (1/ V ) представляет собой линейную функцию.
Экспериментально доказали, что закон Бойля-Мариотта выполняется с большой степенью точности.
Теоретическая часть. Изобарный процесс. Закон Гей-Люссака.
Сообщение об открытии закона, определяющего зависимость объёма газа от температуры при постоянном давлении (и неизменной массе), установленного французским учёным Гей-Люссаком, было опубликовано лишь в 1802 году. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческих слов: isos – равный и baros – тяжесть, вес). Исследуемый газ находится в стеклянном баллончике, соединённом с длинной стеклянной трубкой. Газ заперт небольшой капелькой ртути в трубке. Так как трубка расположена горизонтально, то давление в баллончике всё время остаётся равным атмосферному. Температура газа увеличивается от 0 до 100 о С. За изменением объёма можно следить по перемещению капельки ртути. Гей-Люссак измерял объём газа в интервале температур от 0 до 100 о С. При исследовании различных газов он получил для них следующие значения температурного коэффициента объёмного расширения = (V – V0 )/V0 · t:
Таблица 1. Температурный коэффициент объемного расширения газов.
Газ
Температурный коэффициент объёмного расширения, 1/ о С
Анализ полученных результатов позволил Гей-Люссаку сделать следующие выводы:
все газы и пары одинаково расширяются при одном и том же повышении температуры;
для всех газов увеличение объёма в интервале температур от температуры таяния льда до температуры кипения воды равно 100/26666 первоначального объёма.
Таким образом, на основании наблюдений Гей-Люссак установил закон: относительное изменение объёма газа данной массы при постоянном давлении прямо пропорционально изменению температуры t. (V – V)/V = at, где a – температурный коэффициент объёмного расширения, численно равный относительному изменению объёма газа при изменении его температуры на 1 градус. Опыт показывает, что при малых плотностях коэффициент объёмного расширения одинаков для всех газов: a = 1/273 1/ о C. С точки зрения МКТ этот факт объясняется тем, что молекулы газа находятся в среднем на больших расстояниях друг от друга, и особенности межмолекулярных сил для различных газов в этих условиях не сказываются. Закон можно записать в виде: V = V(1 + t). Объём данной массы газа при постоянном давлении меняется линейно при изменении температуры. [4]
Опыт №4 «Экспериментальное определение зависимости объёма газа от температуры при постоянном давлении. Определение температурного коэффициента объёмного расширения газа» [3]
Запустить программу L-физика. Выбрать раздел «Газовые законы и свойства насыщенных паров», а в нём – эксперимент «Изобарный процесс». Поместить гофрированный полиэтиленовый резервуар в горячую воду (t = 70 о C), извлечь и подождать 2 минуты. Измерения проводить в течение 10-15 минут. На первом экране будет получена зависимость
V = V(t). Аппроксимировать экспериментальные результаты в виде прямой, уравнение прямой имеет вид: У= к Х + b, где к = V, b = Vo. На основе данных эксперимента получить значение температурного коэффициента объёмного расширения газа и сравнить его с теоретическим значением(1/273 = 0,0037)
4. Введение понятия идеального газа.
Если продолжить изобару в область низких температур, где измерения не проводились, то прямая пересекает ось температуры в точке, соответствующей объёму, равному нулю. Но, это не означает, что объём газа действительно обращается в ноль. Ведь все газы при сильном охлаждении превращаются в жидкости, а к жидкостям ни закон Бойля – Мариотта, ни закон Гей-Люссака не применимы. Реальные газы подчиняются основным газовым законам лишь приближённо и тем менее точно, чем больше плотность газа и ниже его температура. Газ, который в точности подчиняется газовым законам, называют идеальным.
В молекулярно-кинетической теории модель «идеальный газ» удовлетворяет следующим требованиям:
объём всех молекул газа много меньше объёма сосуда;
силы притяжения между молекулами малы, и ими пренебрегают;
молекулы взаимодействуют только при соударении (удар упругий), при этом действуют силы отталкивания;
время столкновения много меньше времени между столкновениями.
5. Введение понятия газовой шкалы температур.
Тот факт, что численное значение температурного коэффициента объёмного расширения в предельном случае малых плотностей одинаково для всех газов, позволяет установить температурную шкалу, не зависящую от вещества, – идеальную газовую шкалу температур.
Приняв за основу шкалу Цельсия, можно определить температуру из соотношения: t = (V – V)/ V, где V – объём газа при 0 о С, а V – его объём при температуре t. Так осуществляется определение температуры, не зависящее от вещества термометра.
6. Ввести понятие абсолютной температуры.
Предельную температуру, при которой объём идеального газа становится равным нулю, принимают за абсолютный нуль температуры. Найдём значение абсолютного нуля по шкале Цельсия. Приравнивая объём V к нулю и учитывая, что = 1/273 1/ о С, получим: 0 = V(1 + 1/273t). Отсюда абсолютный нуль температуры равен: t = – 273 о C. Это предельная, самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказал Ломоносов.
Английский учёный Уильям Кельвин ввёл абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, и единица температуры по этой шкале равна градусу по шкале Цельсия, поэтому абсолютная температура Т связана с температурой по шкале Цельсия формулой: Т = t + 273 о , причём 1 о С = 1К. С точки зрения МКТ при Т = 0К тепловое движение молекул прекращается.
Применяя шкалу Кельвина, закон Гей-Люссака можно записать в более простой форме: 1 + t = 1 + 1/273(T – 273) = T . Тогда V = V T.
Объём газа данной массы при постоянном давлении прямо пропорционален абсолютной температуре.
Отсюда следует, что отношение объёмов газа одной и той же массы в различных состояниях при постоянном давлении равно отношению абсолютных температур: V1/V2 = T1/T2.[1]
7. Результаты эксперимента позволят продолжить работу с таблицей. [2]
Таблица 2. Характеристики изобарного процесса
Постоянный параметр
Название изопроцесса
Связь между другими параметрами
Объяснение связи Между параметрами с точки зрения МКТ
Графики изопроцесса
Р = const
При m = cost.
Изобарный процесс (закон Гей-Люссака, 1802 год).
Рост температуры означает увеличение средней кинетической энергии теплового движения молекул газа. Чтобы поддерживать давление постоянным, необходимо не допустить увеличения числа ударов о единицу площади поверхности стенки
Авогадро в 1811 году высказал смелую гипотезу: в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
В настоящее время гипотеза Ампера строго доказана и носит название закона Авогадро. Согласно закону Авогадро различные газы, взятые в количестве 1 моль, имеют одинаковые объёмы при одинаковых давлениях и температурах, так как число молекул в них одинаковое. При нормальных условиях, т.е. при температуре 0 o С и атмосферном давлении 101325 Па, этот объём, как показывают измерения, равен Vµ = 0,0224 м 3 /моль = 22,4 л/моль. Объём Vµ называют молярным.
9. Закон Дальтона
Давление, которое имел бы каждый из газов, составляющих смесь, если удалить из сосуда остальные газы, называют парциальным (т.е. частным) давлением.
Английский химик Дальтон установил, что для достаточно разряжённых газов давление смеси газов p равно сумме парциальных давлений всех газов p1, p2, p3 … : p = p1 + p2 + p3
С точки зрения МКТ закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает давление на стенки сосуда независимо от присутствия других газов.
10. Уравнение состояния идеального газа
Используя законы Бойля – Мариотта и Гей-Люссака, можно получить уравнение, связывающее все три параметра p, V и T, то есть уравнение состояния идеального газа:
Итак, произведение давления данной массы газа на его объём, делённое на абсолютную температуру, есть величина постоянная, не зависящая от состояния, в котором находится газ: PV/T=const (Уравнение Клапейрона).
11. Опыт № 2.Экспериментальная проверка уравнения состояния идеального газа. [3]
Запустить программу L-физика, выбрать эксперимент «Уравнение состояния идеального газа», использовать установку для демонстрации изотермического процесса. Сосуды с водой различной температуры готовятся заранее. Резервуар с газом попеременно погружается в сосуд с горячей или холодной водой. В целях оптимизации эксперимента следует сначала записать параметры газа в 2-3 состояниях при одном значении температуры, затем при другом. На экране данные представляются в координатах (T, PV). Из уравнения состояния идеального газа следует, что произведение PV прямо пропорционально абсолютной температуре газа T. Именно это и демонстрируется при нажатии кнопки «прямая».
12.Универсальная газовая постоянная [1]
Возьмём газ в количестве 1 моль. При нормальных условиях Vµ = 0,0224м 3 /моль. Следовательно, для моля любого газа pV/T = 8,31 Дж/(моль·К). Таким образом, для одного моля газа произведение давления на объём, отнесённое к абсолютной температуре, является постоянной величиной для всех газов. Эту постоянную величину называют универсальной газовой постоянной и обозначают буквой R : R = 8, 31 Дж/(моль·К).
13. Уравнение Менделеева – Клапейрона
Для 1 моль идеального газа p · Vµ = RT. Если взять газ в количестве молей v = m/M, где m – масса газа, а М – его молярная масса, то объём этого количества вещества при тех же значениях давления и температуры равен V = vVµ. Умножим обе части уравнения состояния для 1 моля газа на v и получим уравнение состояния идеального газа, то есть уравнение Менделеева – Клапейрона: pV = (m/M)RT. Единственная величина в уравнении состояния, зависящая от рода газа, это его молярная масса.
Исследовательская часть. Изобарный процесс. Закон Гей-Люссака.
С помощью программы L-микро был исследован изобарный процесс.
Поместили гофрированный полиэтиленовый резервуар в горячую воду (t = 70оC). После извлечения измерения проводили в течение 15 минут.
На первом экране получили зависимость V = V(t). Аппроксимировали экспериментальные результаты в виде прямой, уравнение которой имеет вид: V= к t + b, где к = α Vо, b = Vo.
На основе данных эксперимента получили значение температурного коэффициента объёмного расширения газа.
α э V0 = 1,76 см 3/K
α э = 1,76/427 1/ K = 0,00412 1/ K = 0,004 1/ K
Экспериментальное значение температурного коэффициента объёмного расширения совпало
с теоретическим значением :
Понятие газовой шкалы температур
Тот факт, что численное значение температурного коэффициента объёмного расширения одинаково для всех разрежённых газов, позволяет установить температурную шкалу, не зависящую от вещества, – идеальную газовую шкалу температур.
Приняв за основу шкалу Цельсия, можно определить температуру из соотношения:
где V0 – объём газа при 0°С, а V – объём при t.
Понятие идеального газа
Если продолжить изобару в область низких температур, где измерения не проводились, то прямая пересекает ось температуры в точке, соответствующей объёму, равному нулю.
Но, это не означает, что объём газа действительно обращается в ноль. Ведь все газы при сильном охлаждении превращаются в жидкости, а к жидкостям ни закон Бойля – Мариотта, ни закон Гей-Люссака не применимы.
Реальные газы подчиняются основным газовым законам лишь приближённо.
Газ, который в точности подчиняется газовым законам, называют идеальным.
Понятие абсолютной температуры
Предельную температуру, при которой объём идеального газа становится равным нулю, принимают за абсолютный нуль температуры. Найдём значение абсолютного нуля по шкале Цельсия.
Приравнивая объём V к нулю и учитывая, что α = 1/273 1/ °С, получим: 0 = V0(1 + 1/273t).
Отсюда абсолютный нуль температуры равен:
Это предельная, самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказал Ломоносов.
Английский учёный Уильям Кельвин ввёл абсолютную шкалу температур.
Нулевая температура по шкале Кельвина соответствует абсолютному нулю,
единица температуры по этой шкале равна градусу по шкале Цельсия,
абсолютная температура Т связана с температурой по шкале Цельсия формулой:
Т = t + 273°, причём 1°С = 1К.
С точки зрения МКТ при Т = 0К тепловое движение молекул прекращается.
Применяя шкалу Кельвина, закон Гей-Люссака можно записать в более простой форме.
Объём газа данной массы при постоянном давлении прямо пропорционален абсолютной температуре.
Отсюда следует, что отношение объёмов газа одной и той же массы в различных состояниях при постоянном давлении равно отношению абсолютных температур:
Теоретическая часть. Изохорный процесс. Закон Шарля.
С помощью уравнения состояния можно найти зависимость давления газа от температуры при постоянном объёме: Р = mRT/MV. Эту зависимость экспериментально установил французский физик Жак Шарль (1746-1823) в 1787 году (Шарль – в 1787 г., то есть раньше, чем Гей-Люссак, установил и зависимость объёма от температуры при постоянном давлении, но он своевременно не опубликовал своих работ).
Закон Шарля: давление данной массы газа при постоянном объёме прямо пропорционально абсолютной температуре. Следовательно, отношение давлений данной массы газа при постоянном объёме равно отношению его абсолютных температур: p1/p2 = T1/T2.
Процесс изменения давления газа, вызванный изменением температуры при постоянном объёме, называют изохорным (от греческих слов isos – равный и – занимаемое место). [4]
15. Заполним таблицу для изохорного процесса [2]
Таблица 3. Характеристики изохорного процесса.
Постоянный параметр
Название изопроцесса
Связь между другими параметрами
Объяснение связи между параметрами с точки зрения МКТ
График изопроцесса (изохоры)
V = const
При m = const.
Изохорный (закон Шарля)
Увеличение температуры газа означает увеличение средней кинетической энергии теплового движения частиц. При постоянном объёме это приводит к увеличению числа ударов частиц о единицу площади поверхности стенки в единицу времени, то есть к увеличению давления.
Зависимость давления газа от температуры графически изображается прямой линией – изохорой. Большему объёму соответствует нижняя изохора.
Убедитесь самостоятельно, что р = р · · Т, где р – давление газа при Т = 273К, а коэффициент , называемый температурным коэффициентом давления газа, равен температурному коэффициенту объёмного расширения = 1/273 1/К, = (р – р) /рt
Исследовательская часть. Изохорный процесс. Закон Шарля.
С помощью уравнения состояния можно найти зависимость давления газа от температуры при постоянном объёме: Р = mRT/MV. Эту зависимость экспериментально установил французский физик Жак Шарль (1746-1823) в 1787 году.
Закон Шарля: давление данной массы газа при постоянном объёме прямо пропорционально абсолютной температуре:
p/T = const при V= const
Отношение давлений данной массы газа при постоянном объёме равно отношению его абсолютных температур: p1/p2 = T1/T2.
С помощью программы L-микро был исследован изохорный процесс.
Поместили установку в горячую воду при 80°С на 5 мин. Датчик температуры успевал приходить в равновесие с окружающим его газом при медленном изменении температуры во время остывания резервуара с газом на воздухе.
На основе данных эксперимента получили значение температурного коэффициента давления газа.
Экспериментальное значение температурного коэффициента давления газа совпало с теоретическим значением:
Применяя шкалу Кельвина, закон Шарля
можно записать в более простой форме.
Экспериментально доказали, что для воздуха применим закон идеального газа для изохорного процесса Шарля.
3. Заключение. (В заключении в лаконичном виде формулируются выводы и результаты, полученные автором.)
1.В ходе исследовательской работы с помощью оборудования лаборатории L -микро были произведены измерения параметров реального газа ( воздуха) и построены графики в изотермическом, изохорном и изобарном процессах.
2.Убедились, что разряжённые газы с большой степенью точности подчиняются законам идеального газа.
3.Измеренные в ходе работы температурные коэффициенты объёмного расширения и давления газа практически совпали с теоретическими значениями.
4.Удостоверились, что газовая шкала температур позволяет измерять температуры вне зависимости от рабочего вещества.
4. Список использованных источников и литературы. (В список литературы заносятся публикации, издания и источники, использованные автором – в алфавитном порядке. Они должны быть оформлены по библиографическому ГОСТу. )
1). Руководство по выполнению работ L -микро. Авторы: Хоменко С.В., Чарушин А.В. Москва: МГИУ, 2007г
2). Г.Я.Мякишев, А.З.Синяков. Молекулярная физика. Термодинамика. 10 класс. Учебник для углублённого изучения физики. – М: Дрофа, 2016. https :// yandex . ru / images
3)Н.С.Пурышева, Н.В.Шаронова, Д.А.Исаев Фундаментальные эксперименты в физической науке. Элективный курс. – М.: Бином, 2005
Как объяснить закон Бойля-Мариотта на основе МКТ?
вопрос опубликован 15.01.2017 20:06:46
С точки зрения МКТ — при неизменной температуре, чем меньше обём мы будем делать у газа, тем молекулы будут ближе друг к другу и чаще ударяться о стенки сосуда, следовательно давление возрастает и наоборот — увеличим объём, удары сократятся и давление уменьшится.
Если сомневаешься в правильности ответа или его просто нет, то попробуй воспользоваться поиском на сайте и найти похожие вопросы по предмету Физика либо задай свой вопрос и получи ответ в течении нескольких минут.
Закон Бойля-Мариотта. Молекулярно-Кинетическая теория (МКТ) идеальных газов
Молекулярно-Кинетическая теория (МКТ) идеальных газов
Молекулярная физика – это раздел физики, изучающий строение и свойства веществ исходя из молекулярно-кинетического представления, основывающийся на том, что все тела состоят из молекул, находящиеся в непрерывном хаотическом движении.
Законы поведения огромного числа молекул изучаются с помощью статистического метода. Этот метод основан на том, что все свойства молекулярно-кинетической систем определяется свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик (энергия и скорость) этих частиц.
В МКТ пользуются идеализированной моделью идеального газа, согласно которой считают, что:
· Собственный объем идеального газа пренебрежимо мал по сравнению с объемом сосуда
· Между молекулами газа отсутствуют силы взаимодействия
· Столкновение молекул газа между собой и со стенками сосуда абсолютно упругие
Рассмотрим закон, описывающий поведение идеальных газов.
Для каждой масс газа при постоянной температуре, произведение объема на давление постоянно. T=const, pV=const, m=const.
Кривая изображает зависимость между p и V характеризующими свойства вещества при постоянной температуре называется Изотермой, а процесс – изотермическим.
P
T2
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 9491 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Молекулярно-кинетическое истолкование закона Бойля—Мариотта
Давление газа зависит от числа ударов молекул о стенку сосуда. Число ударов прямо пропорционально числу молекул в единице объема (концентрации п). При уменьшении объема газа концентрация увеличивается, так как п = 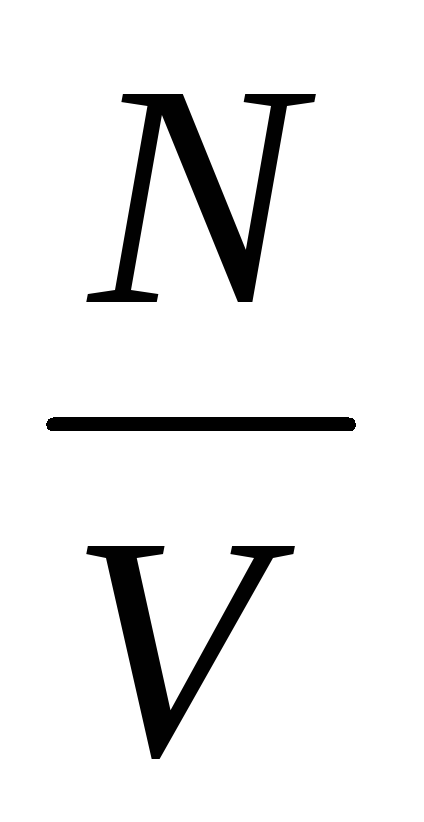
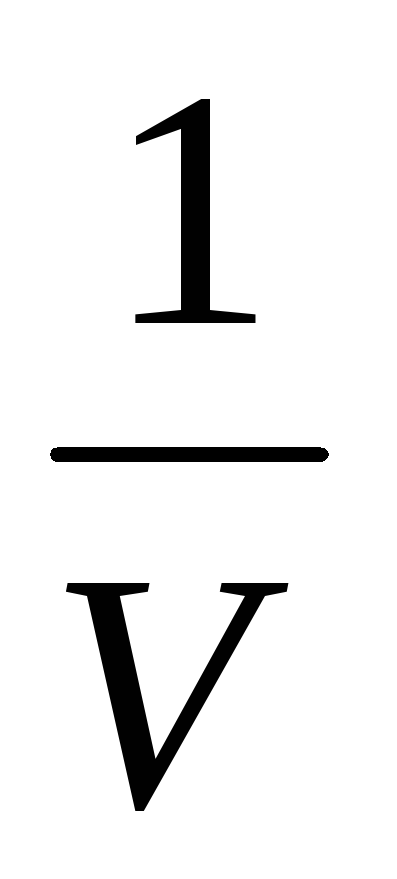
Закон Бойля—Мариотта устанавливает простую обратно пропорциональную зависимость между давлением и объемом газа при постоянной температуре.
§ 3.6. Закон Гей-Люссака. Идеальный газ
Сообщение об открытии еще одного газового закона было опубликовано лишь в 1802 г., спустя почти 150 лет после открытия закона Бойля—Мариотта. Закон, определяющий зависимость объема газа от температуры при постоянном давлении (и неизменной массе), был установлен французским ученым Гей-Люссаком (1778— 1850).
Закон Гей-Люссака
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греческих слов: isos — равный и baros — тяжесть, вес).
Схематически прибор Гей-Люссака показан на рисунке 3.9. Исследуемый газ находится в стеклянном баллончике, соединенном с длинной стеклянной трубкой. Газ заперт небольшой капелькой ртути в трубке. Так как трубка расположена горизонтально, то давление в баллончике все время остается равным атмосферному. Температура газа с помощью специального нагревателя увеличивается от 0 до 100 °С. За изменением объема можно следить по перемещению капельки ртути.
При изучении теплового расширения следует рассматривать не абсолютное изменение объема, а относительное. Если при температуре t= 0 °С объем газа равен V, а при температуре t он равен V, то относительное изменение объема есть 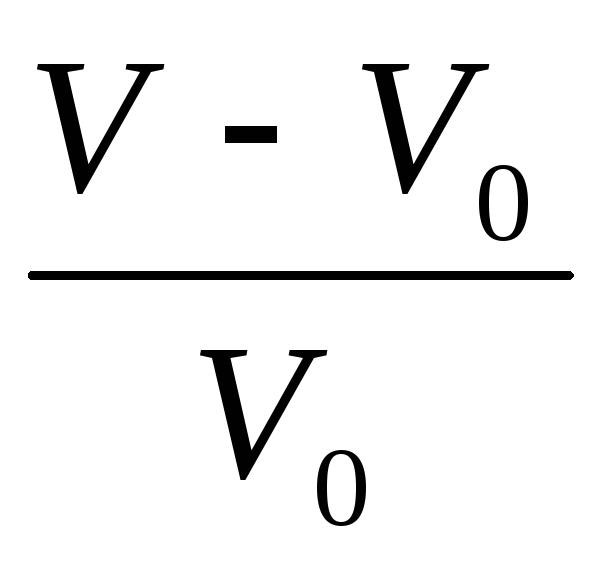
На основании наблюдений Гей-Люссак установил закон: относительное изменение объема газа данной массы при постоянном давлении прямо пропорционально изменению температуры t:
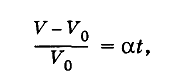
где α — температурный коэффициент объемного расширения.
Температурный коэффициент объемного расширения ос численно равен относительному изменению объема газа при изменении его температуры на 1 °С.
Измеряя объем газа при двух опорных точках, например 0 и 100 °С, можно найти коэффициент α:
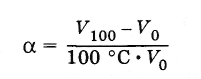
Опыт показывает, что при малых плотностях температурный коэффициент объемного расширения одинаков для всех газов:
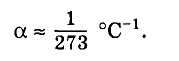
Это означает, что газы изменяют свой объем примерно на 1/273 того объема, который каждый из газов занимал при 0 °С, если температура меняется на 1 °С.
С точки зрения молекулярно-кинетической теории, одинаковое значение коэффициента а для всех газов объясняется тем, что молекулы газа находятся в среднем на больших по сравнению с их размером расстояниях друг от друга. Особенности межмолекулярных сил для различных газов в этих условиях не сказываются.
Уравнение (3.6.1) можно записать в другой форме:

Объем газа определенной массы согласно уравнению (3.6.4) при постоянном давлении меняется линейно при изменении температуры.
Объяснение закона бойля мариотта с точки зрения мкт
Закон Бойля-Мариотта характерен для 1 из трех изопроцессов (процессы, в которых 1 из параметров T,P или V постоянные), в частности для изотермического процесса, т. Е температура в таком процессе не меняется. Вот тебе и весь закон:
При Т=const P*V=const. Можешь еще график начертить, чтобы было понятнее, это будет изотерма. Начерти в координатах РV, график-парабола и чем меньше будет Т, тем график бкдет сильнее»прижиматься» к осям, но касаться их не будет
Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
Свойства реальных газов рассматриваются на примере поведения физической модели «идеальный газ», в которой молекулы представлены в виде материальных точек, отсутствуют силы межмолекулярного взаимодействия, взаимодействие молекул происходит только при их соударениях и со стенками сосуда и является упругим.
Связь термодинамических макропараметров газа (p-давление,V-объем, T-температура) с его микропараметрами (m-масса молекул, -средняя квадратичная скорость молекул, -средняя кинетическая энергия молекул, n-концентрация молекул) устанавливает основное уравнение МКТ идеального газа.
Реальные газы при не слишком низких температурах и достаточно малых давлениях по своим свойствам близки к идеальному газу.
Мкт газовые законы
Мкт газовые законы
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Физика — рефераты, конспекты, шпаргалки, лекции, семинары
Изопроцессы. Газовые законы
Изопроцессами называют термодинамические процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров состояния системы.
1 ˚ Изотермический процесс.
Р.Бойль (англ.), Э. Мариотт (фр.), ХХVII в.
Произведение pV = const для данного количества газа при постоянной температуре.
Объяснение закона Бойля-Мариотта с точки зрения МКТ.
Давление — это обобщенная, усредненная действие молекул (атомов, частиц) на стены. При уменьшении объема в несколько раз во столько же раз увеличивается число молекул в единице объема (концентрация), а значит и число ударов молекул в стенки за единицу времени. Последнее ведет к росту давления.
2 ˚ Изохорный процесс.
Ж. Шарль (фр.), 1787 год.
Давление определенной массы газа при нагревании на 1 ˚ С при постоянном объеме увеличивается на 1/273 часть его давления при 0 ˚ С.
где α = (p — p0) / p0t = 1/273 (K-1) — температурный коэффициент давления.
Tt = T — 273, р = р0 (1 + αt) = р0 + р0 α (T — 273) = p0αT.
Поэтому р = p0αT или р / Т = const при неизменной массе идеального газа.
Объяснение закона Шарля на основе МКТ.
Согласно основным положениям МКТ при росте температуры идеального газа растет средняя скорость движения молекул (атомов, частиц), а потому возрастает частота соприкосновения со стенками сосуда. Это вызывает рост давления молекул на стенки.
3 ˚ Изобарный процесс.
Ж. Гей-Люссак (фр.), 1802 год.
Увеличение температуры газа на 1 ˚ С при постоянном давлении увеличивает его объем на 1/273 часть того объема, который занимает газ при 0 ˚ С.
где β = (V — V0) / V0t — температурный коэффициент объемного расширения газа.
Учитывая, что t = T — 273, закон Гей-Люссака можно представить в следующем виде:
V = V0βt, V / T = const, при неизменной массе идеального газа.
Объяснение закона Гей-Люссака на основе МКТ.
Согласно основным положениям МКТ при росте температуры идеального газа растет средняя скорость движения молекул (атомов, частиц), а потому растет среднее расстояние между молекулами, и вызывает рост объема, который занимает идеальный газ.
Объединенный газовый закон.
Законы Бойля-Мариотта, Шарля и Гей-Люссака, установленные экспериментально, объединяются в одну формулу, которую называют объединенным газовым законом.
Для данной массы идеального газа (m = const) в ходе произвольного равновесного термодинамического процесса величина pV / T остается постоянной:
Если в ходе данного процесса масса газа меняется, то объединенный газовый закон приобретает следующий вид:
Уравнением состояния идеального газа называют соотношение, которое связывает между собой параметры идеального газа в равновесном состоянии: f (p, V, T, m) = 0.
Экспериментально установлено уравнение
называют уравнением состояния или уравнением Клапейрона-Менделеева.
В последнем уравнении R = 8,31 Дж / (моль • К) называют универсальной газовой постоянной, а число ν = m / μ указывает на количество молей вещества, для которых записано уравнение состояния и коре находятся в состоянии термодинамического равновесия.
Основные положения молекулярно-кинетической теории и эмпирические газовые законы
Тела могут находиться в разных агрегатных состояниях (газообразном, жидком, твердом или в виде плазмы), но все они состоят из молекул, а молекулы — из атомов. Элементарная молекулярно-кинетическая теория газов основана на классической механике, молекулы представлены материальными точками.
Молекулярно -кинетическая теория строения вещества основана на следующих основных положениях:
1. Молекулярное строение веществ подтверждено существованием процессов растворения, диффузии, броуновского движения и др.
2. Молекулы находятся на определенных расстояниях друг от друга, что доказывается возможностью сжатия и перечисленными выше процессами. Размеры молекул газа малы по сравнению с расстояниями между ними. При отсутствии внешних сил молекулы газа равномерно заполняют весь предоставленный им объем.
3. Молекулы связаны силами молекулярного взаимодействия — притяжения и отталкивания. Силы отталкивания на малых расстояниях превосходят силы притяжения, но быстро убывают с увеличением расстояния между молекулами, и с некоторого расстояния r, называемого радиусом молекулярного действия, ими можно пренебречь. В отсутствие внешних воздействий молекулы находятся вустойчивом состоянии на расстояниях 2r. Эти силы имеют электромагнитную природу.
4. Молекулы находятся в непрерывном беспорядочном движении, что доказывают те же процессы.
5. Внутреннюю энергию молекулярной системы составляет сумма кинетической энергии движения молекул, потенциальной энергии их взаимодействия и всех прочих энергий этой системы.
6. В любом, даже самом малом объеме газа, к которому применимы выводы этой теории, число молекул велико.
Газовые законы были получены эмпирически для равновесного состояния:
закон Бойля—Мариотта, который выполняется при постоянной температуре Т, имеет для 1 моля идеального газа следующий вид: 
закон Гей-Люссака — изменение объема при температуре Т, постоянном давлении 

закон Шарля — изменение давления и температуры T при постоянном объеме 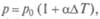

Уравнение состояния, введенное Клапейроном, для заданной массы газа объединяет три газовых закона, связывая между собой параметры газа. Клапейрон впервые употребил и графическое изображение обратимых циклических процессов, вычислив работу как соответствующую площадь на графике. Согласно закону Авогадро, количества любых газов при одинаковых температуре и давлении занимают одинаковый объем, который при нормальных условиях равен 22,4 л = 22,4 • 10 -3 м3 . Д. И. Менделеев обобщил с учетом закона Авогадро уравнение Клапейрона: pV= 
Газовые законы, как всякие эмпирические, справедливы приблизительно и описывают поведение почти идеальных газов при невысоких давлениях и не слишком высоких температурах. Подобных универсальных законов нет для жидкостей или твердых тел. Их свойства зависят от типа частиц, из которых они состоят, и силы взаимодействия между частицами в них меняются в широких пределах. Опыт показывает, что эти силы, имеющие отчасти характер электростатического взаимодействия, при расстояниях между молекулами более 10 -9 м убывают столь быстро, что ими можно пренебречь. Поэтому свойства идеальных газов близки к свойствам реального газа.
Так как молекул много и они часто ударяются о стенку, их суммарное действие на поверхность можно заменить одной непрерывно действующей силой, которая как бы сглаживает отдельные толчки. Такое описание называется статистическим — время и место удара каждой молекулы о поверхность не интересны, важен только общий эффект, т. е. то, что входит в статистический закон.
Средняя кинетическая энергия поступательного движения молекулы газа при тепловом равновесии одинакова для всех молекул газов, находящихся в тепловом контакте. Значит, 
Температура газа должна определяться средней кинетической энергией его молекул. В 1730 г. Д. Бернулли наметил кинетику газовых сред. В частности, он сумел из атомистических представлений вывести закон Бойля — Мариотта. Этот закон вывел и М. В.Ломоносов — его гипотеза о внутреннем вращательном движении составляющих материю частиц позволила наглядно объяснить механизм нагревания двух трущихся друг о друга поверхностей.
Дата добавления: 2014-11-10 ; просмотров: 931 . Нарушение авторских прав
11.2.2. Вывод основных газовых законов молекулярно кинетической теории
Из основного уравнения молекулярно-кинетической теории газов (11.12) можно вывести все газовые законы, установленные экспериментально.
11.2.2.1. Закон Бойля-Мариотта
В основном уравнении 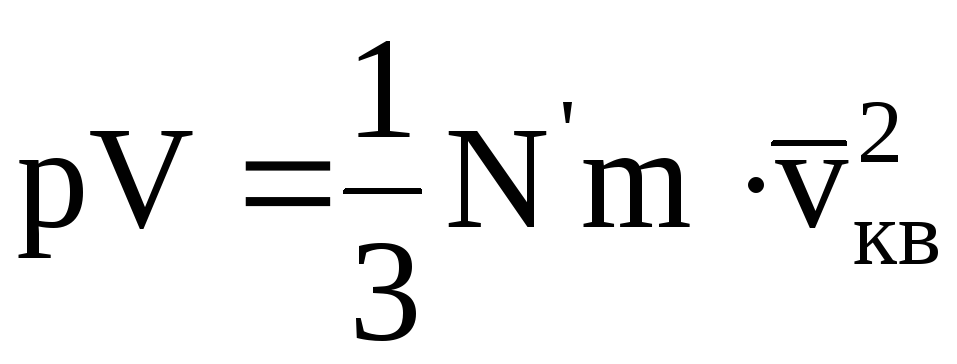
p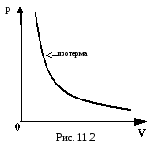
В термодинамике процесс, происходящий при постоянной температуре, называется изотермическим. Графически он изображается в координатах p, V изотермой (рис. 11.2).
11.2.2.2. Закон Гей-Люссака
Запишем основное уравнение молекулярно-кинетической теории для двух состояний одной и той же массы газа при одинаковых давлениях, но разных температурах
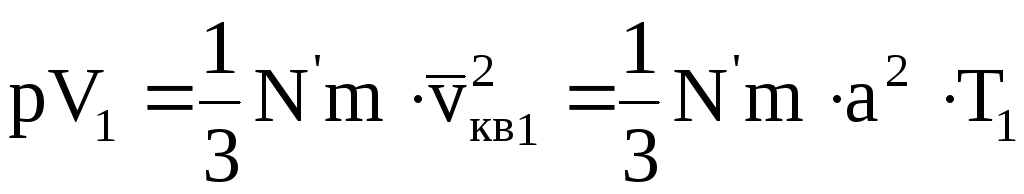
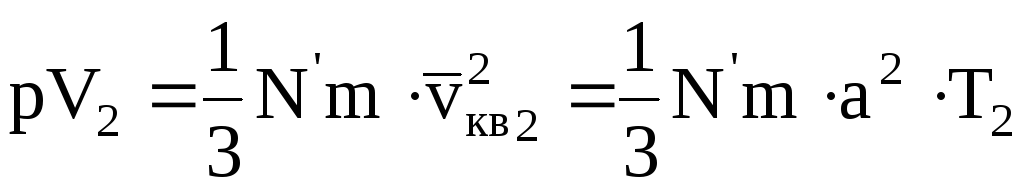
где квадрат средней квадратичной скорости vкв заменен на a 2 T (a — коэффициент пропорциональности; T — абсолютная температура).
Разделив (11.16) на (11.17), получим
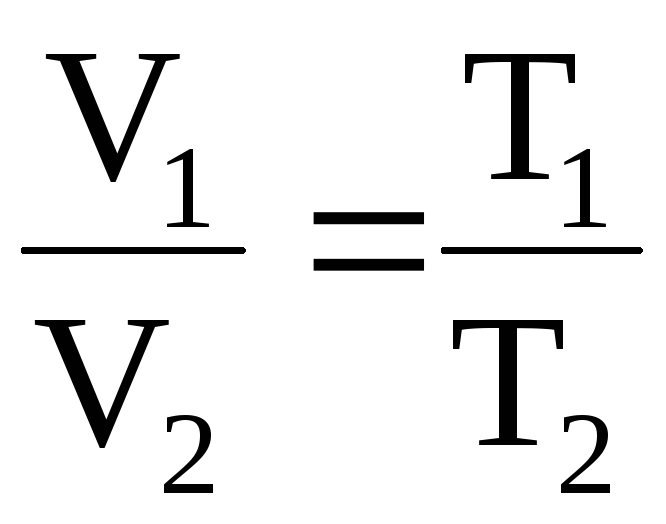
т.е. для данной массы газа при постоянном давлении их объемы относятся как абсолютные температуры. Или «Для данной массы газа при постоянном давлении отношение объема к абсолютной температуре остается величиной постоянной»:
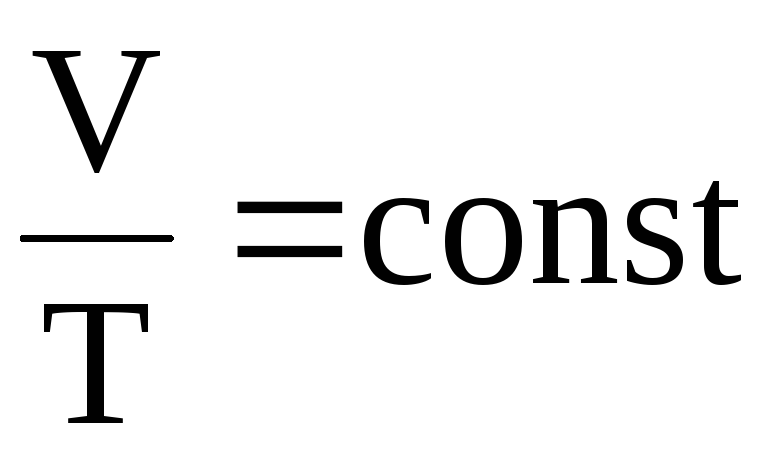
Формулы (11.18) и (11.19) отображают закон Гей-Люссака.
В термодинамике процесс, происходящий при постоянном давлении, называется изобарическим.
Экспериментально установлено, что в этом случае объем газа изменяется по закону (при m = const, p = const)
где — коэффициент объёмного расширения — величина, которая показывает, как изменилась каждая единица начального объёма газа (при 0 0 С) от нагревания его на один градус при постоянном давлении

Такой процесс в координатах V, t он изображается изохорой (рис. 11.3).
11.2.2.3. Закон Шарля
Если данную массу газа нагреть при постоянном объеме от температуры T1 до температуры T2, то основное уравнение молекулярно кинетической теории для этих двух состояний будет иметь вид
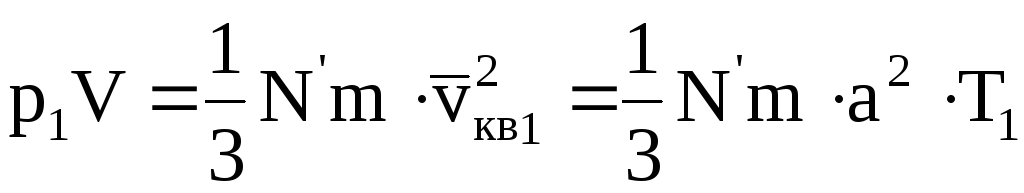
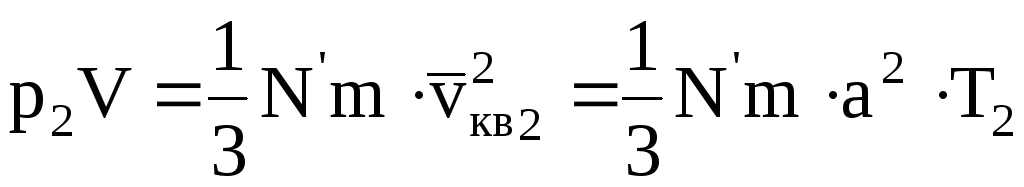
Разделив (11.22) на (11.23), получим

т.е. для данной массы газа при постоянном объеме их давления относятся как абсолютные температуры. Или: «Для данной массы газа при постоянном объеме отношение давления к абсолютной температуре остается величиной постоянной»
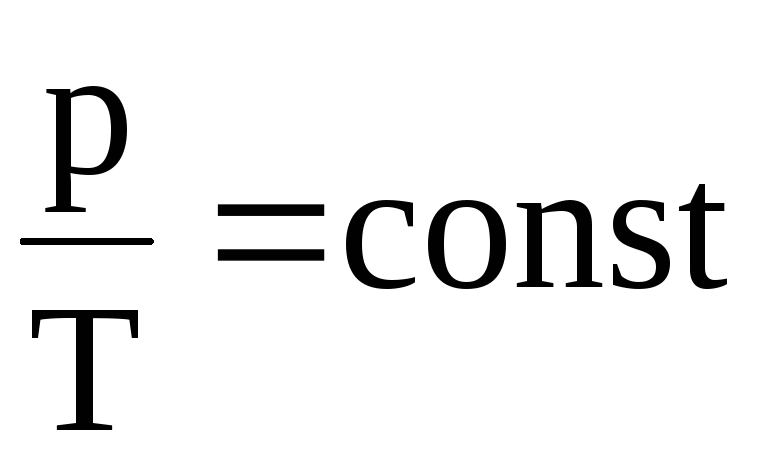
Формулы (11.24) и (11.25) отображают закон Шарля.
В термодинамике процесс, происходящий при постоянном объеме, называется изохорическим.
Давление данной массы газа при изохорическом процессе изменяется по закону (при m = const, V = const)

где — термический коэффициент давления, который показывает, на какую часть изменилась каждая единица начального давления газа (при 0 0 С) от нагревания его на один градус при постоянном объёме
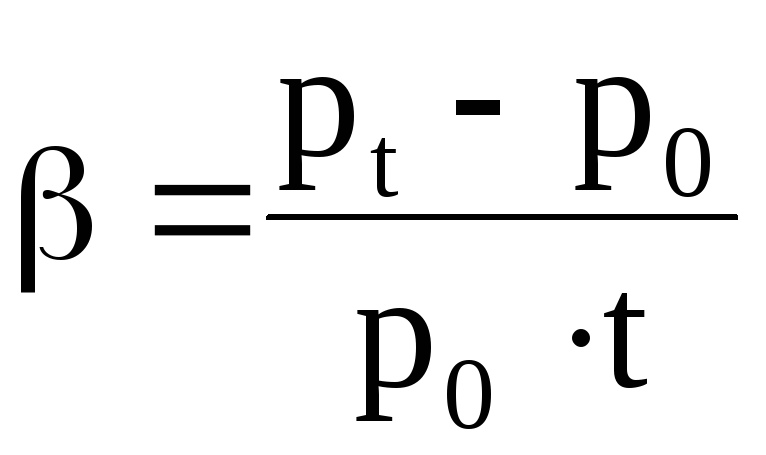
Графически в координатах p, t такой процесс изображается изобарой (рис.11.4).
Т
Объединение учителей Санкт-Петербурга
Основные ссылки
Уравнение состояния идеального газа. Газовые законы.
Уравнение состояния идеального газа
(уравнение Менделеева – Клапейрона).
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние.
В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул.
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m.
Мы знаем, что . Следовательно, . Учитывая, что , получим: .
Произведение постоянных величин есть величина постоянная, следовательно: — универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая).
Таким образом, имеем:
— уравнение состояния (уравнение Менделеева – Клапейрона).
Другие формы записи уравнения состояния идеального газа.
1.Уравнение для 1 моля вещества.
Если n=1 моль, то, обозначив объем одного моля Vм, получим: .
Для нормальных условий получим:
2. Запись уравнения через плотность: — плотность зависит от температуры и давления!
3. Уравнение Клапейрона.
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества n=const. Тогда:
Эта запись означает, что для данной массы данного газа справедливо равенство:
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: .
Газовые законы.
1. Закон Авогадро.
В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов).
Доказательство:
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково.
2. Закон Дальтона.
Давление смеси газов равно сумме парциальных (частных) давлений каждого газа.
Доказательство:
3. Закон Паскаля.
Давление, производимое на жидкость или газ, передается во все стороны без изменения.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ – раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество. Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это их движение воспринимается как тепло.
До 19 в. весьма популярной основой учения о тепле была теория теплорода или некоторой жидкой субстанции, перетекающей от одного тела к другому. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Понятие об атомах долго казалось ненужным для теории тепла, однако многие ученые уже тогда интуитивно связывали тепло с движением молекул. Так, в частности, думал русский ученый М.В.Ломоносов. Прошло немало времени, прежде чем молекулярно-кинетическая теория окончательно победила в сознании ученых и стала неотъемлемым достоянием физики.
Многие явления в газах, жидкостях и твердых телах находят в рамках молекулярно-кинетической теории простое и убедительное объяснение. Так давление, оказываемое газом на стенки сосуда, в котором он заключен, рассматривается как суммарный результат многочисленных соударений быстро движущихся молекул со стенкой, в результате которых они передают стенке свой импульс. (Напомним, что именно изменение импульса в единицу времени приводит по законам механики к появлению силы, а сила, отнесенная к единице поверхности стенки, и есть давление). Кинетическая энергия движения частиц, усредненная по их огромному числу, определяет то, что принято называть температурой вещества.
Истоки атомистической идеи, т.е. представления о том, что все тела в природе состоят из мельчайших неделимых частиц-атомов, восходят еще к древнегреческим философам – Левкиппу и Демокриту. Более двух тысяч лет назад Демокрит писал: «…атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля». Решающий вклад в развитие молекулярно-кинетической теории был внесен во второй половине 19 в. трудами замечательных ученых Дж.К.Максвелла и Л.Больцмана, которые заложили основы статистического (вероятностного) описания свойств веществ (главным образом, газов), состоящих из огромного числа хаотически движущихся молекул. Статистический подход был обобщен (по отношению к любым состояниям вещества) в начале 20 в. в трудах американского ученого Дж.Гиббса, который считается одним из основоположников статистической механики или статистической физики. Наконец, в первые десятилетия 20 в. физики поняли, что поведение атомов и молекул подчиняется законам не классической, а квантовой механики. Это дало мощный импульс развитию статистической физики и позволило описать целый ряд физических явлений, которые ранее не поддавались объяснению в рамках обычных представлений классической механики.
Молекулярно-кинетическая теория газов.
Газовое состояние (см. ГАЗ) – одно из тех состояний вещества, описание которого на основе методов молекулярно-кинетической теории уже с самого начала ее развития дало наиболее полные и ощутимые результаты. В первую очередь это относится к так называемому идеальному газу, молекулы которого большую часть времени проводят в состоянии свободного хаотического движения, резко меняя свою скорость лишь в моменты кратковременных столкновений. Молекулярно-кинетическая теория успешно объясняет все известные экспериментальные законы идеального газа (закон Бойля – Мариотта, закон Гей-Люссака, закон Авогадро и формулируемое на их основе уравнение состояния Менделеева – Клапейрона). На базе этой теории получили свое полное объяснение процессы переноса в газах: диффузия, вязкость и теплопроводность.
Давление газа.
В качестве одного из примеров применения молекулярно-кинетической теории можно рассмотреть вывод выражения для давления газа. Сначала определяется среднее число столкновений молекул, происходящих за единицу времени с поверхностью стенки сосуда. В газе выделяются три взаимно перпендикулярных оси, соответствующие декартовой системе координат. Если в сосуде содержится N молекул, то из-за огромного их числа логично предположить, что в любой момент времени вдоль каждого из направлений будут двигаться примерно N/3 молекул. Очевидно, что в направлении самой стенки сосуда перпендикулярно к ней будет в среднем двигаться 1/6 часть всех молекул.
Пусть есть плоский элемент поверхности на стенке сосуда D S. Предполагается, для простоты, что все молекулы движутся с одинаковой скоростью v. Тогда за время D t до элемента стенки D S долетят все движущиеся по направлению к нему молекулы, которые заключены в объеме цилиндра с основанием D S и высотой v D t (рис. 1).
Если n = N/V – число молекул в единице объема, то число молекул, долетевших до стенки и ударившихся об нее, равно D v = (n/6)v D S D t. Соответственно, число ударов молекул об единичную площадку в единицу времени оказывается равным
Каждая молекула, летящая к стенке, при столкновении с ней передает стенке свой импульс. Поскольку скорость молекулы при упругом столкновении со стенкой меняется от величины v до –v, величина передаваемого импульса равна 2mv. Сила, действующая на поверхность стенки D S за время D t, определяется величиной полного импульса, передаваемого всеми молекулами достигнувшим стенки за этот промежуток времени, т.е. F = 2mv n c D S/ D t, где n c определено выражением (1). Для величины давления p = F/ D S в этом случае находим: p = (1/3)nmv2.
Для получения окончательного результата можно отказаться от предположения об одинаковой скорости молекул, выделив независимые группы молекул, каждая из которых имеет свою приблизительно одинаковую скорость. Тогда средняя величина давления находится усреднением квадрата скорости по всем группам молекул или
Это выражение можно представить также в виде
где – средняя кинетическая энергия молекул газа (в расчете на одну молекулу).
Тепловое равновесие, понятие температуры. Известно, что тепло всегда перетекает от горячего тела к холодному, т.е. температура соприкасающихся тел стремится выравняться. Это явление характеризуют как переход системы в состояние теплового равновесия. Понятие температуры является не столь очевидным, как многие привычные понятия механики: масса, сила, энергия и т.д. Температура связана с весьма неопределенным понятием теплоты и холода, которые располагаются в сознании человека где-то рядом с запахом и вкусом. Одно из главных достижений молекулярно-кинетической теории состоит в том, что теплота рассматривается просто как одна из форм энергии, а именно – кинетическая энергия атомов и молекул. Эта величина, усредненная по огромному числу беспорядочно движущихся частиц, и оказывается мерилом того, что называется температурой тела. Такое представление распространяется на все вещества – твердые, жидкие и газообразные. Частицы нагретого тела движутся быстрее, чем холодного. Если два тела, имеющие первоначально разные температуры, входят в соприкосновение друг с другом, движение частиц в одном из них замедляется, в другом наоборот ускоряется: средняя кинетическая энергия частиц становится везде одинаковой. Это и означает, что система в целом приходит в состояние полного теплового равновесия.
Поскольку понятие температуры тесно связано с усредненной кинетической энергией молекул, было бы естественным и в качестве единиц ее измерения использовать энергетические единицы (например, эрг или джоуль). Однако, энергия теплового движения частиц фактически очень мала по сравнению с эргом (не говоря уже о джоуле), поэтому использование этой величины оказывается неудобным. В молекулярной физике пользуются практически удобной условной единицей измерения температуры – градусом, который определяется таким образом, что интервал температур между точками кипения и замерзания воды при атмосферном давлении полагается равным 100 градусам.
Если температура T измеряется в градусах Кельвина (К), то связь ее со средней кинетической энергией молекул имеет вид
где k = 1,38·10 –16 эрг/K – переводный коэффициент, определяющий, какая часть эрга содержится в градусе. Величина k называется постоянной Больцмана (она была введена Планком в 1899).
Уравнение состояния. Газовые законы.
Подстановка соотношений (4) в (3), приводит к известному уравнению состояния идеального газа
Из соотношений (2) и (5) следует также выражение для средне-квадратичной скорости молекул
Этой формуле удобно придать другой вид, умножив числитель и знаменатель под знаком квадратного корня на число Авогадро
Здесь M = mNA – атомная или молекулярная масса, величина R = kNA = 8,318·10 7 эрг называется газовой постоянной.
Средняя скорость молекул в газе даже при умеренных температурах оказывается очень большой. Так, для молекул водорода (H2) при комнатной температуре (T = 293K) эта скорость равна около 1900 м/c , для молекул азота в воздухе – порядка 500 м/с. Скорость звука в воздухе при тех же условиях равна 340 м/с.
Учитывая, что n = N/V, где V – объем, занимаемый газом, N – полное число молекул в этом объеме, легко получить следствия из (5) в виде известных газовых законов. Для этого полное число молекул представляется в виде N = vNA, где v – число молей газа, и уравнение (5) принимает вид
которое носит название уравнения Клапейрона – Менделеева.
При условии T = const давление газа меняется обратно пропорционально занимаемому им объему (закон Бойля – Мариотта).
В замкнутом сосуде фиксированного объема V = const давление меняется прямо пропорционально изменению абсолютной температуры газа Т. Если газ находится в условиях, когда постоянным сохраняется его давление p = const, но изменяется температура (такие условия можно осуществить, например, если поместить газ в цилиндр, закрытый подвижным поршнем), то объем, занимаемый газом, будет меняться пропорционально изменению его температуры (закон Гей-Люссака).
Пусть в сосуде есть смесь газов, т.е. имеются несколько разных сортов молекул. В этом случае величина импульса, передаваемого стенке молекулами каждого сорта, не зависит от наличия молекул других сортов. Отсюда следует, что давление смеси идеальных газов равно сумме парциальных давлений, которые создавал бы каждый газ в отдельности, если бы занимал весь объем. В этом состоит еще один из газовых законов – известный закон Дальтона.
Длина свободного пробега молекул. Одним из первых, кто еще в 1850-х дал разумные оценки величины средней тепловой скорости молекул различных газов, был австрийский физик Клаузиус. Полученные им непривычно большие значения этих скоростей сразу же вызвали возражения. Если скорости молекул действительно так велики, то запах любого пахучего вещества должен был бы практически мгновенно распространяться из одного конца замкнутого помещения в другой. На самом деле распространение запаха происходит очень медленно и осуществляется, как теперь известно, посредством процесса так называемой диффузии в газе. Клаузиус, а затем и другие исследователи, сумели дать убедительное объяснение этому и другим процессам переноса в газе (таким как теплопроводность и вязкость) с помощью понятия средней длины свободного пробега молекул, т.е. среднего расстояния, которое пролетает молекула от одного столкновения до другого.
Каждая молекула в газе испытывает очень большое число столкновений с другими молекулами. В промежутке между столкновениями молекулы движутся практически прямолинейно, испытывая резкие изменения скорости лишь в момент самого столкновения. Естественно, что длины прямолинейных участков на пути молекулы могут быть различными, поэтому имеет смысл говорить лишь о некоторой средней длине свободного пробега молекул.
За время D t молекула проходит сложный зигзагообразный путь, равный v D t. Изломов траектории на этом пути столько, сколько произошло столкновений. Пусть Z означает число столкновений, которое испытывает молекула в единицу времени Средняя длина свободного пробега равна тогда отношению длины пути к полному числу столкновений Z D t, испытанных молекулой на этом пути,
Для оценки величины Z принимается, что молекулы представляют собой твердые упругие шарики радиуса a, которые равномерно распределены в объеме газа с плотностью n. Сначала предполагается, что молекула движется в среде, где все остальные молекулы неподвижны. Можно видеть, что молекула пролетает мимо другой молекулы, не испытав столкновения с ней, если расстояние между центрами молекул превышает 2a. Следовательно, за время t, равное 1c, молекула взаимодействует только с теми партнерами по столкновению, центры которых расположены в объеме цилиндра длиной и с площадью основания s = 4p a2 (рис.2). На самом деле, после каждого столкновения направление движения молекулы меняется, и нужно рассматривать ее движение в цилиндре, составленном как бы из отдельных колен, однако смысл рассуждений не меняется, если считать этот коленчатый цилиндр выпрямленным.
Величину s называют эффективным поперечным сечением столкновений молекул. Число молекул в объеме цилиндра равно n s . Таким же будет число столкновений, т.е. Z = n s . Используя (9), находим
На самом деле, конечно, в газе одновременно находятся в движении все молекулы, поэтому в выражение для Z должна входить средняя скорость относительного движения молекул, так что Z = nотн. s . Более точный расчет, проведенный впервые Максвеллом, показывает, что . В результате получается известная в элементарной кинетической теории формула
Характерный радиус молекул для различных газов можно оценить из экспериментальных данных по вязкости (внутреннему трению) в газе. Для молекул N2, например, a » 2,0·10 –10 м. В таблице 1 приведены рассчитанные по формуле (10) значения l 0 в мкм (1мкм = 10 –6 м) для некоторых газов при нормальных условиях (p = 1атм, T=273K). Эти значения оказываются примерно в 100–300 раз больше собственного диаметра молекул.
- http://school-science.ru/6/11/36191
- http://obrazovalka.ru/fizika/question-400753.html
- http://studopedia.ru/3_163767_zakon-boylya-mariotta.html
- http://studfiles.net/preview/2383541/page:26/
- http://fizikahelp.ru/92/923/11032.html
- http://fizclass.ru/idealnyj-gaz-osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-idealnogo-gaza/
- http://112ak.ru/5239-mkt-gazovye-zakony/