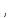Нас окружают разнообразные предметы. Мы можем увидеть, что это либо твердые тела, либо жидкости, либо газы. Возникает масса вопросов обо всем, что нас окружает. Ответы на многие вопросы дает молекулярно-кинетическая теория.
Молекулярно-кинетическая теория – это совокупность воззрений, используемых для описания наблюдаемых и измеряемых свойств вещества на основе изучения свойств атомов и молекул данного вещества, их взаимодействия и движения.
Основные положения молекулярно-кинетической теории
Все тела состоят из частиц – атомов, молекул, ионов.
Все частицы находятся в непрерывном хаотическом тепловом движении.
Между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Таким образом, в молекулярно-кинетической теории объектом исследования является система, состоящая из большого количества частиц – макросистема. Для объяснения поведения такой системы законы механики не применимы. Поэтому основным методом исследования является статистический метод изучения свойств вещества.
Для объяснения и предсказания явлений важно знать основные характеристики молекул:
Оценка размера молекулы может быть сделана как размер кубика a в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы:
- Масса молекул
Отношение массы вещества m к числу молекул N в данном веществе:
- Относительная молекулярная масса
Отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:
- Количество вещества
Количество вещества равно отношению числа частиц N в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле веществаNА:
- Постоянная Авогадро
Количество молекул, содержащихся в 1 моль вещества.
- Молярная масса
Молярной массой вещества называют массу вещества, взятого в количестве 1 моля.
В Международной системе единиц молярная масса вещества выражается в кг/моль.
- Взаимодействие (количественно на основе опытов)
Для взаимодействия молекул характерно одновременно и притяжение, и отталкивание: на расстояниях r r – притяжение, причем оно быстро убывает. На расстоянии r система двух молекул обладает минимумом потенциальной энергии (сила взаимодействия равна нулю) – это состояние устойчивого равновесия
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях. С точки зрения МКТ агрегатные состояния различаются по значению среднего расстояния между молекулами и характеру движения молекул друг относительно друга.
Основные положения молекулярно-кинетической теории неоднократно подтверждались различными физическими экспериментами. Например, исследованием:
Б) Броуновского движения
Молекулярно-кинетическая теория объясняет строение и свойства тел на основе движения и взаимодействия атомов, молекул и ионов. В основе МКТ лежат три положения, которые полностью подтверждены экспериментально и теоретически:
1) все тела состоят из частиц – молекул, атомов, ионов;
2) частицы находятся в непрерывном хаотическом тепловом движении;
3) между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Молекулярное строение вещества подтверждается непосредственным наблюдением молекул в электронных микроскопах, а также растворением твердых веществ в жидкостях, сжимаемостью и проницаемостью вещества. Тепловое движение – броуновским движением и диффузией. Наличие межмолекулярного взаимодействия прочностью и упругостью твердых тел, поверхностным натяжением жидкостей.
Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории
Характеристика тепловых явлений в молекулярной физике. Рассмотрение основных положений молекулярно-кинетической теории. Основной порядок взаимодействия молекул. Изучение строения газообразных, жидких и твердых тел. Описание Броуновского движения.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 16.01.2015 |
| Размер файла | 358,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ГБОУ НПО АО «Профессиональное училище № 1»
РЕФЕРАТ НА ТЕМУ:
«Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории»
Выполнил: Акишин Дмитрий Андреевич
Проверил: Жубрева Лидия Николаевна
1. Тепловые явления в молекулярной физике
2. Основные положения молекулярно-кинетической теории
3. Взаимодействие молекул
4. Строение газообразных, жидких и твердых тел
5. Броуновское движение
1. Тепловые явления в молекулярной физике
тепловой броуновский кинетический твердый
Тепловые явления привлекали внимание людей с древних времён. Умение добывать и поддерживать огонь сделало человека относительно независимым от колебаний температуры окружающей среды. Это было одним из величайших изобретений человечества. Изменение температуры оказывает влияние на все свойства тел. Кроме механических свойств, при изменении температуры меняются и другие свойства тел, например сопротивление электрическому току, магнитные свойства и др. Так, если сильно нагреть постоянный магнит, то он перестанет притягивать железные предметы. Все перечисленные выше и многие другие тепловые явления подчиняются определённым законам. Открытие законов тепловых явлений позволяет с максимальной пользой применять эти явления на практике и в технике. Молекулярно-кинетическая теория. Ещё философы древности догадывались о том, что теплота — это вид внутреннего движения. Но только в ХVIII в. Начала развиваться последовательная молекулярно — кинетическая теория. Цель молекулярно-кинетической теории — объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, беспорядочно движущихся частиц. Большой вклад в развитие молекулярно-кинетической теории был сделан М.В. Ломоносовым. Он рассматривал теплоту как вращательное движение частиц, составляющих тела.
2. Основные положения молекулярно-кинетической теории
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Каждое утверждение строго доказано с помощью опытов. Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или ещё более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в реальности молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займёт всю поверхность, если сосуд велик. Нельзя заставить капельку объёмом 1 мм(в кубе) расплыться так, чтобы она заняла площадь поверхности более 0,6 м(в квадрате). Объём V слоя масла равен произведению его площади поверхности S на толщину d слоя, т.е V=Sd. Следовательно, размер молекулы оливкового масла равен: d = ? 1,7 Ч см.
При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно, объёмом 1.
Диаметр молекулы воды равен примерно 3 Ч . Считая, что каждая молекула воды при плотной упаковке молекул занимает объём капли (1 на объём, приходящийся на одну молекулу:
Размеры атома надо запомнить: D ?см ? м.
3. Взаимодействие молекул
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел. Молекула- это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими.
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличиваются, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул.
При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и между молекулами возникают быстро нарастающие силы отталкивания.
4. Строение газообразных, жидких и твердых тел
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга.
Молекулы с огромными скоростями — сотни метров в секунду -движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т.е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12-10-13 с). С повышением температуры время оседлой жизни молекул уменьшается. Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И. Френкелем, позволяет понять основные свойства жидкостей. Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.8.8). Вот почему жидкость течет и принимает форму сосуда.
Атомы или молекулы твёрдых тел колеблются около определённых положений равновесия, поэтому твёрдые тела сохраняют не только объём ,но и форму
Если соединить центр равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристалической
Кристаллы — это твёрдые тела, атомы или молекулы которых занимают определённое, порядочное положение в пространстве. Поэтому кристаллы имеют плоские грани. Например крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное- это зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Зависимость физических свойств от направления внутри кристалла называют анизотропией. Все кристаллические тела анизотропны.
Монокристаллы и поликристаллы.
Кристаллическую структуру имеют металлы. Если взять большой кусок металла, то на первый взгляд его кристаллическое строении никак не проявляется ни во внешнем виде куска, ни в его физических свойствах
Обычно металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению к друг другу беспорядочно. В результате в объеме, значительно превышающем объем отдельных кристалликов, все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллическим. Одиночные кристаллы называют монокристаллами.
5. Броуновское движение
Броуновское движение- это тепловое движение взвешенных в жидкости( или газе) частиц.
Наблюдения броуновского движения. Английский ботаник Р.Броун (1773-1858) впервые наблюдал это явление 1827 г. Рассматривая в микроскоп взвешенные в воде споры плауна. Позже он рассматривал и другие мельчайшие частицы, в том числе частички камня египетских пирамид. Сейчас для наблюдения броуновского движения используют частички краски гуммируют, которая нерастворима в воде. Эти частички совершают беспорядочное движение. Броуновское движение — тепловое движение, и оно не может прекратиться. С увеличением температуры интенсивность его растёт. Положения частиц, отмеченные точками, определены через равные промежутки времени — 30 с. Броуновское движение можно наблюдать и в газе. Его совершают взвешенные в воздухе частицы пыли или дыма.
Газы — агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек.
Жидкость — агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д.
Твёрдое тело — одно из четырёх агрегатных состояний вещества, отличающееся от др. агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует
1. Физика 10 класс Г. Я Мякишев М. «Просвещение» 2007.
2. Арцимович Л. А., Элементарная физика плазмы, 3 изд., М., 2002;
3. Франк-Каменецкий Д. А., Лекции по физике состояний вещества, М., 2003 (переиздание);
4. Френкель Я. И., Собрание избранных трудов, т. 3, М., 2001;
5. Фишер И.3., Статистическая теория жидкостей, М., 2003;
6. Физика простых жидкостей. Экспериментальные исследования, пер. с англ., М., 2002
Размещено на Allbest.ru
Подобные документы
Основные положения атомно-молекулярного учения. Закономерности броуновского движения. Вещества атомного строения. Основные сведения о строении атома. Тепловое движение молекул. Взаимодействие атомов и молекул. Измерение скорости движения молекул газа.
презентация [226,2 K], добавлен 18.11.2013
Анализ теорий, устанавливающих связи между измеряемыми на опыте величинами и свойствами молекул. Идеальный газ как газ, взаимодействие между молекулами которого пренебрежимо мало. Причины возникновения давления газа в молекулярно-кинетической теории.
презентация [151,4 K], добавлен 08.01.2015
Определения молекулярной физики и термодинамики. Понятие давления, основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Уравнение состояния идеального газа (Менделеева — Клапейрона).
презентация [972,4 K], добавлен 06.12.2013
Основные понятия и определения молекулярной физики и термодинамики. Основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Состояние идеального газа (уравнение Менделеева-Клапейрона).
презентация [1,1 M], добавлен 13.02.2016
Вычисление скорости молекул. Различия в скоростях молекул газа и жидкости. Экспериментальное определение скоростей молекул. Практические доказательства состоятельности молекулярно-кинетической теории строения вещества. Модуль скорости вращения.
презентация [336,7 K], добавлен 18.05.2011
Содержание молекулярно-кинетической теории газов. Химический состав жидкости. Особенности межмолекулярного взаимодействия в данном агрегатном состоянии. Механические и тепловые свойства твердых тел. Практическое применение плазмы — ионизованного газа.
контрольная работа [26,0 K], добавлен 27.10.2010
Характеристика законов Бойля-Мариотта, Бойля-Мариотта, Авогадро. Парциальное давление как давление, которое оказывал бы каждый газ смеси, если бы он один занимал объем, равный объему смеси. Знакомство с положениями молекулярно-кинетической теории газа.
презентация [625,5 K], добавлен 06.12.2016
Изучение корпускулярной концепции описания природы, сущность которой в том, что все вещества состоят из молекул — минимальных частиц вещества, сохраняющих его химические свойства. Анализ молекулярно-кинетической теории газа. Законы для идеальных газов.
контрольная работа [112,2 K], добавлен 19.10.2010
Особенности определения давления газа на стенку сосуда с использованием второго закона Ньютона. Связь этой величины со средней кинетической энергией молекул и их концентрацией. Специфика схематичного вывода основного уравнения упрощенным методом.
презентация [316,6 K], добавлен 19.12.2013
Молекулярная физика как раздел физики, в котором изучаются свойства вещества на основе молекулярно-кинетических представлений. Знакомство с основными особенностями равновесной термодинамики. Общая характеристика молекулярно-кинетической теории газов.
курсовая работа [971,8 K], добавлен 01.11.2013
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Газ занимает весь объем, предоставленный ему. (Он не имеет формы, не сохраняет объем). Молекулы газа находятся друг от друга на больших расстояниях, поэтому практически не притягиваются и не отталкиваются. Считается, что молекулы только взаимодействуют при упругих столкновениях. Поэтому молекулы из-за теплового движения могут друг относительно друга разлететься на какие угодно расстояния.
МКТ, термодинамика (объяснение явлений; интерпретация результатов опытов)
Теория к заданию 11 из ЕГЭ по физике
Молекулярная физика
Молекулярная физика описывает строение вещества с помощью молекулярно-кинетической теории.
Согласно молекулярно-кинетической теории (МКТ), все тела состоят из отдельных частиц — молекул и атомов, то есть не являются сплошными.
Основные положения молекулярно-кинетической теории строения вещества заключаются в следующем:
- вещество состоит из частиц (атомов и молекул);
- эти частицы беспорядочно движутся;
- частицы взаимодействуют друг с другом.
Атом — это наименьшая часть химического элемента, обладающая его свойствами и способная к самостоятельному существованию.
Каждому элементу соответствует определенный род атомов, обозначаемый химическим символом этого элемента. Например, атом кислорода обозначается символом $О$, водорода — $Н$, гелия — $Не$ и т. д.
Атомы могут существовать в свободном состоянии (в виде отдельных атомов) в газах. В жидкостях и твердых телах они существуют в виде молекул, в которых соединяются с атомами того же элемента или других химических элементов (или, как принято говорить, существуют в связанном состоянии).
Молекула — мельчайшая устойчивая частица вещества, состоящая из атомов одного или нескольких химических элементов, сохраняющая основные химические свойства этого вещества. Атомы можно рассматривать как одноатомные молекулы.
Размеры молекул
Для определения размеров молекул проводились различные опыты. Вот один из них.
В сосуд с водой помещают каплю масла, объем которой определяется заранее. (Объем капли $V$ определяют с помощью мензурки, в которую при помощи пипетки капают несколько десятков капель масла, и измеряют их общий объем. Этот объем делят на количество капель). Масло начинает растекаться по поверхности воды, образуя тонкую пленку. После прекращения растекания пленки определяют ее площадь $S$. Если предположить, что образовалась пленка толщиной в одну молекулу (из-за чего и прекратилось растекание масла), то толщина пленки $h$ будет равна диаметру молекулы. Толщина пленки равна отношению ее объема к площади:
Полученное в этом опыте численное значение толщины составляло $0.00000016$ см, или $1.6·10^$ см. Этим числом выражается примерный размер молекул (размеры атомов составляют около $10^$ см).
Поскольку молекулы очень малы, в каждом физическом теле их содержится огромное количество. Так, в $1см^3$ воздуха содержится около $27·10^$ молекул. Чтобы понять, насколько велико это число, представим себе, что через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдет через отверстие за $840 000$ лет.
Масса молекул
Масса молекул (за исключением молекул органических веществ, например, белков) очень мала. Так, масса молекулы воды составляет около $2.7·10^$ г. Работать с такими малыми цифрами неудобно, поэтому в физике и химии принято выражать массы атомов и молекул в относительных единицах.
Атомная единица массы
Атомная единица массы (а.е.м.) — единица массы, равная $/$ массы атома изотопа углерода $12^С$:
Чтобы перевести значение массы атомов или молекул, выраженной в $а.е.м.$, т. е. относительную молекулярную (или атомную) массу вещества $М_r$, в единицу массы СИ (кг), пользуются формулой:
где $N_А$ — постоянная Авогадро.
Атомная масса (относительная молекулярная масса)
Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:
где $M_r$ — относительная молекулярная (атомная) масса; $m_0$ — масса молекулы (атома), выраженная в единицах СИ (кг); $m_$ — масса молекулы изотопа углерода $^С$, выраженная в тех же единицах, что и $m_0$.
Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов. Например: $M_r(H_2O)=2·1+16=18; M_r(CO_2)=12+2·16=44$.
Атомные массы всех химических элементов точно измерены.
Моль. Постоянная Авогадро
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В $1$ моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в $0.012$ кг нуклида углерода $^С$ с атомной массой $12$.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается $N_А$:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул или других структурных элементов вещества), содержащихся в $1$ моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества $v$ равно отношению числа молекул $N$ в данном теле к постоянной Авогадро $N_А$, т. е. к числу молекул в $1$ моле вещества:
Молярная масса
Молярной массой вещества $М$ называют массу вещества, взятого в количестве $1$ моль:
где $m_0$ — масса молекулы данного вещества.
Поскольку для любого тела его масса т связана с количеством молекул $N$ в нем соотношением
то из $v=
Количество вещества равно отношению массы вещества к его молярной массе.
Из $v=
Модели строения газов, жидкостей и твердых тел
Французское слово gaz (газ) произошло от греческого слова «хаос», что означает «полный беспорядок», «неразбериха» (в древнегреческой мифологии хаос — зияющая бездна, наполненная туманом и мраком, якобы существовавшая до сотворения мира).
Термин «газ» был введен в начале XVII в. Я. Б. ван Бельмонтом. Действительно, модель молекулярного хаоса оказалась весьма плодотворной и сохранила свое значение для современных исследований.
Газ — это агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями. Во время столкновения молекулы резко меняют скорость и направление своего движения. Время столкновения молекул намного меньше промежутка времени между двумя столкновениями.
Объем, занимаемый газом, значительно сильнее зависит от давления и температуры, чем объем жидкостей и твердых тел.
Газ можно сжать так, что его объем уменьшится в несколько раз. Это значит, что расстояние между молекулами $l$ намного больше размеров самих молекул: $l >> d$. На таких расстояниях молекулы очень слабо притягиваются друг к другу. По этой причине газы не имеют собственной формы и постоянного объема. Нельзя заполнить газом, например, половину бутылки или стакана.
В отличие от жидкостей и твердых тел газы не образуют свободной поверхности и заполняют весь доступный им объем.
Газообразное состояние — самое распространенное состояние вещества Вселенной (межзвездное вещество, туманности, звезды, атмосферы планет). По химическим свойствам газы и их смеси очень разнообразны — от малоактивных инертных газов до взрывчатых смесей.
Давление газа. Беспрерывно и хаотически двигаясь, молекулы газа сталкиваются не только друг с другом, но и со стенками сосуда, в котором находится газ. Молекул в газе много, потому и число их ударов очень велико. Например, число ударов молекул воздуха, находящегося в комнате, о поверхность площадью $1см^2$ за $1с$, выражается двадцатитрехзначным числом. Хотя сила удара одной молекулы мала, но действие всех молекул на стенки сосуда значительно, оно и составляет давление газа.
Итак, давление газа на стенки сосуда и на помещенное в газ тело вызывается ударами молекул газа.
Жидкость — вещество в состоянии, промежуточном между твердым и газообразным. Это агрегатное состояние вещества, в котором молекулы (или атомы) связаны между собой настолько, что это позволяет ему сохранять свой объем, но недостаточно сильно, чтобы сохранять и форму.
Свойства жидкостей. Жидкости легко меняют свою форму, но сохраняют объем. В обычных условиях они принимают форму сосуда, в котором находятся.
Поверхность жидкости, не соприкасающаяся со стенками сосуда, называется свободной поверхностью. Она образуется в результате действия силы тяжести на молекулы жидкости.
Строение жидкостей. Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул. Объяснение поведения жидкостей на основе характера молекулярного движения жидкости было дано советским ученым Я. И. Френкелем. Оно заключается в следующем. Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удается совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей. Время оседлой жизни молекулы воды, т. е. время колебания около одного положения равновесия при комнатной температуре, равно в среднем $10^$ с. Время одного колебания значительно меньше — $10^—10^$с.
Поскольку расстояния между молекулами жидкости малы, то попытка уменьшить объем жидкости приводит к деформации молекул, они начинают отталкиваться друг от друга, чем и объясняется малая сжимаемость жидкости. Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задает их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда.
Твердое тело. Кристаллические и аморфные тела
Твердое тело — агрегатное состояние вещества, характеризующееся постоянством формы и характером движения атомов, которые совершают малые колебания около положений равновесия.
Кристаллические тела. Твердое тело в обычных условиях трудно сжать или растянуть. Для придания твердым телам нужной формы или объема на заводах и фабриках их обрабатывают на специальных станках: токарных, строгальных, шлифовальных.
В отсутствие внешних воздействий твердое тело сохраняет свою форму и объем.
Это объясняется тем, что притяжение между атомами (или молекулами) у них больше, чем у жидкостей (и тем более газов). Оно достаточно, чтобы удержать атомы около положений равновесия.
Молекулы или атомы большинства твердых тел, таких, как лед, соль, алмаз, металлы, расположены в определенном порядке. Такие твердые тела называют кристаллическими. Хотя частицы этих тел и находятся в движении, движения эти представляют собой колебания около определенных точек (положений равновесия). Частицы не могут уйти далеко от этих точек, поэтому твердое тело сохраняет свою форму и объем.
Кроме того, в отличие от жидкостей, точки положений равновесия атомов или ионов твердого тела, будучи соединенными, располагаются в вершинах правильной пространственной решетки, которая называется кристаллической.
Положения равновесия, относительно которых происходят тепловые колебания частиц, называются узлами кристаллической решетки.
Монокристалл — твердое тело, частицы которого образуют единую кристаллическую решетку (одиночный кристалл).
Анизотропия монокристаллов. Одним из главных свойств монокристаллов, которым они отличаются от жидкостей и газов, является анизотропия их физических свойств. Под анизотропией понимают зависимость физических свойств от направления в кристалле. Анизотропными являются механические свойства (например, известно, что слюду легко расслоить в одном направлении и очень трудно — в перпендикулярном), электрические свойства (электропроводность многих кристаллов зависит от направления), оптические свойства (явление двойного лучепреломления, и дихроизма — анизотропии поглощения; так, например, монокристалл турмалина «окрашен» в разные цвета — зеленый и бурый, в зависимости от того, с какой стороны на него посмотреть).
Поликристалл — твердое тело, состоящее из беспорядочно ориентированных монокристаллов. Поликристаллическими являются большинство твердых тел, с которыми мы имеем дело в быту — соль, сахар, различные металлические изделия. Беспорядочная ориентация сросшихся микрокристалликов, из которых они состоят, приводит к исчезновению анизотропии свойств.
Аморфные тела. Кроме кристаллических, к твердым телам относят также аморфные тела. Аморфный в переводе с греческого означает «бесформенный».
Аморфные тела — это твердые тела, для которых характерно неупорядоченное расположение частиц в пространстве.
В этих телах молекулы (или атомы) колеблются около хаотически расположенных точек и, подобно молекулам жидкости, имеют определенное время оседлой жизни. Но, в отличие от жидкостей, время это у них очень велико.
К аморфным телам относятся стекло, янтарь, различные другие смолы, пластмассы. Хотя при комнатной температуре эти тела сохраняют свою форму, но при повышении температуры они постепенно размягчаются и начинают течь, как жидкости: у аморфных тел нет определенной температуры плавления.
Этим они отличаются от кристаллических тел, которые при повышении температуры переходят в жидкое состояние не постепенно, а скачком (при вполне определенной температуре — температуре плавления).
Все аморфные тела изотропны, т. е. имеют одинаковые физические свойства по разным направлениям. При ударе они ведут себя как твердые тела — раскалываются, а при очень длительном воздействии — текут.
В настоящее время есть много веществ в аморфном состоянии, полученных искусственным путем, например, аморфные и стеклообразные полупроводники, магнитные материалы и даже металлы.
Изопроцессы в газах
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления ($р$), объема ($V$), температуры ($Т$).
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Закон Бойля-Мариотта
Закон Бойля-Мариотта — один из основных газовых законов, он описывает изотермические процессы в газе.
Процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим.
Для данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
$pV=const$ при $T=const$
Этот закон был экспериментально открыт английским ученым Р. Бойлем в 1662 г., в 1676 г. его сформулировал также французский ученый Э. Мариотт.
Закон строго выполняется только для идеальных газов. Для реальных газов он выполняется достаточно хорошо при небольших давлениях и высоких температурах. Так, при давлении $100$ атм. и температуре $0°$С отклонение измеренного значения $рV$ от расчетного составляет $7%$. Закон Бойля-Мариотта, как и другие газовые законы, является следствием уравнения состояния идеального газа.
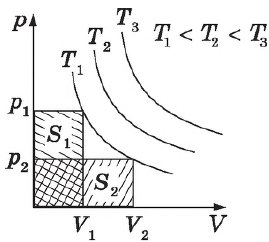
Графики зависимости $p(V)$ при $T=const$ ($p=
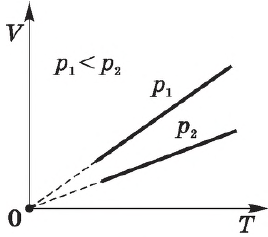
Закон Шарля
Давление $p$ данной массы газа при постоянном объеме пропорционально температуре.
$p=constT$ при $T=const$
Закон был открыт французским физиком Ж. Шарлем в 1787 году.
Процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным (от греч. hora — пространство).
Закон Шарля, как и другие газовые законы, является следствием уравнения состояния идеального газа:
Согласно $
/
В соответствии с $
/
Изохорный процесс используется в газовых термометрах постоянного объема.
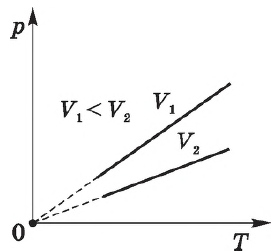
Закон Гей-Люссака
При постоянном давлении $р$ объем $V$ идеального газа меняется линейно с температурой.
где $V_0$ — начальный объем, $t$ — разность начальной и конечной температур. Коэффициент теплового расширения идеальных газов $α=(/)K^$ одинаков для всех газов.
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным (от греч. baros — вес, тяжесть).
Закон открыт французским ученым Ж. Гей-Люссаком в 1802 г. и независимо от него Дж. Дальтоном в 1801 г.
Закон Гей-Люссака, как и другие газовые законы, является следствием уравнения состояния идеального газа. Это становится очевидным, если в $V=V_0(1+αt)$ заменить $t$ абсолютной температурой $T=t+273.15$, а коэффициент расширения $α$ — его численным значением $/$:
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Согласно $
Эта зависимость графически изображается прямой, которая называется изобарой.
Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре, согласно закону Бойля—Мариотта, уменьшается, поэтому изобара, соответствующая более высокому давлению $р_2$, лежит ниже изобары, соответствующей более низкому давлению $р_1$.
В области низких температур все изобары идеального газа сходятся в точке $Т=0$, но это не означает, что объем реального газа действительно обращается в нуль. При низких температурах все газы обращаются в жидкости, а к жидкостям уравнение состояния не применимо.
Насыщенные и ненасыщенные пары
Насыщенный пар
При испарении одновременно с переходом молекул из жидкости в пар происходит и обратный процесс. Беспорядочно двигаясь над поверхностью жидкости, часть молекул, покинувших ее, снова возвращается в жидкость.
Если испарение происходит в закрытом сосуде, то сначала число молекул, вылетевших из жидкости, будет больше числа молекул, возвратившихся обратно в жидкость. Поэтому плотность пара в сосуде будет постепенно увеличиваться. С увеличением плотности пара увеличивается и число молекул, возвращающихся в жидкость. Довольно скоро число молекул, вылетающих из жидкости, станет равным числу молекул пара, возвращающихся обратно в жидкость. С этого момента число молекул пара над жидкостью будет постоянным. Для воды при комнатной температуре это число приблизительно равно $10^$ молекул за $1с$ на $1см^2$ площади поверхности. Наступает так называемое динамическое равновесие между паром и жидкостью.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Это означает, что в данном объеме при данной температуре не может находиться большее количество пара.
При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться. Точно так же не изменяется и масса насыщенного пара над этой жидкостью, хотя пар продолжает конденсироваться.
Давление насыщенного пара. При сжатии насыщенного пара, температура которого поддерживается постоянной, равновесие сначала начнет нарушаться: плотность пара возрастет, и вследствие этого из газа в жидкость будет переходить больше молекул, чем из жидкости в газ; продолжаться это будет до тех пор, пока концентрация пара в новом объеме не станет прежней, соответствующей концентрации насыщенного пара при данной температуре (и равновесие восстановится). Объясняется это тем, что число молекул, покидающих жидкость за единицу времени, зависит только от температуры.
Итак, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема.
Поскольку давление газа пропорционально концентрации его молекул, то и давление насыщенного пара не зависит от занимаемого им объема. Давление $р_0$, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
При сжатии насыщенного пара большая его часть переходит в жидкое состояние. Жидкость занимает меньший объем, чем пар той же массы. В результате объем пара при неизменной его плотности уменьшается.
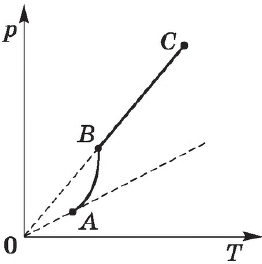
Зависимость давления насыщенного пара от температуры. Для идеального газа справедлива линейная зависимость давления от температуры при постоянном объеме. Применительно к насыщенному пару с давлением $р_0$ эта зависимость выражается равенством:
Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
Экспериментально определенная зависимость $Р_0(Т)$ отличается от зависимости $p_0=nkT$ для идеального газа. С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (участок кривой $АВ$). Это становится особенно очевидным, если провести изохору через точку $А$ (пунктирная прямая). Происходит это потому, что при нагревании жидкости часть ее превращается в пар, и плотность пара растет.
Поэтому, согласно формуле $p_0=nkT$, давление насыщенного пара растет не только в результате повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. Главное различие в поведении идеального газа и насыщенного пара заключается в изменении массы пара при изменении температуры при неизменном объеме (в закрытом сосуде) или при изменении объема при постоянной температуре. С идеальным газом ничего подобного происходить не может (МКТ идеального газа не предусматривает фазового перехода газа в жидкость).
После испарения всей жидкости поведение пара будет соответствовать поведению идеального газа (участок $ВС$ кривой).
Ненасыщенный пар
Если в пространстве, содержащем пары какой-либо жидкости, может происходить дальнейшее испарение этой жидкости, то пар, находящийся в этом пространстве, является ненасыщенным.
Пар, не находящийся в состоянии равновесия со своей жидкостью, называется ненасыщенным.
Ненасыщенный пар можно простым сжатием превратить в жидкость. Как только это превращение началось, пар, находящийся в равновесии с жидкостью, становится насыщенным.
Влажность воздуха
Влажность воздуха — это содержание в воздухе водяного пара.
Окружающий нас атмосферный воздух вследствие непрерывного испарения воды с поверхности океанов, морей, водоемов, влажной почвы и растений всегда содержит в себе водяные пары. Чем больше водяных паров находится в определенном объеме воздуха, тем ближе пар к состоянию насыщения. С другой стороны, чем выше температура воздуха, тем большее количество водяных паров требуется для его насыщения.
В зависимости от количества водяных паров, находящихся при данной температуре в атмосфере, воздух бывает различной степени влажности.
Количественная оценка влажности
Для того чтобы количественно оценить влажность воздуха, пользуются, в частности, понятиями абсолютной и относительной влажности.
Абсолютная влажность — это количество граммов водяного пара, содержащееся в $1м^3$ воздуха при данных условиях, т. е. это плотность водяного пара $р$, выраженная в г/$м^3$.
Относительная влажность воздуха $φ$ — это отношение абсолютной влажности воздуха $р$ к плотности $р_0$ насыщенного пара при той же температуре.
Относительную влажность выражают в процентах:
Концентрация пара связана с давлением ($p_0=nkT$), поэтому относительную влажность можно определить как процентное отношение парциального давления $р$ пара в воздухе к давлению $р_0$ насыщенного пара при той же температуре:
Под парциальным давлением понимают давление водяного пара, которое он производил бы, если бы все другие газы в атмосферном воздухе отсутствовали.
Если влажный воздух охлаждать, то при некоторой температуре находящийся в нем пар можно довести до насыщения. При дальнейшем охлаждении водяной пар начнет конденсироваться в виде росы.
Точка росы
Точка росы — это температура, до которой должен охладиться воздух, чтобы находящийся в нем водяной пар достиг состояния насыщения при постоянном давлении и данной влажности воздуха. При достижении точки росы в воздухе или на предметах, с которыми он соприкасается, начинается конденсация водяного пара. Точка росы может быть вычислена по значениям температуры и влажности воздуха или определена непосредственно конденсационным гигрометром. При относительной влажности воздуха $φ = 100%$ точка росы совпадает с температурой воздуха. При $φ > |U_
Как уже было показано, в процессе плавления кинетическая энергия движения молекул не меняется, так как температура системы неизменна, а подводимое тепло идет на разрушение кристаллической решетки твердого тела, т. е. на увеличение потенциальной энергии молекул и разрыва связей между ними, что приводит к превращению твердого тела в жидкость. В жидкостях средняя кинетическая энергия молекул меньше абсолютного значения средней потенциальной энергии (и внутренняя энергия в целом отрицательна, хотя ее абсолютное значение незначительно отличается от нуля).
При затвердевании , кинетическая энергия жидкости в результате контакта с окружающей средой (теплообмен) уменьшается до величины, при которой расстояния между молекулами становятся достаточными для образования устойчивых связей (образования кристаллических зародышей). Потенциальная энергия молекул в узлах образующейся кристаллической решетки уменьшается, а избыток кинетической энергии выделяется в виде тепла при неизменной температуре. Внутренняя энергия вещества в твердой фазе определяется главным образом взаимодействием молекул и зависит от их расположения: $Е_k t_1$ и, следовательно, $Q > 0$. При охлаждении тела $t_2 0$ и $∆U > 0$, его внутренняя энергия увеличивается. При охлаждении газа $Q 0$) он совершает положительную работу ($А’ > 0$). Если газ отдает тепло окружающей среде, $Q
1.2.Молекулярно-кинетическая теория газов
Молекулярно-кинетическая теория газов рассматривает идеальный газ:
а) молекулы не притягиваются и не отталкиваются;
б) молекулы взаимодействуют только при упругих столкновениях;
в) молекулы представляют собой материальные точки, т.е. обладают массой, но не имеют объёма.
В качестве критерия идеальности газов принято считать соотношение α/L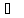
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в паскалях по имени французского учёного и математика
Блеза Паскаля (1623-1662). 1Па = 1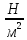
Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р) – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является термодинамическим параметром состояния.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
Термодинамическая температура Т всегда положительна. При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
Т = t + 273,15 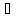
Ro= 8,314 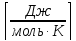
Удельный объем – отношение объема вещества к его массе 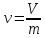
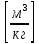
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
1.3. Универсальное уравнение состояния идеального газа
Уравнение состояния идеального газа Клапейрона – Менделеева:
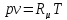
где р – давление, Па,

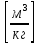
Rμ=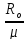
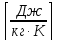
Например, для кислорода 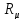
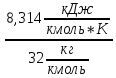

Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для любого процесса 1-2:, p1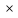
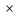
p2

Разделив левую часть первого уравнения на левую часть второго уравнения, а правую часть первого уравнения на правую часть второго уравнения и сократив Rμ, получим:
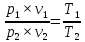
1.4. Смесь идеальных газов
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
Состав смеси задается долями объемными r, r1= 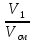

массовыми g g1= и мольными r1′ : r1′ =
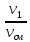
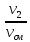
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
Молярная масса смеси: μсм= μ1r1+ μ2r2. μсм= 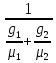
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь между объемными и массовыми долями: g1= r1∙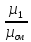
- http://revolution.allbest.ru/physics/00507166_0.html
- http://znanija.com/task/448290
- http://examer.ru/ege_po_fizike/teoriya/mkt_termodinamika_obyasnenie_yavlenij
- http://studfiles.net/preview/5276108/page:2/