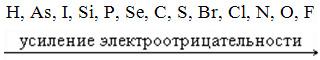а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
1. СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ — ВОССТАНОВИТЕЛЬНЫЕ свойства элементов.
2. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов.
3. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
в) Закономерности, связанные с размерами атомов.
1. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ.
2. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
Вопрос 3.
Строение вещества. Гибридизация орбиталей. Типы химических связей. Потенциал ионизации и электроотрицательность.
Все тела состоят из отдельных частиц — молекул и атомов. Молекулы — это наименьшие частицы вещества. Молекулы состоят из атомов.
Основные сведения о составе вещества:
1) Все тела состоят из отдельных частиц (молекул и атомов), между которыми есть промежутки.
2) Молекулы непрерывно и хаотично движутся.
3) Молекулы взаимодействуют между собой (притягиваются и отталкиваются).
1) Молекулы одного и того же вещества одинаковы.
2) При нагревании промежутки между молекулами увеличиваются, а при охлаждении — уменьшаются.
3) С увеличением температуры, скорость движения молекул возрастает.
По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических — немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
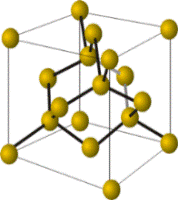
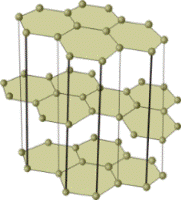
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение — слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников — кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде.
Гибридизация орбиталей
Гибридизация орбиталей — это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
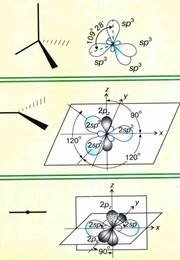
sp 2 — Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°.
Молекулы, в которых осуществляется sp 2 — гибридизация, имеют плоскую геометрию.
sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
Типы химических связей.
1) Ионная (металл + неметалл)
2) Ковалентная (неметалл + неметалл с помощью общих электронных пар)
Виды: * полярная (разные неметаллы)
* неполярная (одинаковые неметаллы)
Виды: * образована обменным механизмом
* образована донорно-акцепторным механизмом
Обменный механизм — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. Каждый из атомов предоставляет в общее пользование по одному электрону:
Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора) .
3) Металлическая (между атомами металлов, между ионами металлов и общими свободными электронами)
4) Водородная (между водородом одной молекулы и другим более электроотрицательным элементом (O, S, N, F) и с другой молекулой)
Потенциал ионизации атома — минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома.
Электроотрицательность (ЭО)– относительная способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Вопрос 4.
Последнее изменение этой страницы: 2017-02-05; Нарушение авторского права страницы
Контрольная работа 1
1.1. Составьте эмпирические формулы оксидов
Эмпирическая формула — запись простейшего выражения относительного числа каждого типа атомов в нём. Она представляет собой линейную запись из символов химических элементов, сопровождающуюся подстрочными индексами, указывающими отношение элементов в соединении.
Известно, что в оксиде молибден шестивалентный. Кислород двухвалентный. Соотношение Mo : O = 2 : 6 = 1 : 3.
Поэтому эмпирическая формула имеет вид MoO3.
2.2. Определите электронное семейство элементов, указанных в разделе 2.1, распределите валентные электроны по квантовым ячейкам в не возбужденном состоянии атома. Поясните, металлические или неметаллические свойства имеет данный элемент с точки зрения строения атома
У атома брома происходит заполнение 4p-подуровня, поэтому он принадлежит к семейству p-элементов.
Распределение электронов по квантовым ячейкам:
Бром имеет почти заполненный внешний электронный уровень (7 электронов). С этой точки зрения он является неметаллом и проявляет окислительные свойства. В то же время, поскольку валентные электроны расположены далеко от ядра, атом брома может отдавать от 1 до 7 электронов и проявлять восстановительные свойства.
2.3. Сравните свойства указанных элементов (радиусы атомов (r), их энергии ионизации (I), энергии сродства к электрону E), электроотрицательности (ЭО), а также химические свойства: металл – неметалл, восстановитель – окислитель) на основании строения атома
Для удобства составим таблицу, в которую занесём свойства атомов указанных элементов.
Энергия ионизации, эВ
Сродство к электрону, эВ
Анализ представленных данных позволяет сделать вывод о близкой химической природе алюминия и галлия. Атомы этих веществ имеют близкие энергетические характеристики — энергию ионизации, энергию сродства к электрону и электроотрицательность.
Внешний электронный уровень алюминия и галлия содержит 3 электрона:
13Al: 1s2 2s22p6 3s23p1
31Ga: 1s2 2s22p6 3s23p63d10 4s24p1
Поэтому алюминий и галлий являются металлами, а в химических реакциях проявляют восстановительные свойства.
2.5. Рассмотрите образование химических связей в молекулах с точки зрения метода валентных связей (МВС)
В молекуле BF3 имеет место sp2-гибридизация центрального атома, что определяет треугольную форму молекулы.
Атом бора в основном состоянии имеет электронную конфигурацию 1s22s22p1, а в возбужденном состоянии — 1s22s12p2. В основном состоянии валентность бора равна 1, в возбужденном состоянии — 3.
Атом фтора в основном и возбужденном состояниях имеет электронную конфигурацию 1s22s22p5. Валентность фтора равна 1.
В результате гибридизации орбиталей бора образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов.
Эти гибридные орбитали взаимодействуют с p-орбиталями атомов фтора:
В молекуле BF3 после образования трех σ-связей у атома бора остается вакантная 2р-орбиталь. Негибридная p-атомная орбиталь перпендикулярна плоскости.
Связи B—F в молекуле полярны. В целом молекула неполярна, так как центры положительного и отрицательного зарядов совпадают.
3.2. Напишите выражение константы химического равновесия обратимой реакции. В соответствии с принципом Ле-Шателье, обоснуйте, в каком направлении сместится равновесие реакции при понижении температуры
332. 2HCl(г) D H2(г) + Cl2(г); DН0 = 184,6 кДж
2HCl(г) D H2(г) + Cl2(г); DН0 = 184,6 кДж
Выражение константы равновесия:
Понижение температуры смещает равновесие в сторону экзотермической реакции.
Тепловой эффект реакции положителен, — теплота поглощается, реакция эндотермическая. Значит, при понижении температуры равновесие сместится влево (в сторону образования HCl).
Литература
1. Глинка химия. – М.: КноРус, 2013. – 752 с.
2. Коровин химия. – М.: Высшая школа, 2008. – 560 с.
3. , Смарыгин химия. – М.: Дрофа, 2005. – 592 с.
4. Угай и неорганическая химия. – М.: Высшая школа, 2004. – 528 с.
5. Лидин по общей и неорганической химии. – М.: КолосС, 2008. – 352 с.
Общая и неорганическая химия
Определите электронное семейство элементов, распределите валентные электроны по квантовым ячейкам в не возбужденном состоянии атома. Поясните, металлические или неметаллические свойства имеет данный элемент с точки зрения строения атома.
Лучший ответ по мнению автора
Федор Жуков
Вольфрам W (Z = +74)
В соответствии с рядом Клечковского, электронная формула вольфрама:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4
на внешнем энергетическом уровне вольфрама 2 электрона (6s2), вольфрам проявляет металлические свойства.
Оцените, пожалуйста, ответ. Если он Вас устраивает, отметьте как лучший. Если желаете, оставьте отзыв о работе эксперта. Спасибо
Тема №2 «Закономерности изменения химических свойств элементов»
В данном уроке рассматриваются основные законы периодичности таблицы Менделеева, изменения свойств элементов по группам и периодам, основные свойства различных групп.
Закономерности изменения химических свойств элементов.
Оглавление
Периодичность свойств химических элементов
Радиусы атомов, их периодические изменения в системе химических элементов
В одной и той же группе с увеличением номера периода атомные радиусы возрастают, т. к. увеличение заряда атома оказывает противоположный эффект. С точки зрения теории строения атомов принадлежность элементов к металлам или неметаллам определяется способностью их атомов отдавать или присоединять электроны. Атомы металлов сравнительно легко отдают электроны и не могут их присоединять для достраивания своего внешнего электронного слоя.
Радиусы атомов
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
a) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
- При перемещении СПРАВА НАЛЕВО вдоль ПЕРИОДА МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении — возрастают неметаллические. Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
- Например, углерод — более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод. Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!), все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того — в левой или правой части таблицы они находятся.
- У d- и f-элементов, как мы знаем, есть «резервные» электроны из «предпоследних» оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
- Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы. Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам. Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный «блок» (это сделано в “длинной” форме таблицы), то обнаружится закономерность, показанная на Левая нижняя часть блока содержит типичные металлы, правая верхняя — типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
- Полуметаллы расположены примерно вдоль диагонали, проходящей по p-элементам от левого верхнего к правому нижнему углу Периодической таблицы
- Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной «октетной» ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них — существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
- При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой «шубой» из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
- Перечисленные выше причины объясняют, почему СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ — ВОССТАНОВИТЕЛЬНЫЕ свойства элементов.
- Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У «тяжелых» благородных газов криптона и ксенона, которые находятся в нижней части группы, удается «отобрать» электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для «легких» гелия, неона и аргона это осуществить не удается.
- В правом верхнем углу таблицы находится самый активный неметалл-окислитель фтор (F), а в левом нижнем углу — самый активный металл-восстановитель цезий (Cs). Элемент франций (Fr) должен быть еще более активным восстановителем, но его химические свойства изучать крайне трудно из-за быстрого радиоактивного распада.
- По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
- При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
- в) Закономерности, связанные с размерами атомов.
- Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода.
- При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
г) Закономерности, связанные с валентностью элементов.
- Элементы одной и той же ПОДГРУППЫ имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
- s-Элементы имеют валентности, совпадающие с номером их группы.
- p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы (число электронов на внешней оболочке).
- d-Элементы обнаруживают много разных валентностей, которые нельзя точно предсказать по номеру группы.
- Не только элементы, но и многие их соединения — оксиды, гидриды, соединения с галогенами — обнаруживают периодичность. Для каждой ГРУППЫ элементов можно записать формулы соединений, которые периодически «повторяются» (то есть могут быть записаны в виде обобщенной формулы).
Итак, подытожим закономерности изменения свойств, проявляемые в пределах периодов:
Изменение некоторых характеристик элементов в периодах слева направо:
- заряд ядер атомов увеличивается;
- радиус атомов уменьшается;
- электроотрицательность элементов увеличивается;
- количество валентных электронов увеличивается от 1 до 8 (равно номеру группы);
- высшая степень окисления увеличивается (равна номеру группы);
- число электронных слоев атомов не изменяется;
- металлические свойства уменьшается;
- неметаллические свойства элементов увеличивается.
Изменение некоторых характеристик элементов в группе сверху вниз:
- заряд ядер атомов увеличивается;
- радиус атомов увеличивается;
- число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода);
- число электронов на внешнем слое атомов одинаково (равно номеру группы);
- прочность связи электронов внешнего слоя с ядром уменьшается;
- электроотрицательность уменьшается;
- металличность элементов увеличивается;
- неметалличность элементов уменьшается.
Z — порядковый номер, равен числу протонов; R — радиус атома; ЭО — электроотрицательность; Вал е- —количество валентных электронов; Ок. св. — окислительные свойства; Вос. св. — востановительные свойства; Эн. ур. — энергитические уровни; Ме — металические свойства; НеМе — неметаллические свойства; ВСО — высшая степень окисления
Шпаргалки
Справочный материал для прохождения тестирования:
Характеристика элемента по его положению в Периодической системе Д. И. Менделеева с точки зрения строения атома
|
- http://pandia.ru/text/80/327/19550.php
- http://www.liveexpert.ru/topic/view/555180-obshaya-i-neorganicheskaya-himiya
- http://www.chem-mind.com/2017/03/05/%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%BD%D0%BE%D1%81%D1%82%D1%8C-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85-%D1%8D%D0%BB/
- http://uz.denemetr.com/docs/1267/index-4294.html
- http://studfiles.net/preview/6327915/
- http://helpiks.org/9-20224.html
- http://skachate.ru/fizika/127763/index.html
- http://referatbooks.ru/kontrolnaya-rabota/himiya-zadaniya/