Ответ оставил Гость
Из за движение молекул газа происходят соударения о стенки сосуда. Тк молекул много и они маленькие, то соударения происходят в огромном количество и равномерно по всей площади сосуда. Они и вызывают давление
Если ответа нет или он оказался неправильным по предмету Физика, то попробуй воспользоваться поиском на сайте или задать вопрос самостоятельно.
Если же проблемы возникают регулярно, то возможно Вам стоит обратиться за помощью. Мы нашли великолепную онлайн школу, которую без всяких сомнений можем порекомендовать. Там собраны лучшие преподаватели, которые обучили множество учеников. После обучения в этой школе, Вы сможете решать даже самые сложные задачи.
Газы: частица движутся свободно между столкновениями друг с другом.
Жидкости: частицы колеблются около положения равновесия, сталкиваюсь с соседними молекулами. Время от времени она совершает прыжок на другое место.
Твёрдые тела: частицы колеблются около определенных положений равновесия. Иногда частицы меняют положения равновесия, но это происходит крайне редко.
Каков характер упаковки частиц у газов, жидкостей и твердых тел?
Твёрдые тела и жидкости упаковка плотная: расстояния между центрами соседних частиц приблизительно равно диаметру самих частиц. В газах: расстояние между соседними частицами во много раз больше диаметров частиц.
Каково среднее расстояние между молекулами у газов, жидкостей и твердых тел?
Среднее расстояние между молекулами а) газов: намного больше размеров самих молекул; б) жидкостей: равно диаметру молекул; в) твердых тел: равно диаметру молекул.
Перечислите основные свойства газов, жидкостей и твердых тел.
а) Газы: занимают весь предоставленный объём, не имеют форму; б) жидкостей: текучи, сохраняют объём, принимают форму сосуда; в) твёрдые тела: сохраняют объём и форму.
Что называют идеальным газом в МКТ?
Идеальный газ-это модель сильно разряжённых реальных газов, это газ частицы которого только движутся и не взаимодействуют электромагнитными силами друг с другом. Частицы этого газа представляются в виде упругих шариков.
Назовите условия, при которых газ можно считать идеальным?
Плотность газа очень мала, то есть он сильно разряжён: промежутки между молекулами настолько велики, что они не притягиваются и не отталкиваются электромагнитными силами.
Модуль 6. Основное уравнение МКТ.
Каков механизм возникновения давления газа с точки зрения МКТ?
Газы давят на поверхности тел и стенки сосудов за счёт столкновений молекул этими поверхностями.
Какую скорость движения молекул называют средней квадратичной?
Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа.
Что называют концентрацией молекул? Какая формула выражает смысл этого понятия?
Концентрация показывает, какое количество молекул содержится в 
Запишите и объясните физический смысл основного уравнения МКТ?
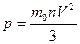
Последнее изменение этой страницы: 2016-12-12; Нарушение авторского права страницы
Давление газа с точки зрения молекулярно-кинетической теории. Молекулярно-кинетический смысл абсолютной температуры
Давление газа с точки зрения молекулярно-кинетической теории.
Давление газа на стенку сосуда есть результат ударов мапе-кул газа об эту стенку. При каждом ударе молекула газа действует на стенку с определенной (с макроскопической точки зрения бесконечно малой) силой. Обратно направленная сила, с которой действует на молекулу стенка сосуда, заставляет молекулу отражаться от стенки. Если бы в сосуде содержалось всего несколько молекул, го пх удары следовали бы друг за другом редко и беспорядочно, п нельзя было бы говорить ни о какой регулярной силе давления, действующей на стенку. Мы имели бы дело с отдельными практически мгновенными бесконечно малыми толчками, которым время от времени подвергалась бы стенка. Если же число молекул в сосуде очень велико, то будет велико и числе ударов их о стенку сосуда. Удары станут следовать непрерывно друг за другом. Одновременно о стенку сосуда будет ударяться громадное количество молекул. Бесконечно малые силы отдельных ударов складываются в конечную и почти постоянную силу, действующую на стенку. Эта сила, усредненная по времени, и есть давление газа, с которым имеет дело макроскопическая физика.
При своем движении молекулы газа ударяются о стенки сосуда, в котором находится газ, создавая тем самым давление газа на стенки. Если газ находится в равновесии, то все направляющие движения молекул равновероятны.
Пусть в единице объема содержится n0 молекул. При абсолютно упругом ударе молекулы об стенку ее импульс изменяетмся на 2m0v. Ясно, что за время t до стенки долетят и упруго отразятся от нее все молекулы, находящиеся внутри параллелепипеда с основанием S и высотой vt.
Таких молекул будет: n = (1/6) n0 S v t ; следовательно общее изменение импульса молекул, долетевших за время t до стенки и упруго-отразившихся от нее будет: 2m0 v n = (1/3) n0 m0 v (ст.2) S t ; Это изменение импульса равно импульсу силы, действующей со стороны стенки на молекулы, а следовательно, согласно третьему закону Нбютона со стороны молекул на стенки: (1/3) n0 m0 v (ст.2) S t = F t ; F = (1/3) m0 v (ст.2) n0 S ; P = (1/3) n0 m0 v (ст.2) — основное уравнение.
Термодинамическая температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражаестя следующей формулой:
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
kB = 1.380 6505(24) × 10−23 Дж/K — постоянная Больцмана
T — термодинамическая температура, К
Абсолютная температура – есть величина, пропорциональная средней энергии поступательного движения молекул.
1.2.Молекулярно-кинетическая теория газов
Молекулярно-кинетическая теория газов рассматривает идеальный газ:
а) молекулы не притягиваются и не отталкиваются;
б) молекулы взаимодействуют только при упругих столкновениях;
в) молекулы представляют собой материальные точки, т.е. обладают массой, но не имеют объёма.
В качестве критерия идеальности газов принято считать соотношение α/L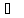
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в паскалях по имени французского учёного и математика
Блеза Паскаля (1623-1662). 1Па = 1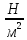
Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р) – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является термодинамическим параметром состояния.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
Термодинамическая температура Т всегда положительна. При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
Т = t + 273,15 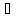
Ro= 8,314 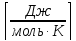
Удельный объем – отношение объема вещества к его массе 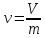
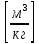
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
1.3. Универсальное уравнение состояния идеального газа
Уравнение состояния идеального газа Клапейрона – Менделеева:
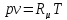
где р – давление, Па,

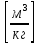
Rμ=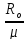
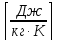
Например, для кислорода 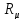
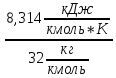

Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для любого процесса 1-2:, p1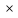
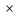
p2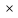

Разделив левую часть первого уравнения на левую часть второго уравнения, а правую часть первого уравнения на правую часть второго уравнения и сократив Rμ, получим:
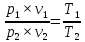
1.4. Смесь идеальных газов
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
Состав смеси задается долями объемными r, r1= 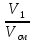

массовыми g g1= и мольными r1′ : r1′ =
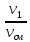
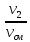
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
Молярная масса смеси: μсм= μ1r1+ μ2r2. μсм= 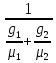
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь между объемными и массовыми долями: g1= r1∙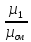
Механизм возникновения давления с точки зрения мкт
59. Давление газа с точки зрения молекулярно-кинетической теории
59. Давление газа с точки зрения молекулярно-кинетической теории
1. Молекулы взаимодействуют друг с другом посредством моле-кулярных сил. На далеких расстояниях — это силы притяжения, убывающие с увеличением расстояния, на близких — силы отталкивания, быстро возрастающие при сближении молекул. Расстояние между центрами сблизившихся молекул, на котором силы притяжения переходят в силы отталкивания, принимается за диаметр молекулы. В газах при нормальных условиях средние расстояния между молекулами еще велики по сравнению с их диаметрами. На таких расстояниях молекулярные силы очень слабы и не играют существенной роли. Молекулярные силы проявляются лишь на близких расстояниях порядка диаметров молекул. Под действием этих сил скорости сблизившихся молекул претерпевают значительные изменения как по величине, так и но направлению. Взаимодействия молекул на близких расстояниях называют столкновениями. Между двумя последовательными столкновениями молекула газа движется практически свободно, т. е. прямолинейно и равномерно. При каждом столкновении молекула газа почти мгновенно меняет направление своего движения, а затем движется с новой скоростью опять прямолинейно и равномерно, пока не произойдет следующее столкновение. Если газ в целом находится в покое (например, заключен в закрытом сосуде), то в результате столкновений устанавливается хаотическое движение, в котором все направления движения молекул равновероятны. Оно называется тепловым движением. Чем более разрежен газ, тем длиннее средний путь, проходимый молекулой между двумя последовательными столкно-вениями. Для достаточно разреженного газа, заключенного в сосуд, можно в первом приближении пренебречь размерами молекул и столкновениями их друг с другом. Надо учесть только столкновения молекул со стенками сосуда, в который газ заключен. В этом при-ближении молекулы газа могут рассматриваться как материальные точки, не взаимодействующие между собой и движущиеся прямолинейно и равномерно между каждыми двумя последовательными столк-новениями со стенками сосуда. Такая простейшая модель приводит к законам идеальных газов. Чтобы показать это, надо выяснить моле-кулярный смысл давления, температуры и внутренней энергии газа.
2. Давление газа на стенку сосуда есть результат ударов мапе-кул газа об эту стенку. При каждом ударе молекула газа действует на стенку с определенной (с макроскопической точки зрения бесконечно малой) силой. Обратно направленная сила, с которой действует на молекулу стенка сосуда, заставляет молекулу отражаться от стенки. Если бы в сосуде содержалось всего несколько молекул, го пх удары следовали бы друг за другом редко и беспорядочно, п нельзя было бы говорить ни о какой регулярной силе давления, действующей на стенку. Мы имели бы дело с отдельными практически мгновенными бесконечно малыми толчками, которым время от времени подвергалась бы стенка. Если же число молекул в сосуде очень велико, то будет велико и числе ударов их о стенку сосуда. Удары станут следовать непрерывно друг за другом. Одновременно о стенку сосуда будет ударяться громадное количество молекул. Бесконечно малые силы отдельных ударов складываются в конечную и почти постоянную силу, действующую на стенку. Эта сила, усредненная по времени, и есть давление газа, с которым имеет дело макроскопическая физика.
3. Вычислим давление газа на стенку сосуда. Пусть газ заключен в закрытый сосуд, и все молекулы одинаковы. Вообще говоря, они дви-жутся с различными скоростями, отличающимися друг от друга как по величине, так и по направлению. Разделим все молекулы на группы так, чтобы молекулы одной и той же группы в рассматриваемый момент времени имели приблизительно одинаковые по величине и направлению скорости. Скорость молекул i-й группы обозначим Vi, а число таких молекул в единице объема — /7,. Возьмем на стенке сосуда малую площадку о (рис. 43). Если молекулы движутся по направлению к площадке о, то они могут столкнуться с ней. Если же они движутся от площадки, то столкновений не будет. Предположим, что молекулы г-й группы движутся ио направлению к площадке а, и подсчитаем число г; молекул такой группы, ударяющихся об эту площадку за малое время dt. Построим на площадке а, как на основании, косой цилиндр с обра-зующими V >
Zi = atiiVix dt.
Дальнейший ход вычислений зависит от характера взаимодействия ударяющихся молекул со стенкой. Обычно при вычислениях считают, что стенка гладкая, а молекулы при ударе отражаются от нее зеркально, т. е. по законам удара идеально упругих шаров: абсолютная величина скорости при отражении не изменяется, угол падения равен углу отражения. Затем доказывается, что эти предположения не являются существенными. Однако в действительности стенка сосуда для ударяющейся молекулы не может быть идеальным зеркалом — ведь она сама состоит из молекул. Благодаря этому молекулы i-й группы после отражения будут иметь, вообще говоря, самые разнообразные по величине и направлению скорости, направленные от стенки, и распределятся по различным скоростным группам. Поэтому мы проведем дальнейшие вычисления, не вводя никаких специальных предположений относительно законов отражения молекул от стенки сосуда. Единственное предположение, которое будет и пользовано в вычислениях, состоит в том, что при отражении от стенки молекула в среднем не теряет и не приобретает кинетическую энергию. В дальнейшем будет показано, что это предположение означает, что температура газа должна быть равна температуре стенки. Для целей вычисления процесс взаимодействия молекулы со стенкой удобно мысленно разбить на два этапа. На первом этапе молекула замедляется и останавливается, как бы прилипая к стенке. Иа втором этапе молекула отталкивается стенкой, ускоряется и отскакивает от нее. Вычислим сначала силу F, которая действовала бы на площадку о со стороны газа, если бы весь процесс взаимодействия молекул газа со стенкой ограничивался только первым этапом, т. е. в предположении, что после ударов молекулы газа как бы прилипают к стенке. Молекулы i-ii группы, ударившиеся о площадку о за время dt, до удара обладали количеством движения г,р; == — atiiVixP > 0), т.е.
К силе F] следует прибавить силу F, которая действует на площадку о на втором этапе. Сила F, вполне аналогична силе отдачи, испытываемой орудием при выстреле. Роль снаряда играют молекулы, летящие от площадки о, т. е. молекулы, для которых vix а с неи и Давление газа Р.
Однако столкновения вносят качественные изменения в физическую интерпретацию давления Р. Пока не было столкновений, молекулы газа совершенно не взаимодействовали друг с другом. Величина Р имела только один смысл: она давала давление газа иа стенку сосуда. При наличии столкновений появляется силовое взаимодействие между макроскопическими частями газа. Роль стенки для любой макроскопической части газа может играть граничащая с ней другая макроскопическая часть того же газа. В этих условиях величина Р имеет также смысл внутреннего давления, посредством которого осуществляется силовое взаимодействие между примыкающими друг к другу макроскопическими частями газа. Именно такой смысл имеет давление Р в гидродинамике и аэродинамике.
5. Формулы (59.4) и (59.5) применимы как к нерелятпвистским,
так и к релятивистским движениям молекул. В случае нереляти-
вистских движений масса молекулы т может считаться постоянной.
§ eoj СКОРОСТИ ТЕПЛОВОГО ДВИЖЕНИЯ ГАЗОВЫХ МОЛЕКУЛ 193
Полагая в формулах (59.4) и (59.5) р = mv, получим для этого случая
При выводе этих формул молекулы рассматривались как бес-структурные материальные точки. Не принималось во внимание вращение молекул, а также внутримолекулярное движение. При столкновениях могут меняться скорости вращения молекул. Молекула может перейти в возбужденное состояние, или из возбужденного состояния вернуться в нормальное. Но все эти процессы не играют роли, когда речь идет о вычислении давления газа. Существенно только изменение поступательного количества движения молекулы при столкновениях ее со стенкой. Оно равно массе молекулы, умноженной на изменение скорости ее центра масс. Поэтому формулы (59.6) и (59.7) остаются в силе. Надо только понимать под v скорость поступательного движения молекулы (точнее, ее центра масс). Таким образом, формуле (59.7) можно придать вид
где (/inner) — среднее значение суммы кинетических энергий по-ступательного движения всех молекул газа. При столкновениях энергии вращательного и внутримолекулярного движений могут переходить в энергию поступательного движения и наоборот. Однако в установившемся состоянии среднее значение величины ЕтсТ остается неизменным.
Формула (59.8), как ясно из ее вывода, справедлива не только для однородного газа, но и для смеси различных газов. В этом случае под ЕПОСТ по-прежнему следует понимать сумму кинетических энергий поступательного движения молекул всех газов, содержащихся в сосуде. Из вывода ясно также, что для нашей модели газа, состоящей из невзаимодействующих молекул, справедлив закон Дальтона: давление смеси газов равно сумме парциальных давлений этих газов.
| Автор: Диков Александр | Дата: 2010-05-17 01:08:18 | Просмотров: 7640 |
Репетиторы, математика, русский язык, физика, сдать ЕГЭ, ЕГЭ 2012, тестирование ЕГЭ, ответы по ЕГЭ, репетитор, карта сайта,
Все права защищены и принадлежат авторам размещающих материалы на сайте. Данный сайт ни какой ответственности за размещенный материал не несет. Копирование материалов возможна только с указанием URL ссылки на исходный материал.
Молекулярно-кинетический смысл давления
Читайте также:
- Административный процесс можно рассматривать в широком управленческом смысле и в узком юрисдикционном смысле.
- Альбер Камю(1913 — 1960) сделал главной проблемой своей экзистенциональной философии проблему смысла жизни.
- В общем смысле под этикой управления понимается свод моральных принципов и ценностей, направляющих поведение индивида или группы индивидов.
- Вероятностный смысл математического ожидания
- Владение в экономическом и юридическом смысле
- Вопрос 3. Процесс группового давления.
- Геометрический смысл векторного произведения
- Геометрический смысл комплексного числа
- Геометрический смысл определенного интеграла
- Геометрический смысл производной
- Геометрический смысл смешанного произведения
- Лицензия на осуществление видов деятельности отличается от лицензии на право пользования участком недр, так как регулируются разными законами и имеют различный правовой смысл.
Опыт Штерна
Молекулярно-кинетическая теория
В основе молекулярно-кинетической теории лежат три положения:
1) Вещество состоит из микроскопических частиц (молекул), разделенных промежутками
2) Эти частицы (молекулы) находятся в непрерывном хаотическом движении
3) Частицы взаимодействуют друг с другом с силами, которые на больших расстояниях являются силами притяжения, а на маленьких, силами отталкивания
Впервые предположение о дискретном строении вещества на уровне догадок высказал Демокрит. Основы молекулярно-кинетической теории были заложении русским ученым Ломоносовым. Дальнейшее развитие МКТ получила в трудах Клаузиуса, Максвелла, Больцмана и Джоуля. МКТ подтверждают теплопроводность, броуновское движение, процесс диффузии.
Молекула – наименьшая устойчивапя обособленная частица вещества, обладающая его основными химическими свойствами. Размеры молекул колеблются от 10 –10 до 10 –7 м.
МКТ находит свое подтверждение в броуновском движении, диффузии. Определение скорости теплового движения впервые было осуществлено в опыте Штерна.
Установка немецкого физика О. Штерна состояла из двух коаксиальных цилиндров. По общей оси протянута платиновая проволока, покрытая слоем серебра. При пропускании тока по проволоке, атомы серебра испаряются. Испаряющиеся атомы разлетаются во все стороны. Во внутреннем цилиндре имеется щель, пролетая сквозь которую, атомы серебра оседают на внутренней поверхности внешнего цилиндра. При вращении установки. Атомы осаждаются не напротив щели, а смещаются на некоторое расстояние. Измеряя смещение можно вычислить скорость атомов серебра. При вращении серебряная полоска оказывается размытой, что говорит о том, что атомы имеют разную скорость.
С точки зрения молекулярно кинетической теории, давление газа – это есть результат ударов молекул газа о стенку.
Выделим площадку и рассмотрим процесс столкновений молекул с этой стенкой. Будем считать, что молекулы движутся с разными скоростями, в разных направлениях, но молекулы газа одинаковы.
Разделим процесс столкновения на два этапа:
1. Молекулы подлетают к стенке и, в процессе взаимодействия с молекулами стенки их скорость становится равной нулю.
2. Импульс молекулы увеличивается под действием силы отталкивания от нуля до конечного значения скорости, с которой молекулы отлетают от стенки.
Разделим все газа на группы, так что молекулы каждой имеют почти одну и ту же по величине и направлению скорость и рассмотрим молекулы какой-то i-той группы.
В процессе 1 за время dt к стенке подлетают молекул данной группы, при этом их импульс меняется на величину , где – число молекул данной группы в единицу объема газа.
В процессе 2 молекулы отлетают от стенки хаотично. Рассмотрим j группу молекул, двигающихся от стенки. За время dt их импульс изменился за счет действия сил отталкивания от стенки на величину
Средняя сила, действующая на молекулы газа, направлена перпендикулярно стенке вдоль оси Ox, поэтому , где в последней сумме учитываются молекулы, движущиеся как к стенке, так и от нее. Давление . В силу того, что все направления движения молекул равновероятны, , где , . Тогда . Эта формула справедлива как в релятивистском случае, так в нерелятивистском. В нерелятивистском случае можно формулу расписать как , где – средняя кинетическая энергия поступательного движения одной молекулы.
Замечание 1: При выводе этой формулы не учитывались столкновения между молекулами. Поскольку при столкновении происходит процесс перехода одной группы в другую, то при вычислении давления это будет не существенно, а существенен учет поступательного движения молекул.
Замечание 2: Если молекулы не тождественны и взаимодействуют друг с другом, то можно найти давление каждой группы молекул, а общее давление будет равно сумме давлений каждой группы …. Отсюда следут закон Дальтона.
Пример: Давление фотонного газа.
Если скорость частиц газа сравнима со скоростью света, то такой газ называется релятивистким в земных условиях.
Возьмем какую-то полость и будем поддерживать стенки этой полостипри какой-то постоянной температуре. Стенки будут испускать инфракрасное излучение, состоящее из фотонов. Такой газ, состоящий из хаотически движущихся во всех направлениях фотонов, называется фотонным газом. Давление фотонного газа можно посчитать, учитывая, что импульс фотона равен , тогда , где – объемная плотность потока энергии.
| | | следующая лекция ==> | |
| Термодинамические неравенства | | | Теорема о равномерном распределении кинетической энергии по степеням свободы |
Дата добавления: 2014-01-04 ; Просмотров: 1840 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Молекулярная физика. Термодинамика
Молекулярная физика. Термодинамика.
1.Какие тела называют макроскопическими?
1.это тела, состоящие из малого числа молекул;
2.это тела, состоящие из большого числа молекул;
2.Какое движение называют тепловым?
1.это беспорядочное движение молекул;
2.это упорядоченное движение молекул
3.Каковы основные положения МКТ?
1.вещество состоит из частиц;
2.частицы хаотически движутся;
3.частицы взаимодействуют друг с другом;
4 вещество состоит из частиц;. частицы хаотически движутся; частицы взаимодействуют друг с другом;
4.Каковы размеры молекул?
1.1,7 х 10-10м ; 2. 1,7 х 10-12м; 3. 1,7 х 10-7м; 4. 1,7 х 10-9м;
5.Какие факты доказывают, что вещество состоит из частиц?
6.Какие факты доказывают, что частицы беспорядочно движутся?
7. Какие факты доказывают, что частицы взаимодействуют друг с другом?
1.диффузия, броуновское движение;
2.капли слипаются, смачивание, твердое тело без усилий не разорвать;
3.растворимость твердых и жидких веществ, фото крупных молекул, сжимаемость газов;
8.Что называют относительной молекулярной массой?
9.Что называют молярной массой?
1.масса вещества, взятая в количестве 1 моля;
2.отношение массы молекулы mо данного вещества к 1/12 массы атома углерода mоС;
10.Что представляет собой 1 моль вещества?
1.это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг;
2. это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,12 кг;
11.Чему равно число Авогадро?
1. 6,02 хмоль,02 хмоль,02 хмоль,02 х 1 12.Как определить количество вещества?
12.Как определить молярную массу?
13.Как определить число молекул любого количества вещества?
1. ν = N/NА ; 2. ν = mо NА ; 3. N = NА 
14.Какие параметры называют макроскопическими?
1.характеризуют состояние макроскопических тел;
2.характеризуют состояние микроскопических тел;
15.Какое равновесие называют тепловым?
1.состояние, при котором все параметры остаются долго неизменными;
2.состояние, при котором все макроскопические параметры остаются долго неизменными;
3.состояние, при котором все параметры быстро меняются ;
4.состояние, при котором часть макроскопических параметров остается неизменными;
16.Что характеризует температура?
1.состояние теплового равновесия;
2.состояние динамического равновесия;
3.состояние движения молекул;
4.скорость движения молекул;
17.Каким прибором измеряют температуру?
1.манометром 2.хронометром; 3.термометром; 4.гигрометром;
18.Почему гаснет свеча в сильной струе воздуха?
19.Когда лед может быть нагревателем?
20.Какой термометр более чувствительный: ртутный или спиртовой (при прочих равных условиях)?
1.коэффициент объемного расширения спирта больше, чем у ртути;
2.если другое тело имеет температуру ниже температуры льда;
3.удаляя пламя струей воздуха от фитиля свечи, снижаем температуру ниже той, при которой соединяется стеарин с кислородом воздуха;
21.Чему равны средние кинетические энергии молекул всех газов при тепловом равновесии?
1.одинаковы; 2.разные; 3.зависит от вида газа;
22.Что называют абсолютным нулем температуры?
1.очень низкую температуру;
2.при которой давление идеального газа равно нулю, при постоянном объеме;
3.при которой давление идеального газа неравно нулю, при постоянном объеме;
4.при которой давление идеального газа равно нулю, при изменении объеме;
23.Чему равна постоянная Больцмана?
1. 1,38∙ 10-23 
24.Как связана средняя кинетическая энергия хаотического движения молекул с абсолютной температурой?
1. 




25.Как зависит давление идеального газа от концентрации и температуры?
1. 




26.Как определить среднюю квадратичную скорость теплового движения молекул?
1. 





27.Какой газ называют идеальным?
1.это газ, взаимодействие, между молекулами которого очень велико;
2.это газ, взаимодействие, между молекулами которого очень мало;
3.это реальный газ (им может быть и воздух);
4.это физическая модель реального газа;
28.Что представляет собой идеальный газ?
1.расстояние между молекулами больше их диаметра, молекулы — упругие шарики, силы притяжения равны нулю, движение молекул по законам Ньютона, отталкивание – только при ударах;
2.расстояние между молекулами меньше их диаметра, молекулы — упругие шарики, силы притяжения равны нулю, движение молекул по законам Ньютона, отталкивание – только при ударах;
3.расстояние между молекулами больше их диаметра, молекулы — упругие шарики, силы притяжения равны нулю, движение молекул по законам атомной физики, отталкивание – только при ударах;
4.расстояние между молекулами больше их диаметра, молекулы — упругие шарики, силы притяжения больше нуля, движение молекул по законам Ньютона, отталкивание – только при ударах;
29.Каков механизм возникновения давления газа с точки зрения МКТ?
1.давление газа возникает в результате столкновения молекул со стенками сосуда, в котором находится газ;
2. давление газа возникает в результате его расширения в сосуде, в котором находится газ;
3.давление газа возникает в результате столкновения молекул друг с другом ;
30.Как определить давление идеального газа в МКТ?
1. p = 1/3mо n


31.Как связано давление идеального газа со средней кинетической энергией молекул?
1.p = ⅓ n



32.Что называют уравнением состояния идеального газа?
1.зависимость массы газа от объема ;
2.уравнение, связывающее P, V,T для данной массы газа;
3.уравнение, связывающее давление и концентрацию;
4.зависимость массы газа от давления ;
33.Каково значение универсальной газовой постоянной?
1. R = 8,31 Дж/моль∙ К; 2.k = 1,38 ∙ 10-23 Дж/К; 3.NА = 6,02 ∙ 1023 моль-1 ; 4.mе = 1,6 ∙ 10-19 Кл;
34.Укажите уравнение состояния идеального газа Менделеева.
1. pV =

35. Укажите уравнение состояния идеального газа Клапейрона.
1. pV =


36.Какие процессы называют изопроцессами?
1.протекают при постоянном значении одного из параметров;
2.протекают при постоянном значении всех параметров;
3.пртекают в любых условиях;
37.Какой процесс называют изотермическим?
38. Какой процесс называют изохорным?
39.Какой процесс называют изобарным?
1.протекает при постоянном объеме;
2.протекает при постоянном давлении;
3.протекает при постоянной температуре;
4.протекает при постоянном количестве теплоты;
40.Укажите уравнение изотермического процесса.
41. Укажите уравнение изобарного процесса.
42.Укажите уравнение изохорного процесса.
1. pV = const, при T = const; 2. 

43.Какой процесс называют испарением?
44.Какой процесс называют конденсацией?
1.молекулы, имеющие большую кинетическую энергию, покидают жидкость;
2.молекулы, имеющие малую кинетическую энергию, покидают жидкость;
3.молекулы покидают жидкость при любой температуре;
4. молекулы покинувшие жидкость возвращаются обратно;
45.Какой пар называют насыщенным?
1.пар, находящийся в статическом равновесии со своей жидкостью;
2.пар, находящийся в динамическом равновесии со своей жидкостью;
3.пар находящийся над жидкостью;
46.Что называют давлением насыщенного пара?
1.давление, при котором жидкость находится в равновесии со своим паром;
2.давление, при котором жидкость не находится в равновесии со своим паром;
3.давление создаваемое жидкостью;
47.Какова зависимость давления насыщенного пара от температуры?
1.увеличивается с ростом температуры и увеличением концентрации;
2.уменьшается с ростом температуры и увеличением концентрации;
3.давление пара прямо пропорционально объему;
4.давление пара прямо пропорционально температуре;
48.Как происходит процесс кипения жидкости? Вставьте пропущенные слова.
При кипении по всему ………. жидкости образуются быстро растущие …………….. пара, которые ………………. на поверхность. Температура кипения жидкости остается …………….
49.При каком условии начинается процесс кипения?
1.давление насыщенного пара в пузырьках меньше давления в жидкости;
2.давление насыщенного пара в пузырьках сравнивается давлением в жидкости;
3.давление насыщенного пара в пузырьках во много раз больше давления в жидкости;
50.От чего зависит температура кипения жидкости?
1. от объема; 2.от давления; 3.от внешнего давления; 4.от концентрации;
51.Какие тела называют кристаллическими?
1.это твердые тела, атомы или молекулы которых занимают определенные упорядоченные положения в пространстве;
2.это твердые тела, атомы или молекулы которых занимают произвольные положения в пространстве;
3.это все твердые тела;
52.Что называют анизотропией?
1.это независимость физических свойств от направления внутри кристалла;
2.это зависимость физических свойств от направления внутри кристалла;
3.это зависимость только оптических свойств от направления внутри кристалла;
4.это зависимость только механических свойств от направления внутри кристалла;
53.Что называют монокристаллом?
54.Что называют поликристаллом?
1.тело, состоящее из множества отдельных кристалликов; 2.это одиночный кристалл;
3.это твердое тело малых размеров; 4.это твердое тело больших размеров;
55.Все металлы имеют поликристаллическую структуру. Почему они изотропны?
1.кристаллики ориентированы хаотично, все направления равноправны и свойства металлов одинаковы по всем направлениям;
2.кристаллики расположены упорядоченно, все направления равноправны и свойства металлов одинаковы по всем направлениям;
3.кристаллики ориентированы хаотично, все направления неравноправны и свойства металлов одинаковы по всем направлениям;
56.Какая разница в строении крупинки сахарного песка и куска сахара – рафинада?
1.крупинка – монокристалл, а кусок – поликристалл;
2.крупинка – поликристалл, а кусок – монокристалл;
3.оба поликристаллы; 4.оба монокристаллы;
57. Чему равна внутренняя энергия?
а) она равна потенциальной энергии молекул
б) она равна кинетической энергии молекул
в) она равна сумме потенциальной и кинетической энергий движения молекул
г) она равна работе
58. Какими способами можно изменить внутреннюю энергию тела?
а) совершить работу
б) передать количество теплоты
в) нагреть тело и совершить работу
г) поднять тело на некоторую высоту
59. Мука из-под жерновов выходит горячей, хлеб из печи вынимают тоже горячим. Какова причина повышения температуры этих тел?
а) совершение работы
б) передача теплоты
в) результат химических процессов
г) совершение работы и передача теплоты
60. Что будет лучшей грелкой: мешочек с песком или бутылка с горячей водой (масса и температура одинаковы)?
а) мешочек с песком
б) бутылка с водой
61. Проволока может нагреться в пламени или при многократном сгибании. Правильно ли утверждать, что в обоих случаях проволока получила некоторое количество теплоты?
а) только при нагревании в пламени
б) только при многократном сгибании
в) правильно с обоих случаях
62. Может ли газ нагреться или охладиться без теплообмена с окружающей средой?
Механизм возникновения давления с точки зрения мкт
Опубликовано 28.09.2017 по предмету Физика от Гость >>
Ответ оставил Гость
Из за движение молекул газа происходят соударения о стенки сосуда. Тк молекул много и они маленькие, то соударения происходят в огромном количество и равномерно по всей площади сосуда. Они и вызывают давление
Если тебя не устраивает ответ или его нет, то попробуй воспользоваться поиском на сайте и найти похожие ответы по предмету Физика.
Основное уравнение молекулярно-кинетической теории газов
Это уравнение устанавливает взаимосвязь между давлением газа (термодинамическим параметром) и средней кинетической энергией теплового движения его молекул (механической характеристикой системы). С точки зрения молекулярно-кинетической теории, давление газа на стенку сосуда является результатом многочисленных ударов молекул газа о стенку. При огромном числе молекул, находящихся в сосуде, одновременно будет производиться огромное количество ударов о стенки. Поэтому достаточно малые и очень быстро меняющиеся силы, порождаемые отдельными ударами, будут складываться практически в постоянную силу, давления, действующую на каждую единицу площади стенок сосуда.
Найдем давление идеального газа на стенку сосуда. Сила, с которой газ действует на стенку, определяется упругими столкновениями молекул со стенкой и, в соответствии со вторым основным законом динамики, равна импульсу, передаваемому стенке всеми молекулами за единицу времени, а давление газа найдется как отношение этой силы к площади стенки. При этом будем считать, что идеальный газ – это система, состоящая из исчезающе малых по размерам твердых шариков конечной массы, хаотически движущихся во всем доступном им объеме, не взаимодействующих на расстоянии и сталкивающихся между собой и со стенками сосуда по законам соударения упругих шаров.
Выделим на поверхности сосуда, в который газ заключен, малую площадку S. Вследствие малости ее можно считать плоской. Введем декартову систему координат, направив ось X перпендикулярно выделенной площадке, как показано на рис. 2.2. С площадкой S могут столкнуться только те молекулы, которые летят в ее направлении, т.е. у которых x-компонента скорости Предположим сначала, что все подлетающие к площадке молекулы имеют одно и то же значение этой x-компоненты. При упругом ударе молекулы о площадку знак этой скорости, а значит, и импульса меняются на противоположный, не изменяя своей величины. Изменение импульса одной молекулы при столкновении с площадкой составит Здесь – масса молекулы. Импульс, переданный площадке этой молекулой, в соответствии с законом сохранения импульса, будет
| Рис. 2.2 |
За время до площадки долетят и столкнутся с ней только те молекулы, которые в начальный момент находились от площадки на расстоянии, не большем vxΔt, и занимали объем слоя пространства, примыкающего к площадке. Число ударов молекул о площадку за время будет равно числу молекул, находящихся внутри этого слоя, т.е. где n – концентрация молекул газа. Импульс, переданный площадке этими молекулами, составит
Предположение, что все молекулы газа имеют скорости с одной и той же компонентой vx, конечно, не верно. Скорости vx у всех молекул разные и каждая молекула, ударяясь о площадку, вносит свой вклад. Учтем, однако, что нам требуется оценить только коллективный эффект, возникающий от столкновения с площадкой большого числа молекул. Этот эффект описывается средним значением полученного выше выражения. Именно средний импульс определяет силу давления молекул на стенку сосуда. Усредняя это выражение по всем , примем во внимание, что не все молекулы с одним и тем же значением сталкиваются с площадкой, а только те из них, у которых x-компонента vx > 0. Учтем также, что в равновесном состоянии движение молекул является полностью беспорядочным. Поэтому число молекул, летящих к площадке S и от нее, в среднем одно и то же. Это означает, что среднее значение для vx > 0 вдвое меньше среднего значения для всех vx. Таким образом, оказывается, что за время площадка S со стороны газа получит импульс, в среднем равный Разделив этот импульс на промежуток времени , получим среднее значение силы, с которой газ действует на данную площадку, а разделив затем эту силу на площадь площадки S, найдем давление, оказываемое газом на площадку:
Вследствие беспорядочности движения молекул средние значения квадратов компонент вектора скорости будут одинаковы. А так как то для средних значений всех квадратов компонент скорости будем иметь
(2.5)
С учетом этого находим
(2.6)
Отсюда видно, что давление идеального газа определяется только концентрацией молекул, их массой и средним значением квадрата скорости молекулы.
Правую часть этой формулы можно записать в виде где – среднее значение кинетической энергии поступательного движения молекулы. Учитывая это, получим
(2.7)
Это и есть основное уравнение молекулярно-кинетической теории газов. Основным его называют потому, что это первое соотношение, которое было получено на основе представления о газе как о совокупности быстро и хаотически движущихся частиц. Его называют также уравнением Клаузиуса.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 9116 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
- http://infopedia.su/13x9a9a.html
- http://mydocx.ru/1-14696.html
- http://studfiles.net/preview/5276108/page:2/
- http://repetitor.biniko.com/blog-id114.htm
- http://studopedia.su/2_33038_molekulyarno-kineticheskiy-smisl-davleniya.html
- http://pandia.ru/text/79/044/6211.php
- http://depcult95.com/fizika/post1401875.html
- http://studopedia.ru/16_44680_osnovnoe-uravnenie-molekulyarno-kineticheskoy-teorii-gazov.html