Читайте также:
- II. Особенности систем бухгалтерского учета и внутреннего контроля малых предприятий.
- IV. Особенности получения аудиторских доказательств.
- А. Возникновение и развитие денег с позиции товарной теории денег.
- А. Особенности и направления общественного движения 30—50-х годов XIX в.
- Административные наказания, применяемые за нарушения таможенных правил, и особенности их назначения
- Анатомо-физиологические особенности младших школьников[47].
- Ациклические сопряженные системы. Особенности электронного строения
- Б. ГЛАВНЫЕ ОСОБЕННОСТИ
- Банки являются особым типом финансовых посредников, перераспределяющих капиталы между их поставщиками и потребителями. Они имеют следующие основные особенности.
- Билет. Экологическая экспертиза: понятие, особенности, виды, порядок проведения.
- Биологические особенности опухолей
- В экономической теории различают фрикционную, структурную (технологическую), сезонную, циклическую виды безработицы.
Скорость химической реакции можно регулировать с помощью катализатора. Вещества, которые участвуют в реакциях и изменяют (чаще всего увеличивают) ее скорость, оставаясь к концу реакции в первоначальном виде и количестве, называются катализаторами. Само изменение скорости химической реакции в присутствии катализаторов получило название катализа.
Если от добавления катализатора к реагирующей смеси скорость реакции увеличивается, катализ называют положительным, если же реакция замедляется, то катализ называют отрицательными, а катализатор ингибитором.
Катализаторами могут быть самые разнообразные вещества в любом из трех агрегатных состояний: кислоты, соли, основания, оксиды, металлы, их атомы, молекулы или ионы, различные органические и органоминеральные соединения, газообразные вещества. В ряде случаев каталитическое действие оказывают всевозможные примеси (например, пыль), поверхность стенок сосуда, а также продукты реакции (в этом случае реакция называется автокаталитическая).
Катализ идет за счет перераспределения химических связей или сил электростатического взаимодействия участников реакции, механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений или образования активированного комплекса, при этом скорость процесса увеличивается в 2-3 раза.
Участие катализатора в реакции не отражается на стехиометрических коэффициентах и величине теплового эффекта химической реакции, а по сравнению с массой реагирующих веществ масса катализатора мала, но к концу реакции он выделяется в неизменном виде.
Катализатор в одинаковой мере действует как на скорость прямой, так и обратной реакции. Он ускоряет лишь наступление состояния химического равновесия.
Катализаторы действуют избирательно, то есть, скорость одних реакций данный катализатор ускоряет, а скорость других не изменяет или замедляет.
В ряде случаев присутствие посторонних веществ изменяет действие катализаторов: те вещества, которые усиливают положительную активность катализаторов, сами по себе являясь неактивными, называются промоторамиили активаторами; те вещества, которые замедляют или практически полностью подавляют действие катализатора, называются каталитическими ядами; существуют вещества, присутствие которых не влияет на активность катализаторов (нейтральные).
По агрегатному состоянию каталитические реакции делят на гомогенные и гетерогенные.
Гомогенным катализом называют катализ, в котором катализатор и реагирующие вещества образуют одну фазу, то есть, находятся в одном агрегатном состоянии.
Механизм воздействия катализатора на химическую реакцию находит свое объяснение в теории промежуточных соединений. Катализатор с одним из реагирующих веществ образует непрочное промежуточное соединение, которое легко реагирует со вторым компонентом реакции. Это положение подтверждается тем, что в ряде случаев удалось выделить соединения катализатора с одним из компонентов реакции.
В общем виде для реакции типа А + В ® С весь каталитический процесс в присутствии катализатора К можно представить следующими уравнениями:
А = К ® АК; АК + В ® С + К.
Как видим, катализатор образует неустойчивое промежуточное соединение АК. Скорость данной каталитической реакции, в конечном счете, зависит от того, как быстро образуется и разлагается это промежуточное соединение. Например, если скорость расщепления промежуточного соединения АК на исходные компоненты намного выше, чем превращение промежуточного соединения в конечный продукт, скорость реакции будет мала. И, наоборот, если скорость превращения промежуточного соединения в конечный продукт значительно больше скорости его разложения, каталитическая реакция будет протекать очень быстро.
Опыт показывает, что подавляющее большинство каталитических процессов протекает со скоростью, имеющей промежуточное значение между этими крайними пределами.
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах, чаще всего катализатором является твердое тело, а реагирующие вещества находятся в жидком или газообразном состоянии и реакция протекает на поверхности раздела двух фаз, то есть, на поверхности катализатора. Поэтому гетерогенные каталитические процессы часто называют просто контактными, а твердые катализаторы – контактными веществами.
Как правило, все гетерогенные каталитические реакции протекают в несколько стадий: 1) диффузия исходных веществ к поверхности катализатора; 2) адсорбция этих веществ на поверхности катализатора, при этом происходит деформация связей в молекулах; 3) химическое превращение адсорбированных (и активированных) молекул; 4) десорбция продуктов реакции; 5) диффузия продуктов реакции. Скорость процесса в целом зависит от скорости самой медленной стадии.
Опыт показывает, что причина и механизм гетерогенного катализа заключается в том, что катализ связан с адсорбцией реагирующих веществ на поверхности катализатора, а в каталитической реакции принимает участие не вся поверхность катализатора, а лишь небольшая ее часть, состоящая из отдельных участков, называемыми активными центрами.
Наиболее простое объяснение образования активных центров на поверхности твердых катализаторов заключается в наличии неровностей на поверхности. Атомы твердого вещества, расположенные в углублениях, будут энергетически более уравновешенными по сравнению с атомами, находящимися на выступах шероховатой поверхности катализатора. На этих центрах, имеющих свободное силовое поле, и будет в первую очередь происходить адсорбция реагирующих молекул.
В настоящее время имеется целый ряд теорий, объясняющих механизм гетерогенного катализа. Согласно мультиплетной теории А. А. Баландина, между параметрами кристаллической решетки катализатора и длинами химических связей реагентов и продуктов реакции необходимо структурное соответствие. На активных центрах катализатора образуются мультиплетные комплексы, то есть промежуточные соединения и происходит перераспределение связей между исходными веществами и продуктами реакции.
На скорость каталитических реакций влияет площадь поверхности катализатора или его степень дисперсности, температура (обычно увеличивает скорость процесса), давление (для реакций, идущих с изменением объема, увеличение давления обычно увеличивает скорость), природа растворителя (особенно его полярность).
В настоящее время наиболее распространенными промышленными катализаторами являются Pt, Pd, Rh, Fe, Ni, CuO, RuO2, V2O5, NiO, Fe2O3, ZnO, SiO2, Cr2O3, Al2O3, Al2Cl3, Ag2O, WO3, алюмосиликаты. Их используют при получении аммиака, азотной и серной кислот, метанола, водорода, хлора, этилена и других продуктов химической промышленности.
Вопросы для самоконтроля:
1. Что называется химической кинетикой?
2. Что представляет собой средняя и истинная скорость процесса?
3. От каких факторов зависит скорость химической реакции?
4. Как формулируется закон действующих масс?
5. Каков физический смысл константы скорости химической реакции, и от каких факторов она зависит?
6. Как рассчитывают скорость реакции в гетерогенных системах?
7. Как формулируется правило Вант-Гоффа?
8. Как проводят классификацию химических реакций по молекулярности?
9. Как проводят классификацию химических реакций по порядку?
10. Каково аналитическое выражение кинетического уравнения реакций первого порядка?
11. Каково аналитическое выражение кинетического уравнения реакций второго порядка?
12. Как определяют порядок реакции?
13. Каковы основные положения теории активации?
14. Что такое энергия активации?
15. Каково аналитическое выражение уравнения Аррениуса?
16. Каковы основные понятия катализа?
17. В чем состоит теория гомогенного катализа?
18. Каковы особенности гетерогенного катализа?
19. В чем заключается адсорбционно-деформационная теория гетерогенного катализа?
20. В чем заключается мультиплетная теория гетерогенного катализа?
Вопросы для самостоятельной работы:
1. Математически вывести кинетические уравнения реакций первого и второго порядка.
2. Изучить теорию активизации молекул и уравнение Аррениуса.
3. Особенности каталитических реакций.
4. Теории гомогенного и гетерогенного катализа.
Литература:
1. Семенова Е. В., Кострова В. Н., Федюкина У. В. Химия. – Воронеж: Научная книга – 2006, 284 с.
2. Коровин Н.В. Общая химия. — М.: Высш. шк. – 1990, 560 с.
3. Глинка Н.Л. Общая химия. – М.: Высш. шк. – 1983, 650 с.
4. Глинка Н.Л. Сборник задач и упражнений по общей химии. – М.: Высш. шк. – 1983, 230 с.
5. Ахметов Н.С. Общая и неорганическая химия. М.:Высшая шк. – 2003, 743 с.
6. Угай Я.А. Общая и неорганическая химия. — М.: Высш. шк. – 1997, 550 с.
7. Зайцев О.С. Общая химия. Направление и скорость химических процессов. Строение вещества. — М.: Высш. шк. – 1983, 250 с.
Дата добавления: 2013-12-12 ; Просмотров: 1370 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
В книжной версии
Том 13. Москва, 2009, стр. 312
Скопировать библиографическую ссылку:
КАТА́ЛИЗ (от греч. ϰατάλυσις – разрушение), увеличение скорости или инициирование химич. реакции в присутствии веществ ( катализаторов ), многократно вступающих в промежуточное химич. взаимодействие с участниками реакции и восстанавливающих свой химич. состав после каждого цикла этих взаимодействий. Замедление или практически полное подавление химич. реакции в присутствии веществ, вступающих во взаимодействие с участниками реакции и затем восстанавливающих свой состав, называют ингибированием, а соответствующие вещества – ингибиторами химических реакций . Способность катализатора изменять скорость реакции характеризуют его каталитич. активностью: отношением скорости катализируемой реакции, т. е. числа катализируемых превращений молекул реагентов в единицу времени, к массе или объёму катализатора. Особый вид К. – автокатализ , когда химич. процесс ускоряется конечными или промежуточными продуктами реакции. Явления К. распространены в природе и широко применяются в пром-сти. Большинство химич. реакций являются каталитическими. Природа веществ, способных выполнять роль катализаторов, может быть очень разнообразной.
Механизм — каталитическое действие
Механизм каталитического действия предлагается объяснить следующим образом. [1]
Механизм каталитического действия с точки зрения адсорбционной теории этого периода сводится к адсорбции молекул реагирующих веществ на поверхности катализатора, в результате чего происходит их деформация, снижающая высоту энергетического барьера, который необходимо преодолеть для осуществления реакции. Для дальнейшего развития этой теории необходимо было внести в достаточно широкое понятие о деформации молекул более конкретное содержание. [2]
Механизм каталитического действия при гомогенном катализе заключается в образовании между реагирующими веществами и катализатором промежуточных соединений, которые иногда удается выделить или обнаружить аналитически. [3]
Механизм каталитического действия при гомогенном катализе заключается в образовании между реагирующими веществами и катализатором промежуточных соединений, которые иногда удается выделить или обнаружить аналитически. Ускорение процессов при участии катализаторов в подавляющем большинстве случаев происходит за счет снижения энергии активации в результате образования промежуточного продукта по сравнению с энергией активации образования некаталитического гомогенного активного комплекса. [4]
Механизм каталитического действия окислов металлов в реакции разложения муравьиной кислоты. [5]
Механизм каталитического действия объясняют по-разному. Наиболее перспективны, видимо, те представления, которые учитывают химическое поверхностное взаимодействие между катализатором и реагирующим веществом. Предполагается, что для активности твердого катализатора наиболее важно локализованное взаимодействие с индивидуальным атомом или ионом поверхности. Реагирующие вещества в процессе промежуточного поверхностного взаимодействия образуют поверхностный комплекс, который по составу и строению сходен с обычным комплексом. Поэтому при прогнозировании каталитического действия необходимо учитывать свойства реагирующего вещества и катализатора, особенно их способность к комплексообразованию. Строение поверхностного комплекса, характер перераспределения в нем электронной плотности, степень переноса заряда должны во многом определять направление каталитической реакции. При этом следует учитывать, что обычно в первую очередь изменяется реакционная способность атомов, непосредственно связанных координационной связью или соседних с ней. [6]
Механизм каталитического действия в процессах превращений простых виниловых эфиров сводится к образованию оксониевых соединений и их диссоциации. В последнем случае осуществляются реакции, не имеющие места без применения катализаторов. Сюда относятся реакции присоединения воды, спиртов, процессы полимеризации и другие превращения. [7]
Механизм каталитического действия меркаптанов и тиокето-нов на иод-азидную реакцию еще полностью не выяснен. По-видимому, одно и то же объяснение неприменимо ко всем соединениям. Действие меркаптанов, вероятно, аналогично каталитическому действию сероводорода и растворимых сульфидов металлов. [8]
Механизм каталитического действия натрийкапролактама окончательно не выяснен. [10]
Механизм каталитического действия сиккативов заключается в том, что катион переходного металла при взаимодействии с молекулами пероксида отдает или принимает электроны с образованием свободных радикалов, которые затем вступают в дальнейшую реакцию. [11]
Механизм каталитического действия ионов Н3О состоит в том, что образуется промежуточное соединение за счет перехода протона от молекулы катализатора ( НзО) к молекулам исходного вещества. [12]
Механизм каталитического действия лизоцима , предложенный Филлипсом на основании результатов рентгеноструктурного анализа, исходит из того соображения, что разрыв гликозиднои связи осуществляется между участками связывания D и Е активного центра. [13]
Механизм каталитического действия антрахинона на процесс делигнификации древесины сложен и до конца не выяснен, несмотря на то, что эта проблема признана одной из актуальнейших в химии древесины Частью этого механизма является роль переносчика водорода в системе окислительно-восстановительных реакций. [14]
Механизм каталитического действия меркаптанов , тиокетонов, тиокислот на иод-азидную реакцию еще полностью не выяснен. Возможно, что он различен для разных соединений. [15]
Механизм каталитических реакций. Гомогенный и гетерогенный катализ
Гомогенный и гетерогенный катализ. Понятие о механизме каталитических реакций
− Сформировать представление о понятиях: «катализ», «катализаторы», «ингибиторы», «каталитические яды», «каталитическое отравление», «избирательность».
− Рассмотреть гомогенный и гетерогенный катализ, механизм каталитических реакций.
− Закрепить знания, умения и навыки учащихся по составлению уравнений реакций (расстановка коэффициентов), по решению задач на тему катализ.
− Развитие у студентов навыков наблюдения, логического мышления, умений делать выводы и заключения.
Ход лекции
I. Организационный момент. Проверка знаний по скорости химической реакции.
II. Объяснение нового материала.
Для большинства химических процессов немаловажную роль играет скорость их протекания. Одним из широко применяемых методов управления скоростью химической реакции является использование катализаторов.
Катализаторами называют вещества, которые увеличивают скорость химической реакции, но сами в результате реакции не расходуются.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом.
Катализаторы изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации.
Вы, конечно, слышали и о других интересных веществах — ингибиторах (от лат. inhibere — задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате скорость реакции резко замедляется и она прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы.
Различают 2 вида катализа: гомогенный и гетерогенный.
Какие вещества используют в качестве катализаторов? В гомогенном катализе это кислоты, основания, соли, особенно соли переходных металлов (Cr, Mn, Fe, Со, Ni и др.). При гетерогенном катализе в качестве катализаторов чаще всего используют переходные металлы и их оксиды.
Механизм каталитических реакций
Механизм действия катализаторов является очень сложным. Основная гипотеза, объясняющая катализ, — предположение об образовании промежуточных продуктов при взаимодействии катализатора и реагирующего вещества. Если реакция А + В = АВ без катализатора происходит медленно, то при добавлении катализатора К он реагирует с одним из исходных веществ, образуя непрочное и очень реакционноспособное промежуточное соединение АК (или ВК).
Катализатор (обозначим его К) очень быстро вступает во взаимодействие с одним из реагентов (обозначим его А) с образованием неустойчивого и химически активного промежуточного соединения АК, которое в свою очередь вступает во взаимодействие с реагентом В с образованием конечного продукта АВ. Катализатор при этом выделяется в чистом виде. В результате вместо медленного одностадийного процесса
А + В = АВ медленно (13-1)
мы имеем быстрый двухстадийный:
1. А + В + К = АК + В быстро (13-2)
2. АК + В = АВ + К быстро (13-3)
А + В → АВ быстро (13-4)
Механизм действия катализатора заключается в том, что он изменяет «путь» процесса реагенты →продукты, причем новый путь характеризуется меньшей высотой энергетического барьера, т.е. меньшей энергией активации (Еа) по сравнению с энергией активации Еа некатализируемой реакции
Изменение энергии реакционной системы катализируемой и некатализируемой реакции представлено на рис. 1.
Из рисунка видно, что увеличение скорости реакции вприсутствии катализатора достигается за счет уменьшения энергии активации процесса, причем наиболее медленная стадия (с большей Еа) определяет скорость процесса в целом.
 |
Чем значительнее снижение энергии активации (Екат), тем активнее катализатор. Например, для реакции 2HI = Н2 + I2 энергия активации без катализатора составляет 184 кДж, в присутствии в качестве катализатора золота Еа = 105 кДж, а платины — 69 кДж.
Рис. 1. Влияние катализатора на протекание реакции при гомогенном катализе. 1 — активированное состояние в реакции без катализатора; 2, 3 — активированные состояния двух стадий катализируемой реакции.   |
Гомогенный катализ – это катализ, при котором и катализатор, и реагирующие вещества находятся в одном агрегатном состоянии (фазе).ализ при котором ида катализа: гомогенный и гетерогенный.
Механизм действия такого катализатора состоит в образовании промежуточного вещества. При этом понижается энергия активации. Например, при старом способе производства серной кислоты нитрозным способом окисление оксида серы (IV) в оксид серы (VI) проводили с помощью катализатора NO — оксида азота (II). При этом катализатор вначале взаимодействовал с кислородом, образуя промежуточное более активное вещество — оксид азота (IV), который далее взаимодействовал с SO2, окисляя его в SO3:
Гетерогенный катализ – это катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV):
Механизм гетерогенного катализа. Дня объяснения гетерогенного катализа чаще всего пользуются адсорбционной теорией катализа. Согласно этой теории при гетерогенном катализе происходит адсорбция реагирующих веществ поверхностью катализатора (то есть поглощение молекул реагирующих веществ пористой поверхностью катализатора, с образованием активных частиц, участвующих в реакции). Под действием «активных центров» катализатора у адсорбированных молекул ослабляется связь между атомами, увеличиваются расстояния между атомами в реагирующих молекулах, реагирующие молекулы деформируются, а иногда даже диссоциируют на отдельные атомы. Молекулы продуктов не образуют прочных связей с катализатором и десорбируются.
Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится неработоспособной, требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества.
Например, при производстве серной кислоты контактным способом используют твердый катализатор — оксид ванадия (V) V2O5:
Очень эффективно работают биологические катализаторы — ферменты. Как вы помните, по химической природе это белки. Благодаря им в живых организмах при невысокой температуре с большой скоростью протекает множество сложных химических реакций. Ферменты отличаются особой специфичностью, каждый из них ускоряет только «свою» реакцию, идущую в нужное время и в нужном месте с выходом, близким к 100%. Создание аналогичных ферментам искусственных катализаторов — мечта химиков!
Из приведенной схемы видно, что хотя катализатор и принимает участие в процессе реакции и существенным образом изменяет ее механизм, но в результате реакции его состав и количество остаются без изменений.
Существует целый ряд веществ, называемых каталитическими ядами, наличие которых даже в малых количествах на несколько порядков снижает или полностью подавляет активность катализатора. Действие каталитических ядов — уничтожение активности катализатора — называют каталитическим отравлением
Некоторые вещества усиливают действие катализаторов, сами катализаторами не являясь. Такие вещества называют промоторами (например, небольшая добавка щелочных металлов резко повышает действие V2О5 как катализатора в процессе окисления SО2 в SО3).
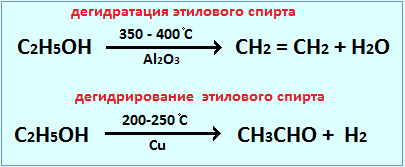
Важным свойством катализаторов является избирательность их действия. Это означает, что, применяя разные катализаторы, можно из одних и тех же реагентов получить разные продукты реакции. Например, в присутствии меди при 200 — 250°С происходит дегидрирование этилового спирта, а на оксиде алюминия при 350 — 360’С происходит его дегидратация:
Поэтому должно быть понятным, что поиски, подбор, исследования и дальнейшее внедрение в практику все новых и новых катализаторов является одной из сложнейших и важнейших задач современной химии, так как роль катализаторов в химическом производстве очень велика. Перечислам лишь несколько химических производств, где используют катализаторы.
1. В нефтяной промышленности для крекинга углеводородов (с помощью которого увеличивается выход бензина из керосина) и для реформинга (который приводит к перестройке структуры углеводородов и повышению октанового числа бензина)
2. При переработке природного газа.
3. При получении полимеров, искусственного каучука.
4. При получении серной кислоты, аммиака, синтетического метилового и этилового спиртов и т.д.
Катализ играет большую роль не только в химии, но и в биологии, так как практически все биохимические превращения, происходящие в живых организмах, являются каталитическими. В роли катализаторов в этом случае выступают ферменты — вещества биологического происхождения.
1. Что такое катализ?
2. Что такое катализатор?
3. Как называют в-ва, которые снижают скорость химической реакции?
4. Какие 2 вида катализа различают?
5. Где используются катализаторы?
ИТОГИ ЛЕКЦИИ.
РЕФЛЕКСИЯ.
Домашнее задание: доклад «Производство и применение катализаторов на предприятиях РБ».
Механизм каталитического действия
Самым эффективным средством воздействия на химические процессы является применение катализаторов. Присутствуя в реакционном пространстве в количествах, в тысячи раз меньших концентрации реагентов, катализаторы способны изменять скорость процесса на несколько порядков.
Катализаторами называют химические вещества, изменяющие скорость химического процесса, но при этом не меняющие ни своего количества, ни химического состава.
Процесс изменения скорости реакции под воздействием катализатора называется катализом. В общем виде каталитическую реакцию отражает схема: [Cat]
Механизм действия катализатора объясняется с позиций теории активированного комплекса следующим образом.
Катализатор с одним из реагентов образует активированный комплекс, взаимодействующий впоследствии с другим реагентом:
Реагент катализатор активированный копмлекс – I
В + [A…Cat] ──► [A…Cat…B] ──► AB + Cat
Реагент активир.комплекс – I активир.комплекс – II продукт катализатор
Если энергия активации промежуточных стадий создания активированного комплекса с катализатором окажется меньше энергии активации процесса в отсутствие катализатора, то общая скорость каталитического процесса значительно увеличится (так как большее число молекул в системе будут обладать эффективной энергией). Такой катализ называется положительным, а сам катализатор обозначают как [К + ].
В другом случае, если активированный комплекс с катализатором оказывается более прочным, чем в его отсутствие, то скорость каталитического процесса резко уменьшается. Такой катализ называют отрицательным, обозначая его как [К — ].
На рис.59 изображены кривые изменения полной энергии системы в отсутствие катализатора и при положительном и отрицательном катализе.
Надо при этом помнить, что катализатор не меняет механизма и направления процесса, а влияет только на его скорость. Катализу подвергаются только термодинамически возможные процессы, т.е. такие, для которых изменение свободной энергии Гиббса ΔG + ] относят: металлы Pt, Pd, Rh, Ir, Fe, Ni; оксиды металлов CuO, RuO2, V2O5, NiO, Fe2O3, ZnO, Cr2O3, Al2O3,Ag2O, WO3; оксид кремния SiO2; алюмосиликаты, цеолиты, комплексы металлов.
Отрицательный катализ широко используется для замедления нежелательных или побочных процессов. Например, в реакции
для предотвращения обратного процесса восстановления водородом катионов железа(II) в систему вводят анилин, играющий роль отрицательного катализатора для обратной реакции.
 |
Рис. 59. Изменение энергии активации Еа реакционной системы в
отсутствие катализатора (средний пик), при положительном
катализе (Еа k + ) и при отрицательном катализе (Ea k — ).
В реакции Н2 + Сl2 → 2HCl такую же функцию выполняет газообразный кислород О2. Но и анилин, и кислород остаются после реакции в неизменном количестве и состоянии.
Наряду с отрицательными катализаторами для остановки нежелательных процессов применяются ингибиторы, но они отличаются от катализаторов тем, что входят в состав продуктов катализа. Например, ингибитором коррозии железа может служить гидрокарбонат кальция Са(НСО3)2, под действием которого на поверхности металла образуется нерастворимая пленка карбоната железа FeCO3, предотвращающая дальнейшее окисление металла.
Отличительной особенностью катализаторов является избирательность (селективность) их действия по отношению к вполне конкретной реакции и полная инертность по отношению ко всем другим процессам, происходящим в этой же системе. Например, при нагревании этанола параллельно протекают две различные реакции:
расходуется до 20% этилового
(II) СН3–СН2ОН → СН3СОН + Н2 – реакция дегидрирования, в ней
участвует 80% этанола.
В зависимости от поставленной задачи, можно увеличить выход продукта по любой из этих реакций, если правильно использовать катализаторы. Так, например, положительным катализатором для реакции I служит оксид алюминия Аl2O3, а для реакции II – металлическая медь Cu.
Сверх селективными (или супраселективными) катализаторами являются ферменты – белки с большой молекулярной массой. Например, при комнатной температуре половина от взятого количества мочевины разлагается водой за 3200 лет, а в присутствии фермента – уреазы время ее полу превращения при той же температуре составляет всего 10 -4 с. Часто хорошими катализаторами служат растворители, особенно полярные, например, вода Н2О.
Различают гомогенный (однофазный) и гетерогенный (двухфазный) катализ.
В гомогенном катализе катализатор и реагенты находятся в одинаковом агрегатном состоянии. Примерами гомогенного катализа служат следующие реакции. А) в газовой фазе: [Н2О(г)]
Б) в жидкой фазе: [J — (р-р)]
Механизм участия катализатора в гомогенном процессе рассмотрим на примере реакции восстановления пероксида водорода (реакция Б).
1-ая стадия – образование активированного комплекса пероксида водорода с катализатором: Н2О2 + [J — (р-р)] ──► [J…O — …Н…Н…О(р-р)] .
2-ая стадия – взаимодействие активированного комплекса с молекулой пероксида водорода и высвобождение катализатора:
В гетерогенном катализе реагенты и катализатор находятся в разных агрегатных состояниях, причем, катализатор, как правило, находится в более конденсированной фазе, чем реагенты.
В качестве иллюстрации механизма гетерогенного катализа рассмотрим процесс гидрирования этилена в присутствии твердого катализатора – активированного угля или никелевой пластины:
1-ая стадия – адсорбция газообразных этилена и водорода на поверхности твердого катализатора с образованием активированных комплексов:
2-ая стадия – десорбция интермедиатов с поверхности катализатора и их взаимодействие друг с другом:
Объяснение механизма гетерогенного катализа было дано русским ученым А.А. Баландиным, который предположил, что реакция совершается только на активных центрах, находящихся в узлах кристаллической решетки катализатора. В результате этого энергия активации снижается, и скорость процесса возрастает. Как следует из этой теории, для гетерогенного катализа важна высокая развитость поверхности катализатора. Проиллюстрируем это утверждение конкретным примером разложения пероксида водорода Н2О2 в присутствии катализатора платины Pt: [Pt]
А) Pt- гладкая, реакция не идет.
Б) Pt-шероховатая, заметно выделение газообразного кислорода.
В) Pt-порошок, бурное выделение газа.
Г) Pt-коллоид (ж), реакция идет со взрывом.
Каталитические яды – это вещества, дезактивирующие поверхность катализатора. К ним относятся оксиды мышьяка As2O3, As2O5, синильная кислота HCN.
Промоторами называют вещества, способные увеличивать активность катализатора за счет его постоянной очистки. К ним относятся, например, минеральные соли (сульфат натрия Na2SO4 – промотор для оксида ванадия V2O5).
Задания для закрепления темы
1. Объясните, какие меры необходимо предпринять, чтобы обратимые химические процессы сделать практически необратимыми. Приведите примеры из лабораторной и промышленной практики и базу их применения.
2.Приведите примеры конкретных химических процессов, в которых скорость реакции не зависит от концентрации реагентов. Каким образом можно управлять подобными процессами?
3. Приведите конкретные примеры механизмов химических процессов в гомогенной и гетерогенной системах в присутствии и отсутствии катализаторов.
4. Цепные реакции. Их значение в технике. Механизм действия катализатора в цепной реакции.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 7657 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Теория промежуточных соединений в катализе и их термодинамические и кинетические аспекты
Основные положения сложного катализа в химико-технологических процессах нефтехимического синтеза
Катализом называется изменение скорости химических реакций под действием особых ускорителей – катализаторов.
Катализ – явление физико-химическое, темно связанное со скоростью и с механизмом химических реакций. Практическое значение катализа очень велико. Его применение давно стало необходимостью в нефтехимической и химической промышленности, в производстве синтетических каучуков и смол, смазочных веществ, растворителей, лекарственных препаратов и
Основные положения науки о катализе:
Ø катализатором является вещество, которое ускоряет определенную реакцию, непосредственно участвуя в ней, но после окончания реакции выделяется вновь в неизменном виде;
Ø катализатор лишь ускоряет реакцию, но не смещает термодинамического равновесия в сторону образования целевого продукта.
Количество катализатора, необходимое для изменения скорости реакции, всегда очень невелико. Действие катализатора специфично, он изменяет скорость только одной какой-то реакции или группы однотипных реакций.
Таким образом, ускоряя одну из возможных реакций, катализатор способствует увеличению селективности (избирательности) по целевому продукту.
В ряде процессов применение катализаторов разного действия позволит получить со значительным выходом различные продукты. Например, окисление этилена на серебряном катализаторе лежит в основе производства оксида этилена, а на палладиевом катализаторе значителен выход ацетальдегида.
Основные группы каталитических процессов:
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе (газовой или жидкой). При гетерогенном катализе катализатор и реагенты или продукты реакции находятся в разных фазах (обычно применяют твердые катализаторы). При ферментативном катализе катализатор находится в коллоидном состоянии.
Ферментативные каталитические процессы протекают в биологических системах под воздействием ферментов.
Теория промежуточных соединений в катализе и их термодинамические и кинетические аспекты
Сущность катализа заключается в образовании промежуточных активированных комплексов субстрата с катализатором. Это вызывает перераспределение электронной плотности в молекуле субстрата и делает ее реакционноспособной.
Любой каталитический процесс является равновесным процессом. Образование промежуточного активированного комплекса, а затем перегруппировка связей в нем требует затраты энергии активации. Распад промежуточного комплекса связан с увеличением энтропии, т.е. термодинамически возможен и самопроизволен. Использование катализатора способствует либо распаду (разрыхлению) промежуточного комплекса, либо его образованию. И то, и другое приводит к увеличению скорости реакции. В гетерогенном катализе образование активированного промежуточного комплекса связано с сорбцией исходных веществ на поверхности катализатора, т.е. с адсорбцией.
Действие катализатора связано с экзотермическим эффектом ∆Н # 
В случае гомогенного катализа
А + В 
Вначале образуется промежуточное соединение – субстрат-катализатор:
А + В + Kt ↔ AKt + B, (5.2)
где Kt – катализатор; k1 и k-1 – константы скорости соответственно прямой и обратной реакций.
Затем происходит образование активированного комплекса со вторым реагентом, константа скорости которого k2:
AKt + B 
В дальнейшем активированный комплекс распадается с выделением катализатора и конечных продуктов реакции, константа скорости которого k3:
[ AB # ] Kt 
Действие гомогенного катализа в подавляющем большинстве случаев определяется экзотермическим эффектом образования активированного комплекса. В гомогенном катализе скорость реакции прямо пропорциональна концентрации катализатора.
Снижение энергии активации в каталитической реакции может быть связано и с тем, что промежуточные соединения состоят из меньшего числа молекул, чем это необходимо для некаталитической реакции.
Скорость реакции тем больше, чем меньше энергия активации Е, и вследствие экспоненциальной зависимости
Влияние катализатора на снижение энергии активации можно проиллюстрировать следующими данными: энергия активации некаталитических реакций 125-190 кДж/моль, энергия активации реакций гомогенного и гетерогенного катализа 70-120 кДж/моль, энергия активации реакций ферментативного катализа 35-70 кДж/ моль.
Автокатализ
Автокаталитическиминазываются реакции, в которых катализатором является один из промежуточных или конечных продуктов реакции. Так, в цепных реакциях автокатализаторами служат свободные радикалы. К числу автокаталитических относятся некоторые реакции разложения взрывчатых веществ, горения, полимеризации и другие.
Для автокатализа характерна малая скорость реакций в начальный период, называемый периодом индукции, и быстрое нарастание выхода продукта в последующий период в результате возрастания количества катализатора. В дальнейшем выход продукта увеличивается согласно закону действующих масс, так же как и для обычных реакций.
Для возбуждения цепных реакций в исходную смесь обычно вносится вещество (инициатор), которое, реагируя с исходным веществом, вызывает зарождение цепи, т.е. образование первых свободных радикалов, и таким образом ускоряет реакцию подобно катализатору. Однако инициаторы в
отличие от типичных катализаторов расходуются в процессе реакции.
Гомогенный катализ
Гомогенный катализ может протекать в газовой или жидкой фазе. Механизм гомогенного катализа состоит в образовании между реагентами и катализаторами нестойких, промежуточных соединений, существующих в той же фазе (газовой или жидкой), после распада которых образуется продукт реакции, а катализатор регенерируется. В отличие от гетерогенно-каталитических реакций при гомогенных реакциях состав промежуточных соединений в ряде случаев можно выявить анализом. Процессы гомогенного катализа классифицируются:
Ø по типу взаимодействия между реагирующими веществами и катализатором на окислительно-восстановительные и кислотно- основные;
Ø по фазовому состоянию на жидкофазные (в растворах) и газофазные.
При выборе катализатора особое значение имеют его активность и селективность, доступность, относительно низкая стоимость, малая коррозионная способность, малое воздействие на окружающую среду.
Гомогенные катализаторы очень активны, но имеют определенные недостатки:
Ø сложность отделения катализатора от реакционной массы (отмывка, отгонка), при котором может образовываться большое количество токсичных или загрязненных сточных вод;
Ø сложность регенерации, что увеличивает долю катализатора в себестоимости продукции;
Катализаторами в растворах служат кислоты (катион Н + ), основания (анион ОН — ), ионы металлов (Ме + , Ме 2+ ), а также вещества, способствующие образованию свободных радикалов.
Механизм кислотно-основного (ионного) катализа в растворах заключается в том, что идет обмен протонами между катализатором и реагирующими веществами, сопровождающийся внутримолекулярными превращениями. При кислотном катализе протон (или положительный ион) переходит сначала от катализатора к реагирующей молекуле, а при основном катализе катализатор служит вначале акцептором протона или донором аниона по отношению к молекуле реагента. В последующей стадии каталитической реакции протон перемещается в обратном направлении, и катализатор восстанавливает свой состав.
По такому типу протекают реакции гидратации, дегидратации, гидролиза, этерификации, поликонденсации в растворах. Примером кислотно-основного катализа в растворе может служить гидратация олефинов в спирты, катализируемая кислотами (НА).
RCH=CH2 + HA 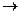
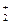
RCH2−CH 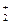
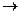
Н + + А — 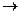
На стадии (а) катализатор служит донором протона; на стадии (в) катализатор регенерируется.
К ионным относятся и окислительно-восстановительные каталитические реакции в растворах, ускоряемые ионами металлов с переменной степенью окисления (меди, марганца, железа).
Газофазный гомогенный катализ (процесс, при котором и реагенты, и катализатор – газы) применяют сравнительно редко. Примером его могут служить дегидратация уксусной кислоты в парах при участии катализатора (парообразного тиэтилфосфата); окисление метана в формальдегид кислородом воздуха, ускоряемое оксидами азота.
Газофазний катализ может осуществляться по молекулярному и радикальному цепному механизму.
Ø При молекулярном механизме каталитической реакции происходит обмен атомами между катализатором и реагирующими веществами.
Ø Радикальный механизм гомогенного катализа возможен как в газовой, так и в жидкой фазе. Катализатор служит инициатором, направляющим реакцию по цепному механизму. Ускорение достигается в результате появления богатых энергией частиц – свободных радикалов в процессе самой реакции. По такому механизму протекают некоторые окислительные реакции в газах, полимеризация в жидкой фазе и т. п.
Скорость гомогенного каталитического процесса возрастает с повышением концентрации исходных веществ и катализатора согласно закону действующих масс.
Повышение давления ускоряет газовые реакции, так как с ростом давления увеличивается концентрация реагентов. Повышение температуры вызывает ускорение гомогенных реакций в соответствии с уравнением Аррениуса. Перемешивание имеет наибольшее значение для жидкостных процессов, так как скорости диффузии в жидкостях в десятки и сотни тысяч раз меньше, чем в газах. Перемешивание растворов позволяет сильно увеличить общую скорость процесса за счет снятия диффузионных торможений.
Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной продукционной смеси (жидкости или газа), в результате чего часть катализатора теряется безвозвратно, а продукт загрязняется им.
| | | следующая лекция ==> | |
| Тождества теории множеств | | | Гетерогенный катализ |
Дата добавления: 2017-11-04 ; просмотров: 1692 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
- http://bigenc.ru/chemistry/text/2051727
- http://www.ngpedia.ru/id154608p1.html
- http://studopedya.ru/1-85320.html
- http://studopedia.ru/19_312503_kataliticheskie-protsessi-tipi-katalizatorov-i-ih-svoystva.html
- http://helpiks.org/9-37368.html
- http://mplast.by/encyklopedia/kataliz-i-katalizatoryi/