Теоретические представления о природе комплексообразования возникли из попыток дать объяснение химическому взаимодействию устойчивых молекул с ионами и атомами различных элементов – например, молекулы иода с иодид-ионом, молекулы монооксида углерода с атомами железа, кобальта, никеля и т.п.
Одновременно шел поиск причин заметной неспецифичности таких взаимодействий, в результате чего оказываются прочно связаны между собой и ионы, и атомы, и молекулы. Например, в хлориде дихлороакватриамминкобальта(III) с комплексообразователем связаны и хлорид-ионы, и нейтральные молекулы аммиака и воды.
Химические связи в комплексных (координационных) соединениях отличаются большим разнообразием, что обусловлено всевозможными сочетаниями ковалентных связей разной полярности, кратности и степени делокализации электронных пар.
В свое время было предложено много различных теорий связи в координационных соединениях, но значительная часть этих теорий уже стала достоянием истории. В настоящем разделе рассматриваются основные понятия только теории валентных связей (метода валентных связей) и теории кристаллического поля.
Теория валентных связей была первой из квантовомеханических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней.
Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p— или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя.
При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число квантовых ячеек – атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей.
Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталями лиганда, упрочняя связь по дативному механизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентной связью, достаточной прочной и энергетически выгодной.
Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации.
Рассмотрим образование некоторых комплексов с позиций теории валентных связей. Прежде всего отметим, что валентные орбитали атомов комплексообразователей близки по энергии:
Тип гибридизации
Геометрия комплекса
Примеры
линейная
треугольная
тетраэдр
dsp 2
квадрат
sp 3 d(z 2 )
тригональная бипирамида
квадратная пирамида
sp 3 d 2 ,
d 2 sp 3
октаэдр
sp 3 d 3
пентагональная бипирамида
Например, катион [Zn(NH 3 ) 4 ] 2+ включает комплексообразователь цинк(II). Электронная оболочка этого условного иона имеет формулу [Ar] 3d 10 4s 0 4p 0 и может быть условно изображена так:
Вакантные 4s— и 4p-орбитали атома цинка(II) образуют четыре sp 3 -гибридные орбитали, ориентированные к вершинам тетраэдра.
Каждая молекула аммиака имеет неподеленную пару электронов у атома азота. Орбитали атомов азота, содержащие неподеленные пары электронов, перекрываются с sp 3 -гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион тетраамминцинка(II)
Поскольку в ионе нет неспаренных электронов, то он проявляет диамагнитные свойства.
Тетрахлороманганат(II)-ион [MnCl 4 ] 2 — содержит пять неспаренных электронов на 3d-орбитали и вакантные 4s— и 4p-орбитали. Вакантные орбитали образуют sp 3 -гибридные орбитали, которые перекрываются с p-атомными орбиталями хлорид-ионов:
Полученный таким образом тетраэдрический ион является парамагнитным, так как содержит пять неспаренных электронов.
Применяя обычный алгоритм предсказания типа гибридизации атомных орбиталей в рамках метода валентных связей, можно определить геометрию комплексов разного состава. Для этого прежде всего необходимо написать электронную формулу валентного уровня и построить схему распределения электронов по квантовым ячейкам. Например, для нейтрального атома никеля:
Переход 4s-электронов на 3d-подуровень превращает парамагнитный атом Ni 0 в диамагнитную частицу Ni*:
Полученные вакантные орбитали подвергаются гибридизации, образуя тетраэдрическую конфигурацию. Так построен тетраэдрический диамагнитный комплекс тетракарбонилникель [Ni(CO) 4 ] (КЧ = 4), который характеризуется значительной устойчивостью.
Если комплексообразователем служит никель(II) с электронной конфигурацией то надобность в перемещении электронов с 4s-подуровня перед гибридизацией отпадает, так как для реализации координационного числа 4 имеется достаточное число вакантных орбиталей:
Такое строение имеет неустойчивый парамагнитный комплекс тетрабромоникколат(II)-ион Однако при объединении двух электронов 3d-подуровня в пару и превращении одной из квантовых ячеек этого подуровня в вакантную меняется и тип гибридизации, и характеристика получаемого комплекса:
Тип гибридизации dsp 2 и плоскоквадратная форма комплекса реализуются при образовании устойчивого диамагнитного комплекса тетрацианоникколат(II)-иона (КЧ = 4):
Если синтез цианидного комплекса вести в условиях избытка лиганда, можно реализовать координационное число 5:
Устойчивый диамагнитный комплекс пентацианоникколат(II)-ион имеет форму квадратной пирамиды:
Октаэдрический комплекс никеля(II) хотя и парамагнитен, но достаточно устойчив. Его образование обусловлено sp 3 d 2 -гибридизацией атомных орбиталей никеля:
Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, комплекс, как правило, в значительной степени парамагнитен и называется внешнеорбитальным или высокоспиновым . Строение таких комплексов может отвечать типу гибридизации, например, sp 3 d 2 .
Такие комплексы, при образовании которых имеет место гибридизация с участием атомных орбиталей предвнешнего d-подуровня, называются внутриорбитальными или низкоспиновыми и, как правило диамагнитны или слабо парамагнитны (все или почти все электроны комплексообразователя спарены, а тип гибридизации, например, d 2 sp 3 или dsp 2 ).
При рассмотрении комплексов железа(II) обнаруживаются и внешнеорбитальные, и внутриорбитальные комплексы.
Приведенная схема показывает, как образуются парамагнитный высокоспиновый гексафтороферрат(II)-ион [FeF 6 ] 4 — и диамагнитный низкоспиновый
Сама по себе теория валентных связей не дает ответа на вопрос, какой вид комплекса образуется в каждом конкретном случае, так как этот метод не учитывает влияния природы лиганда. Поэтому метод валентных связей должен обязательно дополняться данными о магнитных свойствах комплекса либо сведениями о влиянии лиганда на характер образующегося комплекса.
Теория кристаллического поля пришла на смену теории валентных связей в 40-х годах XX столетия. В чистом виде она сейчас не применяется, так как не может объяснить образование ковалентных связей в комплексных соединениях и совершенно не учитывает истинного состояния лигандов (например, их действительных размеров) даже в случае взаимодействий, близких к чисто электростатическим.
Уже с середины 50-х годов упрощенная теория кристаллического поля была заменена усовершенствованной теорией поля лигандов, учитывающей ковалентный характер химических связей между комплексообразователем и лигандом.
Однако наиболее общий подход к объяснению образования комплексных соединений дает теория молекулярных орбиталей (МО), которая в настоящее время превалирует над всеми остальными. Метод молекулярных орбиталей предусматривает и чисто электростатическое взаимодействие при отсутствии перекрывания атомных орбиталей, и всю совокупность промежуточных степеней перекрывания.
Рассмотрим основные понятия теории кристаллического поля, которая, как и теория валентных связей, все еще сохраняет свое значение для качественного описания химических связей в комплексных соединениях из-за большой простоты и наглядности.
В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.
Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d-подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов ( октаэдрическое, тетраэдрическое или иное кристаллическое поле ). Когда в качестве лигандов координируются молекулы H 2 O, NH 3 , CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
Рассмотрим случай октаэдрического расположения лигандов (например, или В центре октаэдра находится атом-комплексообразователь М(+ n ) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F — или полярные молекулы типа NH 3 ). В условном ионе М(+ n ), не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).
Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z 2 ) и d(x 2 — y 2 ), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов. Физической моделью такого взаимодействия может служить сильно сжатая пружина.
Другие три d-АО – d(xy), d(xz) и d(yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d-АО с лигандами минимально, а следовательно – энергия d(xy), d(xz) и d(yz)-АО понижается по сравнению с исходной.
Таким образом, пятикратно вырожденные d-АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz), и двукратно вырожденные орбитали с более высокой энергией, d(z 2 ) и d(x 2 — y 2 ). Эти новые группы d-орбиталей с более низкой и более высокой энергией обозначают d e и d g :
Разность энергий двух новых подуровней d e и d g получила название параметра расщепления D 0 :
Расположение двух новых энергетических подуровней d e и d g по отношению к исходному (d-АО) на энергетической диаграмме несимметричное:
Квантово-механическая теория требует, чтобы при полном заселении новых энергетических уровней электронами общая энергия осталась без изменения, т.е. она должна остаться равной Е 0 .
Иначе говоря, должно выполняться равенство
где 4 и 6 – максимальное число электронов на d g — и d e -АО. Из этого равенства следует, что
D 0 / (Е 0 – Е 1 ) = 5/2, откуда (Е 0 – Е 1 ) = 2/5 ´ D 0 >.
Размещение каждого электрона из шести максимально возможных на d e -орбитали вызывает уменьшение (выигрыш) энергии на 2/5 D 0 .
Наоборот, размещение каждого электрона из четырех возможных на d g -орбитали вызывает увеличение (затрату) энергии на 3/5 D 0 .
Если заселить электронами d e — и d g -орбитали полностью, то никакого выигрыша энергии не будет (как не будет и дополнительной затраты энергии):
4 ´ 3/5 ´ D 0 — 6 ´ 2/5 ´ D 0 = 0.
Но если исходная d-АО заселена только частично и содержит от 1 до 6 электронов, и эти электроны размещаются только на d e -АО, то мы получим значительный выигрыш энергии.
Выигрыш энергии за счет преимущественного заселения электронами d e -атомных орбиталей называют энергией стабилизации комплекса полем лигандов .
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое . Чем сильнее поле лигандов, чем больше значение параметра расщепления D 0 .
Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях. Длины волн полос поглощения комплексов l в кристаллическом состоянии или в растворе, обусловленные переходом электронов с d e — на d g -АО, связаны с параметром расщепления D 0 следующим образом:
n = 1 / l ; D 0 = Е 2 – Е 1 = h ´ n = h ´ ( c / l ) = h ´ c ´ n ,
где постоянная Планка h равна 6,626 ´ 10 — 34 Дж . с;
скорость света с = 3 ´ 10 10 см/с.
Единица измерения D 0 – та же, что у волнового числа n : см — 1 , что приближенно отвечает 12 Дж/моль.
Параметр расщепления, помимо типа лиганда, зависит от степени окисления и природы комплексообразователя.
В комплексных соединениях, включающих комплексообразователи одного и того же периода и в одинаковой степени окисления, с одними и теми же лигандами, параметр расщепления примерно одинаков. С ростом степени окисления комплексообразователя значение D 0 увеличивается. Так, для аквакомплексов [Mn(H 2 O) 6 ] 2+ и [Fe(H 2 O) 6 ] 2+ значение параметра расщепления составляет 7800 и 10400 см — 1 , а для [Mn(H 2 O) 6 ] 3+ и [Fe(H 2 O) 6 ] 3+ — 13700 и 21000 см — 1 соответственно.
При увеличении заряда ядра атома-комплексообразователя D 0 тоже растет. Катионы гексаамминкобальта(III) гексаамминродия(III) (Z = 27, 45 и 77) характеризуются параметрами расщепления, равными 22900, 34100 и
Зависимость D 0 от природы лигандов более разнообразна. В результате исследования многочисленных комплексных соединений было установлено, что по способности увеличивать параметр расщепления металлов-комплексообразователей, находящихся в своих обычных степенях окисления, наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд , вдоль которого значение D 0 монотонно растет:
I — Br — Cl — » NCS — NO 3 — F — OH — H 2 O » H — NH 3 NO 2 — CN — » NO » CO.
Таким образом, наиболее сильное электростатическое поле вокруг комплексообразователя и самое сильное расщепление d-АО вызывают лиганды NO 2 — , CN — и CO.
Рассмотрим распределение электронов по d e — и d g -орбиталям в октаэдрическом поле лигандов. Заселение d e — и d g -орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки d e -подуровня:
Если число электронов на d-подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий d e — и d g -орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки d g -подуровня. При сильном поле лигандов и высоком значении D 0 заселение четвертым и пятым электроном d g -подуровня исключено; происходит заполнение d e -орбиталей.
При слабом поле лигандов заселяющие квантовые ячейки 4 или 5 электронов имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен. В сильном поле лигандов образуются одна, а затем две электронные пары на d e -подуровне, так что парамагнетизм комплекса оказывается гораздо слабее.
Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d e -подуровне, дополняя конфигурации до электронных пар (одной в случае d 6 , двух – d 7 и трех – d 8 ):
В случае сильного поля лигандов шестой электрон заселяет d e -АО, приводя к диамагнетизму комплекса, после чего седьмой и восьмой электроны поступают на d g -подуровень:
Очевидно, при восьмиэлектронной конфигурации различия в строении между комплексами с лигандами слабого и сильного поля исчезают. Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов и . В соответствии с расположением в спектрохимическом ряду, аммиак NH 3 относится к числу лигандов сильного поля , а фторид-ион F — – слабого поля . Следовательно, заселение электронами атомных орбиталей в данных комплексах будет происходит по схеме:
В анионе лиганды F — создают слабое кристаллическое поле ( D 0 = 13000 см — 1 ), и все электроны исходной 3d 6 -АО размещаются на d e — и d g -орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен.
В ионе лиганды NH 3 создают сильное кристаллическое поле ( D 0 = 22900 см — 1 ), все 3d 6 -электроны размещаются на более энергетически выгодной d e -орбитали. Переход электронов с d e — на d g -орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен.
Аналогичным образом могут быть представлены схемы распределения электронов по орбиталям в октаэдрическом поле для ионов и
Лиганды H 2 O создают слабое поле; обмен электронами между d e — и d g -орбиталями не вызывает затруднений и поэтому число неспаренных электронов в комплексном ионе такое же, как и в условном ионе Fe +II . Получаемый аквакомплекс – высокоспиновый, парамагнитный.
Наоборот, лиганды CN — вызывают значительное расщепление d-АО, составляющее Это значит, что существует сильная тенденция к размещению всех электронов на d e -орбиталях. Выигрыш энергии, получаемый при таком заселении орбиталей, много больше энергетических затрат, обусловленных спариванием электронов.
Многие комплексные соединения в кристаллическом состоянии и водном растворе отличаются яркой окраской. Так, водный раствор, содержащий катионы , окрашен в интенсивно синий цвет, катионы придают раствору фиолетовую окраску, а катионы красную. Теория кристаллического поля позволяет объяснить появление той или иной окраски у комплексных соединений.
Если через раствор или кристаллический образец вещества пропускать свет видимой части спектра, то в принципе возможны три варианта физического поведения образца: отсутствие поглощения света любой длины волны (образец вещества бесцветен, хотя может иметь полосы поглощения в ультрафиолетовой области спектра); полное поглощение света во всем интервале длин волн (образец будет казаться черным); наконец, поглощение света только определенной длины волны (тогда образец будет иметь цвет, дополнительный к поглощенному узкому участку спектра). Таким образом, цвет раствора или кристаллов определяется частотой полос поглощения видимого света:
Поглощение квантов света комплексами (например, имеющими октаэдрическое строение) объясняется взаимодействием света с электронами, находящимися на d e -подуровне, сопровождаемое их переходом на вакантные орбитали d g -подуровня.
Например, при пропускании света через водный раствор, содержащий катионы гексаакватитана(III) , обнаруживается полоса поглощения света в желто-зеленой области спектра (20300 см — 1 , l » 500 нм). Это связано с переходом единственного электрона комплексообразователя с d e -АО на d g -подуровень:
Поэтому раствор, содержащий , приобретает фиолетовый цвет (дополнительный к поглощенному желто-зеленому).
Раствор соли ванадия имеет зеленый цвет. Это также обусловлено соответствующими переходами электронов при поглощении ими части энергии светового луча. В основном состоянии, при электронной конфигурации ванадия(III) 3d 2 , два неспаренных электрона занимают d e -подуровень:
Существует всего два варианта перехода двух электронов на d g -подуровень: либо оба электрона занимают d g -АО, либо только один из них. Любые другие переходы электронов, связанные с уменьшением суммарного спина, запрещены.
Указанным переходам электронов, получивших избыточную энергию, соответствует полоса поглощения около 400 нм в спектре поглощения раствора хлорида гексаакваванадия(III). Поглощение пурпурно-фиолетовой области спектра дает дополнительный цвет раствора – ярко-зеленый.
Если комплексообразователь имеет электронную конфигурацию d 0 или d 10 , то переходы электронов с d e — на d g -подуровень или наоборот невозможны либо из-за отсутствия электронов, либо из-за отсутствия вакантных орбиталей. Поэтому растворы комплексов с такими комплексообразователями, как Sc(III), Cu(I), Zn(II), Cd(II) и т.п., не поглощают энергии в видимой части спектра и кажутся бесцветными:
Избирательность поглощения света зависит не только от комплексообразователя и степени его окисления, но и от вида лигандов. При замене в комплексном соединении лигандов, находящихся в левой части спектрохимического ряда, на лиганды, создающие сильное электростатическое поле, наблюдается увеличение доли энергии, поглощаемой электронами из проходящего света и как следствие – уменьшение длины волны соответствующей полосы поглощения. Так, водный раствор, содержащий катионы тетрааквамеди(II) окрашен в голубой цвет, а раствор сульфата тетраамминмеди(II) имеет интенсивно синюю окраску.
Читайте также:
- GУметь использовать на практике современные технологии и методы менеджмента.
- I. Метод амальгамации
- I. Структура социологии, её объект, предмет, метод и функции.
- III Реклама, как метод продвижения товара на рынок
- III. Гидрометаллургичесие методы
- III. Эмиссионный метод.
- IV Методы установленных цен в маркетинге
- IV Персональные продажи, как метод продвижения товара на рынок
- V. Ценовая политика на предприятии. Методы ценообразования.
- VI. Нулевой метод
- VII. Дифференциальный метод
- X Методы изучения рынка с помощью инструментария маркетинга
ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Согласно представлениям метода ВС химическая связь в комплексных соединениях носит донорно-акцепторный характер. Свободные электронные пары, которыми обладают лиганды, заполняют пустые орбитали центрального иона. Эти орбитали объединяют в гибридные комбинации в зависимости от координационного числа (к.ч.).
Комплексные соединения с к.ч., равным двум, описываются, как правило, с позиции sp-гибридизации. Примерами являются комплексные соединения Ag (I); Cu (I); Au (I). Рассмотрим комплексный ион AgCl2 – . Электронная конфигурация иона Ag + 4d 10 , орбитали 5s, 5p, 5d, 5f и 5g пустые. Самые низкие по энергии из них 5s и 5p. Именно туда “селятся” две электронные пары от двух анионов хлора:
Таким образом, рассматриваемый комплекс описывается с позиции sp-гибридизации, ион серебра и два аниона хлора расположены на прямой.
Комплексные соединения с к.ч., равным трём, обычно описываются исходя из sp 2 -гибридизации, например, Ag(CN)3 2– . Три аниона CN – расположены вокруг катиона Ag + по вершинам правильного треугольника.
В качестве примеров комплексных соединений с к.ч., равным четырём, рассмотрим два комплекса никеля (II): NiF4 2– ; Ni(CN)4 2– . Электронная “макушка” иона Ni 2+ – 3d 8 , более высокие по энергии орбитали пусты:
Как видно, возможны два варианта – заполнение электронными парами лигандов только пустых орбиталей и освобождение одной 3d-орбитали за счёт спаривания электронов с последующим заполнением её электронной парой лиганда, а затем – заполнение пустых орбиталей. Очевидно, всё будет определяться энергетическим балансом – выигрышем в энергии, связанным с образованием связи (Есв), и энергетическим проигрышем, равным энергии образования электронной пары из неспаренных электронов (Епары). Если Епары > Есв, то спиновое состояние центрального иона в комплексе останется тем же, что и у свободного иона. В случае, если Есв > Епары, происходит образование пары и освобождение одной орбитали в 3d-оболочке. Всё будет определяться прочностью связи лиганд–центральный ион. На практике Есв > Епары в случае только цианидных комплексов двухзарядных центральных ионов, а для комплексов с трёхзарядным ионом – комплексообразователем со следующими лигандами: CN – , NO2 – , NH3.
Вернёмся к рассматриваемым комплексным ионам. Для NiF4 2– Епары > Есв и электронное состояние центрального иона останется неизменным:
Связь в комплексном анионе характеризует sp 3 -гибридизация, комплексный ион имеет тетраэдрическое строение и характеризуется высоким значением спина.
Для цианидного комплексного аниона Есв > Епары, электроны “загоняются” в пару, и освободившаяся орбиталь будет занята парой электронов:
Химическую связь в этом комплексе описываем с позиций dsp 2 -гибридизации, комплексный анион имеет квадратное строение и характеризуется низким спином.
В связи со спиновым состоянием рассматриваемых частиц напомним, что наличие или отсутствие неспаренных электронов имеет отношение к магнитным характеристикам веществ. Ферромагнитные вещества мощно взаимодействуют с магнитным полем; это в первую очередь железо, кобальт, никель и комбинации на их основе. Парамагнитные вещества слабо реагируют на магнитное поле, фактически отзываются на него. Частицы парамагнитных веществ содержат в своём составе неспаренные электроны. Наконец, диамагнитные вещества вообще безразличны к магнитному полю. Частицы, составляющие такие вещества (атомы, молекулы, ионы), не содержат неспаренных электронов. Перечисленные выше комплексные анионы (кроме NiF4 2– ) являются диамагнетиками. Ион NiF4 2– обладает парамагнитными свойствами. Парамагнетизм является основой физико-химического метода – электронного парамагнитного резонанса (ЭПР), позволяющего изучать функциональные особенности вещества.
Для описания химической связи в комплексах с к.ч., равным пяти, как правило, привлекают представления о dsp 3 -гибридизации. Рассмотрим в качестве примера не совсем традиционное комплексное соединение – пентакарбонил железа Fe(CO)5. Карбонилы – соединения металлов с оксидом углерода (II) могут рассматриваться, по крайней мере, в отношении химической связи, как своеобразные комплексные соединения. При этом, говоря о карбонилах и других соединениях с СО, следует иметь в виду, что это очень сильные лиганды, дающие прочную химическую связь.
Электронное строение атома железа …3d 6 4s 2 . Являясь сильным лигандом, для которого Есв > Епары, СО “загоняет” указанные 8 электронов в 4 пары, находящиеся в составе 3d-оболочки, высвобождая одну из 3d-орбиталей и 4s-орбиталь:
Химическая связь в молекуле Fe(CO)5 описывается с позиции dsp 3 -гибридизации, молекула имеет форму тригональной бипирамиды, она диамагнитна.
В качестве примеров комплексных соединений с к.ч., равным шести, рассмотрим ионы [Fe(H2O)6] 2+ и [Fe(CN)6] 4– . Центральным ионом является ион Fe 2+ , имеющий конфигурацию внешнего слоя 3d 6 :
Вода является лигандом, для которого Епары > Есв, поэтому для комплекса [Fe(H2O)6] 2+ будет сохраняться электронная конфигурация свободного иона, свободные электронные пары от молекул воды будут последовательно занимать 4s-, 4p- и 4d-орбитали:
Связь характеризуется sp 3 d 2 -гибридной комбинацией орбиталей; для того, чтобы показать, что задействованы внешние d-орбитали, говорят о “внешней” гибридизации. Комплексный катион имеет октаэдрическое строение и является парамагнитным.
В случае цианидного комплекса Есв > Епары, поэтому шесть 3d-электронов займут три орбитали, а остальные две будут заполняться электронами лигандов:
Тип гибридизации орбиталей будет таким же, что и в предыдущем случае, однако здесь задействованы внутренние d-орбитали, поэтому говорят о “внутренней” гибридизации. Комплексный анион имеет октаэдрическое строение и является диамагнитным.
Дата добавления: 2014-01-04 ; Просмотров: 2400 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Лекции по химии
вторник, 27 марта 2012 г.
Природа химической связи в комплексных соединениях
Существуют 3 типа связи, которые объясняют природу химической связи в комплексных соединениях:
1. Метод В.С. (валентных связей).
2. Теория кристал. поля.
3. Метод МО (молекулярных орбиталей).
1. В основе метода валентных связей лежат положения:
1. связь между комплексообразователем и лигандами донорно – акцепторного механизма.
Лиганды представляют свободные электронные пары, а комплексообразователь свободные орбитали. Мерой прочности такой связи служит степень перекрывания -орбиталей.
2. Орбитали центрального поля участвуют в образовании связи подвергающейся гибридизации, тип которой определяется природой и структурой лиганда.
Магнитные свойства определяются наличием неспаренных валентных электронов.
Если электроны спарены, то комплекс диамагнитен (не обладает магнитными свойствами)
Механизм образования связи и тип её гибридизации зависит также от природы комплексообразователя.
Реакционная способность комплексных соединений во многом зависит от скорости обмена лигандов на ионы или молекулы. Условиями благоприятными для обмена лигандов является:
1) внешняя гибридизация
2) положение у комплексообразователя свободных внутренних d-орбиталей: в случае внешней гибридизации связь лигандов с комплексообразователем значительно слабее, чем при внутренней гибридизации, поэтому их обмен осуществляется с меньшими энергетическими затратами. Данный комплекс более активен (реакционно способен).
Теория кристаллического поля
Она рассматривает воздействия лигандов на d-орбитали комплексообразователя. Лиганды располагаются относительно (+) заряженного иона (–) концами своего диполя. В результате между d-электронами (центрального) и лигандами образуется сила отталкивания, что приводит к увеличению энергии d-электрона. Однако она неоднородна и зависит от расстояния и природы лиганда.
Рассмотрим несколько случаев:
1) если d — располагаются близко к лигандам, то энергия их увеличивается.
2) если d — расположены дальше от лигандов, то энергия их уменьшается.
Т.е. под действием лигандов происходит расщепление энергетического уровня d-орбиталей.
Величина е – расщепления зависит от природы лиганда и конфигурации комплекса.
Для перевода с одной орбитали на другую необходимо затратить энергию (Р).
При этом возможны 2 случая:
1) Если , то электроны центрального поля в комплексе занимают те же орбитали, что и в свободном ионе. В этом случае ион Ме находится в состоянии с высоким значением S.
Связь в комплексных ионах
Что удерживает атомы в комплексном ионе? Существуют два возможных ответа. В некоторых комплексах, например в ионе [AlF6] 3- связь между атомами обусловлена взаимным притяжением положительного иона Al 3+ и отрицательно заряженных ионов F — . Следовательно, связь ионная. В других комплексных ионах, таких как [Fe(CN)6] 3 — , налицо заметное обобщение электронов центрального атома-комплексообразователя и окружающих его групп. Следовательно, связь в основном ковалентная. При таком обобщении электрон или электронная пар присоединяющейся группы часть времени находится на орбите, принадлежащей центральному атому. В других случаях электронная пара образуется обоими атомами, участвующими в образовании химической связи.
Пространственная структура комплексных частиц может быть объяснена с позиций метода валентных связей (МВС). МВС для описания комплексных соединений разработал и предложил Л. Полинг. Основные положения его теории:
1) связь между комплексообразователем и лигандами донорно-акцепторная. Прочность связи зависит от степени перекрывания орбиталей;
2) орбитали комплексообразователя подвергаются гибридизации, что определяет пространственное строение комплекса;
3) дополнительное упрочнение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи;
4) магнитные свойства, комплексных соединений, объясняются наличием или отсутствием неспаренных электронов.
Этот метод предполагает, что комплексная частица возникает в результате образования ковалентных связей между комплексообразователем и лигандами. При этом ковалентная s-связь образуется в результате перекрывания вакантной орбитали атома (или иона) комплексообразователя (акцептора) с заполненными, т.е. содержащими неподеленные пары электронов, орбиталями лигандов (доноров). Максимально возможное число s-связей определяет координационное число комплексообразователя.
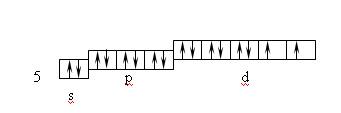
Поскольку при одинаковых лигандах образующиеся s-связи равноценны, то образование комплексной частицы сопровождается гибридизацией акцепторных орбиталей комплексообразователя. При координационном числе 4 чаще всего реализуется sp 3 – гибридизация, что соответствует тетраэдрической координации лигандов, или dsp 2 – гибридизация, отвечающая плоско-квадратной координации лигандов. Так, в комплексе [Zn(NH3)4] 2+ , ион Zn 2+ является комплексообразователем. Нейтральный атом цинка имеет электронную структуру: 4s 2 3d 10 4p 0 4d 0 ; а ион Zn 2+ : 4s 0 3d 10 4p 0 4d 0 . Таким образом, ион цинка предоставляет для электронных пар лигандов (условно показанных на схеме точками) одну 4s- и три 4p- орбитали.
[Zn(NH3)4] 2+
причем осуществляется sp 3 –гибридизация, ион [Zn(NH3)4] 2+ обладает диамагнитными свойствами, так как нет неспаренных электронов.
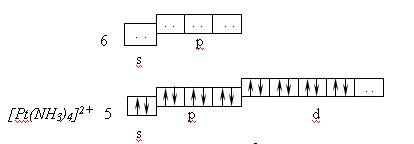
Ионы d–элементов с четырьмя занятыми d–орбиталями (Pt 2+ , Pd 2+ , Au 3+ ) при координационном числе 4 предоставляют для электронных пар лигандов одну d- , одну s- и две p-орбитали, например, в комплексе [Pt(NH3)4] 2+ , комплексообразователем является ион Pt 2+ . Нейтральный атом имеет электронную структуру: 6s 1 4f 14 5d 9 6p 0 6d 0 , а ион Pt 2+ : 6s 0 4f 14 5d 8 6p 0 6d 0
Лиганды NH3 связываясь с комплексообразователем, вызывают перераспределение электронов на его орбиталях.
При этом осуществляется dsp 2 -гибридизация. Комплекс [Pt(NH3)4] 2+ — диамагнитен и в рамках МВС является внутриорбитальным.
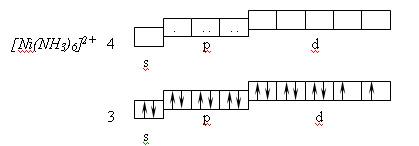
При координационном числе 6 осуществляется октаэдрическая координация лигандов, которая определяется d 2 sp 3 – или sp 3 d 2 – гибридизацией. Такая координация имеет место, например в комплексе [Ni(NH3)6] 2+ . Комплексообразователем является ион Ni 2+ . Нейтральный атом никеля имеет электронную структуру: 4s 2 3d 8 4p 0 4d 0 , а ион Ni 2+ имеет следующую электронную конфигурацию: 4s 0 3d 8 4p 0 4d 0 .
Лиганды NH3, входящие в состав комплексного иона, не вызывают перераспределения электронов комплексообразователя и образуют донорно-акцепторные связи с ним, используя свободные орбитали. Осуществляется sp 3 d 2 –гибридизация, ион [Ni(NH3)6] 2+ обладает парамагнитными свойствами, то есть имеет два неспаренных электрона, которые придают повышенную реакционную способность и в рамках МВС относится к группе внешнеорбитальных комплексов.
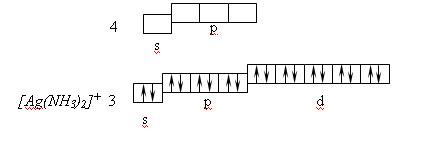
Координационному числу 2 отвечает гибридизация sp–типа и линейная координация лигандов, например, в комплексе [Ag(NH3)2] +
Рассмотренные примеры показывают, что МВС успешно объясняет определенные значения координационных чисел, геометрические формы комплексных частиц и магнитные свойства комплексных соединений.
С точки зрения МВС нельзя объяснить строение многих комплексных соединений, например «сандвичевых». Наиболее плодотворным в теории комплексных соединений, ведущим в настоящее время стал ММО. Молекулярные орбитали в комплексных соединениях образуются по тому же принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах. Отличие их заключается в том, что молекулярные орбитали в комплексных соединениях являются многоцентровыми, делокализованными.
Теория кристаллического поля основана на представлениях об электростатической природе взаимодействия между центральным атомом и лигандами. Однако, в отличие от простой ионной теории, здесь учитывается различное пространственное расположение d-орбиталей и связанное с этим различное изменение энергии d-электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов. Хотя теория кристаллического поля оказалась плодотворной в трактовке магнитных, оптических и некоторых других свойств комплексных соединений, она не смогла объяснить сам факт образования некоторых комплексов, например, так называемых «сандвичевых»- дибензолхрома ферроцена и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный атом, не принимает во внимание участия электронов лигандов в образовании химических связей с ним. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным типом связи между центральным атомом и лигандами.
Хим. связь в комплексн.соед. Теории строения комплесн.соед. Метод ваелентн.связей(МВС)
Метод валентных связей (МВС) к комплексным соединениям впервые применил Л. Полинг. он исходил из следующего предположения: связь в комплексном соединении ковалентная и осуществляется по донорно-акцепторному механизму за счет перекрывания вакантных орбиталей центрального атома и заполненных орбиталей лиганда.Геометрия комплексного иона определяется типом гибридизации свободных орбиталей ЦА (Табл. 2.1). Геомет. строение и тип гибр-ции комплекс. ионов
| КЧ | Тип гибридизации | Пространственное строение | Пример |
| sp | Линейное | [Ag(NH3)2] + | |
| sp 2 | Тригональное | [HgI3] − | |
| sp 3 | Тетраэдр | [FeBr4] 2− | |
| dsp 2 | Квадрат | [Ni(СN)4] 2− | |
| dsp 3 , d 3 sp | Тригональная бипирамида | [CuCl5] 3− | |
| d 2 sp 2 , d 4 s | Квадратная пирамида | [Ni(CN)5] 3− | |
| d 2 sp 3 | Октаэдр | [Co(NH3)6] 3+ | |
| d 3 sp 3 | Пентагональная бипирамида | [V(CN)7] 4− | |
| d 4 sp 3 | Квадратная антипризма | [TaF8] 3− |
Рассмотрим с этих позиций строение двух комплексов кобальта(III): ионов гексааминокобальта(III) [Co(NH3)6] 3+ и гексафторокобальтата(III) [CoF6] 3− (Рис. 2.1). Строение ионов [Co(NH3)6] 3+ и [CoF6] 3− по МВС
Электронная конфигурация свободного иона Со 3+ : 3d 6 4s 0 4p 0 4d 0 . Орбитали иона кобальта, участвующие в образовании связи с ионами F − , гибридизуются с образоваинем sp 3 d 2 -гибридных орбиталей (внешнеорбитальный комплекс), что и определяет октаэдрическую конфигурацию комплексного иона [CoF6] 3− .
В ионе [Co(NH3)6] 3+ реализуется иное распределение электронов по орбиталям – все электроны кобальта спарены. Комплекс также имеет октаэдрическую структуру, но иной тип гибридизации – d 2 sp 3 (внутриорбитальный комплекс). Выбрать одну из этих двух возможных конфигураций можно только, если известны магнитные свойства комплекса. Ион [Co(NH3)6] 3+ диамагнитен, все электроны спарены, а ион [CoF6] 3− парамагнитен. Определить магнитные свойства комплекса с точки зрения метода валентных связей невозможно, также как и цветность комплекса, и его внутри- или внешнеорбитальность.
Некоторые лиганды или их атомы могут иметь вакантные орбитали, например PH3, H2S. В этом случае образуются дополнительные связи по донорно-акцепторному механизму (дативные связи), в которых лиганд служит акцептором, а комплексообразователь, имеющий неподеленные электронные пары, − донором. Образование дативных связей приводит к увеличению прочности комплексов.
Влияние на величину энергии расщепления природы централ.атома (заряда, радиуса, конфигураци), природы, числа, расположение лигандов. Спектрохимический ряд. Окраска и магнитные свойства комплексов.
Теория кристаллического поля (ТКП) является развитием простой электростатической теории образования комплексов. Она лучше всего применима к соединениям d-элементов и является наиболее простой моделью, позволяющей достаточно просто объяснить их свойства. Согласно теории связь в комплексе осуществляется за счет электростатического взаимодействия между положительно заряженным центральным атомом и отрицательно заряженными лигандами. Лиганд рассматривается только как источник заряда (кристаллического поля), тогда как для центрального атома учитывается пространственное расположение d-орбиталей.
Геометрическое строение комплексно частицы определяется в первом приближении максимальным взаимным отталкиванием отрицательно заряженных лигандов: шесть лигандов образуют октаэдр, четыре – тетраэдр.
В свободном атоме или ионе все пять d-орбиталей одного и того же уровня имеют одинаковую энергию, т.е. они вырождены. Если, гипотетически, ион d-элемента внести в центр сферы равнораспределенного отрицательного заряда, то на все пять электронных облаков будет действовать одинаковая сила отталкивания. В результате этого произойдет возбуждение d-подуровня, но вырождение не снимется. Иная картина возникает, если ион попадает в октаэдрическое, тетраэдрическое или иное окружение (менее симметричное, чем сферическое). Допустим, положительный ион d-элемента находится в октаэдрическом окружении отрицательно заряженных ионов или полярных молекул.
В этом случае — и — электроны испытывают большее электростатическое отталкивание от лигандов, чем dxy-, dxz— и dyz—электроны.
Следовательно, энергия d-электронов в этих условиях не одинакова: в — и — состоянии ( ) энергия выше, чем в dxy-, dxz— и dyz—состоянии ( ). Таким образом, если в свободном или находящемся в сферическом поле ионе пять d-орбиталей имеют одинаковую энергию, то в октаэдрическом поле лигандов они разделяются на две группы с разными энергиями – в три и две орбитали.
Энергетическая разность d-уровней Δ называется энергией расщепления кристаллическим полем. Она выражается в единицах Dq (мера силы кристаллического поля), причем ΔЕ = Е1 – Е2 = 10Dq=Δ. Для октаэдрического комплекса энергия -орбиталей на 2/5Δ (4 Dq) ниже вырожденных d-орбиталей, а − на 3/5Δ (6 Dq) выше.
Величина энергии расщепления определяет свойства КС, поэтому важно знать факторы, от которых она зависит.
Не нашли то, что искали? Воспользуйтесь поиском:
- http://studopedia.su/2_23978_metod-valentnih-svyazey.html
- http://lech-ximiya.blogspot.com/2012/03/blog-post_2666.html
- http://studfiles.net/preview/5713068/page:7/
- http://studopedia.ru/15_6898_him-svyaz-v-kompleksnsoed-teorii-stroeniya-komplesnsoed-metod-vaelentnsvyazeymvs.html