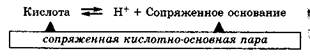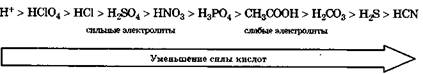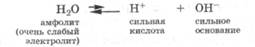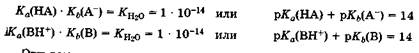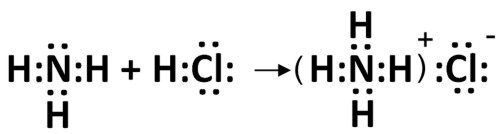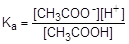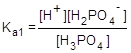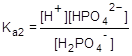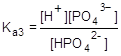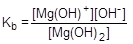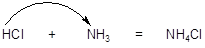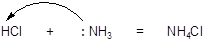Читайте также:
- A-аминокислоты. Пептиды
- A. Организм. Индивид. Личность. Ииндивидуальность. Теория развития индивидуальности Б.Г. Ананьева.
- B-ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
- I.4. Общая теория относительности (ОТО) и теория гравитации
- L Ситуативная теория (Т.Хилтон)
- N В этом случае образуется больше ксантина и, следовательно, мочевой кислоты
- N Оценивается базальная и стимулированная секреция соляной кислоты (стимулируют пантагастрином)
- XY» — Теория Д.макгрегора.
- Автомобильная углекислотно-зарядная станция АУЗС-2М-131
- Автомобильная углекислотно-зарядная станция АУЗС-2М-131
- Адсорбционная теория Штерна
- Азотистая кислота
Более универсальные определения понятий кислота и основание, чем данные в рамках ионной теории Аррениуса, сформулированы в протонной теории. Основы этой теории были заложены датским физико-химиком Бренстедом и английским химиком Лаури. Теория называется протонной потому, что главная роль в определении понятий кислота и основание отведена в ней простейшей химической частице Н + – катиону водорода в виде свободного протона,
В соответствии с протонной теорией
кислота — это вещество, водородсодержащие частицы которого (молекулы, ионы) способны отдавать свои протоны;
основание — это вещество, частицы которого (молекулы, ионы) способны принимать протоны от кислот.
Таким образом, кислота—это донор протонов: НА = а — + Н + , основание – это акцептор протонов: В + Н + = НВ + (НА — общая формула кислоты, В — общая формула основания).
В определениях кислот и оснований проявляется заметная аналогий с определениями восстановителей и окислителей, участвующих в процессах отдачи и приема электронов. Как в окислительно-восстановительной паре окисленной форме соответствует восстановленная форма, содержащая, как минимум, на один электрон больше, так и согласно протонной теории каждой кислоте соответствует свое основание, имеющее, как минимум, на один протон меньше:
| НА « | А — | + Н + | и | В + | Н + « | НВ + |
| кислота 1 | основание 1 | протон | основание 2 | протон | кислота 2 |
Каждая кислота переходит в соответствующее ей основание в результате потери протона, а каждое основание переходит в соответствующую ему кислоту в результате приобретения протона.
Кислота и соответствующее основание образуют кислотно-основную сопряженную пару Кислота/Основание: НА/А — и НВ + /В
Азотная кислота и нитрат-ион НNО3/NО3 —
Хлороводород и хлорид-ион НС1/Сl —
Катион аммония и аммиак NН4 + /NН3
Поскольку при передаче протона частица кислоты отдает один положительный элементарный заряд, то в каждой сопряженной паре Кислота/Основание присутствует, как минимум, один ион, а заряд частицы кислоты на единицу больше, чем у частицы основания.
Протонная теория приписывает кислотные свойства таким частицам, как NН4 + , а основные свойства — частицам NО3 — и С1 — , это показывает, как сильно различаются определения Бренстеда — Лаури и Аррениуса. По Бренстеду — Лаури кислотно-основные свойства приписываются любым частицам (молекулам, ионам), так что и кислоты, и основания могут быть нейтральными (НNО3, НС1, NН3) и заряженными (НSО4 — , NН4 + , NО3 — , SО4 2- ).
В соответствии с протонной теорией любая водородсодержащая частица может проявлять и кислотные, и основные свойства. Например: НNО3 « NО3 — + Н + и НNО3 + Н + « Н2NО3 + .
В первой сопряженной паре НNО3 — кислота и NО3 — — основание, а во второй — Н2NО3 + (катион нитратодиводорода) — кислота и НNО3 — основание.
В протонной теории кислоты (доноры протонов) и основания (акцепторы протонов) объединяются в одно понятие протолит. Протолиты — это вещества, способные к отдаче или приему протонов.
Протолиты, которые в одних условиях могут отдавать свои протоны, а в других — принимать протоны, называются амфолитами. Таким образом, амфолиты могут одновременно быть донорами и акцепторами протонов. Например: Амфолитом является гидрокарбонат-ион:
Если две сопряженные пары Кислота/Основание привести в контакт, то между ними может произойти обмен протонами — протолиз. Химические реакции, сопровождающиеся протолизом, называются протолитическими:
НА + В « А — + НВ + или кислота 1 + основание 2 « основание 1 + кислота 2
Известно, что в ряду жидких веществ:
Вследствие конкуренции за обладание протоном кислотно-основные реакции — обратимые процессы, характеризующиеся состоянием протолитического равновесия.
Из законов термодинамики следует, что протолитическое равновесие всегда будет смещено в сторону образования более слабых протолитов.
В соответствии с протонной теорией вода является по отношению к самой себе амфолитом: Н2О = ОН — + Н + и Н2О + Н + = Н3О + , что объясняет протекание автопротолиза воды:
Автопротолиз воды количественно характеризуется ионным произведением воды:
КВ = [Н3O + ] [ОН — ] = 1 • 1 0 — 14 (25 °С)
Дата добавления: 2014-01-07 ; Просмотров: 1265 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Кислоты и основания с точки зрения протонной теории
Теории кислот и оснований — совокупность фундаментальных физико химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований двух классов веществ, реагирующих между собой. Задача теории предсказание продуктов… … Википедия
Амфотерность — (от др. греч. (ἀμφότεροι «двойственный», «обоюдный») способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства. Понятие амфотерность как характеристика двойственного поведения вещества… … Википедия
ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ
Понятия «кислота» и «основание» применяют по отношению к двум группам соединений, обладающих совокупностью диаметрально противоположных свойств. В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот и оснований. Согласно этой теории понятиям кислота и основание отвечают следующие определения.
 |
Кислота — молекула или ион, способные отдавать катион водорода (протон). Кислота — донор протонов.
Основание — молекула или ион, способные присоединять катион водорода (протон). Основание — акцептор протонов.
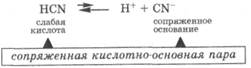
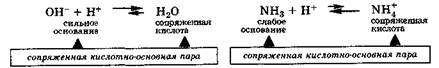
Кислота, отдавая протон, превращается в частицу, стремящуюся его принять, которая называется сопряженным основанием:
Основание, присоединяя протон, превращается в частицу, стремящуюся его отдать, которая называется сопряженной кислотой:
Совокупность кислоты и ее сопряженного основания или основания и его сопряженной кислоты называются сопряженными кислотно-основными парами.
Сила кислоты определяется ее способностью отдавать протон, т. е. сильная кислота — активный донор протона. Сила кислот в водных растворах уменьшается в ряду:
 |
Сила основания определяется его способностью присоединять протон, т. е. сильное основание — активный акцептор протона. Сила оснований в водных растворах, т. е. их сродство к протону, уменьшается в ряду:
Сильные кислоты, легко отдавая протон, превращаются в сопряженные основания, которые плохо присоединяют протон. Поэтому диссоциация этих кислот протекает практически необратимо:
Слабые кислоты, трудно отдавая протон, превращаются в сопряженные основания, которые активно принимают протон, что делает диссоциацию слабых кислот обратимым процессом, причем равновесие смещено в сторону недиссоциированной формы:
Аналогичным образом ведут себя сильные и слабые основания, превращаясь в результате реакции в соответствующие сопряженные кислоты, т. е. и в этих случаях также имеются сопряженные кислотно-основные пары:
Некоторые вещества способны выступать в одних реакциях в роли донора протона, отдавая его соединениям, у которых сродство к протону выше, а в других — в роли акцептора протона, отнимая его у соединений с меньшим сродством к протону. Такие вещества называются амфолитами.
Амфолиты — молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать в реакции, характерные как для кислот, так и для оснований. Амфолит проявляет свойства кислоты или основания в зависимости от того, с какими веществами он взаимодействует. Типичным амфолитом является вода, так как в результате ее электролитической диссоциации образуются одновременно сильная кислота и сильное основание:
Кроме того, вода взаимодействует и с кислотами, выступая основанием, и с основаниями, проявляя свойства кислоты:
 |
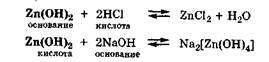 |
Амфолитами являются гидроксиды некоторых металлов (Zn, Al, Pb, Sn, Cr):
Амфолитами являются гидроанионы многоосновных кислот, например НС03-, НР042-и Н2РО4-.
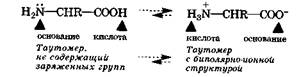
Амфолитами являются также соединения, молекулы которых содержат две различные кислотно-основные группы, например важные в биологическом отношении а-аминокислоты. Молекула а-аминокислоты в результате переноса протона от карбоксильной группы на аминогруппу превращается из таутомера*, не содержащего заряженные группы, в таутомер, имеющий биполярно-ионную (цвиттерионную) структуру. Таким образом, для а-аминокислот характерна прототропная таутомерия (разд. 21.2.1).
В кристаллическом состоянии и в водных растворах это равновесие для а-аминокислот практически полностью смещено в сторону таутомера с биполярной структурой. Так, для глицина в водном растворе содержание таутомера с биполярно-ионной структурой в 223 000 раз больше, чем другого таутомера.
Вследствие этой особенности строения молекулы а-аминокислот проявляют кислотные свойства за счет аммонийной группы ( NH3+), а основные — за счет ионизованной карбоксильной группы (—СОО- ), выступая амфолитами:
Как и все амфолиты, а-аминокислоты являются слабыми электролитами.
Согласно протолитической теории кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основанию называется протолизом и объясняется тем, что эти два вещества имеют разное сродство к протону. В кислотно-основном взаимодействии всегда участвуют две сопряженные кислотно-основные пары, и переход протона всегда происходит в сторону образования более слабых кислот, включая сопряженные. Если склонность к взаимодействию с протоном у реагентов соизмерима, то наблюдается протолитическое равновесие.
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон (Н + ) между основаниями взаимодействующих сопряженных кислотно-основных пар (НА, А- и ВН + , В). Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты:
Схематично протолитическое равновесие можно представить следующей схемой:
Переход протона всегда происходит от сильной кислоты каниону слабой кислоты, что сопровождается вытеснением слабой кислоты из ее соли под действием более сильной кислоты.
Протолитическое равновесие наблюдается при ионизации слабых электролитов в воде (разд. 7.2). Так, ионизация слабой кислоты в водных растворах является следствием конкуренции за протон между анионом слабой кислоты и водой, выступающей основанием, т. е. акцептором протона. Этот процесс является обратимым и характеризуется константой равновесия Ка:
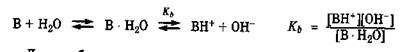 |
При взаимодействии слабого основания с водой последняя, выступая донором протона, способствует ионизации этого основания, носящей равновесный характер:
для слаоых электролитовсила кислот и оснований характеризуется величинами констант кислотности Каи основности Кbссоответственно (разд. 7.2). Если эти константы характеризуют протолитическое взаимодействие воды с кислотой или основанием одной сопряженной пары НА, А или ВН + , В, то произведение констант кислотности Ка и основности Kb, компонентов данной пары всегда равно ионному произведению воды Кн2о = 1 * 10 -14 (при 22 °С):
Эти выражения позволяют заменить в случае водных растворов константу основности Кь или показатель основности рКь слабого основания на константу кислотности Каили на показатель кислотности рКасопряженной кислоты этого основания. На практике для характеристики протолитических свойств соединения обычно используют величину рКа. Так, силу аммиака в воде как основания (pKb, = 4,76) можно охарактеризовать показателем кислотности иона аммония NH4+, т. е. сопряженной кислоты: рKа(NH4+) = 14 — 4,76 — 9,24. Поэтому в случае водных растворов нет необходимости в специальной таблице констант или показателя! основности, достаточно единой шкалы кислотности, представленной в табл. 8.1, где свойства оснований характеризуются констгантой Каили показателем кислотности рКаих сопряженных кислот. Самой сильной кислотой в водных растворах является ка-тион водорода Н + (точнее НзО + ), а самым сильным основанием -анион ОН-. Величина рКаколичественно характеризует силу слабьпх электролитов в водных растворах.
Слабая кислота тем слабее, чем больше значение ее рКа. Слабое основание тем слабее, чем меньше значение рКа его сопряженной кислоты.
Значение рКаравно значению рН водного раствора, в котоpoм данный слабый электролит ионизован на 50 %: поскольку в атом случае [А — ] = [НА], то Ка= [Н + ] и рКа= рН. Так, для уксусной кислоты в ее водном растворе с рН = рKа(СН3СООН) = = 4,76 имеет место равенство [СН3СОО-] = [СН3СООН], а для вод-Hoгo раствора аммиака равенство [NH4] = [NH3 ■ Н2О] будет наблюдаться в растворе с рН = рKа(NH4+) = 9,24.
Кроме того, значение рКапозволяет определить значение рН’ водных растворов, где данная слабая кислота НА находится преимущественно (99 % и более) в виде аниона (А») — это будет в растворах с рН > рКа + 2; или в виде молекул (НА) — в растворах с рН
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.003 с) .
Теория кислот и оснований
В настоящее время не существует однозначного определения понятий кислоты и основания, которое в равной степени можно было бы использовать для характеристики кислотно-основных взаимодействий в любых растворителях. Для характеристики электролитов в водных растворах в настоящее время можно использовать понятия кислоты и основания, данные Аррениусом.
Согласно теории Аррениуса кислотой считается соединение, при электролитической диссоциации которого образуются катионы водорода, а основанием считается соединение, в результате диссоциации которого образуется гидроксид-ион. Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид – ионов. К амфолитам относят гидроксиды цинка, алюминия, хрома и других аммфотерных элементов, а так же аминокислоты, белки, нуклеиновые кислоты.
Таким образом, свойства кислот обусловлены наличием в их растворах водород — ионов, а свойства оснований — присутствием в их растворах гидроксид — ионов. Однако такой взгляд на кислоты и основания применим только для водных растворов.
Ограниченность понятий кислоты и основания, данных Аррениусом, можно проиллюстрировать примерами:
1. Молекула NH3 + не содержит иона ОН — , а молекула СО2 — иона H + , однако в водном растворе первая проявляет свойства основания, а вторая — кислоты.
2. Безводный хлорид водорода, состоящий только из молекул, реагирует с безводными основаниями.
3. Многие электролиты, содержащие водород, в одном растворителе диссоциируют как кислоты, а в другом – как основания. Например, СН3СООН в воде – слабая кислота:
а в жидком фториде водорода — основание:
Исследования подобного типа реакций, и в особенности реакций, протекающих в неводных растворителях, привело к созданию более общих теорий кислот и оснований.
Протонная теория кислот и оснований.
В 1923 г. И. Бренстед и Т. Лоури разработали протонную теорию кислот и оснований.
Согласно этой теории:
— кислотой называют любое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т.е. быть донором протонов;
— основанием называют вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов.
Такие определения кислот и оснований позволяют включать в их число не только молекулы, но и ионы. Например, карбонат-ион согласно протонной теории является основанием, т.к. в водном растворе он присоединяет протон:
Согласно протонной теории кислоты подразделяют на три типа:
1. Нейтральные кислоты, например HCl, H2SO4, H3PO4 и др.
2. Катионные кислоты, представляющие собой положительные ионы, например NH4 + , Н3О + :
3. Анионные кислоты, представляющие собой отрицательные ионы, например, HSO4 — , H2PO4 — , HPO4 2- и др.:
Подобного типа классификация имеется и для оснований:
1. Нейтральные основания, например, NH3,Н2О, С2Н5ОН и др.:
2. Анионные основания, представляющие собой отрицательные ионы, например, Cl — , СН3СОО — , ОН — :
3. Катионные основания, представляющие собой положительные ионы, например, Н2N−NH3 + .
Растворители типа воды, жидкого аммиака, а так же анионы многоосновных кислот, которые могут быть и донорам и акцепторами протонов, являются амфолитами.
Например, в реакции Н2О + NH3 → ОН — + NH4 + молекула воды отдает протон и является кислотой.
Однако в реакции Н2О+ HCl→ Н3О + +Сl — молекула воды присоединят протон и является основанием. Таким образом, вода — типичный амфолит.
Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет или функцию кислоты или основания. Например, при растворении аммиака вода – кислота NH3+ Н2О NH4 + + ОН — При растворении фторида водорода – основание HF+ Н2О F — +H3O +
Если сродство к протону у растворителя больше, чем у растворенного вещества, то растворитель выступает как основание (сродство к протону Н2О больше сродства к протону HF), а если оно меньше – как кислота (сродство к протону Н2О меньше сродства к протону NH3).
Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте:
I. (кислота)1 = (сопряженное основание)1 + Н + т.е. каждой кислоте соответствует сопряженное основание.
Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту:
II. (основание)2 + Н + = (сопряженная кислота)2
Например, кислоте H2SO4 соответствует сопряженное основание HSO4 — , а основанию Cl — — сопряженная кислота НСl.
Для краткости обратимый процесс кислотно-основного взаимодействия называют кислотно-основным равновесием.
Например:
Несмотря на свои достоинства теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявляющим функцию кислоты веществ, не содержащих водорода, например галогенидам бора, алюминия, кремния и олова. Поэтому более общей является теория кислот и оснований Льюиса.
Теория Льюиса (электронная теория).
В теории Льюиса за основу взято наиболее общее свойство кислот и оснований – их электронное строение.
Согласно этой теории:
— кислотой называют вещество, принимающее неподеленную электронную пару, — акцептор электронов;
— основанием называют вещество, поставляющее электроны для образования химической связи, — донор электронов.
По Льюису отличительной способностью кислот и оснований является их взаимная нейтрализация путем образования ковалентной связи:
В приведенных примерах в качестве кислоты выступают молекулы трихлорида брома и оксида серы (VI), а в качестве оснований – молекулы аммиака и воды.
Таким образом, теория Льюиса рассматривает разные химические процессы как однотипные: реакцию аминов с галогенидом бора, комплексообразование.
К основаниям Льюиса относят галогенид — ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R — органический радикал).
К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов.
Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Люйсу, как кислота.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 8446 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Свойства кислот и оснований
Распространенные кислоты:
- HCl — хлороводород (соляная кислота);
- H2SO4 — уксус;
- H2CO3 — серная кислота;
- CH3COOH — угольная кислота (газированная вода);
- H3BO3 — борная кислота (глазные капли);
- C16H12O6 — аспирин.
Распространенные основания:
- NH3 — нашатырный спирт (водный раствор аммиака);
- NaOH — гидроксид натрия (щелок);
- NaHCO3 — бикарбонат натрия (пищевая сода);
- CaCO3 — карбонат кальция.
Основные свойства кислот и оснований сведены в таблице:
| Кислоты | Основания | |
|---|---|---|
| На вкус | кислые | горькие |
| При попадании на кожу | вызывают ожог | вызывают ощущение намыленности |
| Вступают в реакцию | с металлами с образованием газообразного водорода | с маслами и жирами |
| Цвет индикатора | окрашивают лакмус в красный цвет | окрашивают лакмус в синий цвет |
| Образуют | диоксид углерода при соединении с пищевой содой | соль и воду при соединении с кислотами |
Приведенные выше свойства растворов кислот и оснований объясняют две основные теории: Аррениуса и Бренстеда-Лоури.
Теория Аррениуса
Сванте Аррениус разработал первую современную кислотно-основную теорию, которая, хоть и не лишена недостатков, но актуальна и по сей день.
Согласно теории Аррениуса:
- кислоты являются электролитами, которые диссоциируют с образованием ионов водорода, например: HCl→H + +Cl —
- основания — это электролиты, которые диссоциируют в растворах с отщеплением гидроксид-ионов (ОН — ), например: NaOH→Na + +OH —
Поскольку, при смешивании водного раствора кислоты и основания получается нейтральный раствор, кислотно-основную реакцию Аррениус назвал реакцией нейтрализации.
Ион водорода, взаимодействуя с гидроксид-ионом, образует молекулу воды (основной процесс, лежащий в основе кислотно-основных реакций Аррениуса):
Теория Аррениуса не лишена недостатков. Например, в результате взаимодействия газообразных аммиака с хлористым водородом образуется твердое вещество хлорид аммония:
В результате реакции соляная кислота передает аммиаку ион водорода, однако, данная реакция протекает в газовой фазе, а не в водном растворе (в ней не участвует гидроксид-ион), поэтому, ее нельзя отнести к кислотно-основным реакциям по Аррениусу.
Данную проблему решает протонная теория Бренстеда-Лоури, предложенная в 1923 году.
Теория Бренстеда-Лоури
Согласно теории Бренстеда-Лоури, кислота является донором, поставляя свои протоны водорода для образования химической связи, а основание выступает в роли акцептора, принимая эти протоны. Для образования донорно-акцепторной связи основание предоставляет одну пару своих электронов. Таким образом, ковалентная связь между кислотой и основанием образуется за счет двух электронов, которые изначально принадлежали одному атому, выступающего в качестве донора электронной пары, и свободной орбитали другого атома, выступающего в роли акцептора той же пары. Обычно ковалентная связь образуется из двух атомов, каждый из которых предоставляет по одному своему электрону, однако, при донорно-акцепторном способе формирования ковалентной связи оба электрона предоставляет один и тот же атом.
В ходе реакции взаимодействия NH3 и HCl, соляная кислота является донором протона, при этом аммиак и основание играют роль акцепторов, поскольку у аммиака имеется одна пара несвязанных электронов, которая используется для создания донорно-акцепторной связи.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки:
Протолитическая теория кислот и оснований
При рассмотрении класса оснований обнаруживается недостаточность широко распространенного мнения, что этот класс составляют только гидроксиды металлов и гидроксид аммония. По гидроксид аммония — вещество несуществующее, и основанием следует считать сам аммиак, а также близкие к нему но свойствам амины. Сложнее обстоит дело с солями, которые составляют отдельный класс веществ, но и они могут проявлять свойства как оснований, так и кислот. Очевидно, что наблюдаемая кислотность и основность разных веществ не вмещается в рамки сложившейся в XIX в. классификации химических соединений. На протяжении первых трех десятилетий XX в. были выдвинуты новые теории кислот и оснований, не ограниченные традиционными классами веществ. Выше была затронута электронная теория кислот и оснований. Но она кажется несколько отвлеченной, потому что в вопросе о кислотах и основаниях трудно не учитывать особую роль ионов водорода. Это привело к появлению протолитической теории, авторами которой стали ученые, работавшие независимо друг от друга, Т. М. Лоури (1928, Англия) и Й. Н. Брёнстед (1929, Дания).
В протолитической теории рассматриваются кислоты и основания в протонных растворителях. Это такие растворители, которые сами могут как отдавать, так и связывать протон. Важнейшим растворителем такого типа является вода. Из других веществ можно назвать спирты, аммиак, некоторые органические кислоты. Кислоты и основания определяются по роли частиц в передаче протона.
Кислота — это частица, реагирующая как донор протона.
Кроме обычных молекулярных кислот, это понятие охватывает любые ионы, способные отдавать протон. Одним из простейших ионов такого типа является аммоний NHJ. Аммоний входит в состав солей, и поэтому соли аммония и некоторые другие соли могут рассматриваться в качестве кислот.
Основание — это частица, реагирующая как акцептор протона.
Очевидно, что гидроксиды металлов являются основаниями потому, что имеющийся в них гидроксид-ион связывает протон, превращаясь в молекулу воды. Но данное определение значительно шире, так как в солях все анионы слабых кислот могут связывать протоны, превращаясь в молекулы кислот. Следовательно, основаниями являются не только гидроксиды металлов, но и соли. Известно также много молекулярных веществ, главным образом органических, способных присоединять протон.
Протонирование — присоединение протона к молекуле или иону.
Депротонирование — потеря протона молекулой или ионом.
Кроме кислот и оснований, в протолитической теории рассматриваются амфолиты, т.е. такие частицы, которые могут реагировать как отдавая протон, так и связывая его (табл. 14.3). Амфолитами являются некоторые гидроксиды металлов, кислые и основные соли, аминокислоты, белки. Например, легко представить себе, что анион НС03 в гидрокарбонате натрия, связывая протон, превращается в угольную кислоту, а отдавая протон — в карбонат-ион:
У разных амфолитов могут преобладать как кислотные, так и основные свойства. Выше было отмечено, что гидрокарбонат натрия создает в растворе слабую щелочную среду. У этого вещества преобладают основные свойства.
Разновидности кислот, оснований и амфолитов согласно протолитической теории
12.Протонная теория кислот и оснований и. Бренстеда и т. Лоури.
Протонная теория кислот и оснований.В 1923г И. Бренстед и Т. Лоури разработали протонную теорию кислот и оснований. Согласно этой теории
кислотой называют любое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т.е. быть донором протонов;
основанием называют вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов.
Такие определения кислот и оснований позволяют включать в их число не только молекулы, но и ионы. Например, карбонат-ион согласно протонной теории является основанием, т.к. в водном растворе он присоединяет протон:
Согласно протонной теории кислоты подразделяют на три типа:
1. Нейтральные кислоты, например HCl, H2SO4, H3PO4 и др.
2. Катионные кислоты, представляющие собой положительные ионы, например NH4 + , Н3О + :
3. Анионные кислоты, представляющие собой отрицательные ионы, например, HSO4 — , H2PO4 — , HPO4 2- и др.:
Подобного типа классификация имеется и для оснований:
1. Нейтральные основания, например, NH3,Н2О, С2Н5ОН и др.:
2. Анионные основания, представляющие собой отрицательные ионы, например, Cl — , СН3СОО — , ОН — :
3. Катионные основания, представляющие собой положительные ионы, например, Н2N−NH3 + .
Растворители типа воды, жидкого аммиака, а так же анионы многоосновных кислот, которые могут быть и донорам и акцепторами протонов, являются амфолитами.
Например, в реакции
молекула воды отдает протон и является кислотой. Однако в реакции
молекула воды присоединят протон и является основанием. Таким образом, вода — типичный амфолит.
Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет или функцию кислоты или основания. Например, при растворении аммиака вода – кислота
При растворении фторида водорода – основание
Если сродство к протону у растворителя больше, чем у растворенного вещества, то растворитель выступает как основание (сродство к протону Н2О больше сродства к протону HF), а если оно меньше – как кислота (сродство к протону Н2О меньше сродства к протону NH3).
Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте:
т.е. каждой кислоте соответствует сопряженное основание. Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту:
II. (основание)2+Н + =(сопряженная кислота)2
Например, кислоте H2SO4 соответствует сопряженное основание HSO4 — , а основанию Cl — — сопряженная кислота НСl.
Для краткости обратимый процесс кислотно-основного взаимодействия называют кислотно-основным равновесием.
Несмотря на свои достоинства теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявляющим функцию кислоты веществ, не содержащих водорода, например галогенидам бора, алюминия, кремния и олова. Поэтому более общей является теория кислот и оснований Льюиса.
Теория Льюиса (электронная теория).В теории Льюиса за основу взято наиболее общее свойство кислот и оснований – их электронное строение. Согласно этой теории:
кислотойназывают вещество, принимающее неподеленную электронную пару, — акцептор электронов;
основанием называют вещество, поставляющее электроны для образования химической связи, — донор электронов.
По Льюису отличительной способностью кислот и оснований является их взаимная нейтрализация путем образования ковалентной связи:
В приведенных примерах в качестве кислоты выступают молекулы трихлорида брома и оксида серы (VI), а в качестве оснований – молекулы аммиака и воды.
Таким образом, теория Льюиса рассматривает разные химические процессы как однотипные: реакцию аминов с галогенидом бора, комплексообразование.
К основаниям Льюиса относят галогенид — ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R- органический радикал).
К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов.
Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Люйсу, как кислота.
Большая Энциклопедия Нефти и Газа
Протонная теория — кислота
В этой реакции аммиак служит акцептором протона и, следовательно, с точки зрения протонной теории кислот и оснований ( стр. Действительно, реагируя с кислотами, находящимися в свободном состоянии или в растворе, аммиак нейтрализует их, образуя соли аммония. [31]
В этой реакции аммиак служит акцептором протона и, следо вательно, с точки зрения протонной теории кислот и оснований ( стр. Действительно, реагируя с кислотами, находящимися в свободном состоянии или в растворе, аммиак нейтрализует их, образуя соли аммония. [32]
Это привело к новой концепции кислот и оснований, к химической теории Гантча, и, наконец, к протонной теории кислот Лаури , Бренстеда и Бьеррума, согласно которой кислотой является вещество, способное выделять протон, а основанием — вещество, способное его присоединять. [33]
Здесь донором электронной пары, т.е. основанием по Льюису, является аммиак, а в качестве льюисовской кислоты выступает акцептор электронной пары BFg. Протонная теория кислот и оснований Бренстеда и электронная теория Льюиса дополняют друг друга и имеют глубокую внутреннюю связь. В определенном смысле кислоты, по Бренстеду, представляют собой частный случай льюисовских, поскольку протон характеризуется большим сродством к электронной паре и, по Льюису, может рассматриваться как сильная кислота. [34]
Начало протонной теории кислот и оснований положили исследования, проведенные в 1923 г. Бренстедом, а затем Лоури. [35]
В основу современных теорий кислот и оснований положены представления Бренстеда и Льюиса. По протонной теории кислот и оснований Бренстеда, кислота является донором протона, а основание — акцептором протона. [36]
Перестройка аналитической химии в свете протолитическои теории только начинается. Однако уже сейчас протонная теория кислот и оснований составляет теоретическую основу методов титрования в неводных растворах ( стр. [37]
В настоящее время используются и разрабатываются несколько обобщенных теорий кислот и оснований. Кдци и Франклина, опубликованные в 1896 — 1905 г., протонная теория кислот и оснований, выдвинутая в 1923 г. независимо датским ученым Бренстедом и английским учецьш Лоури, электронная теория, предложенная в 1923 г. американским физико-химиком Льюисом. Хотя эти теории исходят из разных предпосылок, они не противоречат друг другу, и каждая из этих теорий анализирует те особенности кислотно-основного взаимодействия, которых другая теория не касается. Во -, прос о том, какую из указанных теорий использовать, следует решать, исходя из конкретных условий поставленной научной или технической задачи. [38]
Приводившиеся в основном тексте определения кислот и оснований с точки зрения классической теории электролитической диссоциации применимы лишь к в о д-н ы м растворам. Чтобы иметь возможность учитывать химический характер относящихся сюда веществ и в неводных средах, была разработана протонная теория кислот и оснований ( Бренстед, 1923 г.), основанная на следующих определениях: кислоты — вещества, отщепляющие протоны, основания — вещества, присоединяющие протоны. [39]
Приводившиеся выше определения кислот и оснований с позиций классической теории электролитической диссоциации применимы лишь к водным растворам. Чтобы иметь возможность учитывать химический характер относящихся сюда веществ и в неводных средах, была разработана протонная теория кислот и оснований ( Бренстед, 1923 г.), основанная на следующих определениях: кислоты — вещества, отщепляющие протоны, основания — вещества, присоединяющие протоны. [40]
Лекция № 11. Теории кислот и оснований
Существует несколько теорий кислот и оснований. Одна из первых нашла свое отражение в теории электролитической диссоциации, с точки зрения которой кислота — это электролит, отщепляющий при диссоциации в качестве катиона только катион водорода. Например,
Реальный процесс значительно сложнее, и представляет собой взаимодействие растворенного вещества с водой с образованием катиона гидроксония:
Слабые кислоты диссоциируют обратимо и в их растворах устанавливается равновесие, которое характеризуется соответствующей константой — константой кислотной диссоциации, Ka.
CH3COOH 
Процесс диссоциации слабых многоосновных кислот происходит ступенчато, причем каждая ступень характеризуется своей константой, например:
H3PO4
H2PO4 — 
HPO4 2- 
Суммирование уравнений ступенчатой диссоциации дает общее уравнение диссоциации кислоты. Соответственно произведение ступенчатых констант дает общую константу электролитической диссоциации.
H3PO4
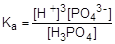
Присутствие в растворах кислот катиона гидроксония обуславливает их общие физические свойства, из которых важнейшим является окрашивание индикаторов в соответствующие цвета: лакмуса в красный, метилового оранжевого в розовый. Фенолфталеин в кислых растворах бесцветен. Важнейшими химическими свойствами кислот являются растворение металлов, стоящих в ряду стандартных электродных потенциалов левее водорода, и взаимодействие с основаниями с образованием солей и воды (реакция нейтрализации).
Основание в рамках теории электролитической диссоциации — это электролит, отщепляющий при диссоциации в качестве аниона только гидроксид-анион. Например,
Очевидно, что процесс диссоциации слабых оснований обратим и характеризуется соответствующей константой равновесия — константой основной диссоциации, Kb.
Mg(OH)2
Общие физические и химические свойства растворов оснований вызваны присутствием в них гидроксид-анионов. Растворы оснований придают характерную окраску кислотно-основным индикаторам: лакмусу — синюю, метиловому оранжевому — желтую, фенолфталеину — малиновую.
Теория электролитической диссоциации удовлетворительно объясняет реакции кислотно-основного взаимодействия в водных растворах, но не пригодна для описания реакций данного типа, протекающих в неводных растворителях или в газах. Примером такой реакции может служить взаимодействие газообразных аммиака и хлороводорода.
Продуктом реакции является соль — хлорид аммония, следовательно реакция является кислотно-основной. Свое объяснение она находит в рамках современных теорий кислот и оснований: протолитической теории Брёнстеда-Лоури и электронной теории Льюиса.
Согласно протолитической теории Брёнстеда-Лоури, кислота — это соединение, являющееся донором катиона водорода (протона). Основание — это акцептор протона. С точки зрения этой теории взаимодействие аммиака с хлороводором трактуется как кислотно-основное:
Процесс присоединения протона к молекуле аммиака электронная теория Льюиса рассматривает более широко, как донорно-акцепторное взаимодействие. В рамках данной теории кислота — это акцептор неподеленной электронной пары, а основание — это донор неподеленной электронной пары.
кислота Льюиса основание Льюиса
Теория Льюиса позволяет трактовать как кислотно-основные и те реакции, которые не сопровождаются переносом протона, например,
кислота Льюиса основание Льюиса
кислота Льюиса основание Льюиса
Для описания кислотно-основных реакций в неводных растворителях обычно используется теория сольвосистем, которая рассматривает взаимодействие относительно процесса собственной диссоциации растворителя. Кислотой является вещество, растворение которого увеличивает концентрацию положительных ионов растворителя. Основанием является вещество, растворение которого приводит к увеличению концентрации отрицательных ионов растворителя. Если рассмотреть уравнение собственной диссоциации воды
H2O + H2O 
то можно увидеть, что теория сольвосистем включает теорию Аррениуса как частный случай. Кроме этого она позволяет рассматривать кислотно-основные реакции в неводных растворителях. В качестве примера такого растворителя рассмотрим жидкий аммиак, который подвергается автоионизации по следующей схеме:
NH3 + NH3
Вещества, растворяющиеся в аммиаке с отщеплением катиона аммония, будут вести себя в нем как кислоты. Вещества, растворение которых в жидком аммиаке ведет к увеличению концентрации амид-анионов, будут вести себя как основания.
Для данной пары кислота — основание можно составить уравнение реакции нейтрализации:
кислота основание соль растворитель
Этот пример наглядно показывает, что кислотно-основные свойства вещества зависят от растворителя. Так, хлорид аммония, который в воде является солью, в жидком аммиаке будет вести себя как кислота.
Литература: [1] с. 234 — 237; [2] с. 309 — 313; [3] с. 131 — 132
Дата добавления: 2017-10-04 ; просмотров: 1216 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кислоты и основания с точки зрения протонной теории
В настоящее время трактовка кислотно-основных свойств соединений производится с позиций трёх основных теорий: теория Аррениуса, Бренстеда-Лоури, Льюиса.
Согласно теории Аррениуса:
- Кислоты — это электролиты при диссоциации которых в качестве катионов образуются только H+
- Гидроксиды — это электролиты при диссоциации которых в качестве аниона образуются только ионы OH-.
Теория кислот и оснований Аррениуса не имеет всеобщего характера и не может объяснить как свойства веществ в неводных растворителях, так и свойства веществ, не подвергающихся диссоциации (NH3, CaO, CO2).
Более общий характер имеет созданная в 1923 году протолитическая теория кислот и оснований Бренстеда-Лоури (теория сопряжённых пар). Согласно этой теории:
- Кислоты — это молекулы или ионы, способные отдавать протон, то есть доноры протонов.
- Основания — это молекулы или ионы, способные присоединять протон, то есть акцепторы протонов.
Согласно протолитической теории, кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основания называется протолизом.
Подобный подход позволяет оценивать кислотно-основные свойства ионов. Например, карбонат-ион может присоединить протон и, следовательно, является основанием, а гидрокарбонат-ион может отдать протон, и значит, является кислотой: (CO3-)основание + (H+) ⇆ (HCO3-)кислота
Кислоты Бренстеда-Лоури делят на 3 типа:
- Нейтральные кислоты: HCl, H3PO4, HNO3, HClO
- Катионные кислоты: NH4+, H3O+
- Анионные кислоты: H2PO4-, HCO3-, HSO4-
На такие же три группы делятся основания:
- Нейтральные основания: NH3, H2O
- Анионные основания: OH-, F-
- Катионные основания: (NH2-NH3)+
Согласно протолитической теории, отдавая протон, кислота превращается в частицу, которая называется сопряжённым основанием. Соответственно, основание, присоединяя протон, превращается в сопряжённую кислоту.
Кислота и сопряжённое ей основание (или основание с сопряжённой кислотой) образуют сопряжённую кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряжённое с ней основание и наоборот.
Молекулы воды (H2O), аммиака (NH3 жидк.), анионы многоосновных кислот могут быть как донорами, так и акцепторами протонов, т.е. являются веществами-амфолитами.
Изоэлектрическая точка (ИЭТ): характеристика состояния р-ра амфотерного электролита (амфолита), способного присоединять или отщеплять протоны, превращаясь либо в положительно, либо в отрицательно заряженные ионы, при котором суммарный электрический заряд амфолита равен нулю. В ИЭТ амфолит не перемещается в электрическом поле. Соответствует рН раствора, при котором одинаковы концентрации положительно и отрицательно заряженных форм (для аминокислот) или числа ионизированных кислотных и основных групп (для макромолекул белков и др. полиамфолитов). Значение рН в ИЭТ (обозначают рI, или рНI) определяется величинами констант диссоциации кислотной и основной ф-ций: pI = 0,5(рК1+рK2).
Гидролизом солей называют взаимодействие солей и воды с образованием слабых электролитов. В итоге гидролиза обычно происходит изменение реакции среды. Гидролиз является обратимым процессом, протекает в крайне незначительной степени, поэтому в схемах реакций ставят знак обратимости. Принято выделять следующие типы гидролиза солей:
- Гидролиз по аниону (сильное основание и слабая кислота);
- Гидролиз по катиону (слабое основание и сильная кислота);
- Гидролиз по катиону и по аниону (слабое основание и слабая кислота);
- Не гидролизуются (сильное основание и сильная кислота).
Способность солей вступать в реакции гидролиза характеризуется степенью гидролиза. Степенью гидролиза hг называют отношение концентрации гидролизованной части соли Сг к её общей концентрации С0: hг = Сг/С0.
Факторы, влияющие на степень гидролиза:
- Температура;
- Концентрация продуктов гидролиза;
- Концентрация соли;
- Разбавление;
- Добавки посторонних веществ.
- http://dic.academic.ru/dic.nsf/ruwiki/1606807
- http://studopedia.org/1-7349.html
- http://studopedia.ru/7_43286_teoriya-kislot-i-osnovaniy.html
- http://prosto-o-slognom.ru/chimia/25_kisloty_i_osnovaniya.html
- http://studme.org/274787/matematika_himiya_fizik/protoliticheskaya_teoriya_kislot_osnovaniy
- http://studfiles.net/preview/5807240/page:2/
- http://www.ngpedia.ru/id508128p3.html
- http://poznayka.org/s98557t1.html
- http://vk.com/page-101519962_51256249