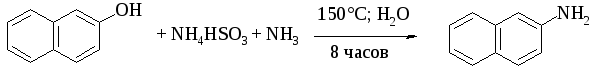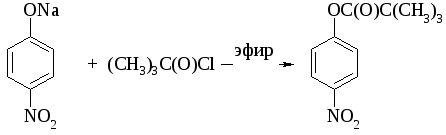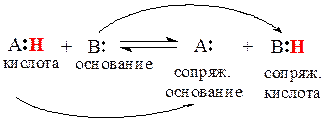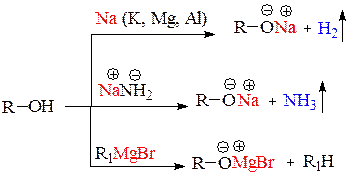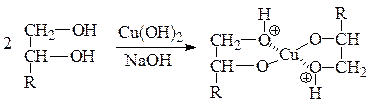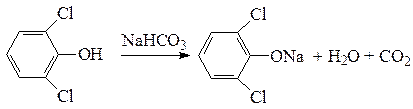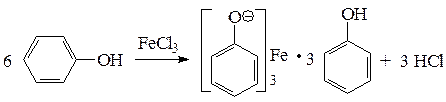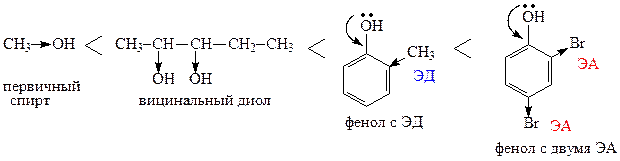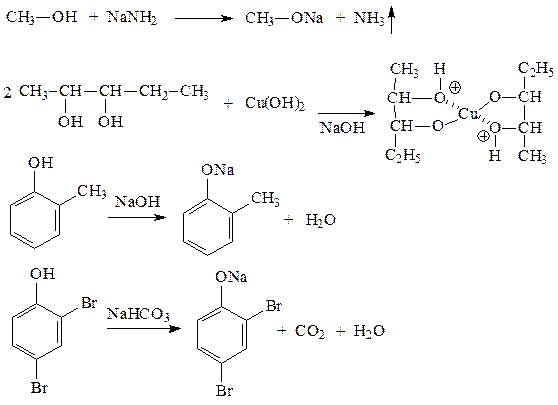Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся поподробнее со строением и свойствами простейшего представителя этого класса- фенолом С6Н5ОН . Название этого вещества и легло в основу в основу названия всего касса — фенолы.
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Фенолы в большинстве реакций по связи О–Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы)
Кислотные свойства фенола
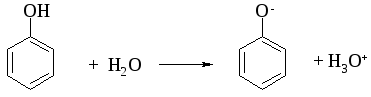
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
- Бромирование фенола. В отличие от бензола для бромирования фенола не требуется добавление катализатора (бромид железа(3)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и пара-положения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Химические свойства фенолов Кислотные свойства фенолов
Несмотря на то, что фенолы по строению подобны спиртам, они являются намного более сильными кислотами, чем спирты. Вместе с тем делокализация заряда в феноксид-ионе происходит в меньшей степени, чем в карбоксилат-ионе, соответственно фенолы более слабые кислоты по сравнению с карбоновыми кислотами. Фенолы растворяются в водном растворе гидроксида натрия, но они не реагируют c гидрокарбонатом натрия. Это простейший, хотя и не очень надежный тест, по которому можно различать фенолы и карбоновые кислоты, которые взаимодействуют c гидрокарбонатом натрия c выделением углекислого газа. Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электронодонорные заместители понижают, a электроноакцепторные — усиливают кислотные свойства фенолов. Фенолы диссоциируют в водных растворах с образованием фенолят-ионов и ионов водорода:
В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
С увеличением длины углеводородного радикала скорость этой реакции замедляется. В присутствии следов влаги образующиеся алкоголяты разлагаются до исходных спиртов.
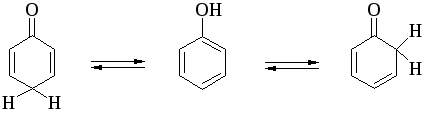
Таутомерия фенолов
Между амбидентными феноксид- и енолят-ионами существует определенная аналогия. Фенол также является аналогом енола и между ним и его кето-формами (2,4- и 2,5-циклогексадиенами) должны существовать отношения, подобные тем, которые наблюдаются для равновесия кето- и енольной форм кетонов.
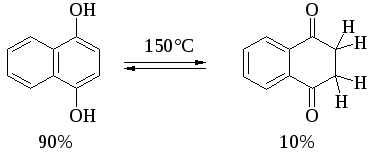
Соотношение двух таутомерных форм здесь полностью обратно тому, которое наблюдается для кетонов, где преобладает кето-форма. Устойчивость таутомерных кето-форм возрастает при переходе к полиатомным фенолам. Так, при плавлении 1,4-дигидроксинафталина получается равновесная смесь, содержащая 10%-дикетоформы.
В 1968 году В.А.Коптюг с сотрудниками предложил простой и чрезвычайно эффективный способ стабилизации кето-формы разнообразных фенолов с помощью сильных кислот Льюиса — хлорида или бромида алюминия. Эти жесткие кислоты Льюиса связывают жесткий карбонильный кислород кето-формы в очень стабильный комплекс, который может быть зафиксирован. Кето-енольная таутомерия лежит в основе замещения фенольного гидроксила на аминогруппу, которое происходит при нагревании 1- или 2-гидроксинафталина, сульфопроизводных α- и β-нафтолов, 6- или 8-гидроксихинолинов и других гидроксипроизводных нафталина, антрацена, хинолина с водным раствором сульфита или гидросульфита аммония при 130-150 о С.
2.3 Этерификация фенолов
Ариловые эфиры карбоновых кислот получают ацилированием фенолов или их Na-, K-солей галогенангидридами или ангидридами кислот.
Реакции электрофильного замещения в ароматическом кольце
Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара- положения. Активирующее влияние гидроксильной группы настолько сильно, что в отдельных случаях реакцию трудно остановить на стадии введения только одного заместителя. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами.
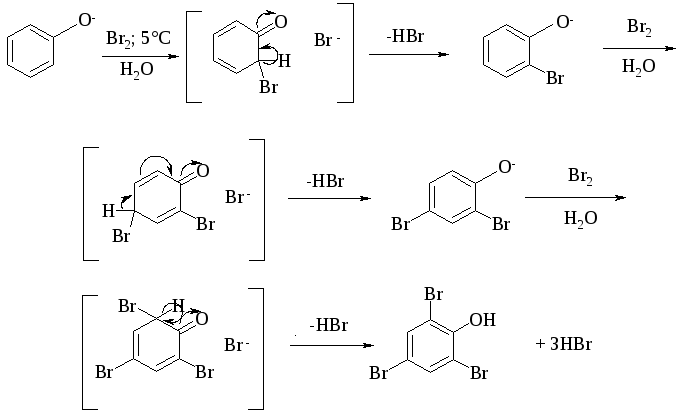
Галогенирование фенолов не требует катализа кислотами Льюиса (FeCl3, FeBr3, AlCl3 и др.) и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион. Фенолят-ион содержит очень сильную активирующую группу — анион кислорода и скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем фенол, он легче диссоциирует, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.
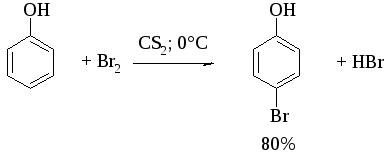
При бромировании фенола в растворе бромистоводородной кислоты или при хлорировании в соляной кислоте диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол.
Аналогичным образом протекает и хлорирование фенола, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов.
Во всех случаях соотношение пара- и орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании.
Почему фенол проявляет кислотные свойства и его относят к кислотам
Содержание статьи
- Почему фенол проявляет кислотные свойства и его относят к кислотам
- Как отличить муравьиную кислоту от уксусной
- Что такое бензольное кольцо
Электронное строение фенолов
По электронному строению фенолы являются полярными соединениями, или диполями. Отрицательный конец диполя – это бензольное кольцо, положительный – группа –OH. Дипольный момент направлен к бензольному кольцу.
Поскольку гидроксильная группа – заместитель I рода, она повышает электронную плотность, особенно для орто- и пара-положений, в бензольном кольце. Это объясняется сопряжением, возникающим между одной из неподеленных электронных пар атома кислорода в OH-группе и π-системой кольца. Такое смещение неподеленной пары электронов приводит к повышению полярности связи O-H.
Взаимное влияние атомов и атомных групп в фенолах отражается на свойствах этих веществ. Так, увеличивается способность к замещению водородных атомов в орто- и пара-положениях бензольного ядра, и обычно в результате таких реакций замещения образуются тризамещенные производные фенола. Повышение полярности связи между кислородом и водородом обусловливает появление достаточно большого положительного заряда (δ+) на атоме водорода, в связи с чем фенол диссоциирует в водных растворах по кислотному типу. В результате диссоциации образуются фенолят-ионы и катионы водорода.
Фенол C6H5OH – слабая кислота, называемая также карболовой кислотой. В этом заключается главное отличие фенолов от спиртов – неэлектроолитов.
Физические свойства фенола
По физическим свойствам C6H5OH – бесцветное кристаллическое вещество с температурой плавления 43˚C и температурой кипения 182˚C. На воздухе он окисляется и приобретает розовую окраску. При обычных условиях фенол ограниченно растворим в воде, но при нагревании выше 66˚C смешивается с H2O в любых отношениях. Это токсичное для человека вещество, способное вызывать ожоги кожи, антисептик.
Химические свойства фенола как слабой кислоты
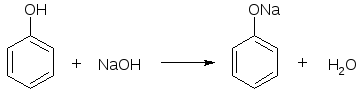
Подобно всем кислотам, фенол диссоциирует в водных растворах, а также взаимодействует со щелочами с образованием фенолятов. Например, реакция C6H5OH и NaOH дает в итоге фенолят натрия C6H5ONa и воду H2O:
Это свойство отличает фенолы от спиртов. Сходство со спиртами – реакция с активными металлами с образованием солей – фенолятов:
Феноляты натрия и калия, образующиеся в результате двух последних реакций, легко разлагаются под действием кислот, даже такой слабой, как угольная. Из этого можно сделать вывод, что фенол – более слабая кислота, чем H2CO3:
Фенолы. Свойства фенолов.
Фенолы – производные ароматических углеводородов, в состав которых могут входить одна или несколько гидроксильных групп, соединенных с бензольным кольцом.
Как называть фенолы?
По правилам ИЮПАК сохраняется название «фенол». Нумерация атомов идет от атома, который непосредственно связан с гидрокси-группой (если она – старшая) и нумеруют так, чтобы заместители получили наименьший номер.
Строение фенола.
У атома кислорода на внешнем уровне находится неподеленная электронная пара, которая «втягивается» в систему кольца (+М-эффект ОН-группы). В результате могут возникнуть 2 эффекта:
1) повышение электронной плотности бензольного кольца в положения орто- и пара-. В основном, такой эффект проявляется в реакциях электрофильного замещения.
2) уменьшается плотность на атоме кислорода, вследствие чего связь О-Н ослабляется и может рваться. Эффект связан с повышенной кислотности фенола по сравнению с предельными спиртами.
Монозамещенные производные фенола (крезол) могут быть в 3х структурных изомерах:
Физические свойства фенолов.
Фенолы – кристаллические вещества при комнатой температуре. Плохо растворимы в холодной воде, но хорошо – в горячей и в водных растворах щелочей. Обладают характерным запахом. Вследствие образования водородных связей, обладают высокой температурой кипения и плавления.
Получение фенолов.
1. Из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, который после взаимодействия с кислотой, превращается в фенол:
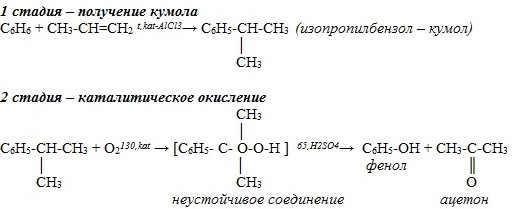
2. Промышленный способ: при каталитическом окислении кумола на воздухе получается фенол и ацетон:
3. Из ароматических сульфокислот с помощью сплавления с щелочами. Чаще проводят реакцию для получения многоатомных фенолов:
Химические свойства фенолов.
р-орбиталь атома кислорода образует с ароматическим кольцом единую систему. Поэтому электронная плотность на атоме кислороде уменьшается, в бензольном кольце – увеличивается. Полярность связи О-Н повышается, и водород гидроксильной группы становится более реакционоспособным и легко может быть замещен атомом металла даже при действии щелочей.
Кислотность фенолов выше, чем у спиртов, поэтому можно проводить реакции:
Но фенол – слабая кислота. Если через его соли пропускать углекислый или сернистый газ, то выделяется фенол, что доказывает, что угольная и сернистая кислота являются более сильными кислотами:
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются – при введении II.
2) Образование сложных эфиров. Процесс протекает при воздействие хлорангидридов:
3) Реакция электрофильного замещения. Т.к. ОН-группа является заместителем первого рода, то реакционная способность бензольного кольца в орто- и пара- положениях повышается. При действии на фенол бромной воды наблюдается выделение осадка – это качественная реакция на фенол:
4) Нитрование фенолов. Реакцию проводят нитрирующей смесью, в результате чего образуется пикриновая кислота:
5) Поликонденсация фенолов. Реакция протекает под воздействии катализаторов:
6) Окисление фенолов. Фенолы легко окисляются кислородом воздуха:
7) Качественной реакцией на фенол является воздействие раствора хлорида железа и образование комплекса фиолетового цвета.
Применение фенолов.
Фенолы используют при получении фенолформальдегидных смол, синтетических волокон, красителей и лекарственных средств, дезинфицирующих веществ. Пикриновая кислота используется в качестве взрывчатых веществ.
Кислотные свойства фенола с электронной точки зрения
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер:Реакции присоединения
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Кислотные свойства фенола с электронной точки зрения
1. Фенолы — производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
2. Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:
3. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
- изомерия положения заместителей в бензольном кольце
- изомерия боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей
4. Строение молекулы
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
- неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее поляризуется. Фенол — более сильная кислота, чем вода и спирты.
- В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
7. Применение фенолов
1. Производство синтетических смол, пластмасс, полиамидов
2. Лекарственных препаратов
4. Поверхностно-активных веществ
7. Взрывчатых веществ
8. Получение фенола в промышленности
1). Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
2). Из каменноугольной смолы (как побочный продукт – выход мал):
(продукт обработки смолы едким натром)
4). Сплавлением солей ароматических сульфокислот с твёрдыми щелочами :
9. Химические свойства фенола (карболовой кислоты)
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C 6 H 5 — OH + NaHCO 3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп ( NO 2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
1). Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы (см. выше), но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
- Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
- Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
- Конденсация с альдегидами. Например:
2). Гидрирование фенола
C 6 H 5— OH + 3 H 2Ni , 170º C → C 6 H 11 – OH циклогексиловый спирт (циклогексанол)
Кислотно-основные свойства спиртов и фенолов
Согласно протолитической теории Бренстеда-Лоури, кислотами являются вещества, способные отдавать протон (Н + ), — доноры протона. Основания — это вещества, способные присоединять протон, — акцепторы протона. Кислотно-основное взаимодействие двух молекул заключается в переносе протона от кислоты к основанию с образованием сопряженного основания и сопряженной кислоты. Чем сильнее кислота или основание, тем слабее сопряженные им основание и кислота. И наоборот. В рамках теории Бренстеда-Лоури любую кислотно-основную реакцию можно описать следующим уравнением:
Гидроксилпроизводные углеводородов (спирты и фенолы) содержат группу ОН, которая может являться как донором, так и акцептором протона.
Кислотные свойства гидроксилпроизводного, т. е. легкость разрыва связи О-Н, будут определяться полярностью и энергией диссоциации этой связи. Чем выше полярность связи О-Н и чем ниже ее энергия диссоциации, тем легче идет разрыв связи, тем выше кислотность.
Электроноакцепторные заместители (ЭА), связанные с ОН-группой, повышают полярность связи О-Н, снижают энергию ее диссоциации и в целом повышают кислотность соединения. Электронодонорные заместители (ЭД), наоборот, снижают полярность, увеличивают энергию диссоциации связи О-Н и снижают кислотные свойства соединения.
Основные свойства гидроксилсодержащих соединений обусловлены наличием неподеленной электронной пары на атоме кислорода. Чем выше электронная плотность на атоме кислорода, тем легче присоединяется протон, тем выше основность соединения. Поэтому электронодонорные заместители, увеличивающие электронную плотность на О, повышают основные свойства соединения, а электроноакцепторные понижают.
Исходя из вышесказанного, представим ряд кислотно-основных свойств гидроксилпроизводных:
Реакции, иллюстрирующие кислотные свойства
Спиртов и фенолов
Спирты являются более слабыми кислотами, чем вода, и обнаружить их кислотность в водных растворах невозможно, рН водного раствора спиртов равно 7. Подтвердить кислотность спиртов можно только в реакциях с активными металлами или очень сильными основаниями в отсутствие воды:
Реакции с активными металлами и их амидами являются качественными на ОН-группу, так как сопровождаются бурным выделением газов.
У многоатомных спиртов кислотность по сравнению с одноатомными возрастает, особенно в случае вицинальных диолов и полиолов. В отличие от одноатомных спиртов, они могут проявлять кислотные свойства не только в реакциях с активными металлами и сильными основаниями, но и в реакциях с гидроксидами тяжелых металлов. В частности, с медь(II)-гидроксидом в щелочной среде вицинальные многоатомные спирты образуют растворимую в воде комплексную соль, окрашенную в темно-синий цвет. Это качественная реакция на вицинальную диольную группу:
Фенолы. Благодаря наличию в молекулах фенолов +М-эффекта, электронная плотность на атоме кислорода понижается, полярность связи О-Н увеличивается и снижается энергия ее диссоциации. Поэтому фенолы, в отличие от спиртов, являются достаточно сильными кислотами и способны образовывать соли даже с водными растворами щелочей:

При наличии в бензольном кольце двух и более электроноакцепторных заместителей кислотность фенольного гидроксила увеличивается настолько, что становятся возможными реакции с солями угольной кислоты:
Кислотные свойства фенолов проявляются также в реакции с железо(III)-хлоридом. При взаимодействии с ионами Fe 3+ образуется комплексная соль фенола, окрашенная в интесивный фиолетовый цвет. Поэтому реакция фенолов с FeCl3 является качественной и используется для обнаружения фенольного гидроксила.
Основность — это способность присоединять протон или кислоты Льюиса. В ряду гидроксилпроизводных наиболее выраженными основными свойствами обладают третичные спирты. Однако вследствие высокой электроотрицательности атома кислорода и, соответственно, низкой поляризуемости его электронов спирты могут реагировать при охлаждении только с сильными минеральными кислотами с образованием оксониевых солей. Основными свойствами обладают и диалкиловые эфиры, которые тоже образуют оксониевые соли с концентрированными кислотами. Растворение в холодных концентрированных кислотах с образованием однофазной системы (оксониевых солей) является качественной реакцией на спирты и диалкиловые эфиры. У фенолов вследствие сопряжения неподеленной электронной пары кислорода с бензольным кольцом (+М-эффект) основные свойства выражены очень слабо. Поэтому фенолы оксониевых солей не образуют и не присоединяют кислоты Льюиса.
Решение
1. Располагаем пентан-2,3-диол; метанол; 2,4-дибромфенол; 2-метилфенол в порядке возрастания их кислотных свойств.
2. Приводим уравнения реакций, которые иллюстрируют кислотные свойства данных веществ:
Для наиболее сильного основанияприводим уравнение реакции образования оксониевой соли с H2SO4.
Самым сильным основанием в этом ряду будет самая слабая кислота — метанол.
Пример решения задачи 23
Для решения данного задания необходимо изучить основные химические свойства спиртов, фенолов и простых эфиров.
- http://studfiles.net/preview/1659470/page:2/
- http://www.kakprosto.ru/kak-889808-pochemu-fenol-proyavlyaet-kislotnye-svoystva-i-ego-otnosyat-k-kislotam
- http://www.calc.ru/Fenoly-Svoystva-Fenolov.html
- http://himija-online.ru/organicheskaya-ximiya/fenol/ximicheskie-svojstva-fenolov.html
- http://www.sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia/urok-no33-stroenie-svojstva-i-primenenie-fenola
- http://megalektsii.ru/s18507t4.html