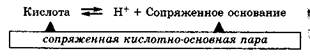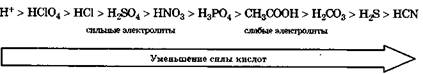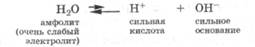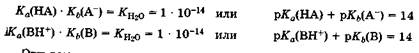При рассмотрении класса оснований обнаруживается недостаточность широко распространенного мнения, что этот класс составляют только гидроксиды металлов и гидроксид аммония. По гидроксид аммония — вещество несуществующее, и основанием следует считать сам аммиак, а также близкие к нему но свойствам амины. Сложнее обстоит дело с солями, которые составляют отдельный класс веществ, но и они могут проявлять свойства как оснований, так и кислот. Очевидно, что наблюдаемая кислотность и основность разных веществ не вмещается в рамки сложившейся в XIX в. классификации химических соединений. На протяжении первых трех десятилетий XX в. были выдвинуты новые теории кислот и оснований, не ограниченные традиционными классами веществ. Выше была затронута электронная теория кислот и оснований. Но она кажется несколько отвлеченной, потому что в вопросе о кислотах и основаниях трудно не учитывать особую роль ионов водорода. Это привело к появлению протолитической теории, авторами которой стали ученые, работавшие независимо друг от друга, Т. М. Лоури (1928, Англия) и Й. Н. Брёнстед (1929, Дания).
В протолитической теории рассматриваются кислоты и основания в протонных растворителях. Это такие растворители, которые сами могут как отдавать, так и связывать протон. Важнейшим растворителем такого типа является вода. Из других веществ можно назвать спирты, аммиак, некоторые органические кислоты. Кислоты и основания определяются по роли частиц в передаче протона.
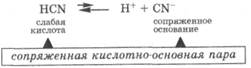
Кислота — это частица, реагирующая как донор протона.
Кроме обычных молекулярных кислот, это понятие охватывает любые ионы, способные отдавать протон. Одним из простейших ионов такого типа является аммоний NHJ. Аммоний входит в состав солей, и поэтому соли аммония и некоторые другие соли могут рассматриваться в качестве кислот.
Основание — это частица, реагирующая как акцептор протона.
Очевидно, что гидроксиды металлов являются основаниями потому, что имеющийся в них гидроксид-ион связывает протон, превращаясь в молекулу воды. Но данное определение значительно шире, так как в солях все анионы слабых кислот могут связывать протоны, превращаясь в молекулы кислот. Следовательно, основаниями являются не только гидроксиды металлов, но и соли. Известно также много молекулярных веществ, главным образом органических, способных присоединять протон.
Протонирование — присоединение протона к молекуле или иону.
Депротонирование — потеря протона молекулой или ионом.
Кроме кислот и оснований, в протолитической теории рассматриваются амфолиты, т.е. такие частицы, которые могут реагировать как отдавая протон, так и связывая его (табл. 14.3). Амфолитами являются некоторые гидроксиды металлов, кислые и основные соли, аминокислоты, белки. Например, легко представить себе, что анион НС03 в гидрокарбонате натрия, связывая протон, превращается в угольную кислоту, а отдавая протон — в карбонат-ион:
У разных амфолитов могут преобладать как кислотные, так и основные свойства. Выше было отмечено, что гидрокарбонат натрия создает в растворе слабую щелочную среду. У этого вещества преобладают основные свойства.
Разновидности кислот, оснований и амфолитов согласно протолитической теории
В настоящее время трактовка кислотно-основных свойств соединений производится с позиций трёх основных теорий: теория Аррениуса, Бренстеда-Лоури, Льюиса.
Согласно теории Аррениуса:
- Кислоты — это электролиты при диссоциации которых в качестве катионов образуются только H+
- Гидроксиды — это электролиты при диссоциации которых в качестве аниона образуются только ионы OH-.
Теория кислот и оснований Аррениуса не имеет всеобщего характера и не может объяснить как свойства веществ в неводных растворителях, так и свойства веществ, не подвергающихся диссоциации (NH3, CaO, CO2).
Более общий характер имеет созданная в 1923 году протолитическая теория кислот и оснований Бренстеда-Лоури (теория сопряжённых пар). Согласно этой теории:
- Кислоты — это молекулы или ионы, способные отдавать протон, то есть доноры протонов.
- Основания — это молекулы или ионы, способные присоединять протон, то есть акцепторы протонов.
Согласно протолитической теории, кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основания называется протолизом.
Подобный подход позволяет оценивать кислотно-основные свойства ионов. Например, карбонат-ион может присоединить протон и, следовательно, является основанием, а гидрокарбонат-ион может отдать протон, и значит, является кислотой: (CO3-)основание + (H+) ⇆ (HCO3-)кислота
Кислоты Бренстеда-Лоури делят на 3 типа:
- Нейтральные кислоты: HCl, H3PO4, HNO3, HClO
- Катионные кислоты: NH4+, H3O+
- Анионные кислоты: H2PO4-, HCO3-, HSO4-
На такие же три группы делятся основания:
- Нейтральные основания: NH3, H2O
- Анионные основания: OH-, F-
- Катионные основания: (NH2-NH3)+
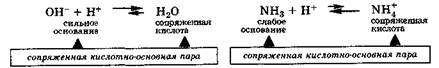
Согласно протолитической теории, отдавая протон, кислота превращается в частицу, которая называется сопряжённым основанием. Соответственно, основание, присоединяя протон, превращается в сопряжённую кислоту.
Кислота и сопряжённое ей основание (или основание с сопряжённой кислотой) образуют сопряжённую кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряжённое с ней основание и наоборот.
Молекулы воды (H2O), аммиака (NH3 жидк.), анионы многоосновных кислот могут быть как донорами, так и акцепторами протонов, т.е. являются веществами-амфолитами.
Изоэлектрическая точка (ИЭТ): характеристика состояния р-ра амфотерного электролита (амфолита), способного присоединять или отщеплять протоны, превращаясь либо в положительно, либо в отрицательно заряженные ионы, при котором суммарный электрический заряд амфолита равен нулю. В ИЭТ амфолит не перемещается в электрическом поле. Соответствует рН раствора, при котором одинаковы концентрации положительно и отрицательно заряженных форм (для аминокислот) или числа ионизированных кислотных и основных групп (для макромолекул белков и др. полиамфолитов). Значение рН в ИЭТ (обозначают рI, или рНI) определяется величинами констант диссоциации кислотной и основной ф-ций: pI = 0,5(рК1+рK2).
Гидролизом солей называют взаимодействие солей и воды с образованием слабых электролитов. В итоге гидролиза обычно происходит изменение реакции среды. Гидролиз является обратимым процессом, протекает в крайне незначительной степени, поэтому в схемах реакций ставят знак обратимости. Принято выделять следующие типы гидролиза солей:
- Гидролиз по аниону (сильное основание и слабая кислота);
- Гидролиз по катиону (слабое основание и сильная кислота);
- Гидролиз по катиону и по аниону (слабое основание и слабая кислота);
- Не гидролизуются (сильное основание и сильная кислота).
Способность солей вступать в реакции гидролиза характеризуется степенью гидролиза. Степенью гидролиза hг называют отношение концентрации гидролизованной части соли Сг к её общей концентрации С0: hг = Сг/С0.
Факторы, влияющие на степень гидролиза:
- Температура;
- Концентрация продуктов гидролиза;
- Концентрация соли;
- Разбавление;
- Добавки посторонних веществ.
Кислота с точки зрения протолитической теории
Теории кислот и оснований — совокупность фундаментальных физико химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований двух классов веществ, реагирующих между собой. Задача теории предсказание продуктов… … Википедия
Амфотерность — (от др. греч. (ἀμφότεροι «двойственный», «обоюдный») способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства. Понятие амфотерность как характеристика двойственного поведения вещества… … Википедия
Большая Энциклопедия Нефти и Газа
Протолитическая теория — кислота
Протолитическая теория кислот и оснований — не единственная. Другие теории исходят из более общих определений кислот и оснований. [2]
Протолитическая теория кислот и оснований, разработанная одновременно И. Лоури ( 1923), более полно объясняет кислотно-основные свойства веществ. По этой теории кислоты рассматривают как вещества, которые теряют протоны, а основания — как вещества, которые их присоединяют. [3]
Протолитическая теория кислот и оснований Бренстеда [1 ] позволяет рассматривать диссоциацию кислот и оснований с единой точки зрения, как диссоциацию кислотную. Условие протекания протолитического процесса определяется наличием у растворенного вещества протоногенных групп и природой растворителя. [4]
По протолитической теории кислоты и основания называют протолитами аналогично электролитам в теории электролитической диссоциации. [5]
Используя протолитическую теорию кислот и оснований, можно удовлетворительно истолковать основные закономерности кислотно-основного катализа. Каталитическое действие кислоты объясняется тем, что она способна отдавать свой протон веществу, которое подвергается химическому превращению. Насколько легко кислота отдает свой протон, можно судить по величине константы прото-лиза, связанной с константой ионизации или диссоциации кислоты. [6]
Поэтому протолитическую теорию кислот и оснований иногда называют теорией Бренстеда, а иногда — теорией Бренстеда-Лоури. [7]
Используя протолитическую теорию кислот и оснований, можно удовлетворительно истолковать основные закономерности кислотно-основного катализа. Каталитическое действие кислоты объясняется тем, что она способна отдавать свой протон веществу, которое подвергается химическому превращению. [8]
Протонная или протолитическая теория кислот и оснований. [9]
С точки зрения протолитической теории кислот и оснований, кислотой является вещество, способное отщеплять протон а оснбванием — вещество, / способное присоединять протон. При таком подходе1 расширяются и круг кислот, и круг оснований. К кислотам наряду с обычными кислотами относятся ионы металлов, существующие в водных растворах в форме аквакомплексов. К основаниям наряду с обычными относятся анионы слабых кислот. [10]
Таким образом, согласно протолитической теории кислот и оснований Бренстеда-Лоури, кислота — это вещество, выделяющее при ионизации протоны, а основание — вещество, присоединяющее протоны. [11]
Во втором издании рассмотрена протолитическая теория кислот и оснований, дано понятие о титровании в неводных растворах, описано фракционированное осаждение ионов, более подробно рассмотрены комплексные и внутрикомплексные соединения, включен материал о комплексонах, показано аналитическое значение констант нестойкости комплексов, больше внимания уделено определению величины рН растворов, степени гидролиза солей, вычислению значения произведения растворимости малорастворимых электролитов с учетом коэффициентов активности ионов; детальнее изложена ионно-хромофорная теория индикаторов. [12]
Она называется поэтому также протолитической теорией кислот и оснований. [13]
Независимо Бренстед и Лаури предложили протолитическую теорию кислот и оснований, дальнейшая разработка которой преимущественно принадлежит Бренстеду. Теория позволяет рассматривать диссоциацию кислот и оснований с единой точки зрения как диссоциацию кислотную. [14]
В 1923 г. Бренстед и Лоури предложили протолитическую теорию кислот и оснований. Вещества же, способные присоединять протоны, называют основаниями. [15]
Протолитическая теория кислот и оснований
(Теория Бренстеда и Лоури)
По протолитической, или протонной теории кислота – это соединение, частица которого может отдать протон (Н + ) другой частице – основанию. Согласно этой теории кислоты и основания — это вещества, теряющие и приобретающие протоны и называемые протолитами. Передача протона от кислоты к основанию называется протолизом. Кислота–донор протонов,а основание–акцептор Н + .
В результате отдачи протона сама кислота превращается в сопряженное ей основание. Основание – акцептор Н + — превращается в сопряженную ему кислоту.
В следующей реакции протолитического равновесия:
НА + В ⇄А — + НВ + (14)
НА – кислота, А — — сопряженное ей основание; В – основание, НВ + — сопряженная ему кислота.
Таким образом, в равновесной протолитической реакции присутствуют две сопряженные пары «кислота / основание»: НА /А — и НВ + / В.
Кислоты и основания, или протолиты, могут быть нейтральными (молекулы), катионными или анионными:
Анионные Молекулярные Катионные
протолиты протолиты протолиты
Протонодонорная способность вещества — это его кислотность; протоноакцепторная способность — это основность. Эти свойства определяются сродством к протону, т.е. величиной энтальпии реакции присоединения протона.
При кислотно-основном взаимодействии роль основания играет тот партнер, у которого протонное сродство выше.
Из термохимических уравнений:
NH3(г) + H + (г)
H2O(г) + H + (г)
OH — (г) + H + (г)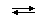
F — (г) + H + (г)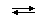
1) NH3 — более сильный акцептор протона и более сильное основание, чем H2O, а NH4 + , наоборот, более слабый донор протона и более слабая кислота, чем H3O + ;
2) OH — — более сильное основание, чем F — , а H2O — более слабая кислота, чем HF.
Количественной характеристикой состояния протолитического равновесия обратимой реакции между кислотой HA и основанием (растворителем) HL
HA(s) + HL 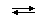
является величина Kк— константа кислотности:
Чем больше значение Kк, тем более сильной кислотой является протолит HA в данном растворителе HL.
Количественной характеристикой состояния протолитического равновесия в реакции между основанием B и кислотой (растворителем) HL
В + HL 
является величина Kо — константа оснόвности:
Kо = [HB + ] . [L — ] / [B] = Const = f(T). (16)
Чем больше значение Kо, тем более сильным основанием является протолит B в данном растворителе HL.
Пример 2.1.
где HCl — кислота, а Н2О – основание.
Протолитическая теория кислот и оснований
Классическое представление о кислотах и основаниях дает теория Аррениуса. Согласно этой теории:
Кислота – электролит, при диссоциации которого образуется в качестве катиона – ион водорода.
Основание – электролит, при диссоциации которого образуется в качестве аниона – гидроксид-ион.
Однако, эта теория не может объяснить кислотно-основные свойства веществ, таких как аммиак, анилин – проявляющих основные свойства и галогенидов металлов или неметаллов (PCl5), проявляющих кислотные свойства.
Поэтому в 1923 году Бренстедом и Лоури была предложена более общая теория кислот и оснований.
Основные положения протолитической теории:
1. Кислотно-основные реакции осуществляются за счет переноса протона Н + от кислоты к основанию.
2. Реакции, сопровождающиеся переносом Н + , называются протолитическими, а вещества, участвующие в них – протолитами.
3. Кислота – это протолит, который является донором Н + , т.е. способна отдавать протон.
Кислота, отдавая протон, превращается в основание, которое называется сопряженным.
Кислота ⇄ H + + сопряженное основание
кислота сопр. осн-е
4. Основание – это протолит, который является акцептором протона H + , т.е. способно принимать протон.
Основание, присоединив H + , превращается в кислоту, которая называется сопряженной.
Основание + H + ⇄ сопряженная кислота
основание сопр. к-та
5. Кислота и соответствующее ей сопряженное основание или основание и сопряженная с ним кислота образуют протолитические пары или сопряженные кислотно-основные пары:
Сила кислоты определяется ее способностью отдавать H + , а сила основания – его способностью присоединять H + . Поэтому сильная кислота, отдав протон, превращается в слабое сопряженное основание, т.е. частицу, плохо присоединяющую протон, а сильное основание – соответственно, в слабую сопряженную кислоту.
В каждой протолитической реакции участвуют 2 пары кислот и оснований и схематически это можно изобразить так:
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 7964 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ
Понятия «кислота» и «основание» применяют по отношению к двум группам соединений, обладающих совокупностью диаметрально противоположных свойств. В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот и оснований. Согласно этой теории понятиям кислота и основание отвечают следующие определения.
 |
Кислота — молекула или ион, способные отдавать катион водорода (протон). Кислота — донор протонов.
Основание — молекула или ион, способные присоединять катион водорода (протон). Основание — акцептор протонов.
Кислота, отдавая протон, превращается в частицу, стремящуюся его принять, которая называется сопряженным основанием:
Основание, присоединяя протон, превращается в частицу, стремящуюся его отдать, которая называется сопряженной кислотой:
Совокупность кислоты и ее сопряженного основания или основания и его сопряженной кислоты называются сопряженными кислотно-основными парами.
Сила кислоты определяется ее способностью отдавать протон, т. е. сильная кислота — активный донор протона. Сила кислот в водных растворах уменьшается в ряду:
 |
Сила основания определяется его способностью присоединять протон, т. е. сильное основание — активный акцептор протона. Сила оснований в водных растворах, т. е. их сродство к протону, уменьшается в ряду:
Сильные кислоты, легко отдавая протон, превращаются в сопряженные основания, которые плохо присоединяют протон. Поэтому диссоциация этих кислот протекает практически необратимо:
Слабые кислоты, трудно отдавая протон, превращаются в сопряженные основания, которые активно принимают протон, что делает диссоциацию слабых кислот обратимым процессом, причем равновесие смещено в сторону недиссоциированной формы:
Аналогичным образом ведут себя сильные и слабые основания, превращаясь в результате реакции в соответствующие сопряженные кислоты, т. е. и в этих случаях также имеются сопряженные кислотно-основные пары:
Некоторые вещества способны выступать в одних реакциях в роли донора протона, отдавая его соединениям, у которых сродство к протону выше, а в других — в роли акцептора протона, отнимая его у соединений с меньшим сродством к протону. Такие вещества называются амфолитами.
Амфолиты — молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать в реакции, характерные как для кислот, так и для оснований. Амфолит проявляет свойства кислоты или основания в зависимости от того, с какими веществами он взаимодействует. Типичным амфолитом является вода, так как в результате ее электролитической диссоциации образуются одновременно сильная кислота и сильное основание:
Кроме того, вода взаимодействует и с кислотами, выступая основанием, и с основаниями, проявляя свойства кислоты:
 |
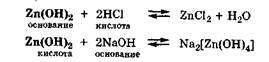 |
Амфолитами являются гидроксиды некоторых металлов (Zn, Al, Pb, Sn, Cr):
Амфолитами являются гидроанионы многоосновных кислот, например НС03-, НР042-и Н2РО4-.
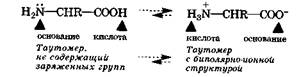
Амфолитами являются также соединения, молекулы которых содержат две различные кислотно-основные группы, например важные в биологическом отношении а-аминокислоты. Молекула а-аминокислоты в результате переноса протона от карбоксильной группы на аминогруппу превращается из таутомера*, не содержащего заряженные группы, в таутомер, имеющий биполярно-ионную (цвиттерионную) структуру. Таким образом, для а-аминокислот характерна прототропная таутомерия (разд. 21.2.1).
В кристаллическом состоянии и в водных растворах это равновесие для а-аминокислот практически полностью смещено в сторону таутомера с биполярной структурой. Так, для глицина в водном растворе содержание таутомера с биполярно-ионной структурой в 223 000 раз больше, чем другого таутомера.
Вследствие этой особенности строения молекулы а-аминокислот проявляют кислотные свойства за счет аммонийной группы ( NH3+), а основные — за счет ионизованной карбоксильной группы (—СОО- ), выступая амфолитами:
Как и все амфолиты, а-аминокислоты являются слабыми электролитами.
Согласно протолитической теории кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основанию называется протолизом и объясняется тем, что эти два вещества имеют разное сродство к протону. В кислотно-основном взаимодействии всегда участвуют две сопряженные кислотно-основные пары, и переход протона всегда происходит в сторону образования более слабых кислот, включая сопряженные. Если склонность к взаимодействию с протоном у реагентов соизмерима, то наблюдается протолитическое равновесие.
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон (Н + ) между основаниями взаимодействующих сопряженных кислотно-основных пар (НА, А- и ВН + , В). Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты:
Схематично протолитическое равновесие можно представить следующей схемой:
Переход протона всегда происходит от сильной кислоты каниону слабой кислоты, что сопровождается вытеснением слабой кислоты из ее соли под действием более сильной кислоты.
Протолитическое равновесие наблюдается при ионизации слабых электролитов в воде (разд. 7.2). Так, ионизация слабой кислоты в водных растворах является следствием конкуренции за протон между анионом слабой кислоты и водой, выступающей основанием, т. е. акцептором протона. Этот процесс является обратимым и характеризуется константой равновесия Ка:
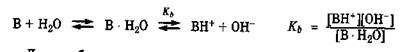 |
При взаимодействии слабого основания с водой последняя, выступая донором протона, способствует ионизации этого основания, носящей равновесный характер:
для слаоых электролитовсила кислот и оснований характеризуется величинами констант кислотности Каи основности Кbссоответственно (разд. 7.2). Если эти константы характеризуют протолитическое взаимодействие воды с кислотой или основанием одной сопряженной пары НА, А или ВН + , В, то произведение констант кислотности Ка и основности Kb, компонентов данной пары всегда равно ионному произведению воды Кн2о = 1 * 10 -14 (при 22 °С):
Эти выражения позволяют заменить в случае водных растворов константу основности Кь или показатель основности рКь слабого основания на константу кислотности Каили на показатель кислотности рКасопряженной кислоты этого основания. На практике для характеристики протолитических свойств соединения обычно используют величину рКа. Так, силу аммиака в воде как основания (pKb, = 4,76) можно охарактеризовать показателем кислотности иона аммония NH4+, т. е. сопряженной кислоты: рKа(NH4+) = 14 — 4,76 — 9,24. Поэтому в случае водных растворов нет необходимости в специальной таблице констант или показателя! основности, достаточно единой шкалы кислотности, представленной в табл. 8.1, где свойства оснований характеризуются констгантой Каили показателем кислотности рКаих сопряженных кислот. Самой сильной кислотой в водных растворах является ка-тион водорода Н + (точнее НзО + ), а самым сильным основанием -анион ОН-. Величина рКаколичественно характеризует силу слабьпх электролитов в водных растворах.
Слабая кислота тем слабее, чем больше значение ее рКа. Слабое основание тем слабее, чем меньше значение рКа его сопряженной кислоты.
Значение рКаравно значению рН водного раствора, в котоpoм данный слабый электролит ионизован на 50 %: поскольку в атом случае [А — ] = [НА], то Ка= [Н + ] и рКа= рН. Так, для уксусной кислоты в ее водном растворе с рН = рKа(СН3СООН) = = 4,76 имеет место равенство [СН3СОО-] = [СН3СООН], а для вод-Hoгo раствора аммиака равенство [NH4] = [NH3 ■ Н2О] будет наблюдаться в растворе с рН = рKа(NH4+) = 9,24.
Кроме того, значение рКапозволяет определить значение рН’ водных растворов, где данная слабая кислота НА находится преимущественно (99 % и более) в виде аниона (А») — это будет в растворах с рН > рКа + 2; или в виде молекул (НА) — в растворах с рН
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.003 с) .
Билеты 21-24
Протолитическая теория кислот и оснований Бренстеда-Лоури.
В 1923 году Бренстед и Лоури разработали протонную теорию кислот и оснований. Согласно этой теории:
— Кислотой называют всякое вещество, молекулярные частицы которого (и ионы) способны отдавать протон, т.е. быть донором протонов. (HB)
— Основанием называют всякое вещество, молекулярные частицы которого (и ионы) способны присоединять протоны, т.е. быть акцепторами протонов.(B)
Молекула и ион или 2 иона, отличающиеся друг от друга на передаваемый протон, называются сопряжённой кислотно-основной парой.
В водных растворах кислот и оснований можно выделить 2 сопряжённые пары, одну из которых образует растворитель.
Равновесие, устанавливающееся в растворах между кислотами и сопряжёнными основаниями, называется протолитическим равновесием или кислотно-основным равновесием.
В водных растворах для произвольной кислоты (HB) функцию основания выполняет вода.
2 кислотно-основная пара

Сила кислот определяется их способностью отдавать протон, а оснований – принимать его.
Мерой этой способности служит соответственно константа кислотности (Ka) и основности(Kb).
Константа вышеприведённого процесса будет иметь вид:
Поскольку концентрация [H2O] –const, то иK[H2O] –const, тогда
Ka= [B-]*[H3O+] / [HB] = K[H2O]
Для произвольного основания Bв водном растворе функцию кислоты будет выполнять вода.

Константы кислотности и основности в сопряжённой паре для водного раствора связаны между собой соотношением:
Ka*Kb=Ku= [H3O] [OH-] – ионное произведение воды.
Чем сильнее кислота, тем слабее сопряжённое ей основание, и наоборот.
Для удобства расчётов часто пользуются не самими константами, а их показателями, т.е. десятичными lg, взятыми со знаком «минус» .
Классификация кислот и оснований Бренстеда:
Кислоты подразделяются на:
1). Нейтральные: HCl,H2SO4,H3PO4.
2) Катионные: NH4+,H3O+
3). Анионные: HPO4-,H2PO4-
1). Нейтральные: NH3,H2O
2). Катионные: NH2-NH3+
3). Анионные: OH-, CH3COO-, Cl-
Электронная теория Льюиса
Отличительный признак кислот и оснований Льюиса является то, что они взаимодействуют друг с другом с образованием донорно-акцепторных связей.
— Кислота – это вещество, принимающее электронную пару, т.е. акцептор электрона.
— Основание – это вещество, поставляющее электроны для образования химической связи, т.е. донор электронов.
В результате приобретаются пары электронов, атомом, ответственным за кислотные свойства рассматриваемого соединения часто возникают завершённые электронные конфигурации.
Основания Льюиса должны обладать одной парой валентных электронов, которые они способны предоставить партнёру для образования ковалентной связи.
К основаниям Льюиса относятся галогенид-ионы, аммиак, алифатические и ароматические амины, кислородные соединения R2CO(R– органический радикал).
Кислоты Льюиса – это любые соединения со свободной орбиталью. Это галогениды бора, алюминия, кремния, олова и другие соединения.
Достоинства теории Льюиса:
— применимость к широкому кругу реакций.
Рассмотренные теории диссоциации кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Льюису, как кислота.
Процесс ионизации с точки зрения протолитической теории Бренстеда-Лоури
Протолитическое равновесие наблюдается при диссоциации слабых электролитов, например, диссоциация уксусной кислоты в воде
кислота1 основание2 основание1 кислота2
Ka= [CH3COO-]*[H3O+] / [CH3COOH]
Диссоциация слабой кислоты в растворе является следствием конкуренции за протон между анионом слабой кислоты (CH3COO-) и водой (выступает в качестве основания).
Диссоциация 2 сопряжённая пара
(1) NH3 +H2O=NH4+ +OH-
о
1 сопряжённая пара
При взаимодействии слабого основания с водой последнее выступает донором протонов, способствует ионизации этого основания.
NH3- иOH- конкурируют за протон в реакции (1)
Гидролиз солей – протолитический процесс взаимодействия ионов соли с молекулами воды, в результате которого образуется малодиссоциирующие молекулы или ионы.
4 случая гидролиза:
1). Если соль образована сильным основанием и сильной кислотой, гидролизу не подвергается
K 2SO4 = 2K+ +SO42-
Среда раствора нейтральная PH=7
2). Соль образована сильным основанием и слабой кислотой, гидролиз по аниону
Na2SO4, K2SiO3, K2S
Na2CO3 = 2Na+ + CO3-
Среда щелочная pH>7
3). Соль образована слабым основанием и сильной кислотой, гидролиз по катиону
Среда кислая, pH Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
Лекция 10 Протолитическая теория кислот и оснований
| Название | Лекция 10 Протолитическая теория кислот и оснований |
| Анкор | lektsia-broshyura_10.doc |
| Дата | 20.09.2017 |
| Размер | 122 Kb. |
| Формат файла | |
| Имя файла | lektsia-broshyura_10.doc |
| Тип | Лекция #20608 |
| Каталог | id63532371 |
| С этим файлом связано 52 файл(ов). Среди них: Practica_tu_espan_771_ol_Las_expresiones_coloquiales.pdf, Diccionario_Visual_ES-RUS.pdf, Terminologi_769_a_me_769_dica.pdf, Vocabulario_Salud_Enfermedades.pdf, Vocabulario_Anatomi_769_a_humana.pdf, Dzheyms_R_Matier_Dzhon_O_Ma_Maykl_Bleyves_-_Ultrazvukovoe_issled, Rak_zheludka.ppt.ppt, Perforativnye_gastroduodenalnye_yazvy.ppt.ppt, Ostry_pankreatit.ppt.ppt, Ostrye_pischevodno-zheludochno-kishechnye_krovotechenia.ppt.ppt и ещё 42 файл(а). Показать все связанные файлы Протолитическая теория кислот и основанийАвторы Й. Брёнстед, Т. Лоури, 1923. Из всех теорий, созданных после теории кислот и оснований Аррениуса, протолитическая теория наиболее близка к последней, представляет собой ее развитие в направлении уточнения понятий кислот и оснований и устранения некоторых недостатков. В протолитической теории классы кислот и оснований не имеют такого принципиального значения, как в более ранних теориях. Рассматривается проявление кислотности и основности любыми веществами, независимо от принадлежности к какому-либо классу. В частности, все соли проявляют кислотные и основные свойства с перевесом в ту или иную сторону. В протолитической теории особое значение имеет взаимодействие веществ с растворителем. Во взаимодействии веществ и проявляются их кислотно-основные свойства. Сущность кислотности состоит в способности частицы вещества (молекулы или иона) отдавать протон p + другой частице, которая, связывая протон, действует как основание. В протолитической теории рассматриваются кислоты и основания в протонных растворителях (вода, спирты, безводные кислоты, аммиак), которые и сами могут как присоединять, так и отдавать протон. Наиболее существенное различие между двумя теориями состоит в понимании природы водородного иона в растворе. В теории Аррениуса это один из катионов с присущими ему свойствами и, в частности, образующий молекулы воды при нейтрализации кислоты щелочью. В протолитической теории, базирующейся на сделанных незадолго открытиях электронов, атомных ядер и протонов, ион водорода или протон как свободная частица не рассматривается. Протон не похож на обычные металлические катионы, так как представляет микрочастицу с условным радиусом 100 пм (10 –10 м), то есть в 100 000 раз больше. Из-за огромного различия в размерах поведение протона не похоже на поведение катионов металлов. Протон легко перемещается от одной молекулы к другой. Однако подвижность протона, его способность к перемещению между молекулами проявляется главным образом в соединениях, в которых водород связан с кислородом, азотом, галогенами. Протон от молекулы кислоты переносится на молекулу воды с образованием иона гидроксония Н3О + . В растворе он дополнительно гидратирован и присутствует, в основном, в виде частиц Н3О + ·3Н2О. Это и есть те частицы, которые по традиции называют ионами водорода и записывают как Н + . Не гидратированный ион Н3О + (оксоний) обнаружен в кристаллогидратах кислот, например, HClO4·Н2О. Согласно кристаллической структуре, это перхлорат оксония Н3О + ClO4 – . Протон как свободная частица в растворе существовать не может. Водород, входящий в состав как молекул воды, так и ионов гидроксония, образует дополнительные водородные связи с окружающими молекулами воды. При небольших смещениях протона водородная связь переходит в ковалентную, а ковалентная в водородную, и протон оказывается перенесенным к другой молекуле. H O H O O H O H H H H 2. Классификация кислот В общем виде кислоту как донор протона обозначают символом НВ. Кислота может не иметь заряда (моле-кулярная кислота), но может быть как катионом так и анионом. Основание как акцептор протона обозначается символом :В или просто В. Наличие свободной электронной пары у основания обязательно. В таблице приведены примеры кислот с разными зарядами. В качестве примеров оснований можно взять те же частицы, лишенные одного протона. В скобках в таблице даны вещества, в состав которых входят электрически заряженные кислоты и основания. Все эти вещества относятся к классу солей. Для катионной частицы в качестве противоиона чаще всего берут Cl – , а для анионной – Na + . Можно брать и другие анионы сильных кислот и катионы сильных оснований. | Молекулярные | Катионные | Анионные |
| Кислоты | HCl, HF, H2SO4, C2H5OH | NH4 + (NH4Cl), RNH3 + (RNH3Cl) | HSO4 – (NaHSO4), H2PO4 – (NaH2PO4) |
| Основания | NH3, RNH2 | NH2CH2CH2NH3 + (NH2CH2CH2NH3Cl) | OH – (NaOH), O 2– (Na2O), Cl – (NaCl), F – (NaF), HSO4 – (NaHSO4), |
| Амфолиты | RCH(NH2)COOH, H2O | Al(OH) 2+ (Al(OH)Cl2) | HCO3 – (NaHCO3) |
Если вещество может (в зависимости от свойств второго реагента) как отдавать, так и связывать протон, то оно называется амфолитом. Амфолитами являются некоторые гидроксиды металлов, кислые и основные соли, аминокислоты, белки. Протонные растворители (в том числе вода) также амфолиты.
Различают разновидности кислот по природе атома, с которым связан протон:
ОН-кислоты – самые многочисленные. Это кислоты, образующиеся при соединении оксидов неметаллов с водой, органические карбоновые кислоты и др.
Галоген-Н кислоты – практически важны, но не многочисленны, так как галогены одновалентны. Есть галоген-Н кислоты среди комплексных соединений.
SH-кислоты – слабые (Н2S, RSH). Имеют важное биологическое значение. Такой кислотой является ацетил-кофермент-α. Кислотами являются также селеноводород и теллуроводород.
СН, NH-кислоты – слабые, возникают при сильном мезомерном эффекте. Как примеры можно назвать трифенилметан, циановодород и пиррол.
3. Протолитические реакции
Центральным понятием протолитической теории является протолитическая реакция. Это реакция переноса протона от кислоты к основанию. Первоначально было предложено так называть перенос протона от молекулы кислоты к молекуле растворителя. Прочие реакции переноса протона называли прототропными. В последнее время протолитическими называют любые реакции переноса протона.
После потери протона оставшаяся часть молекулы кислоты становится основанием. Вместе они составляют сопряженную кислотно-основную пару. Такие пары частиц записывают в виде дроби: HCl/Cl – , H2SO4/HSO4 – , NH4 + /NH3.
Cопряженная к-о пара
+ = +
Cопряженная к-о пара
Куда смещено равновесие? Вправо, если кислота сильнее, чем . Можно говорить и о силе основания: равновесие смещено вправо, если основание сильнее, чем .
4. Вода как протонный растворитель
Кислоты и основания проявляют свои свойства во взаимодействии. В растворах роль второго партнера играет растворитель. В качестве протонного растворителя особенно важна вода. Она играет роль основания по отношению к кислотам, и роль кислоты по отношению к основаниям.
При выводе констант равновесия понадобится знать концентрацию воды. Она в разбавленных водных растворах может считаться постоянной, благодаря большому избытку воды, и равной
с(Н2О) = = 55,3 моль/л (25°С)
В воде устанавливается равновесие аутоионизации при концентрациях ионов с(Н3О + ) = с(ОН ) = 110 –7 моль/л.
Н 2О + Н2О Н3О + + ОН или упрощенно
Н2О Н + + ОН .
(пояснение: 3,2·10 –18 55,3 = 1,810 –16 )
(298,15С) (пояснение: 1,810 –16 55,3 = 110 –14 )
Последняя константа, называемая ионным произведением воды, используется наиболее часто. Приходится учитывать зависимость Kw от температуры:
Норм. условия
Станд. условия
Физиолог. условия
T
273,15 К (0С)
298,15 К (25С)
310,15 К (37С)
Kw
1,110 –15
110 –14
2,410 –14
pKw
14,96
14
13,62
Ионизацией воды обусловлено присутствие ионов гидроксония (ионов водорода, как говорят упрощенно) в водных растворах веществ любых классов, включая основания. Кислоты и основания смещают равновесие ионизации. В растворах кислот низка концентрация ОН – , в растворах оснований – низка концентрация Н3О + , но оба вида ионов всегда присутствуют одновременно, причем произведение их концентраций постоянно. Всякий раствор можно охарактеризовать как водородным показателем рН = –lgс(Н + ), так и гидроксидным показателем рОН = = –lgс(ОН – ).
Практически широко применяется только водородный показатель рН.
Вода хороший ионизирующий растворитель. Молекула воды легко связывает протон, но может и отдавать свой протон. Азотная кислота в вводом растворе ведет себя как сильная, а в уксусной кислоте – слабая.
5. Сила кислот и оснований
Вспомним, что в теории Аррениуса сила кислот характеризуется константами диссоциации. В протолитической теории константы диссоциации не имеют смысла, так как молекула НВ не может просто распадаться на протон Н + и основание В – . Протон должен быть передан другой молекуле. Разные кислоты по силе следует сравнивать в одной и той же среде, в качестве которой логично взять воду. Поэтому сила кислоты оценивается относительно стандартной кислоты, сопряженной воде – гидроксония H3O + . Напишем гипотетические реакции отдачи протона какой-либо кислотой и гидроксонием:
Н В В – + Н + , K(HB)
H 3O + H2O + Н + , K(Н3О + )
Вычитая вторую реакцию из первой, получим уравнение реакции данной кислоты с растворителем:
Н В + H2O H3O + + В –
При вычитании реакций их константы равновесия делятся одна на другую. Таким образом, константа равновесия этой реакции показывает, во сколько раз константа данной кислоты больше константы гидроксония:
После преобразования получаем:
Константа отдачи протона гидроксонием непосредственно не определяется. Ее значение целесообразно принять равным 55,3. Это число совпадает с концентрацией растворителя H2O. После сокращения получаем
Константа Ka(HB) называется константой кислотности. Численно она совпадает с константой диссоциации Аррениуса, а математически показывает, во сколько раз константа данной кислоты отличается от константы гидроксония, то есть 55,3. При различных расчетах часто используется силовой показатель кислоты
Чем больше силовой показатель, тем слабее данная кислота. Константы кислотности и силовые показатели даются в таблицах в учебниках и справочниках. Обычно в таблице дается не только формула кислоты, но и сопряженного основания.
Принимая во внимание, что в растворе, содержащем только данную слабую кислоту НВ, c(H3O + ) = c(B – ), получим формулу для расчета концентрации ионов водорода (гидроксония) в растворе слабой кислоты:
; ,
где co(HB) – суммарная концентрация кислоты в протонированной и депротонированной форме. При наличии в растворе нескольких кислот эта формула не применима.
В случае сильной кислоты
;
Проводя такие же рассуждения для равновесий в растворах оснований В, получим аналогичные формулы:
В + H2O НВ + + OH –
Константа Kb называется константой основности. Соответственно,
– силовой показатель основания В.
Концентрация гидроксид-ионов в растворе слабого основания рассчитывается по формуле
Между константой кислотности кислоты HB и константой основности ее сопряженного основания B – и их силовыми показателями имеется простая взаимосвязь:
Ka(HB)Kb(B – ) = Kw = 10 –14
По этим формулам рассчитываются значения Kbи pKb, и поэтому нет необходимости приводить их в справочных таблицах.
Очевидно, что между силой кислоты и основания, составляющих сопряженную пару, имеется обратно пропорциональная зависимость – чем сильнее кислота, тем слабее сопряженное основание.
Зная константы кислотности и основности, можно рассчитать константу равновесия протолитической реакции, протекающей в водном растворе:
или
CH3COOH + NH3 NH4 + + CH3COO –
K 1,810 –5 5,610 –10
K = 1,810 –5 /5,610 –10 = 3,210 4 (степень превращения 99,5%, не зависит от начальных концентраций)
Можно рассмотреть шкалу кислот и оснований
16 14 7 2 0 -2 pKa
оч. слабые слабые ср. силы сильные
С ила кислот увеличивается
Сила сопряженных оснований увеличивается
pKb -2 0 2 7 14 16
Ионизация – реакция кислоты или основания с водой, сопровождающаяся увеличением абсолютной величины заряда:
N H3 + H2O NH4 + + OH –
H 2PO4 – + H2O HPO4 2– + H3O +
Гидролиз – реакции заряженных кислот и оснований с водой, в ходе которых происходит понижение абсолютной величины заряда:
N H4 + + H2O NH3 + H3O +
H PO4 2– + H2O H2PO4 – + OH –
Нейтрализация – реакция переноса протона от кислоты к основанию, в ходе которой среда изменяется в направлении точки нейтральности.
H 2PO4 – + NH3 HPO4 2– + NH4 +
Обратную реакцию принято называть реакцией гидролиза, но вода в ней не участвует.
В титриметрическом анализе проводят реакции нейтрализации, беря в качестве титрантов только сильные кислоты и основания.
В случае любой сильной кислоты нейтрализация аммиака идет по уравнению
H 3O + + NH3 H2O + NH4 +
В случае любого сильного основания нейтрализация дигидрофосфат-иона идет по уравнению
H 2PO4 – + OH – HPO4 2– + H2O
- http://vk.com/page-101519962_51256249
- http://dic.academic.ru/dic.nsf/ruwiki/1606807
- http://www.ngpedia.ru/id508125p1.html
- http://helpiks.org/7-18361.html
- http://studopedia.ru/5_131232_protoliticheskaya-teoriya-kislot-i-osnovaniy.html
- http://studopedia.org/1-7349.html
- http://studfiles.net/preview/2484446/
- http://biologo.ru/lekciya-10-protoliticheskaya-teoriya-kislot-i-osnovanij/index.html