4. Периодический закон Д. И. Менделеева и периодическая система элементов
Периодический закон Д. И. Менделеева и его обоснование с точки зрения электронного строения атомов. Открытие периодического закона и разработка периодической системы химических элементов Д. И. Менделеевым явились вершиной развития химии в XIX в. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок.
Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Несмотря на всю огромную значимость такого открытия, периодический закон и система Менделеева представляли лишь гениальное эмпирическое обобщение фактов, а их физический смысл долгое время оставался непонятным. Причина этого заключалась в том, что в XIX в . совершенно отсутствовали какие-либо представления о сложности строения атома.
Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Периодическая таблица и электронные конфигурации атомов. В настоящее время известно более 500 вариантов изображения периодической системы: это различные формы передачи периодического закона.
Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869 г., был так называемый вариант длинной формы. В этом варианте периоды располагались одной строкой. В декабре 1870 г. он опубликовал второй вариант периодической системы — так называемую короткую форму. В этом варианте периоды разбиваются на ряды, а группы — на подгруппы (главную и побочную).
В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 2 1 элемент. Каждый период, за исключением первого” начинается щелочным металлом и заканчивается благородным газом (7-й период — незаконченный).
Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами.
В системе 10 рядов. Каждый малый период состоит из одного ряда, каждый большой период — из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства элементов в ряду слева направо изменяются, как у типических элементов
Основным признаком , по которому элементы больших периодов разделены на два ряда, является их степень окисления. Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в четвертом периоде степени окисления элементов от К до Mn изменяются от +1 до +7, затем следует триада Fe, Со, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления у элементов от Cu до Br (это элементы нечетного ряда). То же мы видим в остальных больших периодах, исключая седьмой, который состоит из одного (четного) ряда. Дважды повторяются в больших периодах и формы соединений элементов.
В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами (слово “лантаноиды” означает подобные лантану”, а “актиноиды” — “подобные актинию”). Иногда их называют лантанидами и актинидами, что означает следующие за лантаном, следующие за актинием) . Лантаноиды помещены отдельно внизу таблицы, а в клетке звездочкой указано на последовательность их расположения в системе: La-Lu. Химические свойства лантаноидов очень сходны. Например, все они являются реакционно-способными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия.
В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов. Их также помещают отдельно — под лантаноидами, а в соответствующей клетке двумя звездочками указано на последовательность их расположения в системе: Ас-Lr. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер.
В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением являются фтор — его степень окисления равна -1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения и ксенона.
В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовывать химические соединения.
Каждая группа делится на две подгруппы — главную и побочную, что в периодической системе -подчеркивается смещением одних вправо, а других влево. Главную подгруппу составляют типические элементы (элементы второго и третьего периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу составляют только металлы — элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля.
Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F , С1, Вг, I, А t, побочную — металлы М n , Т c, R е. Таким образом, подгруппы объединяют наиболее сходные между собой элементы.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения; существует всего 8 форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R 2 O, R О, R 2 O 3 , RO 2 , R 2 O 5 , R О 3 , R 2 O 7 , RO 4 , где R — элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы (главной и побочной), кроме тех случаев, когда элементы не проявляют степени окисления, равной номеру группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения, форм таких соединений 4. Их также изображают общими формулами в последовательности R Н 4 , R Н 3 , R Н 2 , R Н. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся.
Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у ф ранция, затем у цезия; неметаллические — у фтора, затем — у кислорода.
Наглядно проследить периодичность свойств элементов можно и исходя из рассмотрения электронных конфигураций атомов.
Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. По числу энергетических уровней в электронной оболочке атома элементы делятся на семь периодов. Первый период состоит из атомов, в которых электронная оболочка состоит из одного энергетического уровня, во втором периоде — из двух, в третьем — из трех, в четвертом — из четырех и т. д. Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень.
В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем Уровне имеют 2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов.
Далее мы видим, что внешние электронные оболочки сходны у атомов элементов (Li, Na, К, Rb, Cs); (Ве, Mg, Са, Sr); (F, Сl, Вг, I); (Не, Nе, Аг, Kr, Хе) и т. д. Именно поэтому каждая из вышеприведенных групп элементов оказывается в определенной главной подгруппе периодической таблицы: Li, Na, К, Rb, Cs в I группе, F, Сl, Вг, I — в VII и т. д. Именно вследствие сходства строения электронных оболочек атомов сходны их физические и химические свойства.
Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Поскольку в периодической системе химических элементов Д. И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам (так называемые триады Fe-Со-Ni, Ru-Rh-Pd, Os-Ir-Pt), то число побочных подгрупп, так же как и главных, равно 8.
По аналогии с переходными элементами число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т. е. 14.
Период начинается элементом, в атоме которого на внешнем уровне находится один s-электрон: в первом периоде это водород, в остальных — щелочные металлы. Завершается период благородным газом: первый — гелием (1 s 2 ), остальные периоды — элементами, атомы которых на внешнем уровне имеют электронную конфигурацию ns 2 np 6 .
Первый период содержит два элемента: водород (Z=1) и гелий (Z= 2). Второй период начинается элементом литием (Z= 3) и завершается неоном (Z = 10). Во втором периоде восемь элементов. Третий период начинается с натрия (Z= 11), электронная конфигурация которого 1s 2 2s 2 2p 6 3s 1 . С него началось заполнение третьего энергетического уровня. Завершается оно у инертного газа аргона (Z = 18), Зs- и 3p-подуровни которого полностью заполнены. Электронная формула аргона: 1s 2 2s 2 2p 6 Зs 2 3p 6 . Натрий — аналог лития, аргон — неона. В третьем периоде, как и во втором, восемь элементов.
Четвертый период начинается калием (Z= 19), электронное строение которого выражается формулой 1s 2 2s 2 2p 6 3s 2 3p64s 1 . Его 19-й электрон занял 4s-подуровень, энергия которого ниже энергии Зd-подуровня. Внешний 4s-электрон придает элементу свойства, сходные со свойствами натрия. У кальция (Z = 20) 4s-подуро-вень заполнен двумя электронами: 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 . С элемента скандия (Z = 21) начинается заполнение Зd-подуровня, так как он энергетически более выгоден, чем 4р-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z = 30). Поэтому электронное строение Sc соответствует формуле 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 , а цинка — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 . В атомах последующих элементов вплоть до инертного газа криптона (Z=36) идет заполнение 4p-подуровня. В четвертом периоде 18 элементов.
Пятый период содержит элементы от рубидия (Z=37) до инертного газа ксенона (Z = 54). Заполнение их энергетических уровней идет так же, как у элементов четвертого периода: после Rb и Sr у десяти элементов от иттрия (Z = 39) до кадмия (Z=48) заполняется 4d-подуровень, после чего электроны занимают 5p-подуровень. В пятом периоде как и в четвертом, 18 элементов.
В атомах элементов шестого периода цезия (Z= 55) и бария (Z = 56) заполняется 6s-подуровень. У лантана (Z= 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-поАуровень, семь орбиталей которого могут быть заняты 14 электронами. Это происходит у атомов элементов лантаноидов с Z = 58 — 71. Поскольку у этих элементов заполняется глубинный 4f-подуровеиь третьего снаружи уровня, они обладают весьма близкими химическими свойствами. С гафния (Z = 72) возобновляется заполнение d-подуровня и заканчивается у ртути (Z = 80), после чего электроны заполняют 6p — подуровень. Заполнение уровня завершается у благородного газа радона (Z= 86). В шестом периоде 32 элемента.
Седьмой период — незавершенный. Заполнение электронами электронных уровней аналогично шестому периоду. После заполнения 7s-подуровня у Франция (Z = 87) и радия (Z = 88) электрон актиния поступает на 6d-подуровень, после которого начинает заполняться 5f-подуровень 14 электронами. Это происходит у атомов элементов актиноидов с Z = 90 — 103. После 103-го элемента идет заполнение б d-подуровня: у курчатовия (Z = 104), нильсбория (Z = 105), элементов Z = 106 и Z = 107. Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами.
Хотя 3 d-подуровень заполняется после 4s-подуровня, в формуле он ставится раньше, так как последовательно записываются все подуровни данного уровня.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства).
1. s-Элементы : заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
2. р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого).
3. d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами).
4. f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
Периодическая система Д. И. Менделеева является естественной классификацией химических элементов по электроны структуре их атомов. Об электронной структуре атома, а значит, и свойствах элемента судят по положению элемента в соответствующем периоде и подгруппе периодической системы. Закономерностями заполнения электронных уровней объясняется различное число элементов в периодах.
Таким образом, строгая периодичность расположения элементов в периодической системе химических элементов Д. И. Менделеева полностью объясняется последовательным характером заполнения энергетических уровней.
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
В свете учения о строении атомов становится обоснованным разделение Д.И. Менделеевым всех элементов на семь периодов. Номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. Поэтому s-элементы имеются во всех периодах, р-элементы — во втором и последующих, d-элементы — в четвертом и последующих и f-элементы — в шестом и седьмом периодах.
Легко объяснимо и деление групп на подгруппы, основанное на различии в заполнении электронами энергетических уровней. У элементов главных подгрупп заполняются или s-подуровни (это s-элементы), или р-подуровни (это р-элементы) внешних уровней. У элементов побочных подгрупп заполняется (d-подуровень второго снаружи уровня (это d-элементы). У лантаноидов и актиноидов заполняются соответственно 4f- и 5f-подуровни (это f-элементы). Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходное строение внешнего электронного уровня. При этом атомы элементов главных подгрупп содержат на внешних уровнях число электронов, равное номеру группы. В побочные же подгруппы входят элементы, атомы которых имеют на внешнем уровне по д ва или по одному электрону.
Различия в строении обусловливают и различия в свойствах элементов разных подгрупп одной группы. Так, на внешнем уровне атомов элементов подгруппы галогенов имеется по семь электронов подгруппы марганца — по два электрона. Первые — типичные металлы, а вторые — металлы.
Но у элементов этих подгрупп есть и общие свойства: вступая в химические реакции, все они (за исключением фтора F) могут отдавать по 7 электронов на образование химических связей. При этом атомы подгруппы марганца отдают 2 электрона с внешнего и 5 электронов со следующего за ним уровня. Таким образом, у элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вторых снаружи) уровней, в чем состоит основное различие в свойствах элементов главных и побочных подгрупп.
Отсюда же следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом — физический смысл номера группы.
Итак, строение атомов обусловливает две закономерности: 1) изменение свойств элементов по горизонтали — в периоде слева право ослабляются металлические и усиливаются неметаллические свойства; 2) изменение свойств элементов по вертикали — в подгруппе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические. В таком случае элемент (и клетка системы) находится на пересечении горизонтали и вертикали, что определяет его свойства. Это помогает находить и писывать свойства элементов, изотопы которых получают искусственным путем.
С точки зрения теории строения атома, элементы в периодической системе расположены в последовательности увеличения зарядов их ядер, Внутри каждого периода по мере возрастания зарядов ядер элементов последовательно изменяется структура внешних электронных уровней. С этим связан переход элементов от металлов к неметаллам. В периодах слева направо, с увеличением зарядов ядер элементов, усиливается притяжение электронов к ядру и происходит сжатие атома, т. е. уменьшение атомного радиуса элементов. Поэтому в начале каждого периода располагаются элементы, имеющие больший атомный радиус и меньшее число электронов на внешнем электронном слое. Чем больше атомный радиус, тем слабее притяжение электронов внешнего слоя и тем легче элементу отдавать электроны. Такая структура характерна для элементов — металлов, которые сравнительно легко отдают валентные электроны, но не могут принимать их дополнительно для достройки электронных оболочек внешнего уровня.
С увеличением атомного номера элементов увеличивается заряд ядра и число электронов во внешнем слое и уменьшается легкость отдачи электронов с этого слоя. Таким образом, внутри каждого периода с увеличением атомных номеров элементов наблюдается уменьшение металлических свойств элементов и возрастание неметаллических свойств (способность притягивать к себе электроны). Каждый период заканчивается инертным элементом, имеющим завершенную структуру внешнего электронного слоя (полный октет).
Устойчивость такого октета объясняет пассивность инертных элементов, что не позволяет причислить их к металлам или неметаллам. В группах расположены элементы, имеющие одинаковое строение внешнего электронного слоя, т. е. электронные аналоги. Номер группы указывает число электронов на внешней электронной оболочке атомов элементов данной группы. Элементы, находящиеся в одной группе проявляют близкие химические свойства. Однако и внутри группы свойства элементов изменяются. Это связано с тем, что внутри каждой группы сверху вниз у элементов увеличивается число электронных слоев, т. е. атомный радиус. Чем больше атомный радиус, тем дальше от ядра электроны внешнего слоя и тем слабее они удерживаются ядром.
Таким образом, в группах сверху вниз усиливаются металлические и уменьшаются неметаллические свойства. В периодической таблице группы делятся на два типа: 8 групп IA- VIIIA и 8 групп IB- VIIIB. Группа VIIIB состоит из триад. В группах IА и IIA находятся s-элементы, у них последним заполняется электронами s-подуровень внешнего уровня. Далее, согласно правилам Клечковского, для элементов с главным квантовым числом n= 2 и n= 3 (второй и третий период) происходит заполнение р- подуровня. Это р- элементы, они располагаются в группах IIIA- VIIIA. Для элементов IV и V периода после заполнения электронами s- подуровня энергетически более выгодно заполнение соответственно 3d- и 4d- поуровней, что и происходит у элементов групп IB- VIIIB.
Группы типа В расположены в порядке, указывающем число валентных электронов атомов элементов, так как у d- элементов валентными являются электроны не только внешнего уровня, но и заполняемого второго снаружи уровня. После полного заполнения d- электронами второго снаружи уровня, происходит заполнение р- подуровня последнего электронного уровня (группы IIIA- VIIIA).
У актиноидов и лантаноидов происходит заполнение электронами f- подуровня третьего снаружи энергетического уровня, что и обуславливает схожесть их химических свойств.
Как видно, с учетом заполнения электронами энергетических уровней, в периодической таблице с увеличением атомных номеров элементов наблюдается периодическое повторение строения внешних электронных слоев, что и обусловливает периодичность свойств химических элементов.
С электронной конфигурацией атома связаны такие его свойства, как энергия ионизации, сродство к электрону, электроотрицательность, степень окисления.
Смотрите также
Экспериментальные данные и закономерности спектров соединения хромофоров
Рассмотрим теперь, как влияет присутствие в молекуле различных хромофоров и окружающей среды (растворителя) на спектр соединения. Как известно, во многих случаях в электронных спектрах к .
Вопрос. Периодический закон с точки зрения строения атома. Причина периодичности.
1867г – таблица Менделеева
Авторская формулировка(1869г): свойства элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов.
Современная формулировка: свойства простых веществ, а также форма и свойства элементов находятся в периодической зависимости от величин заряда числа атома.
Менделеев располагал элементы не только по принципу возрастания атомных масс, но и учитывал свойства элементов.
Каждому элементу присвоен порядковый (атомный) номер.
Порядковый номер совпадает с числом элементарных положительных электронных зарядов ядра атома этого элемента.
Порядковый номер частично равен положительному заряду ядра его атома.
Периодически повтор.след свойства элементов:
1.Металличность(легко отдают электроны)
2.Энергия ионизации атома – кол-во энергии, кот. Необходимо затратить отрыва электрона от атома.
3.Неметалличность(сильно притягивают электроны)
4.Сродство к электрону – кол-во энергии, которая выделяется при присоединении электрона к атому.
5.Электроотрицательность – способность атома притягивать электроны.
Причины: периодичное повторение св-в эл-ов объясняется периодическим повторением кол-во электронов по внешним электронам слое.
Вопрос. s-, p-, d-, f-элементы, положение в периодической системе. Основные химические свойства
Вопрос.Природа химической связи. Метод валентных связей.
(Хим. Связь имеет электронную природу, образ. за счет электронов)
Природа химической связи едина: взаимодействие атомов в молекуле (ионах, кристаллах) осуществляется под действием электрических сил между электронами и ядрами атомов.
(у S и P элементов за счет электронов внешнего слоя, у d элементов за счет электронов внешнего слоя и предвнешнего)
В формировании химической связи принимают участие валентные электроны. Это электроны внешних электронных слоев, которые наименее прочно связаны с ядром атома. Несмотря на единую электрическую природу связывания атомов существуют различные типы связей, формируемые по разным механизмам. К основным типам связи относятся ковалентная (полярная и неполярная) и ионная связи. Разновидностями этих типов являются донорно-акцепторная (координационная), водородная и другие. Между атомами металлов в конденсированной фазе действует металлическая связь. Метод базируется на двух положениях: 1 ) ковалентная химическая связь образуется парой электронов с антипараллельными спинами, пренадлежащей двум атомам; 2 ) ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
1.2. Строение атома. Периодическая система химических элементов д.И. Менделеева.
Периодичность свойств элементов и
Между положением элемента в периодической системе и строением атома этого элемента существует взаимно-однозначное соответствие, т.е. координаты элемента в периодической системе определяют строение атома и наоборот, по строению атома можно определить его положение в периодической системе.
Для каждого элемента в периодической системе существует пять характеристик: порядковый номер Z, атомная масса А, номер периода, номер группы и подгруппа (главная или побочная). С точки зрения строения атома порядковый номер показывает число протонов в ядре. Атомная масса даёт сумму масс всех частиц атома: протонов, нейтронов и электронов. Учитывая, что масса электрона мала по сравнению с массой протона и нейтрона округлённо можно определять атомную массу, как сумму масс протонов и нейтронов. Отсюда легко найти число нейтронов в ядре как разность атомной массы и числа протонов: А – Z. Атом электронейтрален, поэтому число электронов в электронной оболочке равно числу протонов в ядре, т.е. порядковому номеру элемента – Z.
Номер периода показывает число энергетических электронных уровней в атоме.
Номер группы показывает общее число «валентных» электронов, т.е. электронов, которые могут принимать участие в образовании химических связей. Положение элемента в подгруппе (главной или побочной) определяется распределением «валентных» электронов: если элемент расположен в главной подгруппе, то все его валентные электроны находятся на последнем энергетическом электронном уровне, а все предыдущие уровни заполнены. Если элемент расположен в побочной подгруппе, то все остальные валентные электроны находятся на предпоследнем энергетическом уровне.
Существует форма записи энергетических состояний электронов в атоме, которая называется электронной формулой. В ней главное квантовое число обозначается цифрой (1, 2, 3, 4…), орбитальное – буквой (s-, p-, d-, f-), а число электронов на каждом подуровне показывается индексом вверху, например, электронная формула атома азота 
Основным или нормальным состоянием атома называется состояние, отвечающее минимальному запасу энергии, т.е. электроны занимают энергетические состояния с меньшей энергией. С небольшой затратой энергии (например, при воздействии светового излучения) электроны могут переходить в пределах одного энергетического уровня на более высокий энергетический подуровень. Атом переходит в «возбуждённое» состояние, например, для атома бериллия:
Строение внешних электронных уровней определяет формы и свойства его соединений. Например, для атома № 22 Ti имеем электронную формулу 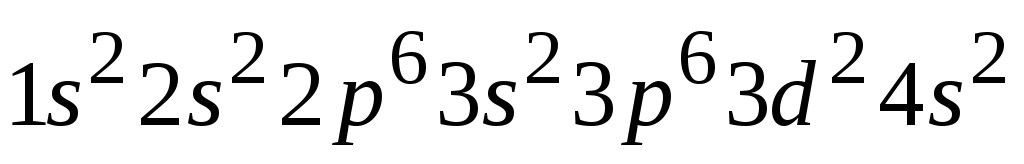
Ti имеет всего четыре валентных электрона, поэтому высшая степень окисления +4.
Оксид, отвечающий этой степени окисления – TiO2, имеет амфотерный характер (с преобладанием основных свойств), поэтому соответствующий ему гидроксид может быть записан в двух формах: Ti(OH)4 или H2TiO3, соответственно он образует соли при взаимодействии и с кислотами и со щелочами:
Ti(OH)4 + 2Н2SO4
Ti(OH)4 + 2НCl 
Низшая степень окисления Ti (как у большинства d–элементов) +2. Оксид TiО имеет основный характер, гидроксид Ti(OH)2 образует соли только с кислотами, например, TiSO4 или TiCl2.
Для характеристики любого элемента необходимо выполнить следующие действия:
Определить состав атома, т.е. указать число протонов, нейтронов и электронов.
Дать электронную формулу атома и распределение электронов внешних энергетических уровней по атомным орбиталям.
Определить высшую и низшую степень окисления и привести формулы и названия соединений, отвечающих данным степеням окисления.
Например, элемент № 34 Se.
Состав атома: (34 p, 46 n) 34 e.
Электронная формула: 1s 2 2s 2 2р 6 3s 2 3p 6 3d 10 4s 2 4p 4 – это p–элемент.
Высшая степень окисления +6, оксид селена (VI) SeO3 – кислотный, гидроксид H2SeO4 — селеновая кислота, соли: Na2SeO4 — cеленат натрия, K2SeO4 — селенат калия.
Низшая степень окисления -2, H2S — селеноводород, K2Se — селенид калия, Na2Se — селенид натрия.
Свойства элементов, определяемые строением внешних электронных слоев атомов, закономерно изменяются по периодам и группам периодической системы. При этом сходство электронных структур порождает сходство свойств элементов–аналогов, но не тождественность этих свойств. Поэтому при переходе от одного элемента к другому в группах и подгруппах наблюдается не простое повторение свойств, а их более или менее ярко выраженное закономерное изменение. В частности, химическое поведение атомов элементов проявляется в их способности терять и приобретать электроны, т.е. в их способности к окислению и восстановлению. Количественной мерой способности атома терять электроны является потенциал ионизации(Еи), а мерой способности их приобретать – сродство к электрону (Ес). Характер изменения этих величин при переходе от одного периода к другому повторяется, причем в основе этих изменений лежит изменение электронной конфигурации атома. Так, завершенные электронные слои, соответствующие атомам инертных газов, обнаруживают повышенную устойчивость и повышенное значение потенциалов ионизации в пределах периода. В то же время наименьшими значениями потенциала ионизации обладают s–элементы первой группы (Li, Na, K, Rb, Cs).
Электроотрицательность является мерой способности атома данного элемента оттягивать на себя электроны по сравнению с атомами других элементов в соединении. Согласно одному из определений (Малликен), электроотрицательность атома 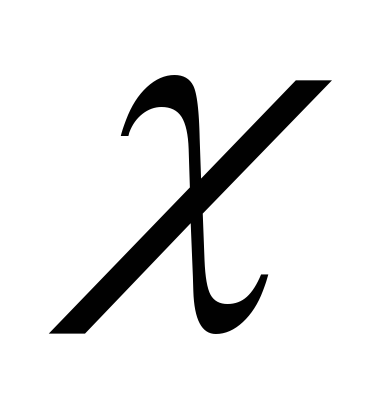

В периодах наблюдается общая тенденция роста электроотрицательности элемента, а в подгруппах – ее снижение. Наименьшими значениями электроотрицательности обладают s–элементы I группы, а наибольшими – р–элементы VII группы.
Электроотрицательность одного и того же элемента может меняться в зависимости от валентного состояния, гибридизации, степени окисления и пр. Электроотрицательность существенно влияет на характер изменения свойств соединений элементов. Так, например, серная кислота проявляет более сильные кислотные свойства, чем ее химический аналог – селеновая кислота, поскольку в последней центральный атом селена из-за меньшей по сравнению с атомом серы электроотрицательности не так сильно поляризует связи Н–О в кислоте, что и означает ослабление кислотности.
Н

Другой пример: гидроксид хрома (II) и гидроксид хрома (VI). Гидроксид хрома (II), Cr(OH)2, проявляет основные свойства в отличие от гидроксида хрома (VI), Н2CrO4, поскольку степень окисления хрома +2 обусловливает слабость кулоновского взаимодействия Cr 2+ с гидроксид-ионом и легкость отщепления этого иона, т.е. проявление основных свойств. В то же время высокая степень окисления хрома +6 в гидроксиде хрома (VI) обусловливает сильное кулоновское притяжение между гидроксид-ионом и центральным атомом хрома и невозможность диссоциации по связи 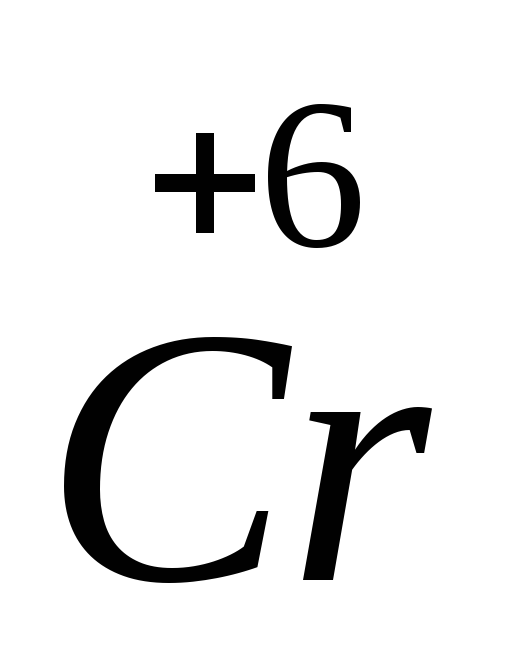
Н

Следующей важной характеристикой атомов является их радиусы. В периодах радиусы атомов металлов с ростом порядкового номера элемента уменьшаются, т.к. с ростом порядкового номера элемента в пределах периода возрастает заряд ядра, а следовательно и уравновешивающий его общий заряд электронов; как следствие, возрастает и кулоновское притяжение электронов, что приводит в конечном счете к уменьшению расстояния между ними и ядром. Наиболее рельефно снижение радиуса наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня.
В больших периодах у d- и f-элементов наблюдается более плавное снижение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов радиусы атомов, как правило, увеличиваются сверху вниз, так как такое смещение означает переход на более высокий энергетический уровень.
Влияние радиусов ионов элементов на свойства образуемых ими соединений можно проиллюстрировать на примере возрастания кислотности галогенводородных кислот в газовой фазе: HI > HBr > HCl > HF.
В этих соединениях сила кулоновского притяжения зависит от кулоновского радиуса, представляющего собой сумму радиусов ионов галогена и водорода. Очевидно, что с ростом радиуса галогена сила кулоновского притяжения снижается, что делает отщепление протона более выгодным.
Примеры решения типовых задач.
Пример 1. Составление электронных и электронно-графических формул атомов элементов, молекулярных формул соответствующих оксидов и гидроксидов по номеру элемента в периодической системе.
Задача. Постройте электронные и электронно-графические формулы атомов элементов № 35 и № 73 и приведите молекулярные формулы образуемых ими оксидов, гидроксидов и солей.
Решение. Электронные формулы показывают распределение электронов в атоме по энергетическим уровням и подуровням. Электронная формула обозначается символами 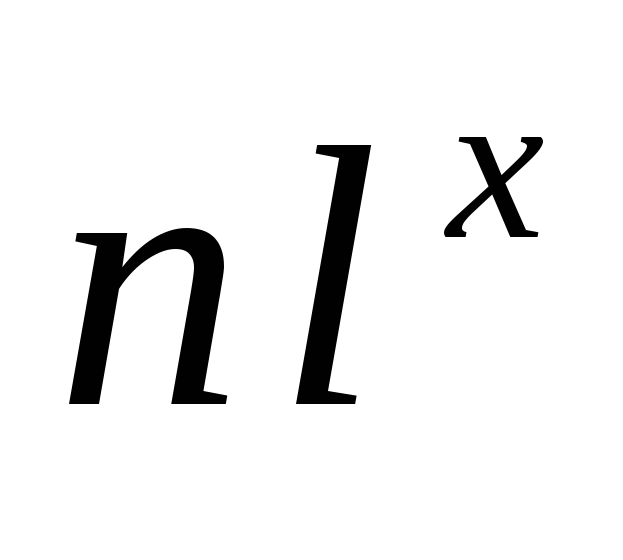
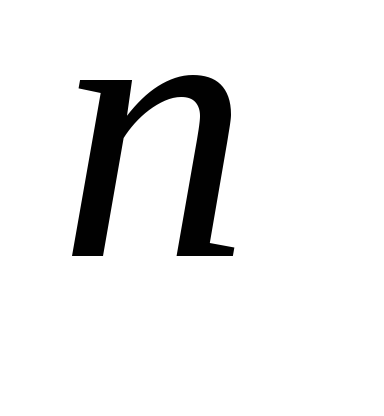
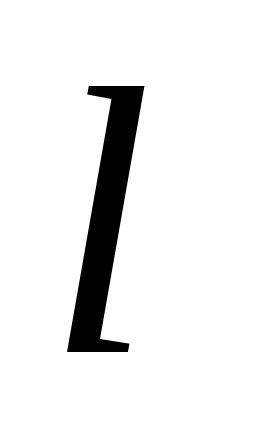
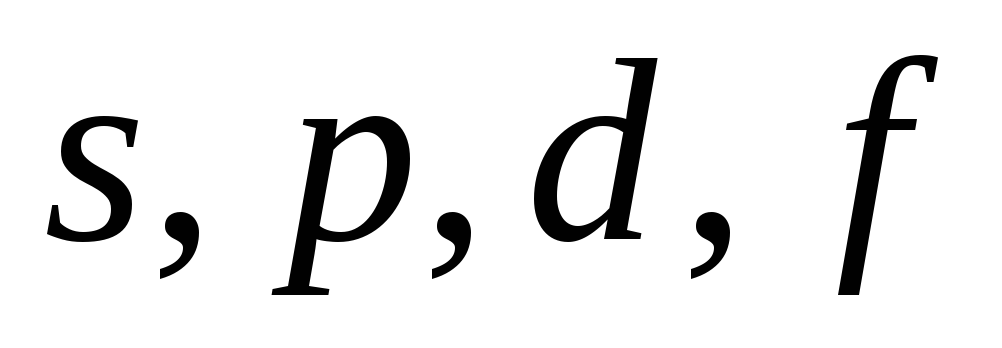

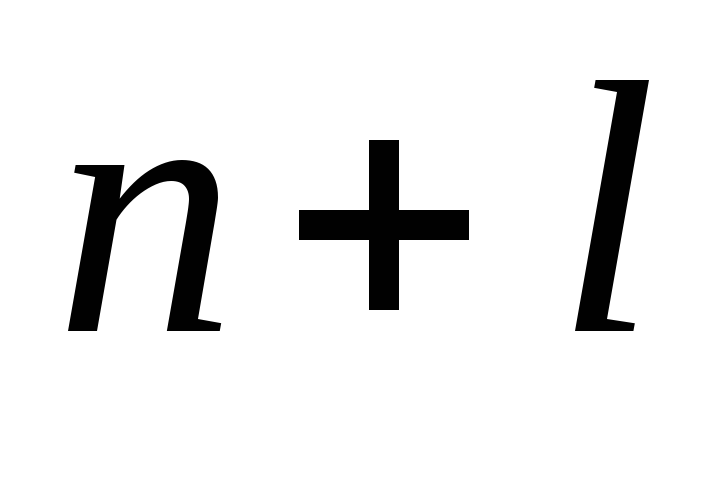
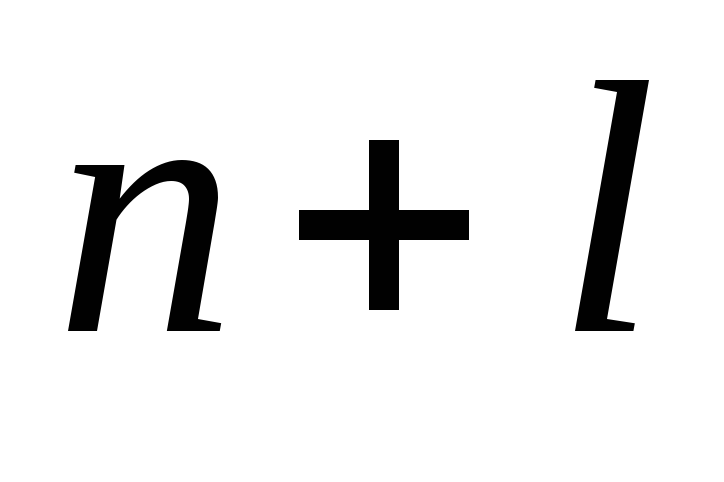
Приложение этих правил к многоэлектронному атому приводит к следующей последовательности заполнения его энергетических уровней и подуровней:
1s2s2p3s3p4s3d4p5s4d5p6s(5d 1 )4f
5d6p7s (6d 3-2 )5f6d7p.
Положение элементов в периодической системе дает для него следующие характеристики: порядковый номер элемента, номер периода, номер группы, подгруппа (главная или побочная). Каждая из этих характеристик однозначно связана со строением атома элемента.
Порядковый номер элемента указывает на число электронов, номер периода показывает на число энергетических уровней. Номер группы для элементов главных подгрупп указывает на число электронов на внешнем энергетическом уровне и на высшую положительную степень окисления. Для элементов побочных подгрупп номер группы указывает только на высшую положительную степень окисления, число же электронов на внешнем энергетическом уровне может быть 1 или 2.
В связи с выше сказанным, электронные формулы для элементов №35 (Br) и №73 (Та) имеют следующий вид:
35Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
73Ta 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 3 6s 2
Электронная структура атома может быть изображена также графическим образом с помощью энергетических, или квантовых ячеек, которые являются схематическим изображением атомных орбиталей (АО).
аждая такая ячейка обозначается в виде прямоугольника, а электроны в этих ячейках обозначаются стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами:
Согласно правилу Хунда орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
Графическая схема для указанных элементов имеет следующий вид:
Br находится в VIIA группе, т.к. все валентные электроны у него находятся на внешнем энергетическом уровне. Следовательно, Br – неметалл, оксид брома (VII) Br2O7 проявляет свойства кислотного оксида, соответствующий ему гидроксид – бромная кислота HBrO4, соль пербромат натрия NaBrO4. Так как на внешнем энергетическом уровне 7 электронов, то приобретая один электрон, бром имеет низкую степень окисления –1. Соединения, соответствующие 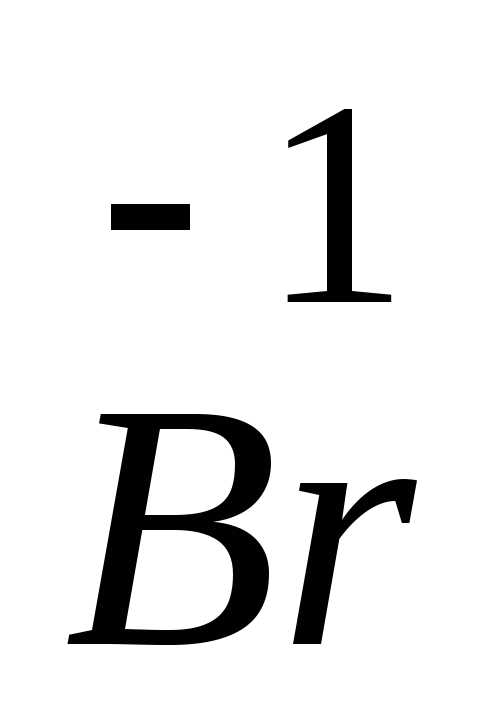
Тантал – d-элемент, поэтому он может проявлять переменную степень окисления и образует несколько оксидов и гидроксидов, причем характер их зависит от степени окисления. Для тантала наиболее типичны соединения, в которых их степень окисления равна +5. Оксид тантала (V) проявляет свойства кислотного оксида, его формула Та2О5, соответствующий ему гидроксид танталовая кислота НТаО3, соль КТаО3. Низшая степень окисления для тантала +2. Оксид и гидроксид Та(II) проявляет основные свойства. Соединения, соответствующие 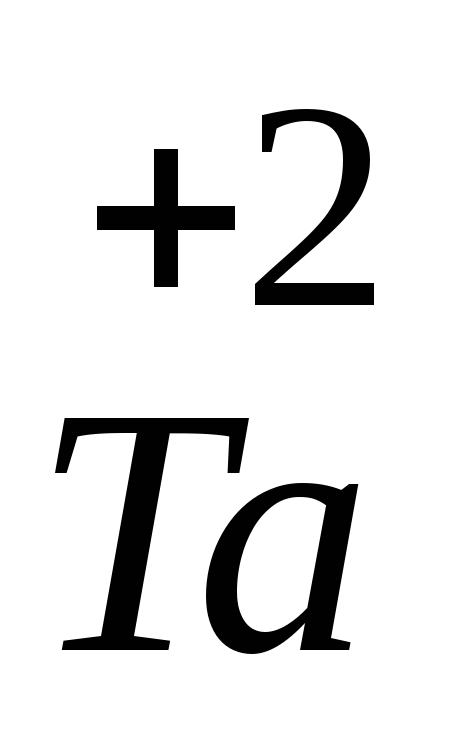
Пример 2. Определение местонахождения элемента в периодической системе химических элементов по его электронной формуле.
Задача. Определите элемент, его местонахождение в периодической системе, если его электронная формула имеет следующий вид: …5s 2 5p 2 .
Решение. Определить элемент и найти его местоположение в периодической системе можно двумя путями.
Первый путь: определить число электронов, а оно укажет на порядковый номер элемента. Электронная формула, соответствующая этому элементу, имеет следующий вид:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 2 ,
т.к. число электронов равно 50, следовательно, это олово. Оно находится в 5 периоде, четвертой группе, главной подгруппе.
Второй путь: этот элемент находится в 5 периоде, т.к. имеет строение внешнего энергетического уровня 5s 2 5р 2 . На внешнем энергетическом уровне находится 4 электрона, следовательно, он находится в IVA группе. Элемент, соответствующий этим координатам – олово.
Пример 3. Составление электронных формул атомов элементов на основе значений квантовых чисел электронов наружного слоя.
Решение. Состояние каждого электрона наружного энергетического уровня определяется следующим набором квантовых чисел:
Главное квантовое число равно четырем, следовательно, электроны находятся на 4-м энергетическом уровне. Орбитальное квантовое число определяет форму орбитали. Если l=1, то орбиталь называется р-орбиталью, следовательно, три электрона находятся на р-подуровне 4-го энергетического уровня. Магнитное квантовое число ml (-1, 0, +1) определяет ориентацию орбитали в пространстве. На всех трех р-орбиталях (px, py, pz) находится по одному электрону (ms=+1/2). Наружный энергетический уровень атома этого элемента содержит пять электронов: …4s 2 4p 3 . Такую электронную конфигурацию наружного энергетического уровня имеет атом мышьяка As, электронная формула которого следующая: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 .
Пример 4. Составление электронных формул вещества на основе значения порядкового номера элемента.
Задача. Составьте электронные формулы атома элемента с порядковым номером 40. Приведите распределение электронов атома этого элемента по квантовым (энергетическим) ячейкам.
Решение. Элемент с порядковым номером 40 – цирконий Zr. Соответственно, на электронных уровнях и соответствующих им подуровнях (орбиталях) необходимо разместить 40 электронов.
В соответствии с правилами заполнения многоэлектронного атома начинаем размещение электронов на нем с самого низкого энергетического уровня, n=1. Ему соответствует единственное значение орбитального числа l=0, определяющего сферическую форму орбитали (s-подуровень). Магнитное квантовое число, определяемое значением l (-l, . 0,…+l) также принимает для этого случая единственное значение ml=0, что демонстрирует наличие единственной орбитали (s-орбитали) на этом подуровне. Согласно правилу Паули на одной орбитали (и соответственно, на s-подуровне) может быт размещено максимум два электрона со спиновыми квантовыми числами ms=+1/2 и ms=-1/2. Поскольку рассматриваемый уровень (n=1) и соответствующий ему s-подуровень после размещения на нем двух электронов исчерпан (1s 2 ), переходим к следующему энергетическому уровню n=2. Этому уровню соответствуют два подуровня, характеризующегося значениями l=0 и l=1. Как указывалось выше, значение l=0 определяет s-подуровень, на котором может быть размещено максимум два электрона 2s 2 . Следующий подуровень, определяемый значением l=1, называется р-подуровнем. Ему соответствует гантелеобразная форма орбитали (p-орбиталь). Для l=1 магнитное квантовое число принимает три значения -1, 0 и +1. Эти три значения определяют наличие на р-подуровне трех орбиталей, каждая из которых может принять максимум два электрона. Это означает, что на р-подуровне (l=1) можно разместить максимум шесть электронов (2р 6 ). Итак, на двух первых энергетических уровнях (n=1, n=2) мы расположим 10 электронов: 1s 2 2s 2 2p 6 . Переходим к следующему уровню, n=3. На этом уровне находятся три подуровня, которым соответствуют значения l: 0, 1, 2 (l=0,1…..n-1). 3s-подуровень (l=0) этого уровня как любой s-подуровень содержит максимум 2 электрона (3s 2 ). 3р-подуровень (l=1) – 6 электронов (3р 6 ). При дальнейшем заполнении многоэлектронного атома возникает дилемма: куда размещать следующие электроны — на 3d (l=2) или 4s (l=0) подуровень? Здесь мы руководствуемся первым правилом Клечковского, согласно которому в первую очередь заполняется подуровень, которому соответствует меньшее значение суммы n+l. Для 3d-подуровня эта сумма равна 3+2=5, а для 4s она равна 4+0=4. Поэтому заполняем 4s-подуровень 4s 2 . Далее необходимо решить дилемму, на каком подуровне размещать следующие электроны: 3d или 4р. Обоим этим подуровням соответствует одинаковое значение n+l=5. Здесь мы руководствуемся вторым правилом Клечковского, согласно которому при равенстве суммы n+l в первую очередь заполняется подуровень, которому соответствует меньшее значение n. Поэтому заполняет 3d-подуровень. Любой d-подуровень (l=2) содержит 5 орбиталей, которым соответствует набор значений m: -2, -1, 0, +1, +2. Максимальное число электронов, размещенных на этом подуровне, равно 5·2=10 (3d 10 ). Таким образом, мы пришли к ситуации, когда полностью исчерпаны первые три уровня (n=1, n=2, n=3) и заполнен s-подуровень 4-го уровня: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 . При заполнении использовано 30 электронов, остается еще 10. Следующий подуровень, подлежащий заполнению, — 4р-подуровень (но не 5s – см. второе правило Клечковского). Ему соответствуют 3р-орбитали, на которых размещаем шесть электронов. Затем заполняем 5s-подуровень (два электрона) и приходим к ситуации 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2 . Остающиеся два электрона размещаем (руководствуясь первым правилом Клечковского) на 4d-подуровне и приходим к электронной формуле атома циркония: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 2 5s 2 . Ей соответствует графическая электронная формула
- http://www.chemicalnow.ru/chemies-4372-2.html
- http://cyberpedia.su/17x88f1.html
- http://studfiles.net/preview/600151/page:4/