Парообразование, которое происходит только со свободной поверхности жидкости, граничрщей с газообразной средой или с вакуумом, называется испарением.
Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории. Как известно, потенциальная энергия молекул жидкости при увеличении расстояния между ними должна возрастать. Следовательно, чтобы покинуть жидкость, молекула должна выполнить работу за счет уменьшения своей кинетической энергии. Среди хаотически движущихся молекул жидкости в ее поверхностном слое всегда найдутся такие молекулы, которые стремятся еылететь из жидкости. Когда такая молекула выходит за поверхностный слой, то возникает сила, втягивающая молекулу обратно в жидкость (рис. 7.1). Поэтому вылетают из жидкости только те молекулы, у которых кинетическая энергия больше работы, необходимой для преодоления противодействия молекулярных сил в слое толщиной где — радиус молекулярного действия.
Покинувшие жидкость молекулы совместно составляют пар над ее поверхностью. Так как из жидкости вылетают молекулы с достаточно большой кинетической энергией, а остаются в ней
молекулы с меньшей кинетической энергией, то среднее значение энергии для молекул, остающихся в жидкости, в процессе испарения уменьшается, т. е. жидкость при испарении охлаждается. Этим объясняется ощущение холода при выходе из воды после купанья, охлаждение руки, смоченной эфиром, и т. п.
Некоторые молекулы пара при хаотическое движении над поверхностью жидкости залетают обратно в жидкость. Это означает, что наряду с испарением жидкости всегда происходит и конденсация ее паров. Так как молекулы пара, залетающие в жидкость, частично передают свою кинетическую энергию молекулам жидкости, то при этом происходит возрастание Еаост у молекул жидкости, т. е. увеличение внутренней энергии жидкости (нагревание жидкости).
Итак, на поверхности жидкости одновременно происходит испарение и конденсация. Когда преобладает процесс испарения, жидкость охлаждается, а когда преобладает конденсация, жидкость нагревается.
Поскольку силы молекулярного взаимодействия зависят от природы молекул, скорость испарения зависит от рода жидкости. Эту зависимость легко обнаружить на опыте. Если в одинаковые открытые сосуды налить равные объемы разных жидкостей, то через некоторое время будет видно, что быстрота испарения этих жидкостей разная. Оказывается, что эфир испаряется быстрее спирта, а спирт — быстрее воды.
Опыт показывает, что скорость испарения жидкости зависит от площади ее свободной поверхности. Чем больше эта площадь, тем быстрее испаряется жидкость. (Приведите примеры, подтверждающие эту зависимость, и объясните ее.)
Испарение происходит при любой температуре. Поэтому над свободной поверхностью жидкости всегда находится пар этой жидкости.
Легко заметить, что с повышением температуры скорость испарения жидкости возрастает. Например, горячая вода испаряется быстрее холодной. Объясняется это тем, что при повышении температуры увеличивается средняя кинетическая энергия молекул жидкости и становится больше таких молекул, которые могут преодолеть противодействие поверхностного слоя жидкости и вылететь за его пределы.
Как было отмечено выше, наряду с испарением жидкости всегда происходит и конденсация ее паров, которая уменьшает скорость испарения. При увеличении плотности молекул пара над поверхностью жидкости конденсация пара возрастает и испарение замедляется. Следовательно, чем меньше плотность пара жидкости над ее поверхностью, тем больше скорость испарения. Поэтому откачка паров с поверхности ускоряет ее испарение.
Отметим еще, что охлаждение жидкости в процессе ее испарения не всегда заметно. Объясняется это тем, что между жидкостью и окружающими телами существует теплообмен, который компенсирует потери ее энергии, уменьшая охлаждение жидкости. Однако при большой скорости испарения температура жидкости может заметно понизиться.
Испарение и конденсация
Переход вещества в газообразное состояние называется парообразованием.
Совокупность молекул, вылетевших из вещества, называется паром это го вещества.
При парообразовании увеличиваются средние расстояния между молекулами. В результате потенциальная энергия взаимодействия частиц увеличивается (численное значение ее уменьшается, но она отрицательна). Таким образом, процесс парообразования связан с увеличением внутренней энергии вещества.
Парообразование может происходить непосредственно из твердого состояния — это возгонка (или сублимация).
Переход из жидкого состояния в газообразное возможен двумя различными процессами: испарением и кипением.
Испарение — это парообразование, происходящее только со свободной поверхности жидкости, граничащей с газообразной средой или с вакуумом.
Экспериментально установлены следующие закономерности:
- При одинаковых условиях различные вещества испаряются с различной скоростью (скорость испарения определяется числом молекул, переходящих в пар с поверхности вещества за 1 с).
- Скорость испарения тем больше:
- чем больше площадь свободной поверхности жидкости;
- чем меньше плотность паров над поверхностью жидкости. Скорость увеличивается при движении окружающего воздуха (ветер);
- чем больше температура жидкости.
- При испарении температура тела понижается.
Механизм испарения можно объяснить с точки зрения MKT: молекулы, находящиеся на поверхности, удерживаются силами притяжения со стороны других молекул вещества. Молекула может вылететь за пределы жидкости лишь тогда, когда ее кинетическая энергия превышает значение той работы, которую необходимо совершить, чтобы преодолеть силы молекулярного притяжения (работа выхода). Поэтому покинуть вещество могут только быстрые молекулы. В результате средняя кинетическая энергия оставшихся молекул уменьшается, а температура жидкости понижается.
Для поддержания температуры испаряющейся жидкости неизменной к ней необходимо подводить некоторое количество теплоты.
Количество теплоты Q, необходимое для превращения жидкости в пар при постоянной температуре, называется теплотой парообразования.
Экспериментально установлено, что Q = Lm, где m — масса испарившейся жидкости, L — удельная теплота парообразования.
Удельная тепло га парообразования — величина, численно равная количеству теплоты, необходимому для превращения в пар жидкости единичной массы при неизменной температуре.
Удельная теплота парообразования L зависит от рода жидкости и внешних условий. При увеличении температуры она уменьшается (рис. 1). Это объясняется тем, что все жидкости при нагревании расширяются. Расстояния между молекулами при этом увеличиваются и силы молекулярного взаимодействия уменьшаются. Кроме того, чем больше температура, тем больше средняя кинетическая энергия движения молекул и тем меньше энергии им нужно добавить, чтобы они могли вылететь за пределы поверхности жидкости.
Молекулы пара хаотически движутся. Поэтому скорости некоторых из них будут направлены в сторону жидкости. Достигнув поверхности, они втягиваются в нее силами притяжения со стороны молекул, находящихся на поверхности жидкости, и снова становятся молекулами жидкости. Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией.
Число возвратившихся в жидкость за определенный промежуток времени молекул тем больше, чем больше концентрация молекул пара, а следовательно, чем больше давление пара над жидкостью. Конденсация пара сопровождается нагреванием жидкости. При конденсации выделяется такое же количество теплоты, которое было затрачено при испарении.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 197-198.
Испарение и конденсация. Кипение жидкости
1. Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарения и кипения.
Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре.
С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар.
Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается.
Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях.
Скорость испарения зависит от температуры жидкости. Иапример, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С.
Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости.
2. Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё.
Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным.
Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся.
3. В воздухе всегда содержится водяной пар, являющийся продуктом испарения воды. Содержание водяного пара в воздухе характеризует его влажность.
Абсолютной влажностью воздуха \( (\rho) \) называют массу водяного пара, содержащегося в 1 м 3 воздуха, или плотность водяного пара, содержащегося в воздухе.
Если относительная влажность равна 9,41·10 -3 кг/м 3 , то это означает, что в 1 м 3 содержится 9,41·10 -3 кг водяного пара.
Для того чтобы судить о степени влажности воздуха, вводят величину, называемую относительной влажностью.
Относительной влажностью воздуха \( (\varphi) \) называют величину, равную отношению плотности водяного пара \( (\rho) \) , содержащегося в воздухе (абсолютной влажности), к плотности насыщенного водяного пара \( (\rho_0) \) при этой температуре:
Обычно относительную влажность выражают в процентах.
При понижении температуры ненасыщенный нар может превратиться в насыщенный. Примером такого превращения является выпадение росы и образование тумана. Так, летним днём при температуре 30 °С плотность водяного пара равна 12,8·10 -3 кг/м 3 . Этот водяной пар является ненасыщенным. При понижении вечером температуры до 15 °С он уже будет насыщенным, и выпадет роса.
Температуру, при которой водяной пар, содержащийся в воздухе, становится насыщенным, называют точкой росы.
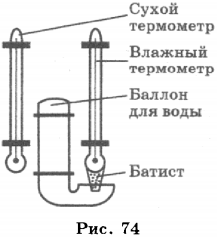
Для измерения влажности воздуха используют прибор, называемый психрометром.
Психрометр состоит из двух термометров, один из которых сухой, а другой — влажный (рис. 74). Термометры прикреплены к таблице, в которой по вертикали указана температура, которую показывает сухой термометр, а по горизонтали — разность показаний сухого и влажного термометров. Определив показания термометров, по таблице находят значение относительной влажности воздуха.
Например, температура, которую показывает сухой термометр, 20 °С, показание влажного термометра — 15 °С. Разность показаний 5 °С. По таблице находим значение относительной влажности \( \varphi \) = 59%.
4. Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
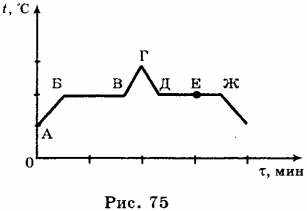
На рисунке 75 приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АБ), кипения (БВ), нагревания пара (ВГ), охлаждения пара (ГД), конденсации (ДЕ) и последующего охлаждения (ЕЖ).
5. Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельной теплотой парообразования \( (L) \) называют величину, равную отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — \( [L] \) = Дж/кг.
Чтобы рассчитать количество теплоты \( Q \) , которое необходимо сообщить веществу массой \( m \) для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования \( (L) \) умножить на массу вещества: \( Q=Lm \) .
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
ПРИМЕРЫ ЗАДАНИЙ
1. Испарение и кипение — два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они
А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное
Б. Происходят при определённой температуре
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Испарение и кипение — два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что
А. Кипение происходит при определённой температуре, а испарение — при любой температуре.
Б. Испарение происходит с поверхности жидкости, а кипение — во всём объёме жидкости.
Правильным(-и) является(-ются) утверждение(-я)
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
3. При нагревании вода превращается в пар той же температуры. При этом
1) увеличивается среднее расстояние между молекулами
2) уменьшается средний модуль скорости движения молекул
3) увеличивается средний модуль скорости движения молекул
4) уменьшается среднее расстояние между молекулами
4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара?
1) изменилась как потенциальная, так и кинетическая энергия молекул пара
2) изменилась только потенциальная энергия молекул пара
3) изменилась только кинетическая энергия молекул пара
4) внутренняя энергия молекул пара не изменилась
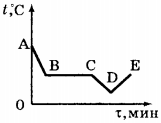
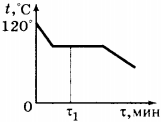
5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды?
1) АВ
2) ВС
3) CD
4) DE
6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени \( \tau_1 \) ?
1) только в газообразном
2) только в жидком
3) часть воды в жидком состоянии, часть — в газообразном
4) часть воды в жидком состоянии, часть — в кристаллическом
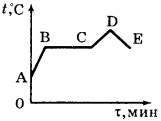
7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта?
1) АВ
2) ВС
3) CD
4) DE
8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения?
1) 240 Дж
2) 90 кДж
3) 230 кДж
4) 4500 кДж
9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см 3 . Во вторник она увеличилась и стала равной 15,4 г/см 3 . Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см 3 ?
1) не выпала ни в понедельник, ни во вторник
2) выпала и в понедельник, и во вторник
3) в понедельник выпала, во вторник не выпала
4) в понедельник не выпала, во вторник выпала
10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10 -3 кг/м 3 , а плотность насыщенного пара при этой температуре 30·10 -3 кг/м 3 ?
11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ПОНЯТИЯ
A) физическая величина
Б) единица физической величины
B) прибор для измерения физической величины
ПРИМЕРЫ
1) кристаллизация
2) джоуль
3) кипение
4) температура
5) мензурка
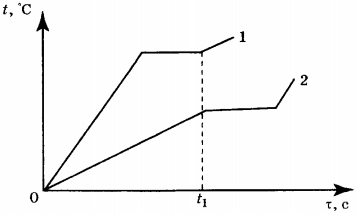
12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера.
1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2
2) Удельная теплоёмкость вещества 1 больше, чем вещества 2
3) Удельная теплота парообразования вещества 1 больше, чем вещества 2
4) Температура кипения вещества 1 выше, чем вещества 2
5) В течение промежутка времени \( 0-t_1 \) оба вещества находились в жидком состоянии
13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
Как понимать испарение с молекулярно кинетической точки зрения
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом . Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры . Например, для воды критическая температура равна , для азота , для кислорода . При комнатной температуре () вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия , когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной . Пар, находящийся в равновесии со своей жидкостью, называют насыщенным .
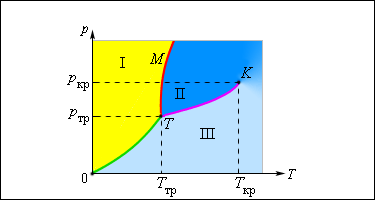
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара данного вещества зависит только от его температуры и не зависит от объема . Поэтому изотермы реальных газов на плоскости () содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
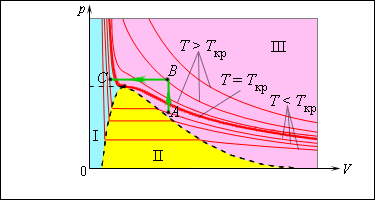 | |||||||||||||||||
| Рисунок 3.4.1. При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре для данного вещества, плотности пара и жидкости становятся одинаковыми. При исчезают физические различия между жидкостью и ее насыщенным паром. Если изотермически сжимать ненасыщенный пар при , то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости. Из газообразного состояния в жидкое можно перейти, минуя двухфазную область. Для этого нужно совершить процесс в обход критической точки . Один из возможных процессов такого рода показан на рис. 3.4.1 ломаной линией . В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении , которое, как правило, меньше давления насыщенного пара . Отношение , выраженное в процентах, называется относительной влажностью воздуха.
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически ), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры давление насыщенного пара определяется по кривой равновесия для данного вещества. Давление насыщенного пара очень быстро возрастает с ростом температуры . Зависимость нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул. Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением . Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению . В частности, при нормальном атмосферном давлении вода кипит при температуре . Это значит, что при такой температуре давление насыщенных паров воды равно . При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на на каждые 300 метров высоты). На высоте давление составляет примерно , и температура кипения понижается до . В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия можно определять температуру кипения жидкости при различных давлениях. Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия . Примером может служить кривая равновесия насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе () кривые равновесия называются фазовой диаграммой .
|
- http://www.physbook.ru/index.php/%D0%A2._%D0%98%D1%81%D0%BF%D0%B0%D1%80%D0%B5%D0%BD%D0%B8%D0%B5
- http://fizi4ka.ru/ogje-2018-po-fizike/isparenie-i-kondensacija-kipenie-zhidkosti.html
- http://physics.ru/courses/op25part1/content/chapter3/section/paragraph4/theory.html
- http://studopedia.ru/8_97003_bilet--.html
- http://bourabai.kz/physics/phases.html
- http://koledj.ru/docs/index-6711.html
- http://studfiles.net/preview/5558367/

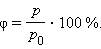
 | 6713 —
| 6713 —  или читать все.
или читать все.  , где k являетсяпостоянной Больцмана(отношениеуниверсальной газовой постоянной R кчислу АвогадроNA), i — число степеней свободы молекул (
, где k являетсяпостоянной Больцмана(отношениеуниверсальной газовой постоянной R кчислу АвогадроNA), i — число степеней свободы молекул (  в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T — абсолютная температура.
в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T — абсолютная температура. которых превышает потенциальную энергию их связи с остальными частицами вещества. Скорость испарения зависит от:
которых превышает потенциальную энергию их связи с остальными частицами вещества. Скорость испарения зависит от: в соответствующем измерении при увеличении его температуры на
в соответствующем измерении при увеличении его температуры на  расширяется на величину
расширяется на величину  , равную:
, равную: ,
, — так называемый коэффициент линейного теплового расширения. Аналогичные формулы имеются для расчета изменения площади и объема тела. В приведенном простейшем случае, когда коэффициент теплового расширения не зависит ни от температуры, ни от направления расширения, вещество будет равномерно расширяться по всем направлениям в строгом соответствии с вышеприведенной формулой.
— так называемый коэффициент линейного теплового расширения. Аналогичные формулы имеются для расчета изменения площади и объема тела. В приведенном простейшем случае, когда коэффициент теплового расширения не зависит ни от температуры, ни от направления расширения, вещество будет равномерно расширяться по всем направлениям в строгом соответствии с вышеприведенной формулой.
 — относительное изменение линейного размера тела при нагревании его на dT градусов при постоянном давлении.
— относительное изменение линейного размера тела при нагревании его на dT градусов при постоянном давлении. Мы видели, что a— величина весьма малая. Так как, кроме того, мы рассматриваем только небольшие изменения температуры, то члены 3a2t и a3t2 малы по сравнению с 3a (например, при a=2,0•10-5 К-1 и t=100 К член 3a2t в 500 раз меньше 3a, a член a3t2 в 750 000 раз меньше 3a). Поэтому мы можем пренебречь членами 3a2t и a3t2 по сравнению с 3a и считать, что b=3a. Итак, коэффициент объемного расширения равен утроенному коэффициенту линейного расширения. Например, для железа он равен 3,6•10-5 К-1.
Мы видели, что a— величина весьма малая. Так как, кроме того, мы рассматриваем только небольшие изменения температуры, то члены 3a2t и a3t2 малы по сравнению с 3a (например, при a=2,0•10-5 К-1 и t=100 К член 3a2t в 500 раз меньше 3a, a член a3t2 в 750 000 раз меньше 3a). Поэтому мы можем пренебречь членами 3a2t и a3t2 по сравнению с 3a и считать, что b=3a. Итак, коэффициент объемного расширения равен утроенному коэффициенту линейного расширения. Например, для железа он равен 3,6•10-5 К-1. ).В состоянии термодинамич. равновесия П. с. не зависят от времени и пространств. координат. В неравновесном состоянии П. с. могут зависеть от координат и времени.
).В состоянии термодинамич. равновесия П. с. не зависят от времени и пространств. координат. В неравновесном состоянии П. с. могут зависеть от координат и времени.
 — давление газа;
— давление газа;  — объём газа.
— объём газа.


 — объём газа,
— объём газа,  — температура.
— температура.
 .
.




 ,
, — давление,
— давление, — молярный объём,
— молярный объём, — универсальная газовая постоянная
— универсальная газовая постоянная — абсолютная температура,К.
— абсолютная температура,К. , где
, где  — количество вещества, а
— количество вещества, а  , где
, где  — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
 , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
 прямо пропорциональна
прямо пропорциональна  , коэффициент пропорциональности
, коэффициент пропорциональности  он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной. U=U1 +U2 , где
U=U1 +U2 , где Q=
Q= U+A
U+A U=
U= Q+A
Q+A Q=0.
Q=0. U
U
 Q1 , полученному от нагревателя:
Q1 , полученному от нагревателя:



 — закон Гука.Сила упругости прямо пропорциональна абсолютной деформации.
— закон Гука.Сила упругости прямо пропорциональна абсолютной деформации.
 .
.
 — направлена всегда перпендикулярно поверхности.
— направлена всегда перпендикулярно поверхности.
 . За единицу механического напряжения в СИ принята единица паскаль (Па): 1 Па= 1Н/м 2 .
. За единицу механического напряжения в СИ принята единица паскаль (Па): 1 Па= 1Н/м 2 . .
. — на самом деле нереально).
— на самом деле нереально). ,
,