Из рассмотренного примера сосуда с газом вполне ясно, что наибольшей вероятностью обладает группа таких состояний, у которых молекулы размещены «равномерно». Всякое отклонение от «равномерности» — смещение однрй части молекул в левую
сторону сосуда, расположение слева более быстрых молекул, направленное движение большей части молекул, короче — любое отклонение от беспорядочности в распределении молекул по местам и скоростям, — влечет за собой уменьшение вероятности состояния. Это замечание позволит нам понять молекулярно-кинетический смысл необратимости реальных процессов.
Как было установлено выше, второе начало термодинамики для необратимых процессов, т. е. закон возрастания энтропии в теплоизолированных системах, представляет собой обобщение опытного факта о невозможности ряда процессов. Так, тепло не может без компенсации переходить от холодного тела к нагретому, тело не может приобрести кинетическую энергию только за счет убыли внутренней энергии окружающей среды, газ может самопроизвольно расшириться, но не сжаться.
Существование необратимых процессов является особенностью молекулярных явлений. В чисто механическом явлении, т. е. процессе без трения, процесс всегда можно повернуть вспять. Маятник при движении вправо проходит в обратном порядке все те состояния, которые проходились при движении влево; биллиардный шар, отскочивший от борта в каком-либо направлении, если на пути его поставить упругую стенку, отскочит от нее и повторит в обратном порядке весь путь, который был пройден «туда». Полная равноценность «туда» и «обратно» очевидна для чисто механических процессов. Почему же свойства обратимости нет у молекулярных процессов, которые мы рассматриваем как совокупность механических движений молекул? Причина лишь одна. Во всех необратимых процессах вероятность состояния возрастает. Обратимый процесс является процессом мыслимым: его осуществление в принципе возможно, однако при наблюдении в те времена, которыми располагает человек, такой процесс практически невероятен.
Это нетрудно показать для любого из необратимых процессов. Тепло переходит от тела нагретого к холодному, но не наоборот. В случае газообразных тел такой процесс можно наглядно представить как перемешивание быстрых молекул с медленными. Обратный процесс не может происходить по закону случая, так как он представлял бы собой сортировку быстрых и медленных молекул, т. е. переход к более упорядоченному состоянию.
По той же причине мы довольно быстро перемешаем лопатой два мешка с разным зерном. Однако можно продолжать перемешивать содержимое этих двух мешков веками, но зерна не разделятся так, чтобы сверху оказались частицы одного сорта, а снизу другого. А ведь число зерен в мешках неизмеримо меньше числа молекул в кубическом миллиметре вещества.
Нетрудно понять также полную невероятность явления, обратного самопроизвольному расширению газа. Если в ящике с перегородкой, который мы только что рассматривали, слева газ, а справа вакуум, то через малое время обе части ящика равномерно заполнятся газом. В принципе может случиться, что молекулы соберутся
обратно все вместе в левой части ящика. Однако вероятность такого события будет крайне мала. Величина ее подсчитана нами, это
Какой бы необратимый процесс мы ни захотели подвергнуть рассмотрению, результат будет всюду одинаков: каждый необратимый процесс связан с возрастанием вероятности состояния.
Итак, имеются две величины, которые возрастают при необратимых процессах: это энтропия 5, с которой мы познакомились ранее, и термодинамическая вероятность состояния которая обсуждалась только что. Представляется естественным, что эти две физические величины должны быть связаны. Наличие такой связи было показано Больцманом. Формула, которая была им указана, имеет вид Энтропия пропорциональна логарифму термодинамической вероятности состояния.
Таким образом, второе начало термодинамики приобретает еще одну формулировку: в обратимых процессах вероятность состояния не изменяется, в необратимых процессах (речь идет о замкнутых системах) вероятность состояния возрастает.
Для простоты ограничимся рассмотрением твердых тел, имеющих кристаллическое строение. Для остальных тел (аморфные и жидкости) молекулярная картина теплового расширения в общих чертах та же. Взаимодействие между частицами, расположенными в узлах кристаллической решетки (ионы, атомы или молекулы), имеет более сложный характер, чем взаимодействие между точечными зарядами. Если на больших расстояниях ионы (например, разноименные) притягиваются, то на достаточно малых расстояниях силы притяжения сменяются быстро растущими силами отталкивания, т.к. при большом сближении электронных оболочек начинают сказываться силы отталкивания между ними.
Зависимость потенциальной энергии взаимодействия U(r) двух соседних частиц от расстояния r между ними позволяет объяснить причину теплового расширения. Для этого достаточно знать лишь приближенный вид потенциальной кривой U(r), которая представлена на рис. 14. Кривая быстро
возрастает от минимального значения в точке r при уменьшении r и сравнительно медленно растет при увеличении r
Из курса механики известно, что сила взаимодействия между частицами F(r) может быть найдена по формуле:
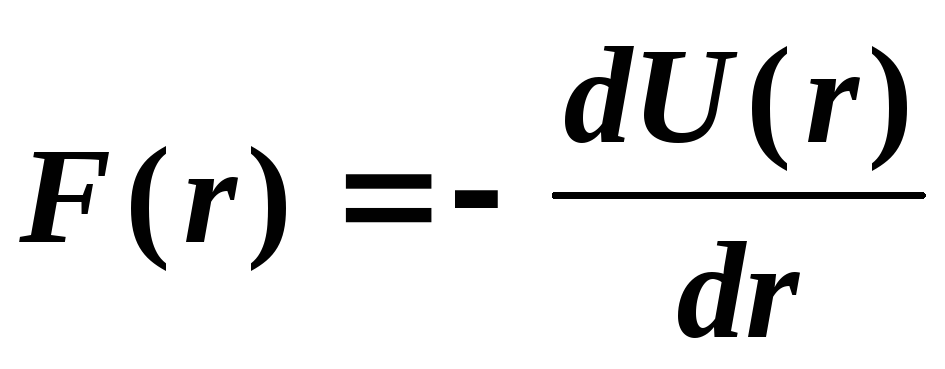
Если сила F(r) положительна, то частицы отталкиваются, если отрицательна, то они притягиваются. Из рис. 14 и формулы (5) нетрудно выяснить, что силы притяжения, действующие на участке r > r сменяются при r r. Изменяется именно среднее расстояние между частицами, а не положение равновесия, которое остается по прежнему в точке r. Увеличение среднего расстояния между частицами обусловливает и увеличение размеров всего тела.
Дальнейшее нагревание приводит к увеличению полной энергии до некоторого значения W2 , при этом колебания совершаются с большей амплитудой около нового среднего положения r2 > r1 и т.д. Грубо говоря, с ростом амплитуды колебаний частицы все сильнее «отталкиваются» друг от друга. Итак, мы видим, что при нагревании тела среднее расстояние между частицами увеличивается, поэтому увеличивается и размер тела.
Если знать форму потенциальной кривой, то можно вычислить коэффициент линейного расширения. Расчеты такого рода дают хорошее согласие с опытом.
Экспериментальная установка состоит из термостата ТС-24 и двух трубок из твердых тел. Через эти трубки протекает вода, нагреваемая термостатом. Скорость протекания воды по трубкам настолько велика, что температуру во всех точках трубок можно считать одинаковой и равной температуре воды в термостате, которая измеряется контрольным термометром. Удлинение трубок l измеряется индикатором, ножка которого упирается в пластину, припаянную к трубке, другой конец трубки фиксируется зажимным винтом. Рабочим участком трубки l считается расстояние от центра винта (зажимного) до той грани пластины, которая соприкасается с ножкой индикатора. Это расстояние измеряется линейкой.
Как объясняется с молекулярной точки зрения
Опубликовано 09.06.2017 по предмету Физика от Гость >>
Ответ оставил Гость
3) расстояние между молекулами уменьшается, а силы притяжения увеличиваются,
Если ответа нет или он оказался неправильным по предмету Физика, то попробуй воспользоваться поиском на сайте или задать вопрос самостоятельно.
Если же проблемы возникают регулярно, то возможно Вам стоит обратиться за помощью. Мы нашли великолепную онлайн школу, которую без всяких сомнений можем порекомендовать. Там собраны лучшие преподаватели, которые обучили множество учеников. После обучения в этой школе, Вы сможете решать даже самые сложные задачи.
Как объясняется с молекулярной точки зрения
Из рассмотренного примера сосуда с газом вполне ясно, что наибольшей вероятностью обладает группа таких состояний, у которых молекулы размещены «равномерно». Всякое отклонение от «равномерности» — смещение однрй части молекул в левую
сторону сосуда, расположение слева более быстрых молекул, направленное движение большей части молекул, короче — любое отклонение от беспорядочности в распределении молекул по местам и скоростям, — влечет за собой уменьшение вероятности состояния. Это замечание позволит нам понять молекулярно-кинетический смысл необратимости реальных процессов.
Как было установлено выше, второе начало термодинамики для необратимых процессов, т. е. закон возрастания энтропии в теплоизолированных системах, представляет собой обобщение опытного факта о невозможности ряда процессов. Так, тепло не может без компенсации переходить от холодного тела к нагретому, тело не может приобрести кинетическую энергию только за счет убыли внутренней энергии окружающей среды, газ может самопроизвольно расшириться, но не сжаться.
Существование необратимых процессов является особенностью молекулярных явлений. В чисто механическом явлении, т. е. процессе без трения, процесс всегда можно повернуть вспять. Маятник при движении вправо проходит в обратном порядке все те состояния, которые проходились при движении влево; биллиардный шар, отскочивший от борта в каком-либо направлении, если на пути его поставить упругую стенку, отскочит от нее и повторит в обратном порядке весь путь, который был пройден «туда». Полная равноценность «туда» и «обратно» очевидна для чисто механических процессов. Почему же свойства обратимости нет у молекулярных процессов, которые мы рассматриваем как совокупность механических движений молекул? Причина лишь одна. Во всех необратимых процессах вероятность состояния возрастает. Обратимый процесс является процессом мыслимым: его осуществление в принципе возможно, однако при наблюдении в те времена, которыми располагает человек, такой процесс практически невероятен.
Это нетрудно показать для любого из необратимых процессов. Тепло переходит от тела нагретого к холодному, но не наоборот. В случае газообразных тел такой процесс можно наглядно представить как перемешивание быстрых молекул с медленными. Обратный процесс не может происходить по закону случая, так как он представлял бы собой сортировку быстрых и медленных молекул, т. е. переход к более упорядоченному состоянию.
По той же причине мы довольно быстро перемешаем лопатой два мешка с разным зерном. Однако можно продолжать перемешивать содержимое этих двух мешков веками, но зерна не разделятся так, чтобы сверху оказались частицы одного сорта, а снизу другого. А ведь число зерен в мешках неизмеримо меньше числа молекул в кубическом миллиметре вещества.
Нетрудно понять также полную невероятность явления, обратного самопроизвольному расширению газа. Если в ящике с перегородкой, который мы только что рассматривали, слева газ, а справа вакуум, то через малое время обе части ящика равномерно заполнятся газом. В принципе может случиться, что молекулы соберутся
обратно все вместе в левой части ящика. Однако вероятность такого события будет крайне мала. Величина ее подсчитана нами, это
Какой бы необратимый процесс мы ни захотели подвергнуть рассмотрению, результат будет всюду одинаков: каждый необратимый процесс связан с возрастанием вероятности состояния.
Итак, имеются две величины, которые возрастают при необратимых процессах: это энтропия 5, с которой мы познакомились ранее, и термодинамическая вероятность состояния которая обсуждалась только что. Представляется естественным, что эти две физические величины должны быть связаны. Наличие такой связи было показано Больцманом. Формула, которая была им указана, имеет вид Энтропия пропорциональна логарифму термодинамической вероятности состояния.
Таким образом, второе начало термодинамики приобретает еще одну формулировку: в обратимых процессах вероятность состояния не изменяется, в необратимых процессах (речь идет о замкнутых системах) вероятность состояния возрастает.
Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории
Характеристика тепловых явлений в молекулярной физике. Рассмотрение основных положений молекулярно-кинетической теории. Основной порядок взаимодействия молекул. Изучение строения газообразных, жидких и твердых тел. Описание Броуновского движения.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 16.01.2015 |
| Размер файла | 358,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
ГБОУ НПО АО «Профессиональное училище № 1»
РЕФЕРАТ НА ТЕМУ:
«Свойства газа, жидких и твердых тел с точки зрения молекулярно-кинетической теории»
Выполнил: Акишин Дмитрий Андреевич
Проверил: Жубрева Лидия Николаевна
1. Тепловые явления в молекулярной физике
2. Основные положения молекулярно-кинетической теории
3. Взаимодействие молекул
4. Строение газообразных, жидких и твердых тел
5. Броуновское движение
1. Тепловые явления в молекулярной физике
тепловой броуновский кинетический твердый
Тепловые явления привлекали внимание людей с древних времён. Умение добывать и поддерживать огонь сделало человека относительно независимым от колебаний температуры окружающей среды. Это было одним из величайших изобретений человечества. Изменение температуры оказывает влияние на все свойства тел. Кроме механических свойств, при изменении температуры меняются и другие свойства тел, например сопротивление электрическому току, магнитные свойства и др. Так, если сильно нагреть постоянный магнит, то он перестанет притягивать железные предметы. Все перечисленные выше и многие другие тепловые явления подчиняются определённым законам. Открытие законов тепловых явлений позволяет с максимальной пользой применять эти явления на практике и в технике. Молекулярно-кинетическая теория. Ещё философы древности догадывались о том, что теплота — это вид внутреннего движения. Но только в ХVIII в. Начала развиваться последовательная молекулярно — кинетическая теория. Цель молекулярно-кинетической теории — объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, беспорядочно движущихся частиц. Большой вклад в развитие молекулярно-кинетической теории был сделан М.В. Ломоносовым. Он рассматривал теплоту как вращательное движение частиц, составляющих тела.
2. Основные положения молекулярно-кинетической теории
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Каждое утверждение строго доказано с помощью опытов. Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или ещё более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в реальности молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды. Масло никогда не займёт всю поверхность, если сосуд велик. Нельзя заставить капельку объёмом 1 мм(в кубе) расплыться так, чтобы она заняла площадь поверхности более 0,6 м(в квадрате). Объём V слоя масла равен произведению его площади поверхности S на толщину d слоя, т.е V=Sd. Следовательно, размер молекулы оливкового масла равен: d = ? 1,7 Ч см.
При очень малых размерах молекул число их в любом макроскопическом теле огромно. Подсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно, объёмом 1.
Диаметр молекулы воды равен примерно 3 Ч . Считая, что каждая молекула воды при плотной упаковке молекул занимает объём капли (1 на объём, приходящийся на одну молекулу:
Размеры атома надо запомнить: D ?см ? м.
3. Взаимодействие молекул
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел. Молекула- это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются. Силы между электрически нейтральными молекулами являются короткодействующими.
На расстояниях, превышающих 2-3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила притяжения сначала увеличиваются, а затем начинает убывать и убывает до нуля, когда расстояние между двумя молекулами становится равным сумме радиусов молекул.
При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и между молекулами возникают быстро нарастающие силы отталкивания.
4. Строение газообразных, жидких и твердых тел
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Газы легко сжимаются, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга.
Молекулы с огромными скоростями — сотни метров в секунду -движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения, сталкиваясь с соседними молекулами. Лишь время от времени она совершает очередной «прыжок», попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т.е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время же одного колебания значительно меньше (10-12-10-13 с). С повышением температуры время оседлой жизни молекул уменьшается. Характер молекулярного движения в жидкостях, впервые установленный советским физиком Я.И. Френкелем, позволяет понять основные свойства жидкостей. Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей. Как известно, жидкости текучи, т. е. не сохраняют своей формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (рис.8.8). Вот почему жидкость течет и принимает форму сосуда.
Атомы или молекулы твёрдых тел колеблются около определённых положений равновесия, поэтому твёрдые тела сохраняют не только объём ,но и форму
Если соединить центр равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристалической
Кристаллы — это твёрдые тела, атомы или молекулы которых занимают определённое, порядочное положение в пространстве. Поэтому кристаллы имеют плоские грани. Например крупинка обычной поваренной соли имеет плоские грани, составляющие друг с другом прямые углы.
Правильная внешняя форма не единственное и даже не самое главное следствие упорядоченного строения кристалла. Главное- это зависимость физических свойств от выбранного в кристалле направления. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл кварца по-разному преломляет свет в зависимости от направления падающих на него лучей. Зависимость физических свойств от направления внутри кристалла называют анизотропией. Все кристаллические тела анизотропны.
Монокристаллы и поликристаллы.
Кристаллическую структуру имеют металлы. Если взять большой кусок металла, то на первый взгляд его кристаллическое строении никак не проявляется ни во внешнем виде куска, ни в его физических свойствах
Обычно металл состоит из огромного количества сросшихся друг с другом маленьких кристалликов. Свойства каждого кристаллика зависят от направления, но кристаллики ориентированы по отношению к друг другу беспорядочно. В результате в объеме, значительно превышающем объем отдельных кристалликов, все направления внутри металлов равноправны и свойства металлов одинаковы по всем направлениям.
Твердое тело, состоящее из большого числа маленьких кристалликов, называют поликристаллическим. Одиночные кристаллы называют монокристаллами.
5. Броуновское движение
Броуновское движение- это тепловое движение взвешенных в жидкости( или газе) частиц.
Наблюдения броуновского движения. Английский ботаник Р.Броун (1773-1858) впервые наблюдал это явление 1827 г. Рассматривая в микроскоп взвешенные в воде споры плауна. Позже он рассматривал и другие мельчайшие частицы, в том числе частички камня египетских пирамид. Сейчас для наблюдения броуновского движения используют частички краски гуммируют, которая нерастворима в воде. Эти частички совершают беспорядочное движение. Броуновское движение — тепловое движение, и оно не может прекратиться. С увеличением температуры интенсивность его растёт. Положения частиц, отмеченные точками, определены через равные промежутки времени — 30 с. Броуновское движение можно наблюдать и в газе. Его совершают взвешенные в воздухе частицы пыли или дыма.
Газы — агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек.
Жидкость — агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д.
Твёрдое тело — одно из четырёх агрегатных состояний вещества, отличающееся от др. агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует
1. Физика 10 класс Г. Я Мякишев М. «Просвещение» 2007.
2. Арцимович Л. А., Элементарная физика плазмы, 3 изд., М., 2002;
3. Франк-Каменецкий Д. А., Лекции по физике состояний вещества, М., 2003 (переиздание);
4. Френкель Я. И., Собрание избранных трудов, т. 3, М., 2001;
5. Фишер И.3., Статистическая теория жидкостей, М., 2003;
6. Физика простых жидкостей. Экспериментальные исследования, пер. с англ., М., 2002
Размещено на Allbest.ru
Подобные документы
Основные положения атомно-молекулярного учения. Закономерности броуновского движения. Вещества атомного строения. Основные сведения о строении атома. Тепловое движение молекул. Взаимодействие атомов и молекул. Измерение скорости движения молекул газа.
презентация [226,2 K], добавлен 18.11.2013
Анализ теорий, устанавливающих связи между измеряемыми на опыте величинами и свойствами молекул. Идеальный газ как газ, взаимодействие между молекулами которого пренебрежимо мало. Причины возникновения давления газа в молекулярно-кинетической теории.
презентация [151,4 K], добавлен 08.01.2015
Определения молекулярной физики и термодинамики. Понятие давления, основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Уравнение состояния идеального газа (Менделеева — Клапейрона).
презентация [972,4 K], добавлен 06.12.2013
Основные понятия и определения молекулярной физики и термодинамики. Основное уравнение молекулярно-кинетической теории. Температура и средняя кинетическая энергия теплового движения молекул. Состояние идеального газа (уравнение Менделеева-Клапейрона).
презентация [1,1 M], добавлен 13.02.2016
Вычисление скорости молекул. Различия в скоростях молекул газа и жидкости. Экспериментальное определение скоростей молекул. Практические доказательства состоятельности молекулярно-кинетической теории строения вещества. Модуль скорости вращения.
презентация [336,7 K], добавлен 18.05.2011
Содержание молекулярно-кинетической теории газов. Химический состав жидкости. Особенности межмолекулярного взаимодействия в данном агрегатном состоянии. Механические и тепловые свойства твердых тел. Практическое применение плазмы — ионизованного газа.
контрольная работа [26,0 K], добавлен 27.10.2010
Характеристика законов Бойля-Мариотта, Бойля-Мариотта, Авогадро. Парциальное давление как давление, которое оказывал бы каждый газ смеси, если бы он один занимал объем, равный объему смеси. Знакомство с положениями молекулярно-кинетической теории газа.
презентация [625,5 K], добавлен 06.12.2016
Изучение корпускулярной концепции описания природы, сущность которой в том, что все вещества состоят из молекул — минимальных частиц вещества, сохраняющих его химические свойства. Анализ молекулярно-кинетической теории газа. Законы для идеальных газов.
контрольная работа [112,2 K], добавлен 19.10.2010
Особенности определения давления газа на стенку сосуда с использованием второго закона Ньютона. Связь этой величины со средней кинетической энергией молекул и их концентрацией. Специфика схематичного вывода основного уравнения упрощенным методом.
презентация [316,6 K], добавлен 19.12.2013
Молекулярная физика как раздел физики, в котором изучаются свойства вещества на основе молекулярно-кинетических представлений. Знакомство с основными особенностями равновесной термодинамики. Общая характеристика молекулярно-кинетической теории газов.
курсовая работа [971,8 K], добавлен 01.11.2013
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
- Существуют вещества с молекулярным и немолекулярным строением.
- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
- Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
- Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
- Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
- Атомы одного вида отличаются от атомов другого вида массой и свойствами.
- При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
- У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
- У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Дайте ответы на следующие вопросы:
- Назовите имя древнегреческого философа, который высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов.
- Назовите имя великого русского учёного, основоположника учения о молекулах и атомах.
- Дайте определение молекуле.
- Дайте определение атому.
- Какие вещества относят к веществам молекулярного строения? Приведите примеры веществ.
- Какие вещества относят к веществам немолекулярного строения? Приведите примеры веществ.
- Какими свойствами характеризуются веществамолекулярного строения?
- Какими свойствами характеризуются веществанемолекулярного строения?
- Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
Как объяснить с молекулярной точки зрения процесс конденсации водяного пара?
1) расстояние между молекулами и силы притяжения увеличиваются, 2) расстояние между молекулами и силы притяжения уменьшаются,
3) расстояние между молекулами уменьшается, а силы притяжения увеличиваются,
4) расстояние между молекулами увеличивается, а силы притяжения уменьшаются.
3) расстояние между молекулами уменьшается, а силы притяжения увеличиваются,
Расстояние между молекулами уменьшается, а силы притяжения увеличиваются.
Если ответ по предмету Физика отсутствует или он оказался неправильным, то попробуй воспользоваться поиском других ответов во всей базе сайта.
Плавление и отвердевание на основе учения о молекулярном строении вещества
Плавление и отвердевание кристаллических тел можно объяснить, на основании атомно-молекулярной теории строения вещества.
Мы знаем, что в кристаллах молекулы (или атомы) расположены в строгом порядке. Этим объясняется, что все кристаллы одного и того же вещества имеют определенную форму. Однако и в кристаллах молекулы или атомы находятся в движении. Но в отличие, например, от газов, где частицы движутся независимо друг от друга, в твердом теле каждая из частиц влияет на движение других.
От скорости движения молекул, как мы знаем, зависит температура тела. При нагревании тела средняя скорость движения молекул возрастает, — следовательно, возрастает и средняя кинетическая энергия их. Вследствие этого размах колебаний молекул (или атомов) увеличивается, при этом силы, связывающие их, уменьшаются. Когда тело нагреется до температуры плавления, размах колебаний настолько увеличится, что нарушится порядок в расположении частиц в кристаллах. Кристаллы теряют свою форму: вещество плавится, переходя из твердого состояния в жидкое.
При отвердевании вещества все происходит в обратном порядке: средняя кинетическая энергия и скорость молекул в охлажденном расплавленном веществе уменьшаются. Силы притяжения могут снова удержать такие медленно движущиеся молекулы друг около друга. Вследствие этого расположение частиц делается снова упорядоченным.
Кристаллизация облегчается, если в жидкости с самого начала присутствуют какие-нибудь посторонние частицы, например пылинки. Они становятся центрами кристаллизации. В обычных условиях в жидкости имеется множество центров кристаллизации, около которых и происходит образование кристалликов.
Вопросы. 1. Как объяснить процесс плавления и отвердевания вещества на основе я учения о молекулярном строении вещества? 2. При каком условии начинается кристаллизация вещества?
Поверхностное натяжение
Молекулы жидкости располагаются очень близко друг к другу, поэтому силы притяжения достигают значительной величины. Каждая молекула испытывает притяжение со стороны соседних с ней молекул.
Если молекула находится внутри жидкости (рис. 16), то равнодействующая сил, действующих на нее, равна нулю. Иначе обстоит дело, если молекула находится в поверхностном слое жидкости. Плотность пара (или газа), с которым граничит жидкость, во много раз меньше плотности жидкости, поэтому равнодействующая сил, действующих со стороны молекул пара, тоже будет намного меньше, чем равнодействующая сил, действующих со стороны молекул жидкости. В результате, на каждую молекулу, находящуюся в приповерхностном слое будет действовать сила, направленная внутрь жидкости.
Рис. 16. Возникновение сил поверхностного натяжения
При переходе молекулы из глубины жидкости в поверхностный слой над молекулой совершается действующими на нее в этом слое силами отрицательная работа. При этом кинетическая энергия молекулы уменьшается, превращаясь в потенциальную. Таким образом, молекулы в поверхностном слое обладают дополнительной потенциальной энергией. Поверхностный слой в целом обладает дополнительной энергией, которая входит составной частью во внутреннюю энергию жидкости.
Наличие этой дополнительной энергии приводит к тому, что жидкость стремится сократить свою поверхность. Жидкость ведет себя так, как если бы она была заключена в упругую растянутую пленку, стремящуюся сжаться. На самом деле никакой пленки нет, поверхностный слой состоит из тех же молекул, что и вся жидкость.
Выделим мысленно на поверхности жидкости участок, ограниченный замкнутым контуром длиной l. Стремление этого участка к сокращению приводит тому, что он будет действовать на остальную часть поверхности с касательными к поверхности силами. Эти силы называются силами поверхностного натяжения. Для количественной оценки силы поверхностного вводят величину, которую называют коэффициентом поверхностного натяжения (или поверхностным натяжением).
Коэффициент поверхностного натяжения (α) – скалярная физическая величина, равная отношению модуля силы поверхностного натяжения F, действующей на границу поверхностного слоя длиной l, к этой длине:
(33)
Для того, чтобы изменить площадь поверхностного слоя при постоянной температуре на величину dS, надо совершить работу
где α – коэффициент поверхностного натяжения.
При изменении площади от S1 до S2 работа будет соответственно равна:
При совершении работы А энергия поверхностного слоя изменяется на величину ΔWпов.
(36)
.
Таким образом, можно дать еще одно определение коэффициента поверхностного натяжения.
Коэффициент поверхностного натяжения – скалярная физическая величина, равная отношению изменения потенциальной энергии поверхностного слоя к изменению площади поверхности этого слоя.
Коэффициент поверхностного натяжения зависит от химического состава жидкости и от ее температуры. С увеличением температуры α уменьшается и обращается в нуль при критической температуре.
Поверхностное натяжение существенно зависит от примесей, имеющихся в жидкостях. Вещества, ослабляющие поверхностное натяжение жидкости, называются поверхностно-активными веществами (ПАВ). Наиболее известным поверхностно-активным веществом относительно воды является мыло. Оно значительно уменьшает ее поверхностное натяжение (примерно с 7,5*10 –2 до 4,5*10 –2 Н/м). Относительно воды поверхностно-активными являются эфиры, спирты, нефть т.д. С молекулярной точки зрения влияние поверхностно-активных веществ объясняется тем, что силы притяжения между молекулами жидкости больше, чем силы притяжения между молекулами жидкости и примеси. Молекулы жидкости в поверхностном слое с большей силой втягиваются внутрь жидкостей, чем молекулы примеси. В результате этого молекулы жидкости переходят с поверхностного слоя вглубь ее, а молекулы поверхностно-активного вещества вытесняются на поверхность.
Поверхностно-активные вещества применяются в качестве смачивателей, флотационных реагентов, пенообразователей, диспергаторов – понизителей твердости, пластифицирующих добавок, модификаторов кристаллизации и др.
Все вышесказанное об особых условиях, в которых находятся молекулы поверхностного слоя, целиком относится также и к твердым телам. Следовательно, твердые тела, как и жидкости, обладают поверхностным натяжением.
При рассмотрении явлений на границе раздела различных сред следует иметь в виду, что поверхностная энергия жидкости или твердого тела зависит не только от свойств данной жидкости или твердого тела, но и от свойств того вещества, с которым они граничат. Строго говоря, нужно рассматривать суммарную поверхностную энергию α12 двух граничащих друг с другом веществ. Только если одно вещество газообразно, химически не реагирует с другим веществом и мало в нем растворяется, можно говорить просто о поверхностной энергии (или коэффициенте поверхностного натяжения) второго жидкого или твердого тела.
Рис. 17. Граница жидкости, газа и твердого тела
Если граничат друг с другом сразу три вещества: твердое, жидкое и газообразное (рис. 17), то вся система принимает конфигурацию, соответствующую минимуму суммарной потенциальной энергии (поверхностной, в поле сил тяжести и т. п.). В частности, контур, по которому граничат все три вещества, располагается на поверхности твердого тела таким образом, чтобы сумма проекций всех приложенных к каждому элементу контура сил поверхностного натяжения на направление, в котором элемент контура может перемещаться (т. е. на направление касательной к поверхности твердого тела), была равна нулю. Из рис. 17 следует, что условие равновесия элемента контура длиной Δl запишется следующим образом:
где αТГ, αТЖи αЖГ – коэффициенты поверхностного натяжения на границах: твердое тело — газ, твердое тело — жидкость и жидкость —газ.
Отсчитываемый внутри жидкости угол θ между касательными к поверхности твердого тела и к поверхности жидкости называется краевым углом. В соответствии с (37)
. (38)
Краевой угол определяется выражением (38) только при условии, что
. (39)
Если (39) не выполняется, т.е. |αТГ – αТЖ| > αЖГ, ни при каком значении θ не может установиться равновесие. Это имеет место в двух случаях.
1) αТГ > αТЖ + αЖГ. Как бы ни был мал угол θ, сила αТГ перевешивает две другие (рис. 18, а). В этом случае жидкость неограниченно растекается по поверхности твердого тела – имеет место полное смачивание. Замена поверхности твердое тело — газ двумя поверхностями, твердое тело — жидкость и жидкость — газ, оказывается энергетически выгодной. При полном смачивании краевой угол равен нулю.
2) αТЖ > αТГ + αЖГ. Как бы ни был угол θ близок к π, сила αТЖ перевешивает две другие (рис. 18,б), В этом случае поверхность, по которой жидкость граничит с твердым телом, стягивается в точку, жидкость отделяется от твердой поверхности — имеет место полное несмачивание. Замена поверхности твердое тело — жидкость двумя поверхностями, твердое тело — газ и жидкость — газ, оказывается энергетически выгодной. При полном несмачивании краевой угол равен π.
Рис. 18. Полное смачивание и полное несмачивание
При соблюдении условия (39) краевой угол может оказаться острым или тупым в зависимости от соотношения между αТГ и αТЖ. Если αТГ > αТЖ, то cosθ > 0 и угол θ— острый (рис. 19,а). В этом случае имеет место частичное смачивание. Если αТГ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Студент — человек, постоянно откладывающий неизбежность. 9491 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Молекулярная физика. Обоснования молекулярно-кинетической теории — броуновское движение, диффузия.
Диффузия, растворимость и броуновское движение могут быть объяснены только на основе представления о молекулярном строении веществ и являются убедительными обоснованиями первого и второго положений молекулярно-кинетической теории.
Броуновское движение.
Броуновское движение (брауновское движение) — беспорядочное движение малых частиц, взвешенных в жидкости или газе, происходящее под действием ударов молекул окружающей среды.
Впервые такое движение исследовал и описал в 1827 г. английский ботаник Р. Браун при изуении под микроскопом взвешенной в воде цветочной пыльцы. Он обнаружил, что частички пыльцы находятся в непрерывном беспорядочном движении, как бы исполняя дикий фантастический танец. Он писал: «Это движение, как я убежден, обусловлено не потоками жидкости, не постепенным ее испарением, а принадлежит самим частицам».
Наблюдаемые (броуновские) частицы размером
1 мкм и менее совершают неупорядоченные независимые движения, описывая сложные зигзагообразные траектории.
Подобный опыт можно проделать, пользуясь краской или тушью, предварительно растертой до таких мельчайших крупинок, которые видны лишь в микроскоп. Можно увидеть, что крупинки краски непрерывно движутся. Самые мелкие из них беспорядочно перемещаются с одного места в другое, более крупные лишь беспорядочно колеблются.
Броуновское движение можно наблюдать и в газе. Например, в воздухе его совершают взвешенные там частицы пыли или дыма.
Броуновское движение никогда не прекращается! В капле воды (если не давать ей высохнуть) движение крупинок можно наблюдать в течение многих дней, месяцев, лет. Оно не прекращается ни летом, ни зимой, ни днем, ни ночью. В кусках кварца, пролежавших в земле тысячи лет, попадаются иногда капельки воды, замурованные в минерале. В этих капельках тоже наблюдали броуновское движение плавающих в воде частиц.
Интенсивность броуновского движения увеличивается с повышением температуры, уменьшением вязкости среды, уменьшением размера частиц. Оно не зависит от химической природы частиц и времени наблюдения.
Броуновское движение служит доказательством существования еще более мелких частиц — молекул жидкости, невидимых даже в самые сильные оптические микроскопы.
Броуновское движение объясняется тем, что благодаря случайной неодинаковости количества ударов молекул жидкости о частицу с разных направлений возникает равнодействующая сила определенного направления. Поскольку подобные флуктуации (флуктуация — случайное отклонение физической величины от ее среднего значения) очень кратковременны, то в следующий миг направление равнодействующей меняется и, следовательно, изменится направление перемещения частицы. Отсюда наблюдающаяся хаотичность броуновского движения, которая отражает хаотичность молекулярного движения.
Открытие броуновского движения имело большое значение для изучения строения вещества. Оно показало, что тела действительно состоят из отдельных частиц — молекул — и что молекулы находятся в непрерывном беспорядочном движении.
Полная теория броуновского движения была разработана Эйнштейном и Смолуховским в 1905-1906 гг. и экспериментально подтверждена Ж. Перреном. Выводы теории показали, что среднее значение квадрата смещения броуновской частицы за определенный промежуток времени пропорционально этому промежутку времени, температуре и постоянной Больцмана.
Эксперименты Ж. Перрена, в которых он определял положение одной определенной частицы через каждые 30 с, подтвердили выводы теории. Перрен проводил также опыты по проверке зависимости концентрации молекул газа от высоты и барометрической формулы — зависимости атмосферного давления от высоты. Он предположил, что броуновские частицы, являясь своего рода большими молекулами, должны подчиняться тем же законам, что и молекулы атмосферы, а, следовательно, их концентрация с высотой должна падать. Его эксперименты полностью подтвердили теорию. Они позволили ему определить постоянную Авогадро, значение которой совпало с уже известным.
Таким образом, броуновское движение является самым ярким подтверждением теплового движения молекул — одного из положений молекулярно-кинетической теории.
Явление, при котором происходит взаимное проникновение молекул одного вещества между молекулами другого, называется диффузией.
Явление это объясняется свойством молекул находиться в беспрерывном движении.
Подтверждением движения молекул газа является всем известное распространение запаха какого-либо пахучего вещества, внесенного в комнату.
В жидкостях наблюдать взаимное проникновение одного вещества в другое можно, если в крепкий раствор медного купороса осторожно добавить воду. Вначале резкая граница между темно-голубым медным купоросом и бесцветной водой со временем исчезает. Механизм проникновения молекул следующий. Сначала вследствие движения отдельные молекулы воды и медного купороса, находящиеся около границы между ними, обмениваются местами. Молекулы медного купороса попадают в нижний слой воды, а молекулы воды — в верхний слой медного купороса. Граница между жидкостями из-за этого расплывается. Проникнув в слой «чужой» жидкости, молекулы начинают обмениваться местами с ее частицами, находящимся во все более глубоких слоях. Граница между жидкостями становится все более расплывчатой. Благодаря беспрерывному и беспорядочному движению молекул этот процесс, в конце концов, приводит к тому, что вся жидкость становится однородной.
В твердых телах также наблюдается диффузия. Так, в одном из опытов гладко отшлифованные пластины свинца и золота положили друг на друга и сжали грузом. Через пять лет золото и свинец проникли друг в друга на 1 мм.
Скорость диффузии зависит от агрегатного состояния вещества и температуры тела. В газах, где расстояние между молекулами очень велико по сравнению с их размерами и движение молекул хаотично, скорость диффузии наибольшая. В жидкостях она меньше, так как и расстояние между молекулами меньше, и движение молекул чуть более упорядочено. В твердых телах, где наблюдается строгий порядок в расположении атомов (или молекул), а сами они совершают лишь небольшие колебательные движения около своих мест, скорость диффузии наименьшая.
Скорость протекания диффузии увеличивается с ростом температуры.
Взаимодействие частиц вещества.
Третье положение MKT о взаимодействии молекул является очевидным. Достаточно вспомнить, сколько усилий требуется, чтобы сломать, скажем, деревянную палку.
Твердые тела и жидкости не распадаются на отдельные молекулы, несмотря на то, что их молекулы разделены промежутками и находятся в непрерывном беспорядочном движении.
Более того, твердое тело, например, трудно растянуть или сжать. Чем же объяснить, что молекулы в телах не только удерживаются друг около друга, но и в некоторых случаях промежутки между ними трудно увеличить?
Дело в том, что молекулы взаимодействуют друг с другом, и природа этого взаимодействия — электрическая. Молекула состоит из заряженных частиц — электронов и ядер. Заряженные частицы одной молекулы при соответствующих расстояниях взаимодействуют (притягиваются или отталкиваются) с заряженными частицами других молекул.
На расстояниях, превышающих 2-3 диаметра молекул, результирующая сила взаимодействия определяется силами притяжения. Вклад последних по мере уменьшения расстояния между молекулами сначала растет, затем убывает. Силы взаимодействия обращаются в нуль, когда расстояние между молекулами становится равным сумме радиусов молекул.
Дальнейшее уменьшение расстояния приводит к перекрыванию электронных оболочек, что вызывает быстрое нарастание сил отталкивания.
- http://studfiles.net/preview/3962366/page:11/
- http://shkolniku.com/fizika/task500847.html
- http://know.alnam.ru/book_k_phis.php?id=94
- http://revolution.allbest.ru/physics/00507166_0.html
- http://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no6-atomy-i-molekuly-atomno-molekularnoe-ucenie-vesestva-molekularnogo-i-nemolekularnogo-stroenia
- http://tvoiznaniya.com/fizika/tz6200060.html
- http://tehnar.net.ua/plavlenie-i-otverdevanie-na-osnove-ucheniya-o-molekulyarnom-stroenii-veshhestva/
- http://studopedia.ru/5_72486_poverhnostnoe-natyazhenie.html
- http://www.calc.ru/Molekulyarnaya-Fizika-Obosnovaniya-Molekulyarnokineticheskoy.html




