Испарение и конденсация. Объяснение явления испарения на основе представлений о молекулярном строении вещества. Удельная теплота парообразования. Ее единицы.
Явление превращения жидкости в пар называется парообразованием.
Испарение-процесс парообразования, происходящий с открытой поверхности.
Молекулы жидкости движутся с разными скоростями. Если какая-нибудь молекула окажется у поверхности жидкости, она может преодолеть притяжение соседних молекул и вылететь из жидкости. Вылетевшие молекулы образуют пар. У оставшихся молекул жидкости при соударении меняются скорости. Некоторые молекулы при этом приобретают скорость, достаточную для того, чтобы вылететь из жидкости. Этот процесс продолжается, поэтому жидкости испаряются медленно.
*Скорость испарения зависит от рода жидкости. Быстрее испаряются те жидкости, у которых молекул притягиваются с меньшей силой..
*Испарение может происходить при любой температуре. Но при высоких температурах испарение происходит быстрее.
*Скорость испарения зависит от площади ее поверхности.
*При ветре (потоке воздуха) испарение происходит быстрее.
При испарении внутренняя энергия уменьшается, т.к. при испарении жидкость покидают быстрые молекулы, следовательно, средняя скорость остальных молекул уменьшается. Значит, что если нет притока энергии из вне, то температура жидкости уменьшается.
Явление превращения пара в жидкость называется конденсацией. Она сопровождается выделением энергии.
Конденсацией пара объясняется образование облаков. Пары воды, поднимающиеся над землей, образуют в верхних холодных слоях воздуха облака, которые состоят из мельчайших капель воды.
Удельная теплота парообразования – физ. величина, показывающая какое кол-во теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Уд. теплоту парообразования обозначают буквой L и измеряется в Дж/кг
Уд. теплоту парообразования воды:L=2,3×10 6 Дж/кг, спирт L=0,9×10 6
Кол-во теплоты, необходимое для превращения жидкости в пар: Q = Lm
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 9116 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Парообразование, которое происходит только со свободной поверхности жидкости, граничрщей с газообразной средой или с вакуумом, называется испарением.
Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории. Как известно, потенциальная энергия молекул жидкости при увеличении расстояния между ними должна возрастать. Следовательно, чтобы покинуть жидкость, молекула должна выполнить работу за счет уменьшения своей кинетической энергии. Среди хаотически движущихся молекул жидкости в ее поверхностном слое всегда найдутся такие молекулы, которые стремятся еылететь из жидкости. Когда такая молекула выходит за поверхностный слой, то возникает сила, втягивающая молекулу обратно в жидкость (рис. 7.1). Поэтому вылетают из жидкости только те молекулы, у которых кинетическая энергия больше работы, необходимой для преодоления противодействия молекулярных сил в слое толщиной где — радиус молекулярного действия.
Покинувшие жидкость молекулы совместно составляют пар над ее поверхностью. Так как из жидкости вылетают молекулы с достаточно большой кинетической энергией, а остаются в ней
молекулы с меньшей кинетической энергией, то среднее значение энергии для молекул, остающихся в жидкости, в процессе испарения уменьшается, т. е. жидкость при испарении охлаждается. Этим объясняется ощущение холода при выходе из воды после купанья, охлаждение руки, смоченной эфиром, и т. п.
Некоторые молекулы пара при хаотическое движении над поверхностью жидкости залетают обратно в жидкость. Это означает, что наряду с испарением жидкости всегда происходит и конденсация ее паров. Так как молекулы пара, залетающие в жидкость, частично передают свою кинетическую энергию молекулам жидкости, то при этом происходит возрастание Еаост у молекул жидкости, т. е. увеличение внутренней энергии жидкости (нагревание жидкости).
Итак, на поверхности жидкости одновременно происходит испарение и конденсация. Когда преобладает процесс испарения, жидкость охлаждается, а когда преобладает конденсация, жидкость нагревается.
Поскольку силы молекулярного взаимодействия зависят от природы молекул, скорость испарения зависит от рода жидкости. Эту зависимость легко обнаружить на опыте. Если в одинаковые открытые сосуды налить равные объемы разных жидкостей, то через некоторое время будет видно, что быстрота испарения этих жидкостей разная. Оказывается, что эфир испаряется быстрее спирта, а спирт — быстрее воды.
Опыт показывает, что скорость испарения жидкости зависит от площади ее свободной поверхности. Чем больше эта площадь, тем быстрее испаряется жидкость. (Приведите примеры, подтверждающие эту зависимость, и объясните ее.)
Испарение происходит при любой температуре. Поэтому над свободной поверхностью жидкости всегда находится пар этой жидкости.
Легко заметить, что с повышением температуры скорость испарения жидкости возрастает. Например, горячая вода испаряется быстрее холодной. Объясняется это тем, что при повышении температуры увеличивается средняя кинетическая энергия молекул жидкости и становится больше таких молекул, которые могут преодолеть противодействие поверхностного слоя жидкости и вылететь за его пределы.
Как было отмечено выше, наряду с испарением жидкости всегда происходит и конденсация ее паров, которая уменьшает скорость испарения. При увеличении плотности молекул пара над поверхностью жидкости конденсация пара возрастает и испарение замедляется. Следовательно, чем меньше плотность пара жидкости над ее поверхностью, тем больше скорость испарения. Поэтому откачка паров с поверхности ускоряет ее испарение.
Отметим еще, что охлаждение жидкости в процессе ее испарения не всегда заметно. Объясняется это тем, что между жидкостью и окружающими телами существует теплообмен, который компенсирует потери ее энергии, уменьшая охлаждение жидкости. Однако при большой скорости испарения температура жидкости может заметно понизиться.
Молекулярная физика. Испарение и конденсация.
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Сублимацию, или возгонку, т.е. переход вещества из твердого состояния в газообразное, также называют испарением.
Из повседневных наблюдений известно, что количество любой жидкости (бензина, эфира, воды), находящейся в открытом сосуде, постепенно уменьшается. Жидкость не исчезает бесследно — она превращается в пар. Испарение — это один из видов парообразования. Другой вид — это кипение.
Механизм испарения.
Как происходит испарение? Молекулы любой жидкости находятся в непрерывном и беспорядочном движении, причем, чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии имеет определенную величину. Но у каждой молекулы кинетическая энергия может быть как больше, так и меньше средней. Если вблизи поверхности окажется молекула с кинетической энергией, достаточной для преодоления сил межмолекулярного притяжения, она вылетит из жидкости. То же самое повторится с другой быстрой молекулой, со второй, третьей и т. д. Вылетая наружу, эти молекулы образуют над жидкостью пар. Образование этого пара и есть испарение.
Поглощение энергии при испарении.
Поскольку при испарении из жидкости вылетают более быстрые молекулы, средняя кинетическая энергия оставшихся в жидкости молекул становится все меньше и меньше. Это значит, что внутренняя энергия испаряющейся жидкости уменьшается. Поэтому если нет притока энергии к жидкости извне, температура испаряющейся жидкости понижается, жидкость охлаждается (именно поэтому, в частности, человеку в мокрой одежде холоднее, чем в сухой, особенно при ветре).
Однако при испарении воды, налитой в стакан, мы не замечаем понижения ее температуры. Чем это объяснить? Дело в том, что испарение в данном случае происходит медленно, и температура воды поддерживается постоянной за счет теплообмена с окружающим воздухом, из которого в жидкость поступает необходимое количество теплоты. Значит, чтобы испарение жидкости про исходило без изменения ее температуры, жидкости необходимо сообщать энергию.
Количество теплоты, которое необходимо сообщить жидкости для образования единицы массы пара при постоянной температуре, называется теплотой парообразования.
Скорость испарения жидкости.
В отличие от кипения, испарение происходит при любой температуре, однако с повышением температуры жидкости скорость испарения возрастает. Чем выше температура жидкости, тем больше быстро движущихся молекул имеет достаточную кинетическую энергию, чтобы преодолеть силы притяжения соседних частиц и вылететь за пределы жидкости, и тем быстрее идет испарение.
Скорость испарения зависит от рода жидкости. Быстро испаряются летучие жидкости, у которых силы межмолекулярного взаимодействия малы (например, эфир, спирт, бензин). Если капнуть такой жидкостью на руку, мы ощутим холод. Испаряясь с поверхности руки, такая жидкость будет охлаждаться и отбирать у нее некоторое количество теплоты.
Скорость испарения жидкости зависит от площади ее свободной поверхности. Это объясняется тем, что жидкость испаряется с поверхности, и чем больше площадь свободной поверхности жидкости, тем большее количество молекул одновременно вылетает в воздух.
В открытом сосуде масса жидкости вследствие испарения постепенно уменьшается. Это связано с тем, что большинство молекул пара рассеивается в воздухе, не возвращаясь в жидкость (в отличие от того, что происходит в закрытом сосуде). Но небольшая часть их возвращается в жидкость, замедляя тем самым испарение. Поэтому при ветре, который уносит молекулы пара, испарение жидкости происходит быстрее.
Применение испарения в технике.
Испарение играет важную роль в энергетике, холодильной технике, в процессах сушки, испарительного охлаждения. Например, в космической технике быстроиспаряющимися веществами покрывают спускаемые аппараты. При прохождении через атмосферу планеты корпус аппарата в результате трения нагревается, и покрывающее его вещество начинает испаряться. Испаряясь, оно охлаждает космический аппарат, спасая его тем самым от перегрева.
Конденсация.
Конденсация (от лат. condensatio — уплотнение, сгущение) — переход вещества из газообразного состояния (пара) в жидкое или твердое состояние.
Известно, что при наличии ветра жидкость испаряется быстрее. Почему? Дело в том, что одновременно с испарением с поверхности жидкости идет и конденсация. Конденсация происходит из-за того, что часть молекул пара, беспорядочно перемещаясь над жидкостью, снова возвращается в нее. Ветер же выносит вылетевшие из жидкости молекулы и не дает им возвращаться.
Конденсация может происходить и тогда, когда пар не соприкасается с жидкостью. Именно конденсацией объясняется, например, образование облаков: молекулы водяного пара, поднимающиеся над землей, в более холодных слоях атмосферы группируются в мельчайшие капельки воды, скопления которых и представляют собой облака. Следствием конденсации водяного пара в атмосфере являются также дождь и роса.
При испарении жидкость охлаждается и, став более холодной, чем окружающая среда, начинает поглощать ее энергию. При конденсации же, наоборот, происходит выделение некоторого количества теплоты в окружающую среду, и ее температура несколько повышается. Количество теплоты, выделяющееся при конденсации единицы массы, равно теплоте испарения.
Объясните с физической точки зрения испарение.
Объясните с физической точки зрения испарение.
В жидкости молекулы находятся в непрерывном движении, причём движутся они с разными скоростями, как по величине, так и по направлению. Молекулы испытывают силы притяжения, и отталкивания тоже, но именно из-за сил притяжения они не могут разлететься, как в газе, и поэтому «кусок жидкости» долго сохраняется именно как нечто единое. Но всё-такие есть очень энергичные молекулы, которые оказались у поверхности жидкости, у которых скорость направлена из жидкости и достаточно велика, чтобы энергии хватило на преодоление притяжения остальных молекул. Вот эти молекулы и вылетают из жидкости, приводя к испарению. Кстати вот почему жидкость, испаряясь, остывает: её покидают самые энергичные молекулы, а тормознутые (холодные) остаются. А теплота испарения связана с тем, что испаряющимся молекулам приходится преодолевать притяжение соседей, совершая при этом работу.
С точки зрения молекулярно-кинетической теории: испарение — это процесс, при котором с поверхности жидкости вылетают более быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости.
Изложения нового материала. Объяснение явления испарения с точки зрения мкт
| Название | Изложения нового материала. Объяснение явления испарения с точки зрения мкт |
| Дата конвертации | 30.03.2013 |
| Размер | 36.83 Kb. |
| Тип | Рассказ |
учитель физики МОУ «Гимназия №5»Урок в 8 классе по теме «Испарение и конденсация»Цели урока:
Тип урока: комбинированный. 1. Зависимость скорости испарении от температуры, движения воздуха. План изложения нового материала.
Ход урока 2. Подготовка к усвоению нового материала На столах у вас лежат предметные стеклышки. Подышите на стеклышко. Что вы наблюдается? Как называется наблюдаемое явление? Как и почему можно изменить «картину» на стеклышке? Объявление темы урока: «Испарение и конденсация». Постановка целей и задач урока. 3. Объяснение нового материала. Рассказ о явлении испарения с точки зрения МКТ. Нарисуйте в тетради сосуд, который наполненный жидкостью. Изобразим молекулы этой жидкости в виде шариков, которые расположены довольно плотно друг к другу. Это молекулярная модель жидкости. Изобразите стрелками направления движения некоторых молекул. Каким молекулам легче всего покинуть жидкость? Вывод: поверхностный слой жидкости могут покинуть молекулы находящиеся вблизи поверхности, и которые имеют большую кинетическую энергию равную работе, которую необходимо совершить против сил сцепления, удерживая их внутри жидкости. Признаки явления испарения с помощью видеофильма «Молекулярная физика» Демонстрация — уменьшение количеств вещества при испарении, которое сопровождается понижением температуры испаряющейся жидкости. Вывод: При испарении происходит понижение температуры, т.к. внутренняя энергия испаряющейся жидкости уменьшается. От каких факторов зависит скорость испарения? Демонстрация – зависимость скорости испарения от температуры, движения воздуха с помощью видеофильма «Молекулярная физика» Вывод: Испарение зависит от: а) температуры; Испарение происходит с любой поверхности, в том числе и с поверхности твердого тела. Пример: бельё высыхает и на морозе. Испаряется и нафталин, поэтому мы чувствуем его запах. Этот процесс называют сублимацией. Конденсация — процесс перехода молекул из пара в жидкость. Этот процесс происходит на поверхности жидкости или твердого тела. Конденсация сопровождается выделением энергии. Пример: образование облаков, выпадение росы. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Испарение в природе, технике. а) В естественных условиях испарение является единственным способом передачи влаги с океанов в атмосферу и основной составляющей круговорота воды на земном шаре. Пример: С поверхности земли, ежегодно испаряется 577 000 куб. км воды. С поверхности Мирового океана — 505 000 куб. км; с поверхности рек, озер ….- 74 000 куб. км. Огромное количество воды испаряется растениями. За вегетационный период 1 га пшеницы испаряется около 2 000 куб. м воды. 1 га взрослых лиственных деревьев за лето испаряет до 15 000 куб. м б) в технике применяется испарение как средство для очистки веществ или разделения жидких смесей перегонкой (получение бензина, керосина и т.д.). Процесс испарения лежит в основе двигателей внутреннего сгорания, холодильных установок, а так же для разбрызгивания воды в горячем цеху для охлаждения воздуха, а также в основе всех процессов сушки в сушильных камерах. а) фронтальная беседа по вопросам. 1. Что называют испарением? б) работа в группах 1 группа: В каких случаях понижение температуры при испарении жидкости полезно и что следует сделать, чтобы его ускорить? 2 группа: Когда быстрое испарение вредно, и каким образом его можно замедлить? 3 группа: Почему учителя физкультуры настаивают, чтобы ученики после урока обязательно переодевались? 1 группа: Выйдя в летний жаркий день из реки, вы ощущаете прохладу, это ощущение усиливается в ветреную погоду. Объясните, почему это происходит? 2 группа: Утром на траве появились капельки росы. Какой будет день, холодный или теплый? 3 группа: Какой суп остынет быстрее: жирный или постный? II уровень. Вспомним основные положения теории1. Что называется испарением? От чего зависит скорость испарения? 2. Что такое динамическое равновесие? 3. Что называется паром? Какой пар называется насыщенным? ненасыщенным? Каковы свойства насыщенного пара? 4. Какой процесс называется кипением и при каких условиях он происходит? 5. Объясните условия кипения жидкости. Для начала неплохо. Попытайтесь ответить на вопросы 1. Как объяснить с точки зрения молекулярно-кинетической теории понижение температуры жидкости при ее испарении? 2. Почему давление насыщенного пара не зависит от объема, в котором он находится? 3. Как зависит давление насыщенного пара от температуры? В чем причина различия между температурной зависимостью давления насыщенного пара и идеального газа? 4. Как температура кипения жидкости связана с давлением ее насыщенного пара? 5. Почему для кипения существенно повышение давления насыщенного пара в пузырьках, а не повышение давления имеющегося в них воздуха? III уровень. Попробуйте выполнить задания
А. За счет трения воздушного потока о поверхность воды она нагревается; Б. Температура воздушного потока всегда больше температуры воды; В. Молекулы воды улетают вместе с воздушным потоком и не могут вернуться в сосуд; Г. Молекулы воздуха из воздушного потока имеют значительную кинетическую энергию и могут прореагировать с молекулами воды, в результате чего образуются летучие вещества.
А. … Б. … при которой давление насыщенных паров жидкости равно внешнему давлению на свободную поверхность жидкости; В. … при которой гидростатическое давление жидкости на дно сосуда равно внешнему давлению на свободную поверхность жидкости; Г. … при которой жидкость переходит в пар.
А. … вся подводимая теплота идет на испарение жидкости; Б. … вся подводимая теплота идет на расширение жидкости; В. … вся подводимая теплота идет на различные химические процессы, происходящие в жидкости; Г. … верно все вышеперечисленное.
A. Б. B. На всех участках; Г. Ни на одном участке.
А. Пар перешел из насыщенного в ненасыщенное состояние; Б. Произошла химическая реакция разложения водяного пара на водород и кислород; В. Часть пара сконденсировалась; Г. Значительная часть молекул водяного пара ионизировалась. IV уровень. Проверьте, все ли Вы усвоили
V уровень. Это сложная задача, однако, если Вы ее решите, то сделаете заметный шаг в познании физики, у Вас будут все основания относиться к себе с большим уважением, чем прежде
Журнал «Квант»Испарение и конденсацияПереход вещества в газообразное состояние называется парообразованием. Совокупность молекул, вылетевших из вещества, называется паром это го вещества. При парообразовании увеличиваются средние расстояния между молекулами. В результате потенциальная энергия взаимодействия частиц увеличивается (численное значение ее уменьшается, но она отрицательна). Таким образом, процесс парообразования связан с увеличением внутренней энергии вещества. Парообразование может происходить непосредственно из твердого состояния — это возгонка (или сублимация). Переход из жидкого состояния в газообразное возможен двумя различными процессами: испарением и кипением. Испарение — это парообразование, происходящее только со свободной поверхности жидкости, граничащей с газообразной средой или с вакуумом. Экспериментально установлены следующие закономерности:
Механизм испарения можно объяснить с точки зрения MKT: молекулы, находящиеся на поверхности, удерживаются силами притяжения со стороны других молекул вещества. Молекула может вылететь за пределы жидкости лишь тогда, когда ее кинетическая энергия превышает значение той работы, которую необходимо совершить, чтобы преодолеть силы молекулярного притяжения (работа выхода). Поэтому покинуть вещество могут только быстрые молекулы. В результате средняя кинетическая энергия оставшихся молекул уменьшается, а температура жидкости понижается. Для поддержания температуры испаряющейся жидкости неизменной к ней необходимо подводить некоторое количество теплоты. Количество теплоты Q, необходимое для превращения жидкости в пар при постоянной температуре, называется теплотой парообразования. Экспериментально установлено, что Q = Lm, где m — масса испарившейся жидкости, L — удельная теплота парообразования. Удельная тепло га парообразования — величина, численно равная количеству теплоты, необходимому для превращения в пар жидкости единичной массы при неизменной температуре. Удельная теплота парообразования L зависит от рода жидкости и внешних условий. При увеличении температуры она уменьшается (рис. 1). Это объясняется тем, что все жидкости при нагревании расширяются. Расстояния между молекулами при этом увеличиваются и силы молекулярного взаимодействия уменьшаются. Кроме того, чем больше температура, тем больше средняя кинетическая энергия движения молекул и тем меньше энергии им нужно добавить, чтобы они могли вылететь за пределы поверхности жидкости. Молекулы пара хаотически движутся. Поэтому скорости некоторых из них будут направлены в сторону жидкости. Достигнув поверхности, они втягиваются в нее силами притяжения со стороны молекул, находящихся на поверхности жидкости, и снова становятся молекулами жидкости. Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией. Число возвратившихся в жидкость за определенный промежуток времени молекул тем больше, чем больше концентрация молекул пара, а следовательно, чем больше давление пара над жидкостью. Конденсация пара сопровождается нагреванием жидкости. При конденсации выделяется такое же количество теплоты, которое было затрачено при испарении. ЛитератураАксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 197-198. Объяснение плавления и отвердевания на основании молекулярно-кинетической теорииЧтобы расплавить тело, мы его нагреваем. По мере нагревания кристаллического тела средняя энергия его молекул увеличивается за счет возрастания средней кинетической энергии. Увеличивается также потенциальная энергия молекул, так как увеличивается амплитуда колебаний молекул около положений равновесия, и увеличивается расстояние между молекулами, т. е. тела при нагревании расширяются. После того как достигнута температура плавления, вся подводимая энергия идет на совершение работы по разрушению пространственной (кристаллической) решетки, т. е. на увеличение потенциальной энергии молекул. В процессе плавления кинетическая энергия молекул не изменяется, о чем свидетельствует постоянство температуры во время плавления. Во время затвердевания вещества его молекулы располагаются упорядоченно, образуя кристаллическую решетку. Их потенциальная энергия в процессе кристаллизации уменьшается, а кинетическая энергия остается неизменной. Поэтому при кристаллизации температура не изменяется и происходит отдача количества теплоты окружающим телам. Когда при охлаждении отвердевает аморфное вещество, его частицы не располагаются в правильном порядке и не образуют кристаллические решетки. В твердом состоянии частицы аморфного тела расположены примерно в таком же беспорядке, как и в жидком. При отвердевании аморфных веществ происходит постепенное уменьшение кинетической энергии их частиц. Но нет скачкообразного уменьшения их потенциальной энергии. Точно так же при нагревании твердого аморфного тела постепенно растет кинетическая энергия его частиц, но нет скачкообразного возрастания их потенциальной энергии, как это наблюдается при плавлении кристаллических тел. Кратко различие в поведении кристаллических и аморфных тел при плавлении можно объяснить следующим образом. В кристаллах связи между молекулами в разных местах разрушаются одновременно, так как они всюду одинаковы. Поэтому переход в жидкое состояние происходит при строго определенной температуре. В аморфных телах при некоторой температуре часть молекул приобретает способность к более или менее свободному перемещению, другая же еще нет. Ведь связи между молекулами неодинаковы из-за отсутствия строгого порядка в расположении молекул относительно друг друга. В результате переход из твердого состояния в жидкое оказывается растянутым на некоторый интервал температур. В дальнейшем мы будем говорить только о плавлении и отвердевании (кристаллизации) кристаллических тел. Переохлаждение жидкостиЖидкость может быть охлаждена ниже температуры кристаллизации. Это явление называется переохлаждением. Его можно наблюдать, например, при охлаждении расплавленного гипосульфита. Гипосульфит расплавляется в пробирке (его температура плавления 48 °С) и остается в ней в жидком состоянии при охлаждении даже до комнатной температуры. Однако если бросить в пробирку кристаллик гипосульфита или встряхнуть ее, то начнется быстрая кристаллизация. В § 8.3 мы отмечали, что для начала кристаллизации необходимы так называемые центры кристаллизации. Если же центров кристаллизации нет, то может произойти переохлаждение жидкости на несколько градусов или даже десятков градусов. Переохлаждение чистой, без каких-либо пылинок и примесей воды нередко наблюдается в природе. Капельки тумана могут оставаться незамерзшими даже при сильных морозах. Такие капельки, осаждаясь на почве, образуют гололедицу. Также переохлажденными оказываются обычно капельки воды в облаках. Переохлажденная жидкость находится в неустойчивом состоянии; с течением времени под влиянием тех или иных воздействий переохлажденная жидкость переходит в более устойчивое при данной температуре кристаллическое состояние. Плавление и кристаллизация тел происходят при строго фиксированной температуре для заданного давления. Аморфные тела постепенно переходят из одного состояния в другое и не имеют определенной температуры плавления (отвердевания). Большая Энциклопедия Нефти и ГазаМеханизм — процесс — парообразованиеМеханизм процесса парообразования с точки зрения молекулярно-кинетической теории заключается в следующем. Молекулы жидкости, находящиеся вблизи от поверхности нагрева и обладающие в данный момент большой скоростью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных молекул, и становятся свободными. Каждая испаряющаяся молекула преодолевает силы сцепления жидкости и сопротивление внешнего давления при затрате некоторого количества тепловой энергии, подводимой извне. [1] Механизм процесса парообразования с точки зрения молеку-лярно-кинетической теории заключается в следующем. Молеку-лы жидкости, находящиеся вблизи поверхности и обладающие в данный момент наибольшей скоростью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных молекул, и становятся свободными. Каждая испаряющаяся молеку-ла затрачивает некоторое количество тепловой энергии, подводимой извне, на преодоление сил сцепления в жидкости и сопротивление внешнему давлению. Количество тепла, затрачиваемое при данной температуре, характеризуется скрытой теплотой испарения. С повышением температуры скрытая теплота испарения уменьшается и при критической температуре становится равной нулю. Наоборот, с понижением температуры скрытая теплота испарения возрастает. [2] Механизм процесса парообразования с точки зрения молекулярно-кинетической теории, заключается в следующем. Молекулы жидкости, находящиеся вблизи поверхности и обладающие в данный момент наибольшей скоростью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных молекул, и становятся свободными. Каждая испаряющаяся молекула затрачивает некоторое количество тепловой энергии, подводимой извне, на преодоление сил сцепления в жидкости и сопротивление внешнему давлению. Количество тепла, затрачиваемое при данной температуре, характеризуется скрытой теплотой испарения. С повышением температуры скрытая теплота испарения уменьшается и при критической температуре становится равной нулю. [3] Механизм процесса парообразования с точки зрения молекулярно-кинетической теории заключается в следующем. Молекулы жидкости, находящиеся вблизи от поверхности нагрева и обладающие в данный момент большой скоростью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных, молекул, и становятся свободными молекулам пара. Преодоление сил сцепления жидкости и сопротивления внешнего давления для каждой испаряющейся молекулы происходит за счет затраты извне соответствующих количеств тепловой энергии. [5] Механизм процесса парообразования с точки зрения молекулярно-кинетической теории заключается в следующем. Молекулы жидкости, находящиеся вблизи от поверхности нагрева и обладающие в данный момент большой скоростью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных молекул, и становятся свободными молекулами. Каждая испаряющаяся молекула преодолевает силы сцепления жидкости и сопротивление внешнего давления при затрате некоторого количества тепловой энергии, подводимой извне. [6] Механизм процесса парообразования с точки зрения молекулярно-инетической теории заключается в следующем. Молекулы жидкости, находящиеся вблизи от поверхности нагрева и обладающие в данный момент большой скоростью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных молекул, и становятся свободными. Каждая испаряющаяся молекула преодолевает силы сцепления жидкости и сопротивление внешнего давления при затрате некоторого количества тепловой энергии, подводимой извне. [7] Механизм процесса парообразования с точки зрения моле-кулярнокинетической теории заключается в следующем. Молекулы жидкости, находящиеся вблизи от поверхности нагрева и обладающие в данный момент большой скоростью, вылетают в пространство над жидкостью, освобождаясь от притяжения остальных молекул и становясь свободными молекулами пара. [8] Принудительная циркуляция оказывает непосредственное воздействие также на механизм процесса парообразования . Это воздействие выражается в искажении естественного угла смачивания и срыве паровых пузырьков со стенки раньше, чем они достигнут отрывного диаметра, характерного для кипения при свободном движении. При значительных скоростях циркуляции влияние ее значительно, а влияние qc, наоборот, невелико. [10] Во многих случаях образующиеся атомы и другие частицы могут соединяться между собой в тех или других сочетаниях. Механизм процесса парообразования при высоких температурах является поэтому часто довольно сложным. [11] Во многих случаях образующиеся агомы и другие частицы могут соединяться между собой в тех или других сочетаниях. В отличие от низких температур, когда свободные атомы и радикалы являются неустойчивыми коротко-живущими частицами, при высоких температурах они могут находиться в состоянии подвижного равновесия с продуктами соединения их между собой. Механизм процесса парообразования при высоких температурах является поэтому часто довольно сложным. [12] Во многих случаях образующиеся атомы и другие частицы могут соединяться между собой в тех или других сочетаниях. В отличие от низких температур, когда свободные атомы и радикалы являются неустойчивыми короткоживущими частицами, при высоких температурах они могут находиться в состоянии подвижного равновесия с продуктами соединения их между собой. Механизм процесса парообразования при высоких температурах является поэтому часто довольно сложным. [13] Во многих случаях образующиеся атомы и другие частицы могут соединяться между собой в тех или других сочетаниях. В отличие от низких температур, когда свободные атомы и радикалы являются неустойчивыми короткоживущими частицами, при высоких температурах они могут находиться в состоянии подвижного равновесия с продуктами соединения их между собой. Механизм процесса парообразования при высоких температурах является поэтому часто — довольно сложным. [14] Цель: Объяснить процесс кипения на основе мкт
|
| Тема: Насыщенный пар. Кипение.
ППС: иллюстрации, модели мультимедийного курса «Открытая Физика 2.5. Часть 1», материалы из раздела «Молекулярно-кинетическая теория».
II.1 Насыщенный пар. В закрытом сосуде с жидкостью при неизменном объеме и постоянной температуре количество пара над ней не изменяется с течением времени. Это говорит о том, что число молекул, покинувших жидкость в единицу времени, в среднем равно числу молекул, возвратившихся обратно. Таким образом, в закрытом сосуде устанавливается динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным. Если воздух из сосуда с жидкостью предварительно откачан, то над поверхностью жидкости будет находиться только насыщенный пар. Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара pданного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1). При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром. Если изотермически сжимать ненасыщенный пар при T |
- http://lib.sernam.ru/book_t_phis.php?id=57
- http://www.calc.ru/Molekulyarnaya-Fizika-Ispareniye-I-Kondensatsiya.html
- http://shpora.org/question/4451549-obyasnite-s-fizicheskoy-tochki-zreniya-isparenie.html
- http://koledj.ru/docs/index-6711.html
- http://poisk-ru.ru/s126t5.html
- http://www.physbook.ru/index.php/%D0%A2._%D0%98%D1%81%D0%BF%D0%B0%D1%80%D0%B5%D0%BD%D0%B8%D0%B5
- http://studfiles.net/preview/2383541/page:106/
- http://www.ngpedia.ru/id154050p1.html
- http://kurs.znate.ru/docs/index-200639.html
 ;
;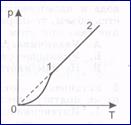 На рисунке изображен график зависимости давления пара от абсолютной температуры. На каком участке пар насыщенный?
На рисунке изображен график зависимости давления пара от абсолютной температуры. На каком участке пар насыщенный?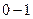 ;
;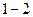 ;
; больше, чем при
больше, чем при 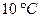 ?
? , находится вода при
, находится вода при 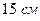 ?
?