Идеальный газ. Идеальный газ с точки зрения молекулярно-кинетической теории простейшая физическая модель реального газа.
Под моделью в физике понимают не увеличенную или уменьшенную копию реального объекта. Физическая модель – это создаваемая учеными общая картина реальной системы или явления, которая отражает наиболее существенные, наиболее характерные свойства системы.
В физической модели газа принимаются во внимание лишь те основные свойства молекул, учет которых необходим для объяснения главных закономерностей поведения реального газа в определенных интервалах давления и температуры.
В молекулярно-кинетической теории идеальным газом называют газ, состоящий из молекул, взаимодействие между которыми пренебрежимо мало. Иными словами, предполагается, что средняя кинетическая энергия молекул идеального газа во много раз больше потенциальной энергии их взаимодействия.
Реальные газы ведут себя подобно идеальному газу при достаточно больших разрежениях, т. е. когда среднее расстояние между молекулами во много раз больше их размеров. В этом случае силами притяжения между молекулами можно полностью пренебречь. Силы же отталкивания проявляются лишь на ничтожно малых интервалах времени при столкновениях молекул друг с другом.
В простейшей модели газа молекулы рассматривают как очень маленькие твердые шарики, обладающие массой. Движение отдельных молекул подчиняется законам механики Ньютона. Конечно, нет никакой гарантии, что с помощью такой модели можно объяснить все процессы в разреженных газах. Ведь известно, что молекулы отличаются не только массами. Они имеют сложное строение.
Но сейчас мы поставим и будем решать достаточно узкую задачу: вычислим давление газа с помощью молекулярно-кинетической теории . Для этой задачи простейшая модель газа оказывается удовлетворительной. Она приводит к результатам, которые подтверждаются опытом.
Давление газа в молекулярно-кинетической теории. Пусть газ находится в закрытом сосуде. Манометр показывает давление газа p0. (Напомним: давление определяется отношением модуля F силы, действующей перпендикулярно поверхности, к площади поверхности S: . Давление выражается в паскалях или миллиметрах ртутного столба: 1 Па = 1 Н/м² = 7,5 · 10 – ³ мм рт. ст.) Но как возникает это давление? Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку сила, действующая со стороны всех молекул на единицу площади стенки, т. е. давление, будет быстро меняться со временем примерно так, как показано на рисунке 18. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади его чувствительного элемента – мембраны. Несмотря на небольшие изменения давления, среднее значение давления p0 практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.
Давление газа будет тем больше, чем больше молекул ударяется о стенку за некоторый интервал времени и чем больше скорости соударяющихся со стенкой молекул.
Возникновение давления газа можно пояснить с помощью простой механической модели. Возьмем диск (он играет роль мембраны манометра) и закрепим его на стержне так, чтобы он располагался вертикально и мог поворачиваться вместе со стержнем вокруг вертикальной оси (рис. 19). С помощью наклонного желоба на диск направим струйку мелкой дроби (дробинки играют роль молекул). В результате многочисленных ударов дробинок на диск будет действовать некоторая средняя сила, вызывающая поворот стержня и изгиб упругой пластины П. Эффект же от ударов отдельных дробинок не заметен.
Тепловое движение молекул. С самого начала нужно отказаться от попыток проследить за движением всех молекул, из которых состоит газ. Их слишком много, и из-за столкновений друг с другом они движутся очень сложно. Нам и не нужно знать, как движется каждая молекула. Мы должны выяснить, к какому результату приводит совокупное движение всех молекул.
Характер же движения всей совокупности молекул газа известен из опыта (см. § З). Молекулы участвуют в хаотическом (тепловом) движении. Это означает, что скорость любой молекулы может оказаться как очень большой, так и очень малой, а направление движении молекул беспрестанно меняется при их столкновениям друг с другом.
Скорости отдельных молекул могут быть любыми, однако среднее значение модуля их скорости вполне определенное. Точно так же рост учеников в классе не одинаков. Но среднее значение роста – определенная величина. Чтобы ее найти, надо сложить вместе рост учеников и разделить эту сумму на количество учеников.
Среднее значение квадрата модуля скорости. В дальнейшем нам понадобится среднее значение не самой скорости, а квадрата скорости, от которого зависит средняя кинетическая энергия молекул.
Обозначим модули скоростей отдельных молекул через v1, v2, v3, …, vN. Среднее значение квадрата скорости определится следующей формулой:
Действительно, для каждой молекулы справедливо выражение (1.9). Сложив эти выражения для отдельных молекул и разделив обе части полученного уравнения на число молекул N, мы придем к формуле (1.10).
Так как направления Ox, Oy и Oz вследствие хаотичности движения молекул равноправны, средние значения квадратов проекций скорости равны друг другу:
т.е. средний квадрат проекции скорости равен 1/3 среднего квадрата самой скорости. Множитель 1/3 появляется вследствие трехмерности пространства и, соответственно, существования трех проекций у любого вектора.
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Понравилась статья, расскажите о ней друзьям:
Идеальный газ с точки зрения мкт
Идеальный газ — это просто!
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало.
Понятие «идеальный газ» вводится для математического описания поведения газов.
Реальные разреженные газы ведут себя как идеальный газ!
Свойства идеального газа:
— взаимодействие между молекулами пренебрежительно мало
— расстояние между молекулами много больше размеров молекул
— молекулы — это упругие шары
— отталкивание молекул возможно только при соударении
— движение молекул — по законам Ньютона
— давление газа на стенки сосуда — за счет ударов молекул газа
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул.
Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
где
n — число молекул в газе
v — модули скоростей отдельных молекул в газе
В теории газов часто используется понятие кинетической энергии молекул.
Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
где
р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м 3 )
— масса молекулы (кг)
— средний квадрат скорости молекул (м 2 /с 2 )
ρ — плотность газа (кг/м 3 )
— средняя кинетическая энергия молекул (Дж)
Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
Дополнительные расчетные формулы по теме
Формула для расчета концентрации молекул:
где
N — число молекул газа
V — объем газа (м 3 )
Формула для расчета плотности газа:
где
mo — масса молекулы (кг)
n — концентрация молекул (1/м 3 )
Молекулярная физика. Термодинамика — Класс!ная физика
1.2.Молекулярно-кинетическая теория газов
Молекулярно-кинетическая теория газов рассматривает идеальный газ:
а) молекулы не притягиваются и не отталкиваются;
б) молекулы взаимодействуют только при упругих столкновениях;
в) молекулы представляют собой материальные точки, т.е. обладают массой, но не имеют объёма.
В качестве критерия идеальности газов принято считать соотношение α/L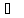
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в паскалях по имени французского учёного и математика
Блеза Паскаля (1623-1662). 1Па = 1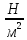
Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р) – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является термодинамическим параметром состояния.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
Термодинамическая температура Т всегда положительна. При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
Т = t + 273,15 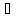
Ro= 8,314 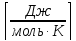
Удельный объем – отношение объема вещества к его массе 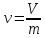
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
1.3. Универсальное уравнение состояния идеального газа
Уравнение состояния идеального газа Клапейрона – Менделеева:
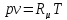
где р – давление, Па,

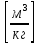
Rμ=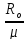
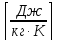
Например, для кислорода 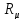
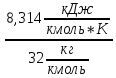

Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для любого процесса 1-2:, p1
p2

Разделив левую часть первого уравнения на левую часть второго уравнения, а правую часть первого уравнения на правую часть второго уравнения и сократив Rμ, получим:
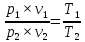
1.4. Смесь идеальных газов
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
Состав смеси задается долями объемными r, r1= 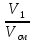

массовыми g g1= и мольными r1′ : r1′ =
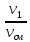
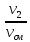
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
Молярная масса смеси: μсм= μ1r1+ μ2r2. μсм= 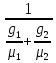
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь между объемными и массовыми долями: g1= r1∙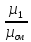
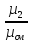
Модель идеального газа в молекулярно-кинетической теории.
Идеальный газ — это теоретическая модель газа, в которой пренебрегают размерами и взаимодействиями частиц газа и учитывают лишь их упругие столкновения.
Другими словами, предполагается, что внутренняя энергия идеального газа определяется лишь кинетической энергией его частиц (т.е. потенциальной энергией взаимодействия молекул пренебрегают).
Модель идеального газа была предложена в 1847 г. Дж. Герапатом. На основе этой модели были теоретически выведены газовые законы (закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля, закон Авогадро), которые ранее были установлены экспериментально. Модель идеального газа была положена в основу молекулярно-кинетической теории газа.
Основными законами идеального газа являются уравнение состояния и закон Авогадро, в которых впервые были связаны макрохарактеристики газа (давление, температура, масса) с массой молекулы (уравнение Менделеева-Клапейрона, или уравнение состояния идеального газа).
В современной физике ее используют также для описания ансамблей любых слабовзаимо-действующих частиц. Модель идеального газа справедлива для реальных классических газов при достаточно высоких температурах и разрежениях, когда среднее расстояние между молекулами много больше размеров самих молекул. В этом случае силами притяжения можно пренебречь. Силы же отталкивания проявляются лишь при столкновении друг с другом в течение ничтожно малых интервалов времени.
В простейшей модели газа молекулы рассматриваются как очень маленькие твердые шарики, обладающие массой. Движение отдельных молекул подчиняется законам механики Ньютона. Конечно, не все процессы в разреженных газах можно объяснить с помощью такой модели, однако давление газа вычислить с ее помощью можно.
Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
Свойства реальных газов рассматриваются на примере поведения физической модели «идеальный газ», в которой молекулы представлены в виде материальных точек, отсутствуют силы межмолекулярного взаимодействия, взаимодействие молекул происходит только при их соударениях и со стенками сосуда и является упругим.
Связь термодинамических макропараметров газа (p-давление,V-объем, T-температура) с его микропараметрами (m-масса молекул, -средняя квадратичная скорость молекул, -средняя кинетическая энергия молекул, n-концентрация молекул) устанавливает основное уравнение МКТ идеального газа.
Реальные газы при не слишком низких температурах и достаточно малых давлениях по своим свойствам близки к идеальному газу.
Идеальный газ в МКТ. Основное уравнение МКТ. Физика. 10 класс.
Идеальный газ в МКТ. Основное уравнение МКТ. Физика. 10 класс.
- Оглавление
- Занятия
- Обсуждение
- О курсе
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Основное уравнение молекулярно-кинетической теории
Идеальный газ
Изучение любой области физики всегда начинается с введения некой модели, в рамках которой идет изучение в дальнейшем. Например, когда мы изучали кинематику, моделью тела была материальная точка, когда изучали планетарные движения, планеты принимались за сферы и т. д. Как вы уже догадались, модель никогда не будет соответствовать реально происходящим процессам, но часто она очень сильно приближается к этому соответствию.
Молекулярная физика, и в частности МКТ, не является исключением. Над проблемой описания модели работали многие учёные, начиная с восемнадцатого века: М. Ломоносов, Д. Джоуль, Р. Клаузиус (Рис. 1). Последний, собственно, и ввёл в 1857 году модель идеального газа.
Рис. 1. Джеймс Джоуль, Михаил Ломоносов, Рудольф Клаузиус соответственно
Определение. Идеальный газ – модель газа, в рамках которого молекулы и атомы газа представлены в виде очень маленьких (исчезающих размеров) упругих шариков, которые не взаимодействуют друг с другом (без непосредственного контакта), а только сталкиваются (см. Рис. 2).
Следует отметить, что разреженный водород (под очень маленьким давлением) практически полностью удовлетворяет модели идеального газа.
Микро- и макропараметры газа
Теперь можно приступить к описанию параметров идеального газа. Они делятся на две группы:
Параметры идеального газа
То есть микропараметры описывают состояние отдельно взятой частицы (микротела), а макропараметры – состояние всей порции газа (макротела). Запишем теперь соотношение, связывающее одни параметры с другими, или же основное уравнение МКТ:
Здесь: — средняя скорость движения частиц;
Определение. — средняя кинетическая энергия поступательного движения
– плотность газа
Выведение основного уравнения МКТ
Вспомним основные сведения про модель идеального газа:
— молекулы движутся хаотически;
— механизм давления идеального газа – это соударение отдельных молекул со стенками сосуда.
Пусть идеальный газ находится в цилиндрическом сосуде (см. Рис. 1). Определим давление p этого газа на поршень.
Рис. 1. Идеальный газ (молекулы) в цилиндрическом сосуде
По определению давление – величина, равная отношению силы (F), действующей перпендикулярно поверхности, к площади этой поверхности (S).
Вычислим силу (F), с которой молекулы действуют на поршень:
1. Определим силу удара одной молекулы о стенку сосуда.
Пусть молекула идеального газа массой ,
где a – ускорение молекулы при ударе;
Рис. 2. Столкновение молекулы с поршнем
Проекция скорости на ось OY не изменяется, поэтому всё изменение скорости равно изменению скорости вдоль оси X:
Согласно третьему закону Ньютона, сила
2. Рассчитаем число молекул N, ударившихся о поршень за интервал .
За интервал времени
– общее число молекул, которое равно произведению концентрации на объём:
Рис. 3. Молекулы, ударившиеся о поршень за время
3. Определим общую силу ударов молекул о поршень.
Эта сила будет равна произведению силы удара одной молекулы на общее число ударов:
Мы живём в трёхмерном мире, то есть любая молекула имеет проекцию скорости
Подставляем это значение в формулу силы ударов молекул о поршень:
Значение данной силы подставим в формулу давления:
– основное уравнение МКТ идеального газа,
где макропараметры ;
микропараметры .
Второй способ записи основного уравнения МКТ
Основное уравнение МКТ можно записать в другом виде, в котором давление связывается не с массой и скоростью молекулы, а с их комбинацией, то есть со средней кинетической энергией одной молекулы.
Среднюю кинетическую энергию поступательного движения молекул газа можно рассчитать по формуле:
Следовательно, основное уравнение МКТ будет выглядеть так:
– давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема
К занятию прикреплен файл «Это интересно!». Вы можете скачать файл в любое удобное для вас время.
Использованные источники:
- http://people-ask.ru/nauki/fizika/osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-mkt-s-vivodom
- http://class-fizika.ru/10_27.html
- http://studfiles.net/preview/5276108/page:2/
- http://www.calc.ru/Model-Idealnogo-Gaza-V-Molekulyarnokineticheskoy-Teorii.html
- http://fizclass.ru/idealnyj-gaz-osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-idealnogo-gaza/
- http://www.kursoteka.ru/course/3314/lesson/11223/unit/27905