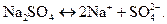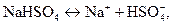С точки зрения теории электролитической диссоциации кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов водорода и анионов кислотного остатка.
Следует различать кислородсодержащие кислоты типа H2SO4, HNO3 и бескислородные кислоты типа HCl, H2S.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
кислота ® ион водорода + анион кислотного остатка
К кислотам — сильным электролитам относят H2SO4, HNO3, HCl, HBr, HI и др. В водном растворе они полностью распадаются на ионы.
Двухосновная H2SO4 диссоциирует ступенчато, причем первый ион H + отрывается от молекулы легче, чем второй. Вторая ступень диссоциации является обратимым процессом и характеризуется значением константы диссоциации:
К кислотам — слабым электролитам относят HF, H2CO3, HCN, H2S, CH3COOH и др. В водном растворе они частично распадаются на ионы. Например,
Слабые многоосновные кислоты диссоциируют ступенчато. Каждую ступень характеризуют своим значением константы диссоциации, например:
Первый ион водорода H + отрывается от молекулы легче, чем последующие от положительно заряженных анионов, поэтому
.
В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли, NaHSO4, NaHCO3, K2HPO4 и т.д.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием гидроксид-ионов OH — и катионов металла.
В общем виде уравнение электролитической диссоциации основания имеет вид:
основание ® гидроксид-ион + катион металла
Сильные основания (щелочи) в водном растворе практически полностью распадаются на ионы, например:
BaOH + ® OH — + Ba 2+
Слабые многокислотные основания диссоциируют ступенчато:
Этим объясняют способность многокислотных оснований образовывать основные соли: CuOHCl, (ZnOH)2SO4 и др.
С точки зрения теории электролитической диссоциации амфотерные гидроксиды (амфолиты) — это вещества, диссоциирующие в водном растворе как по типу кислот, так и по типу оснований. К ним относят Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3, и др. Например, уравнения электролитической диссоциации Be(OH)2:
1) диссоциация по типу основания:
2) диссоциация по типу кислоты:
Рассмотрим некоторые общие закономерности в изменении свойств гидроксидов. Диссоциация кислородсодержащих гидроксидов зависит от сравнительной прочности и полярности связей Э-О и О-Н. Чем менее прочна или более полярна связь, тем легче происходит электролитическая ионизация по этой связи в водных растворах. Таким образом, диссоциация гидроксидов может протекать по двум направлениям:
1) ЭОН « ОН — + Э + (по типу основания)
2) ЭОН « Н + + ЭО — (по типу кислоты)
Чем больше степень окисления и меньше радиус центрального иона (Э), тем менее полярна связь Э-О и выше ее прочность сравнительно со связью О-Н. В данном случае диссоциация идет по типу кислоты, т.е. с отщеплением иона водорода. И наоборот, чем меньше степень окисления и больше радиус центрального иона, тем более полярна связь Э-О и меньше ее прочность, чем связи О-Н. В этом случае диссоциация идет, преимущественно, по типу основания, т.е. с отщеплением гидроксид-ионов. Если полярности связей Э-О и О-Н близки, то диссоциация гидроксида ЭОН может протекать как по типу основания, так и по типу кислоты, т.е. гидроксид является амфотерным.
В периодах с увеличением заряда ядер элементов радиусы ионов уменьшаются, а максимальная степень окисления в соединениях типа ЭОm(ОН)n возрастает от 1 до 7. В связи с этим уменьшается полярность и увеличивается прочность связи Э-О, т.е. основные свойства
гидроксидов ослабевают, а кислотные возрастают. Так, в ряду
NaOH — сильное основание, Al(OH)3 — амфолит, H2SiO3 — слабая кислота, HClO4 — сильная кислота.
В главных подгруппах с увеличением заряда ядер элементов радиусы ионов увеличиваются, а максимальная степень окисления постоянна. В связи с этим увеличивается полярность и уменьшается прочность связи Э-О, т.е. сверху вниз основные свойства увеличиваются, а кислотные убывают. Это хорошо видно на примере гидроксидов элементов IIА группы: Be(OH)2 — амфолит, Mg(OH)2 — основание средней силы, Ba(OH)2 — сильное основание.
Если элемент образует гидроксиды в различных степенях окисления, то в соединениях элементов с низшими степенями окисления более выражены основные свойства, а в соединениях с высшими степенями окисления преобладают кислотные свойства, например:
Объясняется это тем, что для одного и того же элемента с увеличением степени окисления его электроотрицательность растет, а радиус иона уменьшается, что приводит к уменьшению полярности и увеличению прочности связи Э-О и, следовательно, ослаблению основных свойств гидроксида.
Следовательно, с возрастанием степени окисления и уменьшением ионного радиуса у кислородсодержащих гидроксидов преобладает кислотный тип диссоциации. Наоборот, с уменьшением степени окисления и увеличением ионного радиуса центрального иона преобладает основный тип диссоциации.
В бескислородных кислотах (образуют элементы VIА — VIIА групп) полярность связи Э-Н возрастает при переходе от элементов VIА группы к элементам VIIА группы и уменьшается в пределах каждой группы сверху вниз. Однако, в этом же направлении, соответственно, увеличивается и уменьшается прочность связи. Поэтому сила кислот возрастает в ряду HF — HCl — HBr — HI, несмотря на то, что полярность связи в этом направлении уменьшается.
С точки зрения теории электролитической диссоциации соли — это вещества, диссоциирующие в водном растворе на катион металла и анион кислотного остатка. Соли, как правило, являются сильными электролитами (исключение составляют ZnCl2, Fe(CNS)3, HgCl2, Mg(CN)2, и др.) и в водных растворах полностью распадаются на ионы:
.
При этом, в отличие от средних солей, кислые и основные соли диссоциируют ступенчато:
Следует иметь в виду, что определения Аррениуса справедливы только для водных растворов электролитов.
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН — .
1. Изменение цвета индикаторов:
метиловый оранжевый – желтый
2. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
3. Взаимодействие с кислотными оксидами:
4. Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O32NaAIO2 + H2O,
NaOH + AI(OH)3NaAIO2 + 2H2O.
5. Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
6. Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
7. Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2CaO + H2O,
Cu(OH)2CuO + H2O.
голубой цвет черный цвет
Химические свойства амфотерных оснований:
Амфотерные гидроксиды проявляют свойства оснований и кислот, поэтому взаимодействуют как с кислотами, так и с основаниями.
1. Взаимодействие с кислотами с образованием соли и воды:
2. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды:
AI(OH)3 + NaOH Na[AI(OH)4],
AI(OH)3 + NaOH NaAIO2 + 2H2O.
3. Взаимодействие с кислотными и основными оксидами:
2Fe(OH)3 + 3SO3Fe2(SO4)3 + 3H2O,
2Fe(OH)3 + Na2O 2NaFeO2 + 3H2O.
Основные способы получения оснований.
1. Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
3. Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2+ CI2
4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2+ Na2SO4.
Вопросы для самоконтроля
1 — Дайте характеристику Си(OH)2.
2 — Запишите уравнения реакций, подтверждающие его основные свойства.
3 — Напишите уравнения возможных реакций (молекулярные и сокращённые ионные).
ü Гидроксида натрия с нитратом кальция
ü Гидроксида калия с нитратом железа (11)
ü Гидроксида натрия с хлоридом железа (111)
ü Гидроксида калия с хлоридом алюминия.
ПЛАН ЗАНЯТИЯ № 15
Дисциплина: Химия.
Тема:Соли и их свойства.
Цель занятия:Изучить понятие солей в свете теории электролитической диссоциации, углубить знания о свойствах солей и способах получения.
Предметные: владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
Метапредметные: применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
Личностные: химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Соли как электролиты.
2. Соли средние, кислые и оснóвные.
3. Химически свойства солей в свете теории электролитической диссоциации.
4. Способы получения солей.
Оснащение: Интерактивная доска, таблица растворимости, ряд активности металлов и кислот.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 — изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Диссоциация оснований, кислот, амфотерных гидроксидов, солей в водных растворах
Диссоциация оснований.Согласно теории электролитической диссоциации, основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — :
NaOH →Na + + ОН — ; Са(ОН)2 → СаОН + + ОН — ; СаОН + → Са 2+ + ОН — .
Диссоциация кислот.Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + .
Одноосновные кислоты диссоциируют на ионы в одну стадию:
НС1 → Н + + С1 — ; HNO3 → Н + + NO3 .
Вторая ступень: HSO4 → Н + + SO — 4 .
По второй ступени диссоциация HSO — 4 затруднена.
Диссоциация фосфорной кислоты протекает по трем ступеням, причем по первой ступени диссоциация протекает в большей степени, чем по второй, а по второй — больше, чем по третьей.
Третья ступень: НРО 2- 4↔ H + + РО 3- 4.
Водный раствор фосфорной кислоты содержит ионы водорода Н + , дигидрофосфат-ионы Н2РО — 4 , гидрофосфат-ионы НРО 2- 4 и фосфат-ионы РО 3- 4 , причем ионов Н2РО — 4 больше, чем НРО 2- 4 и РО 3- 4 -ионов.
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды диссоциируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации; одновременно образуются катионы Н + и гидроксид-анионы ОН — . Амфотерные гидроксиды способны реагировать и с кислотами, и с основаниями. К ним относятся гидроксиды цинка, алюминия, хрома, свинца и др. Амфотерным электролитом является также вода.
Диссоциация амфотерных гидроксидов по типу кислот и оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме-О-) и между атомами кислорода и водорода (-О-Н) почти одинакова. В результате эти связи в водных растворах разрываются одновременно и появляются катионы Н + и анионы ОН — :
Н + + МеО — ↔ МеОН ↔Ме + + ОН — .
Тогда диссоциацию амфотерного гидроксида цинка в водном растворе можно представить схемой:
Диссоциация солей. 1. Диссоциация средней соли. При растворении в воде средняя соль образует катионы металла и анионы кислотного остатка:
Таким образом, с точки зрения теории электролитической диссоциации, средние соли можно определить как электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка.
2. Диссоциация кислой соли. При растворении в воде кислая соль образует катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток:
Сложный анион НСО3 (гидрокарбонат-ион) частично диссоциирует и дает анион СО 2- 3:
3. Диссоциация основной соли. При диссоциации основной соли образуются анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН — :
MgOHCl → MgOH + + Cl — (α = 1).
Сложный катион MgOH + частично диссоциирует:
MgOH+ ↔ Mg 2+ + ОН — (α + + А1 3+ + 2 SO 2- 4 ;
В результате диссоциации водный раствор двойной соли содержит два катиона и анион кислотного остатка.
Дата добавления: 2014-10-22 ; просмотров: 7801 . Нарушение авторских прав
Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
Кислоты. Для кислот характерны следующие общие свойства:
- а) способность взаимодействовать с основаниями с образованием солей;
- б) способность взаимодействовать с некоторыми металлами с выделением водорода;
Константы диссоциации некоторых сильных кислот в водных растворах при 25 °С
Константа диссоциации К
- в) способность изменять цвета индикаторов, в частности вызывать красную окраску лакмуса;
- г) кислый вкус.
При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т.д. C устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее.
Из сравнения данных, приведенных в табл. 12 и 14, видно, что величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации H2SO4 — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале IO -4 —10“ 2 , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
- а) способностью взаимодействовать с кислотами с образованием солей;
- б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
- в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, очевидно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
а при взаимодействии с гидроксидом натрия — цинкат натрия:
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами. К таким гидроксидам, кроме гидроксида цинка, относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно выразить схемой:
Таким образом, в растворе амфотерного электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионов, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы H + . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН
. Например, при растворении хлорида гидроксомагния диссоциация протекает согласно уравнениям:
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима. В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства оснований. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в неводных средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теорий кислот и оснований принадлежит протонная теория, созданная в 1923 г.
Согласно протонной теории, кислотой является донор протона, т.е. частица (молекула или ион), которая способна отдавать ион водорода — протон, а основанием — акцептор протона, т.е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Связанные этим соотношением основание и кислота называются сопряженными. Например, ион НСО4 является основанием, сопряженным кислоте H2SO4.
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион Cl — — основание, сопряженное кислоте НС1, а ион NH4 — кислота, сопряженная основанию NH3.
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду NH3-H2O-HF эта энергия максимальна для NH3 и минимальна для HF. Поэтому в смеси с NH3 вода функционирует как кислота, а в смеси с HF — как основание:
Электролитическая диссоциация гидроксидов и солей
В водных растворах гидроксиды и соли проводят электрический ток в результате распада на заряженные частицы – ионы. Этот процесс носит название электролитическая диссоциация, а вещества, распадающиеся на ионы в водном растворе, называются электролитами.
Кислотами с точки зрения теории электролитической диссоциации называют вещества, распадающиеся в водных растворах на положительно заряженные ионы водорода (Н + ) и отрицательно заряженные ионы кислотного остатка. Например, соляная кислота диссоциирует по уравнению
Положительно заряженные ионы называют катионами, а отрицательно заряженные – анионами. Таким образом, при диссоциации соляной кислоты образуется катион водорода и анион хлора (хлорид-ион).
Число ионов водорода, образующихся при полной диссоциации молекулы кислоты, называется основностью кислоты.Так, соляная кислота является одноосновной, а серная кислота – двухосновной, т.к. при её диссоциации образуются два иона водорода:
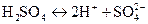
Электролиты могут диссоциировать (распадаться на ионы) полностью, и такие вещества называют сильными электролитами. Электролиты, диссоциирующие частично, называют слабыми или средними. Серная, азотная и соляная кислоты относятся к сильным электролитам (сильным кислотам), а угольная кислота является слабой кислотой (слабым электролитом).
Основаниями с точки зрения теории электролитической диссоциации называют вещества, распадающиеся в водных растворах на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы (ОН — ). Например, гидроксид натрия диссоциирует по уравнению
Число гидроксид-ионов, образующихся при полной диссоциации молекулы основания, называется кислотностью основания.Так, гидроксид натрия является однокислотным, а гидроксид кальция – двухкислотным:
Основания, как и все электролиты, могут быть сильными, слабыми и средней силы. Гидроксиды натрия, калия и кальция являются сильными основаниями, а гидроксид аммония – слабым основанием.
Амфотерные гидроксиды могут диссоциировать как кислоты и как основания:
В реакциях с кислотами амфотерные гидроксиды диссоциируют как основания, а в реакциях с основаниями – как кислоты.
Средние соли в водных растворах диссоциируют на катионы металла и анионы кислотного остатка:
Кислые соли могут диссоциировать частично:
или полностью с образованием кроме иона металла также катиона водорода:
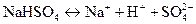
Соответственно, основные соли также могут диссоциировать частично или полностью:
CaOHCl ↔ CaOH + + + Cl — ;
CaOHCl ↔ Ca 2+ + OH — + Cl — .
Большинство солей являются сильными электролитами.
1.11. Контрольные вопросы
1. Какие элементы 3-го периода ПСЭМ относятся к металлам? Ответ: натрий, магний, алюминий.
2. Какие элементы 4-й группы главной подгруппы относятся к неметаллам, полуметаллам, металлам?
Ответ: углерод, кремний – неметаллы, германий – полуметалл, олово и свинец – металлы.
3. Напишите уравнения реакций взаимодействия цинка ( СО + 2), фосфора ( СО + 5) и титана ( СО + 4) с кислородом.
4. Напишите уравнения реакций взаимодействия кальция, фосфора (СО +3, и калия с хлором.
5. Напишите уравнения реакции взаимодействия оксида фосфора(V) и оксида магния с водой.
6. Напишите уравнение реакции взаимодействия оксида магния с оксидом углерода (IV).
7. Напишите уравнения реакций взаимодействия оксида алюминия с оксидом натрия и оксидом серы (VI).
8. Напишите уравнение реакции взаимодействия соляной кислоты с алюминием.
9. Напишите уравнение реакции взаимодействия азотной кислоты с оксидом алюминия.
10. Напишите уравнения реакций взаимодействия серной кислоты с гидроксидом калия и гидроксидом железа (II).
11. Напишите уравнение реакции взаимодействия гидроксида аммония с соляной кислотой.
12. Напишите уравнения реакций взаимодействия гидроксида натрия с оксидом серы (VI) и оксидом цинка (степень окисления цинка +2).
13. Напишите уравнение реакции взаимодействия сульфата железа (III) с едким натром, зная, что гидроксид железа (III) не растворим в воде.
14. Напишите уравнение реакции взаимодействия соляной кислоты с сульфитом натрия (Na2SO3), зная, что сернистая кислота неустойчива и разлагается на воду и газообразный оксид серы (IV).
15. Напишите уравнение реакции взаимодействия сульфата натрия с хлоридом кальция, зная, что сульфат кальция не растворим в воде.
16. Напишите уравнения электролитической диссоциации азотной кислоты, гидроксида калия и хлорида магния.
17. Напишите уравнения электролитической диссоциации угольной кислоты, гидроксида магния и сульфата алюминия.
18. Напишите уравнения электролитической диссоциации фосфорной кислоты (H3PO4) , гидроксида бария (Ba(OH)2) и нитрата магния.
Дата добавления: 2016-10-07 ; просмотров: 4711 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Свойства кислот оснований и солей с точки зрения ТЭД (теории электролитической диссоциации). Амфотерность.
Основания. Название «основание» первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Примеры: NaOH — гидроксид натрия (едкий натр), KOH — гидроксид калия (едкое кали), Ca(OH)2 — гидроксид кальция (гашёная известь).
Основания, которые хорошо растворяются в воде, называются щелочами, К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид — ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид — ион
NaOH 
Ba(OH)2
NH3·H2O 
Кислоты. Кислоты исторически получили своё название из-за кислого вкуса водных растворов тактх веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остатка
H2SO4
CH3COOH 
Соли. С точки зрения теории электролитической реакции соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
Соль -> Катион основания + Анион кислотного остатка
BaCl2
K2CO3
Амфотерность — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H + ), так и по механизму оснований (отщепление гидроксид-ионов, OH – ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
H + + XO − ⇄ XOH ⇄ X + + OH −
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2 ⇄ NO + + OH − Kb ≈ 10 − 7
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы.
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротоли:
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
H2N — CH(R) — COOH + H2O ⇄ [ H3N — CH(R) — COOH ] + + OH −
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3 + являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома (III) известны реакции:
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами H2O и OH – . Например, для Al(OH3) ионные равновесия могут быть записаны следующим образом:
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Окислительно-восстановительные реакции. Понятие «степень окисления». Типы окислительно-восстановительных реакций (привести примеры).
Окислительно-восстановительные реакции, также редокс— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2-х атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окислении вещества в результате отдачи электронов увеличивается его степени окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель +e− ↔ сопряжённый восстановитель.
Восстановление — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель -e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Последнее изменение этой страницы: 2017-02-05; Нарушение авторского права страницы
18.Характеристики кислот, оснований и солей с точки зрения теории электролитической диссоциации. Амфотерность гидроксидов.
Диссоциация оснований. Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-ионы OH : NaOH Na + + OH ; Ca(OH)2 CaOH + + OH ; CaOH + Ca 2+ + OH .
Ступенчатость диссоциации обусловливает возможность образования основных и кислых (см. ниже) солей.
Диссоциация кислот. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода H + . HCl H + + Cl ; HNO3 H + + NO3 ; H2SO4 H + + HSO4 — ; HSO4 H + + SO4 2 ; H3PO4 H + + H2PO4 ; H2PO4 H + + HPO4 2 ; HPO4 2 H + + PO4 3 .
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды дис-социируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H + и гидроксид-анионы OH : H + + MeO ⇄ MeOH ⇄ Me + + OH .
К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома Cr(OH)3, свинца Pb(OH)2 и др.
1. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка. Напри-мер, Na2SO4 2 Na + + SO4 2 ; Ca3(PO)4 3 Ca 2+ + 2 PO4 3 .
2.Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода и кислотного остатка: KHSO3 K + + HSO3 ( = 1).
Сложный анион диссоциирует частично: HSO3 ⇄ H + + SO3 2 ( : Al(OH)2Cl Al(OH)2 + + Cl ( = 1).
Сложный катион диссоциирует частично: Al(OH)2 + ⇄ AlOH 2+ + OH ( 2+ ⇄ Al 3+ + OH ( + + Al 3+ + 2 SO4 2 ;
Сложные соли диссоциируют на катион металла и анионы кислотных остатков. Например, ZnClNO3 Zn 2+ + Cl + NO3 ;
19. Окислительно-восстановительные реакции (овр). Степень окисления атомов Основные окислители и восстановители. Составление уравнений овр методами электронного и электронно-ионного баланса.
ОВР-реакции, протекающие с изменением степени окисления.
Окисление – это процесс отдачи электронов при этом происходит понижение степени окисления.
Восстановление – это процесс присоединения электронов, при этом происходит понижение степени окисления.
Реакции, в кот. ок-ль. и восст-ль предс. собой различные ве-ва наз. межмолеклярными. Если ок-ль и восс-ль атомы одной молекулы — внутримолекулярные.
Под степенью окисления (окислительным числом) понимают условный заряд атома в соединении, вычисленный из предположения, что в молекуле все связи ионные. Степень окисления указывает, сколько электронов оттянуто от атома (положительная степень окисления) или притянуто к нему от другого атома (отрицательная степень окисления). Мера удаления или приближения электронов к атому в степени окисления не отражена.Восстановители
а) Металлы как простые вещества: K 0 , Na 0 , Ca 0 , Al 0 и др.
б) Простые анионы неметаллов: S 2 , Cl , J , Br , Se 2 и др.
в) Сложные анионы и молекулы, содержащие электроположитель-ные элементы в промежуточной степени окисления: S +4 O3 2 , N +3 O2 , As +3 O3 3 , Cr +3 O2 , [Fe +2 (CN)6] 4 , C +2 O, N +2 O, S +4 O2 и др.
г) Простые катионы в низшей степени окисления: Fe 2+ , Sn 2+ , Cr 3+ , Cu + , Mn 2+ , As 3+ и др.
д) Некоторые простые вещества:
е) Катод при электролизе.
а) Неметаллы как простые вещества с большой электроотрицательностью: F2, O2, Cl2 и др.
б) Простые катионы в высокой степени окисления: Sn 4+ , Fe 3+ , Cu 2+ и др., а также H + .
г) Сложные ионы и молекулы, содержащие атомы неметаллов в положительной степени окисления: H2S +6 O4, S +6 O3, HOCl +1 , HCl +5 O3,
д) Анод при электролизе.
В соединениях, когда атомы находятся в промежуточной степени окисления, последние могут проявлять как восстановительные, так и окислительные свойства (окислительно-восстановительная двойствен-ность):
Применяют два метода составления уравнений реакций окисления-восстановления:
Эквивалентная (Нормальная) концентрация
это число эквивалентов в 1 литре раствора. Обозначают символом Сн
0,1 нормальный раствор — децинормальный.
Мольная доля — это величина, характеризующая отношение количества молей данного вещества к общему количеству молей всех веществ, находящихся в смеси или растворе. Для того чтобы определить мольные доли веществ, необходима лишь таблица Менделеева и элементарное умение совершать вычисления.
Чтобы определить мольную долю того или иного вещества, вам понадобится сначала вычислить количество молей и этого вещества и всех других веществ, содержащихся в смеси (растворе), потом подставить эти величины в следующую формулу:Х = n1/Σn , где Х – мольная доля интересующего нас вещества, n1 – количество его молей, а Σn – сумма количества молей всех имеющихся веществ.
Электролитическая диссоциация. Влияние природы вещества на его способность к электролитической диссоциации в водном растворе. Гидратация ионов в растворе. Основания и кислоты с точки зрения теории электролитической диссоциации. Ион гидроксония. Амфотерные гидроксиды. Кислотно-основной характер диссоциации. Диссоциация средних, кислых и основных солей.
Под электролитической диссоциацией понимают распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов. Например, молекула уксусной кислоты так диссоциирует в водном растворе:
CH3COOH === + СО
Процесс диссоциации во всех случаях является обратимым, поэтому при надписи уравнений диссоциации применяется знак обратимости(стрелочки –туда и обратно).
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Гидратация ионов во многом определяет их поведение в растворе — она влияет на скорость передвижения ионов, на условия их взаимного сближения и адсорбции на разделах фаз. Чем больше и устойчивей гидратная оболочка, тем труднее перемещаться ионам в воде и сближаться друг с другом или адсорбироваться.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
NаОН « Na+ + OH-; Ва(ОН)2 « Ba2+ + 2OH-; NH3·H2O « NH4+ + OH-.
С точки зрения теории электролитической диссоциации кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+,
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
СН3СООН = Н+ + СН3СОО-.
Гидроксо́ний (оксоний, гидроний) НзО+ — комплексный ион, соединение протона с молекулой воды.
Амфоте́рные гидрокси́ды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или осно́вных гидроксидов.
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:
При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:
При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:
Соли – это электролиты, которые диссоциируют в растворе на катионы металлов (и NH4+) и анионы кислотных остатков. Соли по своему составу бывают кислые, основные и средние. Кислые соли характерны для слабых многоосновных кислот, основные – для слабых многокислотных оснований, а средние соли могут быть образованы как сильными, так и слабыми кислотами и основаниями. Однако независимо от состава, соли первично диссоциируют на катион металла и кислотный остаток.
Средняя соль AICI3 Û AI+3 + 3CI- , ZnSO4 Û Zn+2 + SO42-.
Кислая соль KHCO3 Û K+ + HCO3- NaH2PO4 Û Na+ + H2PO4
Основная соль— ZnOHCI Û ZnOH+ + CI- Cr(OH)2NO3 Û Cr(OH)2+ + NO3-
Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации. Основные представления теории сильных электролитов. Истинная и кажущаяся степень диссоциации в растворах сильных электролитов. Концентрация ионов в растворе и активность.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита: α = п/N ,
где α— степень диссоциации; п — количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α K2 > K3 = 8 · 10-3 > 6 · 10-8>10-12
Суммарному равновесию: H3PO4 ↔ 3H+ + PO43- отвечает суммарная константа диссоциации: K = K1· K2 ·K3
Закон разбавления Оствальда. Степень диссоциации определяется константой диссоциации и концентрацией слабого электролита в растворе.
Рассмотрим равновесные молярные концентрации исходного слабого электролита и образовавшихся катионов и анионов в состоянии химического равновесия:
| Молярные концентрации веществ В начальный момент времени (τ0) К моменту достижения равновесия (τравн.) | MA с0 [MA] = (1−α )с0 | M+ [M+] = αс0 | A− [A−] = αс0 |
Данное выражение было впервые выведено немецким физико-химиком В. Оствальдом (закон разбавления Оствальда). Закон разбавления показывает, что степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации. Последняя в данном растворителе и для данного электролита зависит только от температуры.
При очень низкой степени диссоциации (α о С), она называется ионным произведением воды KW:
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100 о С значения 10 -13 .
В чистой воде при 25 о С концентрации ионов водорода и гидроксила равны между собой:
[H + ] = [OH — ] = 10 -7 моль/лРастворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными.
Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10 -7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10 -14 . Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации
ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H + ] = 10 -3 моль/л, то [OH — ] = KW/[H + ] = 10 -14 /10 -3 = 10 -11 моль/л, или, если [OH — ] = 10 -2 моль/л, то [H + ] = KW/[OH — ] = 10 -14 /10 -2 = 10 -12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды.
На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями.
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
Легко показать, прологарифмировав ионное произведение воды, что
Если рН среды равен 7 — среда нейтральная, если меньше 7 — кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 8446 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
- http://poisk-ru.ru/s11360t9.html
- http://studopedia.info/1-18209.html
- http://bstudy.net/634904/estestvoznanie/svoystva_kislot_osnovaniy_soley_tochki_zreniya_teorii_elektroliticheskoy_dissotsiatsii
- http://poznayka.org/s65090t1.html
- http://infopedia.su/17x4d38.html
- http://studfiles.net/preview/2180772/page:8/
- http://studopedia.ru/4_120003_ekvivalentnaya-normalnaya-kontsentratsiya.html