Общие сведения о строении металлов
Металлы можно охарактеризовать при помощи нескольких свойств, которые будут общими для всех элементов. К таким характеристикам следует отнести высокую электрическую проводимость и теплопроводность, пластичность, благодаря которой металлы можно подвергать ковке, прокатке, штамповке или вытягиванию в проволоку, металлический блеск и непрозрачность.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип> 1000 o С) и легкоплавкие (Tкип o С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше. Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее. По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Запишем уравнение реакции растворения металла в воде. Поскольку металл двухвалентен, его реакция с водой будет описываться уравнением следующего вида: |
Согласно уравнению реакции:
N (Ме) =n (Н2) = 3,36/22,4 = 0,15 моль.
Найдем относительную атомную массу металла:
Ar(Ме) = m / n= 6,0/0,15 = 40 г/моль
Следовательно, этот металл — кальций.
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Известно, что медь не растворяется в соляной кислоте, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия хлороводородной кислоты с железом. |
Запишем уравнение реакции:
Найдем количество вещества водорода:
Согласно уравнению реакции n(H2) : n(Fe) = 1:1, т.е.n(H2) = n(Fe) = 0,25 моль. Тогда масса железа будет равна (молярная масса – 56 г/моль):
m(Fe)=0,25 ×c 56 = 14 г.
Рассчитаем массовые доли металлов в смеси:
ωFe = 14 / 20 × 100% = 0,7 × 100% = 70%.
Особенности строения атомов металлов
Таблица химических элементов содержит наименования и характеристики ста пяти различных веществ. Основная масса из них является металлами. Эти химические элементы имеют достаточно широкое распространение на нашей планете. Металлы можно встретить в различных соединениях в атмосфере и в недрах земли, в составе живых организмов и растений, а также водах океанов, морей озер и рек. Свойства данных химических элементов весьма специфичны. Их характеристики имеют ярко выраженные отличия от веществ других групп. Так, если элемент относится к разряду металла, то у него в обязательном порядке должен наблюдаться определенный перечень свойств:
— наличие плотной кристаллической структуры;
— выраженный блеск;
— способность к электрической проводимости;
— высокая степень теплопроводности;
— снижение способности проводить электричество с увеличением теплового режима;
— легкая отдача электронов;
— тягучесть, а также ковкость;
— способность образовывать различные сплавы.
Строение металлов, которое определено современным научным мировоззрением, представляет собой кристаллическую решетку. В ее основе находятся свободные электроны и ионы, обладающие положительным зарядом. Сам кристалл изображается в форме решетки, имеющей пространственную структуру. Узлы данной системы заняты ионами, а между ними находятся электроны, обладающие высокой способностью к движению. Строение атомов металлов позволяет активным частицам постоянно перемещаться. Электроны совершают переходы между атомами, а также вращаются вокруг их ядер. Зная особенности строения атомов металлов, можно легко объяснить возникновение в них электрического тока. Он появляется под воздействием разности потенциалов, когда электроны, не имеющие связей с ионами, начинают упорядоченное движение в одном направлении.
Особенности строения атомов металлов обуславливают и высокую тепловую проводимость данных элементов. Электроны, которые совершают непрерывное движение, обмениваются энергией с ионами в момент столкновения с последними. Элементы, находящиеся в узлах кристаллической решетки, передают колебания соседним частицам, те следующим и так далее. Вследствие этого процесса тепловой режим металла уравновешивается. В результате температура всей массы становится одинаковой.
Особенности строения атомов металлов заключаются в существовании между ними связей ковалентного характера. В кристаллической решетке присутствует также сила кулона, которая притягивает электроны и ионы. Это и есть металлическая связь, которая существует между частицами элемента. Данный тип соединения присутствует даже при наличии жидкого состояния вещества. Исходя из этого, можно сделать вывод, что металлической связью обладают не отдельные частицы. Ею владеют их агрегаты.
С точки зрения химии, особенности строения атомов металлов заключаются в беспрепятственной отдаче электронов валентности и переходе при этом в ионы. Вследствие этого, само вещество служит энергетическим восстановителем. Способность отдавать свои электроны у различных металлов находит свое проявление в различной степени. Чем легче происходит данный процесс, тем более активным считается элемент. При этом его взаимодействие с другими веществами происходит максимально энергично. Существует ряд напряжений, который опытным путем был составлен Бекетовым – русским ученым-химиком. Металлы в этом перечне находятся в определенной последовательности, которая характеризует убывание их химической способности к активности. Исходя из ряда напряжений, можно определить свойства элемента:
— при снижении электродного потенциала металла увеличивается его восстановительная функция;
— металлы способны вытеснять из солевых растворов те элементы, которые расположены после них в ряду напряжений;
— металлы, располагаемые в перечне активности слева от водорода, могут вытеснять его из кислотных растворов.
Урок химии :Особенности строения атомов металлов.Физические свойства металлов.
за привлеченного слушателя на курсы профессиональной переподготовки
Урок химии :Особенности строения атомов металлов. Физические свойства металлов.
Образовательная — рассмотреть положение металлов в системе элементов Д.И. Менделеева, познакомить обучающихся с основными физическими свойствами металлов, выяснить, чем они обусловлены; выявить закономерности проявления металлами физических свойств; ввести понятие о сплавах и их свойствах.
Развивающая — развивать теоретическое мышление обучающихся и их умение прогнозировать физические свойства металлов на основе их строения атома.
Воспитательная — способствовать развитию познавательного интереса обучающихся к изучению химии
Обучающиеся должны изучить положение металлов в Периодической системе элементов,
Выяснить особенности строения их атомов и кристаллов; физические свойства металлов; отличие свойств металлов от свойств их сплавов.
Уметь применять полученные знания при выполнении заданий, упражнений по данной теме.
Тип урока: урок изучения нового материала.
коллекция металлов и сплавов; таблицы «Виды химической связи», «Типы кристаллических решеток» и «Общие физические свойства металлов»,
две стеклянные пластинки и вода для проведения опыта.
I. Организационный момент
(преподаватель знакомит обучающихся с темой урока, записанной на доске, планом проведения урока).
II. Новый материал
Преподаватель задает вопросы обучающимся :
1. Как изменяются в периодах периодической системы свойства химических элементов?
2. Как изменяются свойства химических элементов в главных подгруппах?
3. Где располагаются металлы в периодической системе?
Обучающиеся делают выводы:
— Металлами называют химические элементы и простые вещества.
— Металлы занимают левую нижнюю часть периодической системы. А, следовательно, их атомы имеют большие радиусы и, как правило, небольшое количество валентных электронов. Для их ионизации требуется относительно небольшая энергия. Возникающие положительные ионы металла удерживаются все вместе за счет притяжения ко всем свободно движущимся в металле электронам.
Преподаватель демонстрирует таблицу «Виды химической связи», задает вопрос : в чем сходство и различия между металлической связью и ковалентной? ?(сходство с ковалентной: валентные электроны находятся в общем пользовании, но в случае ковалентной в общем пользовании только двух атомов, а в случае металлической связи эти электроны связывают все атомы куска металла, создают «электронный газ».)
В чем сходство и различия между металлической и ионной связью? ( с ионной связью металлическая сходна наличием ионов, но в металлической положительные ионы удерживаются «электронным газом», а в ионной — положительными ионами)
Преподаватель демонстрирует таблицу «Типы кристаллических решеток»:
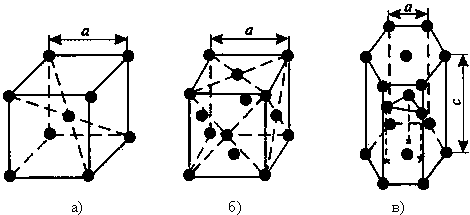
Благодаря притяжению всех свободных электронов всеми положительными ионами металлическая связь очень прочна, поэтому для металлов характерны кристаллические решетки с плотной упаковкой ионов: гексагональная (цинк, магний), кубическая гранецентрированная (медь, серебро, алюминий) и менее плотная — кубическая объемноцентрированная (железо, натрий, барий).
Преподаватель: И так, металл — это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами.
Рассмотрите образцы металлов и назовите, какими общими физическими свойствами они обладают?
Обучающиеся называют: электропроводность, теплопроводность, металлический блеск, твердость, пластичность.
Преподаватель: Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
Обучающиеся делают вывод: причина в особенностях металлической связи, структуре кристаллов металлического типа.
Преподаватель: демонстрирует таблицу «Общие физические свойства металлов»
Преподаватель: Действительно, электрическая проводимость металлов объясняется движением свободных электронов. Почему при нагревании электрическая проводимость металлов уменьшается? Чем обусловлена теплопроводность, и как она изменяется при нагревании? (отвечать на вопросы помогает таблица).
Пластичность — способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов?
В этом нам поможет разобраться следующий опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они легко скользят друг по другу, но их трудно разъединить. Прослойка воды имитирует свободные электроны, а значит причина пластичности — также особое строение кристаллической решетки.
Металлический блеск также обусловлен особым строением металлов (благодаря свободным электронам металлы хорошо отражают световые лучи).
Преподаватель: Да, металлы обладают общими физическими свойствами, которые обусловлены их особым строением, но у разных металлов степень проявления каждого свойства различна. Так, лучшей электропроводностью обладает серебро, на втором месте — медь, а на третьем — золото.
Такие различия в проявлении физических свойств связаны с тем, как плотно упакованы ионы в кристаллической решетке металла, каковы их размеры и сколько валентных электронов у каждого атома обобществляется. Например, чем большее число атомов металла находиться в единице объема металла, тем большей плотностью он будет обладать. Наиболее плотная упаковка ионов в кристаллах гексагонального вида. Однако плотность вещества зависит не только от вида кристаллической решетки, но и от массы составляющих его ионов и от их радиусов. Поэтому наименьшей плотностью обладают щелочные металлы. Самый тяжелый из всех металлов — осмий.
Если металлы образуют кристаллы одного вида (например, щелочные металлы), то возрастание плотности по ряду от лития до цезия объясняется увеличением их атомных масс и масс образуемых ионов, т.к. массы возрастают в большей степени, чем атомные радиусы. Если металлы образуют кристаллы разного вида, то закономерность более сложная, и ее описанием занимается больше физика, чем химия.
В зависимости от плотности металлы принято делить на легкие (их плотность менее 5 г/см 3 ) и тяжелые (их плотность более 5 г/см 3 ). Так у алюминия плотность — 2, 7 г/см 3 — металл легкий.
Пластичность металлов также зависит от вида кристалла и от количества связывающих электронов, от размеров ионов.
Самый пластичный — золото. Кусочек золота величиной со спичечную головку можно расплющить в просвечивающий голубовато-зеленым светом лист площадью 50 квадратных метров. Образец золота весом 1г можно протянуть в проволоку длиной 2 км. Исстари на Руси выделывали «сусальное золото»: сначала его прокатывали в вальцах до толщины листа писчей бумаги, затем укладывали между тонкими пленками, снятыми со слепой кишки коровы и прокатывали на наковальне деревянными молоточками. Повторяя эту операцию неоднократно, получали листочки золота толщиной всего в десятую долю микрона, т.е. 500 атомов. «Сусальное золото» шло на покрытие деревянных предметов, кожи и т.п.
Самые хрупкие металлы V, VI, VII групп. У них от 5 до 7 валентных электронов, следовательно, очень крепкая связь ионов между собой, что препятствует их скольжению друг относительно друга, снижает пластичность. Этим же объясняется их тугоплавкость и твердость.
Чем меньше количество свободных электронов, чем больше размеры ионов, чем слабее связи ионов, тем мягче металлы. Самые мягкие — щелочные металлы, самый твердый — хром.
Температуры плавления металлов изменяются в очень широких пределах: от минус 39°С до 3410 у вольфрама. Ртуть единственный жидкий при обычных условиях металл.
Следует еще раз обратить внимание , что степень проявления физических свойств у разных металлов зависит не только от количества валентных электронов, но и от вида кристаллической решетки, размеров атомов и ионов, т.е. причины проявления металлами физических свойств многообразны.
Самостоятельная работа обучающихся:
1.Заполните таблицу: «Физические свойства металлов»
используя таблицу приложения: «Справочные данные о физических свойствах металлов»
Примеры металлов, у которых свойство наиболее выражено
Физические свойства металлов с точки зрения строения атома
§ 61. Физические свойства металлов
Кристаллические решетку металлов сходны с атомными решетками. Но в атомных решетках связи между атомами ковалентные, а в металлах мы встречаемся с новым видом химической связи: металлической связью. Валентные электроны не закреплены в металлах каждый за своим атомом или своей парой атомов (как в ковалентных связях), а могут отщепляться от атомов и свободно блуждать между ними. Такие электроны осуществляют связь между ионами металла, наподобие прослойке воды между сложенными вместе пластинками: она позволяет перемещать пластинки относительно друг друга, но сопротивляется отрыванию одной пластинки от другой. Из такого внутреннего строения металлов проистекают их характерные, общие физические свойства:
- Пластичность. При деформации, т. е. изменении формы куска металла, происходит смещение пластов из ионов относительно друг друга, но разрыва не происходит, так как связывающие их электроны, соответственно переместившись, продолжают осуществлять связь между сместившимися ионами.
- Электропроводность. Она обусловливается свободой перемещения электронов, поскольку они не закреплены каждый за своим атомом, по всему куску металла.
- Высокая теплопроводность. Переносчиками тепловой энергии из одного участка в куске металла в другой являются главным образом те же электроны.
Они же являются причиной общих оптических свойств неметаллов — непрозрачности и металлического блеска.
По металлическому блеску мы узнаем металлы и их сплавы среди других веществ. Металлы блестят потому, что отражают от своей поверхности световые лучи, а не пропускают их, как стекло, и почти не поглощают, как сажа.
Металлы отражают не только видимый свет, но и невидимые радиоволны. Это свойство металлов используется в радиотелескопах, улавливающих радиоизлучения космоса, и в радиолокаторах, обнаруживающих самолеты на расстоянии сотен километров от наблюдателя.
Будучи общими всем металлам, перечисленные свойства проявляются у них в неодинаковой степени. Так, металлический блеск наиболее ярко проявляется у серебра; оно и применяется в производстве зеркал. Смотрясь в зеркало, мы видим свое отражение от тончайшего слоя серебра, нанесенного на заднюю поверхность стеклянной пластинки.
По электропроводности первое место среди всех веществ занимает то же серебро, к нему примыкают медь и алюминий. В электротехнике из-за дороговизны серебра в качестве материала для электропроводки используются медь и алюминий. Без этих металлов невозможно было бы передавать электрическую энергию на расстояния в десятки, сотни километров от вырабатывающей ее электростанции лишь с незначительными потерями в пути.
Электропроводность остальных металлов изменяется в очень широких пределах. Например, у вольфрама она в 340 раз меньше, чем у серебра. Техника нуждается и в таких металлах с умеренной электропроводностью. Они необходимы в электронагревательных устройствах. Нить накала электролампочки нагревается за счет сопротивления, оказываемого ею электрическому току, поэтому для изготовления ее нужен металлический материал с малой электропроводностью. Сейчас нити накала изготовляются главным образом из вольфрама.
Теплопроводность чистых металлов пропорциональна их электропроводности. Поэтому по теплопроводности металлы располагаются в такой же ряд как и по электропроводности: серебро, за ним следуют медь и алюминий, далее прочие металлы.
Основное механическое свойство металлов — пластичность — на практике проявляется в том, что под ударами молота металлы не дробятся на куски, а расплющиваются — они ковки. Первое место среди металлов по ковкости занимает золото. Его можно прокатывать в тончайшие полупрозрачные листы и вытягивать в тончайшую, невидимую глазом проволоку.
Из неспецифических для металлов физических свойств наибольший практический интерес имеют плотность, температура плавления и твердость.
Плотность металла тем меньше, чем меньше его атомный вес и чем больше радиус атома (почему?). Она у металлов изменяется в очень широких пределах — от 0,5 у лития до 22 у осмия. Металлы с плотностью ниже 5 называются легкими металлами. Из конструкционных металлов к легким относятся магний, алюминий и титан; они используются, главным образом, в строительстве транспорта, титан — в самолетах, летающих со сверхзвуковыми скоростями. Трение о воздух при таких скоростях вызывает сильное разогревание обшивки самолета, а прочность металлов при нагреве сильно снижается, прежде чем станет равной нулю, когда металл расплавится. У титана высокая температура плавления и снижения прочности у него в условиях скоростных полетов, в отличие от алюминиевых сплавов, не происходит.
В тех редких случаях, когда от металлического материала требуется возможно большая плотность (дробь, пули), используется свинец, хотя его плотность примерно вдвое меньше, чем у наиболее тяжелых, но дорогих металлов.
Свойства металлов: температура плавления, прочность, твердость — зависят главным образом от прочности металлической связи. Она у разных металлов неодинакова, и особенно велика у тяжелых металлов с достраивающимся предпоследним электронным слоем атома, поэтому такие металлы отличаются высокой тугоплавкостью и высокой твердостью.
Температуры плавления металлов изменяются в очень широких пределах: от -39°С у ртути до 3410°С у вольфрама. Ртуть как единственный жидкий при обычных условиях металл применяется в измерительных приборах, вольфрам — во всех случаях, когда требуется металлический материал, противостоящий особенно высоким температурам, например для нитей накала электролампочек.
В широких пределах изменяется и твердость металлов: щелочные металлы мягки, как воск, а самые твердые из металлов, к которым относятся вольфрам и хром, не поддаются обработке закаленными напильниками.
К числу общих свойств металлов относится их растворимость друг в друге. Такие растворы металлов называются сплавами. Для каждого металлического изделия и каждой металлической детали подбирается или создается «по заказу» такой материал, который наилучшим образом удовлетворяет назначению изделия или детали. Среди чистых металлов такого материала, в котором сочетались бы все заданные свойства, обычно не находится, и тогда мы обращаемся к сплавам.
Так, в электролампочке, кроме вольфрама и цинка — из него изготовлен цоколь,- мы находим два сплава. Припой — легкоплавкий сплав свинца с сурьмой и оловом, из него состоит контакт лампочки и спай патрона с проволочкой, подводящей ток к нити накала, сама же эта проволочка из платинита — сплава железа с никелем, расширяющегося при нагревании одинаково со стеклом, вследствие чего она может впаиваться в стекло и при нагревании в месте спая не трескается (рис. 49).
Рис. 49. В состав электролампочки входит семь металлов
Строение металлов
Электронное строение атома металла включает:
- положительно заряженное ядро;
- отрицательно заряженные электроны.
Ядро состоит из протонов и нейтронов. Количество протонов, заряд ядра и число электронов соответствуют порядковому номеру металла в периодической таблице.
Электроны в металлических атомах расположены намного дальше от ядра, чем электроны неметаллов. Этим объясняется лёгкость отделения валентных электронов, поэтому металлы всегда являются восстановителями в химических реакциях.
Атомы всех металлов, за исключением ртути, образуют кристаллические решётки. Кристаллическая решётка состоит из повторяющихся комплексов атомов – элементарных кристаллических ячеек, которые бывают трёх видов. Их отличия описаны в таблице строения металлов.
Вид решётки
Характеристика
Примеры
Кубическая объёмно-центрированная (ОЦК)
Восемь ионов находятся по углам условного куба, один – в середине
Ионы располагаются в углах куба и в центре каждой грани. Центр куба свободен
Шестигранная призма. В углах и в центре между ними находятся ионы. Посередине призмы лежат ионы, образующие треугольник
Рис. 1. Виды решёток металлов.
Физические свойства
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Классификация металлов приведена в таблице.
2. Общие физические свойства металлов
- При обычных условиях все металлы (за исключением ртути, её температура плавления — \(–39\) °C) являются твёрдыми веществами.
- Способность металлов отражать падающий на них свет является причиной наличия у них особого металлического блеска.
- Металлы не имеют запаха.
2 .Физические свойства металлов.
С внешней стороны металлы, как известно, характеризуются прежде всего
особым «металлическим» блеском, который обусловливается их способностью
сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно
только в том случае, когда металл образует сплошную компактную массу.
Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными в
порошок, но большинство металлов в мелкораздробленном виде имеет черный
или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и
электропроводностью, причем по способности проводить тепло и ток
располагаются в одном и том же порядке: лучшие проводники — серебро и медь,
худшие — свинец и ртуть. С повышением температуры электропроводность
падает, при понижении температуры, наоборот, увеличивается.
Очень важным свойством металлов является их сравнительно легкая
механическая деформируемость. Металлы пластичны, они хорошо куются,
вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов находятся в связи с
особенностями их внутренней структуры. Согласно современным воззрениям,
кристаллы металлов состоят из положительно заряженных ионов и свободных
электронов, отщепившихся от соответствующих атомов. Весь кристалл можно
себе представить в виде пространственной решетки, узлы которой заняты
ионами, а в промежутках между ионами находятся легкоподвижные электроны.
Эти электроны постоянно переходят от одних атомов к другим и вращаются
вокруг ядра то одного, то другого атома. Так как электроны не связаны с
определенными ионами, то уже под влиянием небольшой разности потенциалов
они начинают перемещаться в определенном направлении, т.е. возникает
Наличием свободных электронов обусловливается и высокая
теплопроводность металлов. Находясь в непрерывном движении, электроны
постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому
колебания ионов, усилившиеся в данной части металла вследствие нагревания,
сейчас же передаются соседним ионам, от них — следующим и т.д., и тепловое
состояние металла быстро выравнивается; вся масса металла принимает
По плотности металлы условно подразделяются на две большие группы:
легкие металлы, плотность которых не больше 5 г/см3, и тяжелые металлы —
все остальные. Плотность, а также температуры плавления некоторых металлов
приведены в таблице №1.
Плотность и температура плавления некоторых металлов.
|Название |Атомный вес |Плотность, |Температура |
| | |г/см3 |плавления, C | и8.
|Литий |6,939 |0,534 |179 |
|Калий |39,102 |0,86 |63,6 |
|Натрий |22,9898 |0,97 |97,8 |
|Кальций |40,08 |1,55 |850 |
|Магний |24,305 |1,74 |651 |
|Цезий |132,905 |1,90 |28,5 |
|Алюминий |26,9815 |2,702 |660,1 |
|Барий |137,34 |3,5 |710 |
|Цинк |65,37 |7,14 |419 |
|Хром |51,996 |7,16 |1875 |
|Марганец |54,9380 |7,44 |1244 |
|Олово |118,69 |7,28 |231,9 |
|Железо |55,847 |7,86 |1539 |
|Кадмий |112,40 |8,65 |321 |
|Никель |58,71 |8,90 |1453 |
|Медь |63,546 |8,92 |1083 |
|Висмут |208,980 |9,80 |271,3 |
|Серебро |107,868 |10,5 |960,8 |
|Свинец |207,19 |11,344 |327,3 |
|Ртуть |200,59 |13,546 |-38,87 |
|Вольфрам |183,85 |19,3 |3380 |
|Золото |196,967 |19,3 |1063 |
|Платина |195,09 |21,45 |1769 |
|Осмий |190,2 |22,5 |2700 |
Частицы металлов, находящихся в твердом и жидком состоянии, связаны
особым типом химической связи — так называемой металлической связью. Она
определяется одновременным наличием обычных ковалентных связей между
нейтральными атомами и кулоновским притяжением между ионами и свободными
электронами. Таким образом, металлическая связь является свойством не
отдельных частиц, а их агрегатов.
Химические свойства металлов.
Основным химическим свойством металлов является способность их атомов
легко отдавать свои валентные электроны и переходить в положительно
заряженные ионы. Типичные металлы никогда не присоединяют электронов; их
ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны,
типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов
далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем
он активнее, тем энергичнее вступает во взаимодействие с другими
Опустим кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк
начинает растворяться, а из раствора выделяется свинец. Реакция выражается
Zn + Pb(NO3)2 = Pb + Zn(NO3)2
Из уравнения следует, что эта реакция является типичной реакцией
окисления-восстановления. Сущность ее сводится к тому, что атомы цинка
отдают свои валентные электроны ионам двухвалентного свинца, тем самым
превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в
виде металлического свинца. Если поступить наоборот, то есть погрузить
кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет.
Это показывает, что цинк более активен, чем свинец, что его атомы легче
отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Вытеснение одних металлов из их соединений другими металлами впервые
было подробно изучено русским ученым Бекетовым, расположившим металлы по их
убывающей химической активности в так называемый «вытеснительный ряд». В
настоящее время вытеснительный ряд Бекетова носит название ряда напряжений.
В таблице №2 представлены значения стандартных электродных
потенциалов некоторых металлов. Символом Me+/Me обозначен металл Me,
погруженный в раствор его соли. Стандартные потенциалы электродов,
выступающих как восстановители по отношению к водороду, имеют знак «-», а
знаком «+» отмечены стандартные потенциалы электродов, являющихся
Стандартные электродные потенциалы металлов.
|Электрод |Е0,В |Электрод |Е0,В |
|Li+/Li |-3,02 |Co2+/Co |-0,28 |
|Rb+/Rb |-2,99 |Ni2+/Ni |-0,25 |
|Ba2+/Ba |-2,90 |Pb2+/Pb |-0,13 |
|Sr2+ /Sr |-2,89 |H+/1/2H2 |0,00 |
|Ca2+/Ca |-2,87 |Sb3+/Sb |+0,20 |
|Na+/Na |-2,71 |Bi3+/Bi |+0,23 |
|La3+/La |-2,37 |Cu2+/Cu |+0,34 |
|Mg2+/Mg |-2,34 |Cu+/Cu |+0,52 |
|Al3+/Al |-1,67 |Ag+/Ag |+0,80 |
|Mn2+/Mn |-1,05 |Pd2+/Pd |+0,83 |
|Zn2+/Zn |-0,76 |Hg2+/Hg |+0,86 |
|Cr3+/Cr |-0,71 |Pt2+/Pt |+1,20 |
|Fe2+/Fe |-0,44 |Au3+/Au |+1,42 |
Металлы, расположенные в порядке возрастания их стандартных
электродных потенциалов, и образуют электрохимический ряд напряжений
металлов: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni,
Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньше электродный потенциал металла, тем больше его
2. Каждый металл способен вытеснять(восстанавливать) из растворов солей
те металлы, которые стоят в ряду напряжений после него.
3. Все металлы, имеющие отрицательный стандартный электродный
потенциал, то есть находящиеся в ряду напряжений левее водорода,
способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение
металлов и их солей только в водных растворах и при комнатной температуре.
Кроме того, нужно иметь ввиду, что высокая электрохимическая активность
металлов не всегда означает его высокую химическую активность. Например,
ряд напряжений начинается литием, тогда как более активные в химическом
отношении рубидий и калий находятся правее лития. Это связано с
исключительно высокой энергией процесса гидратации ионов лития по сравнению
Строение атомов металлов и их особенности
Общие сведения о строении металлов
Металлы можно охарактеризовать при помощи нескольких свойств, которые будут общими для всех элементов. К таким характеристикам следует отнести высокую электрическую проводимость и теплопроводность, пластичность, благодаря которой металлы можно подвергать ковке, прокатке, штамповке или вытягиванию в проволоку, металлический блеск и непрозрачность.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип> 1000 o С) и легкоплавкие (Tкип o С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше. Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее. По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Запишем уравнение реакции растворения металла в воде. Поскольку металл двухвалентен, его реакция с водой будет описываться уравнением следующего вида: |
Согласно уравнению реакции:
N (Ме) =n (Н2) = 3,36/22,4 = 0,15 моль.
Найдем относительную атомную массу металла:
Ar(Ме) = m / n= 6,0/0,15 = 40 г/моль
Следовательно, этот металл — кальций.
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Известно, что медь не растворяется в соляной кислоте, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия хлороводородной кислоты с железом. |
Запишем уравнение реакции:
Найдем количество вещества водорода:
Согласно уравнению реакции n(H2) : n(Fe) = 1:1, т.е.n(H2) = n(Fe) = 0,25 моль. Тогда масса железа будет равна (молярная масса – 56 г/моль):
m(Fe)=0,25 ×c 56 = 14 г.
Рассчитаем массовые доли металлов в смеси:
ωFe = 14 / 20 × 100% = 0,7 × 100% = 70%.
Тема: Общая характеристика металлов по их положению в Периодической системе с точки зрения строения атома Цель урока
|
- http://fb.ru/article/50513/osobennosti-stroeniya-atomov-metallov
- http://infourok.ru/urok-himii-osobennosti-stroeniya-atomov-metallovfizicheskie-svoystva-metallov-1022863.html
- http://chemlib.ru/books/item/f00/s00/z0000037/st065.shtml
- http://obrazovaka.ru/himiya/stroenie-metallov-osobennosti-tablica.html
- http://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/metally-15154/re-a5531b87-3eac-40ca-a3ae-f4f5a1d95caa
- http://studfiles.net/preview/1866005/
- http://ru.solverbook.com/spravochnik/ximiya/11-klass/stroenie-atoma/metally/
- http://uz.denemetr.com/docs/1267/index-4292.html
- http://helpiks.org/5-111104.html




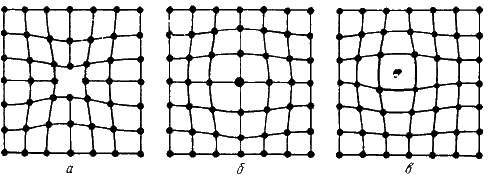
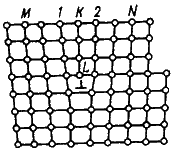 ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.