Идеальный газ. Идеальный газ с точки зрения молекулярно-кинетической теории простейшая физическая модель реального газа.
Под моделью в физике понимают не увеличенную или уменьшенную копию реального объекта. Физическая модель – это создаваемая учеными общая картина реальной системы или явления, которая отражает наиболее существенные, наиболее характерные свойства системы.
В физической модели газа принимаются во внимание лишь те основные свойства молекул, учет которых необходим для объяснения главных закономерностей поведения реального газа в определенных интервалах давления и температуры.
В молекулярно-кинетической теории идеальным газом называют газ, состоящий из молекул, взаимодействие между которыми пренебрежимо мало. Иными словами, предполагается, что средняя кинетическая энергия молекул идеального газа во много раз больше потенциальной энергии их взаимодействия.
Реальные газы ведут себя подобно идеальному газу при достаточно больших разрежениях, т. е. когда среднее расстояние между молекулами во много раз больше их размеров. В этом случае силами притяжения между молекулами можно полностью пренебречь. Силы же отталкивания проявляются лишь на ничтожно малых интервалах времени при столкновениях молекул друг с другом.
В простейшей модели газа молекулы рассматривают как очень маленькие твердые шарики, обладающие массой. Движение отдельных молекул подчиняется законам механики Ньютона. Конечно, нет никакой гарантии, что с помощью такой модели можно объяснить все процессы в разреженных газах. Ведь известно, что молекулы отличаются не только массами. Они имеют сложное строение.
Но сейчас мы поставим и будем решать достаточно узкую задачу: вычислим давление газа с помощью молекулярно-кинетической теории . Для этой задачи простейшая модель газа оказывается удовлетворительной. Она приводит к результатам, которые подтверждаются опытом.
Давление газа в молекулярно-кинетической теории. Пусть газ находится в закрытом сосуде. Манометр показывает давление газа p0. (Напомним: давление определяется отношением модуля F силы, действующей перпендикулярно поверхности, к площади поверхности S: . Давление выражается в паскалях или миллиметрах ртутного столба: 1 Па = 1 Н/м² = 7,5 · 10 – ³ мм рт. ст.) Но как возникает это давление? Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку сила, действующая со стороны всех молекул на единицу площади стенки, т. е. давление, будет быстро меняться со временем примерно так, как показано на рисунке 18. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади его чувствительного элемента – мембраны. Несмотря на небольшие изменения давления, среднее значение давления p0 практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.
Давление газа будет тем больше, чем больше молекул ударяется о стенку за некоторый интервал времени и чем больше скорости соударяющихся со стенкой молекул.
Возникновение давления газа можно пояснить с помощью простой механической модели. Возьмем диск (он играет роль мембраны манометра) и закрепим его на стержне так, чтобы он располагался вертикально и мог поворачиваться вместе со стержнем вокруг вертикальной оси (рис. 19). С помощью наклонного желоба на диск направим струйку мелкой дроби (дробинки играют роль молекул). В результате многочисленных ударов дробинок на диск будет действовать некоторая средняя сила, вызывающая поворот стержня и изгиб упругой пластины П. Эффект же от ударов отдельных дробинок не заметен.
Тепловое движение молекул. С самого начала нужно отказаться от попыток проследить за движением всех молекул, из которых состоит газ. Их слишком много, и из-за столкновений друг с другом они движутся очень сложно. Нам и не нужно знать, как движется каждая молекула. Мы должны выяснить, к какому результату приводит совокупное движение всех молекул.
Характер же движения всей совокупности молекул газа известен из опыта (см. § З). Молекулы участвуют в хаотическом (тепловом) движении. Это означает, что скорость любой молекулы может оказаться как очень большой, так и очень малой, а направление движении молекул беспрестанно меняется при их столкновениям друг с другом.
Скорости отдельных молекул могут быть любыми, однако среднее значение модуля их скорости вполне определенное. Точно так же рост учеников в классе не одинаков. Но среднее значение роста – определенная величина. Чтобы ее найти, надо сложить вместе рост учеников и разделить эту сумму на количество учеников.
Среднее значение квадрата модуля скорости. В дальнейшем нам понадобится среднее значение не самой скорости, а квадрата скорости, от которого зависит средняя кинетическая энергия молекул.
Обозначим модули скоростей отдельных молекул через v1, v2, v3, …, vN. Среднее значение квадрата скорости определится следующей формулой:
Действительно, для каждой молекулы справедливо выражение (1.9). Сложив эти выражения для отдельных молекул и разделив обе части полученного уравнения на число молекул N, мы придем к формуле (1.10).
Так как направления Ox, Oy и Oz вследствие хаотичности движения молекул равноправны, средние значения квадратов проекций скорости равны друг другу:
т.е. средний квадрат проекции скорости равен 1/3 среднего квадрата самой скорости. Множитель 1/3 появляется вследствие трехмерности пространства и, соответственно, существования трех проекций у любого вектора.
Свойства реальных газов рассматриваются на примере поведения физической модели «идеальный газ», в которой молекулы представлены в виде материальных точек, отсутствуют силы межмолекулярного взаимодействия, взаимодействие молекул происходит только при их соударениях и со стенками сосуда и является упругим.
Связь термодинамических макропараметров газа (p-давление,V-объем, T-температура) с его микропараметрами (m-масса молекул, -средняя квадратичная скорость молекул, -средняя кинетическая энергия молекул, n-концентрация молекул) устанавливает основное уравнение МКТ идеального газа.
Реальные газы при не слишком низких температурах и достаточно малых давлениях по своим свойствам близки к идеальному газу.
Давление идеального газа
Читайте также:
- Абсолютное давление (p )
- Б. Давление газа в сосуде растет с повышением температуры.
- Введение. Законы идеального газа. Уравнение Менделеева-Клайперона
- Влияние различных факторов на давление грунта на подпорную стенку
- Вне идеального состояния
- Внутренняя энергия идеального газа.
- Внутренняя энергия тела. Способы ее изменения. Виды теплообмена. Внутренняя энергия идеального газа
- Гидростатическое давление
- ГНОСЕОЛОГИЧЕСКИЙ ПОДХОД К СОЗНАНИЮ. ПОНЯТИЕ ИДЕАЛЬНОГО.
- Горные породы — коллекторы нефти и газа.
- Давление
- Давление в жидкости и газе. Закон Паскаля
Давление газа. Основное уравнение МКТ идеального газа
Идеальный газ. Давление газа. Понятие вакуума. Манометры
Идеальный газ – это модель реального газа, которая обладает следующими свойствами:
1. Молекулы пренебрежимо малы по сравнению со средним расстоянием между ними.
2. Молекулы ведут себя подобно маленьким твердым шарикам: они упруго сталкиваются между собой и со стенками сосуда, никаких других взаимодействий между ними нет.
3. Молекулы находятся в непрекращающемся хаотическом движении.
Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу.
Давление газа определяется столкновением молекул газа со стенками сосуда.
В СИ за единицу давления принимают 1 Па.
Давление, при котором на площадь 1 м 2 действует сила давления в 1 Н, называется Паскалем.
1мм.рт.ст. = 133 Па
1атм = 1ž 10 5 Па
В физике под вакуумом понимают обычно такие разрежения, когда средний свободный пробег молекул газа соизмерим с размерами сосуда.
Манометр — прибор, измеряющий давление жидкости или газа
Принцип действия манометра основан на уравновешивании измеряемого давления силой упругой деформации трубчатой пружины или более чувствительной двухпластинчатой мембраны, один конец которой запаян в держатель, а другой через тягу связан с трибко-секторным механизмом, преобразующим линейное перемещение упругого чувствительного элемента в круговое движение показывающей стрелки.
Идеальный газ. молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударениях молекул друг с другом и со стенками сосуда действуют силы отталкивания.
молекулы идеального газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела.
При столкновении молекулы со стенкой сосуда проекция вектора скорости на ось ОХ, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю (рис.).
Поэтому в результате столкновения молекулы со стенкой проекция ее импульса на ось ОХ изменяется от до . Изменение импульса молекулы показывает, что на нее при столкновении действует сила , направленная от стенки. Изменение импульса молекулы равно импульсу силы :
.
Во время столкновения молекула действует на стенку с силой , равной по третьему закону Ньютона силе по модулю и направленной противоположно.
Молекул газа очень много, и удары их о стенку следуют один за другим с очень большой частотой. Среднее значение геометрической суммы сил, действующих со стороны отдельных молекул при их столкновениях со стенкой сосуда, и является силой давления газа. Давление газа равно отношению модуля силы давления к площади стенки S:
.
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяло вычислить давление газа, если известны масса m молекулы газа, среднее значение квадрата скорости молекул и концентрация n молекул:
.
Уравнение называют основным уравнением молекулярно-кинетической теории.
.
Дата добавления: 2014-12-16 ; Просмотров: 2434 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
1.2.Молекулярно-кинетическая теория газов
Молекулярно-кинетическая теория газов рассматривает идеальный газ:
а) молекулы не притягиваются и не отталкиваются;
б) молекулы взаимодействуют только при упругих столкновениях;
в) молекулы представляют собой материальные точки, т.е. обладают массой, но не имеют объёма.
В качестве критерия идеальности газов принято считать соотношение α/L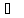
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в паскалях по имени французского учёного и математика
Блеза Паскаля (1623-1662). 1Па = 1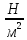
Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р) – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является термодинамическим параметром состояния.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
Термодинамическая температура Т всегда положительна. При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
Т = t + 273,15 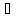
Ro= 8,314 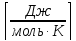
Удельный объем – отношение объема вещества к его массе 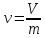
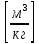
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
1.3. Универсальное уравнение состояния идеального газа
Уравнение состояния идеального газа Клапейрона – Менделеева:
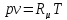
где р – давление, Па,

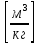
Rμ=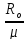
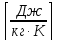
Например, для кислорода 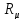
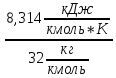

Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для любого процесса 1-2:, p1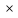
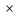
p2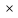

Разделив левую часть первого уравнения на левую часть второго уравнения, а правую часть первого уравнения на правую часть второго уравнения и сократив Rμ, получим:
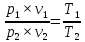
1.4. Смесь идеальных газов
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
Состав смеси задается долями объемными r, r1= 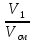

массовыми g g1= и мольными r1′ : r1′ =
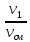
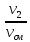
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
Молярная масса смеси: μсм= μ1r1+ μ2r2. μсм= 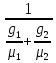
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь между объемными и массовыми долями: g1= r1∙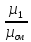
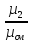
Давление идеального газа
Определение давления идеального газа
Давление идеального газа — это один из самых важных макроскопических параметров, при помощи которого характеризуют состояние системы в молекулярной физике.
Обозначают давление буквой $p$. Если для известной массы идеального газа определены давление и температура (или объем), то полагают, что состояние термодинамической системы в состоянии равновесия определяется однозначно, так как существующие законы и уравнения молекулярно кинетической теории (МКТ) позволяют все остальные параметры вычислить.
В общем случае давление определяют как:
где $F_n$ проекция силы на нормаль к поверхности S данная сила оказывает воздействие, $\Delta S$- площадь поверхности.
Идеальный газ оказывает давление на стенки сосуда, в котором он находится, за счет того, что молекулы этого газа движутся и ударяются о стенки сосуда. Давление идеального газа можно найти, применяя основные положение МКТ. При этом получают, что давление идеального газа равно:
где $m_0$ — масса одной молекулы газа; $n$- концентрация молекул газа; $\left\langle v_
\[p=\fracn\left\langle E_k\right\rangle \left(3\right).\]
С таким важным термодинамическим параметром как термодинамическая температура давление связывает формула:
где $k$ — постоянная Больцмана. Уравнение (4) называют уравнением состояния идеального газа.
Если проводить изохорный процесс ($V=const$) с некоторой массой идеального газа, то давление его будет подчинено закону Шарля:
где $p_1$- давление газа имеющего температуру $T_1$.
При проведении изотермического процесса ($T=const$) c постоянной массой некоторого газа поведение давления можно характеризовать, используя уравнение:
В соответствии с законом Дальтона давление смеси газов можно найти как сумму давлений каждого газа:
где $p_i$ — давление каждого газа в отдельности.
Уравнения МКТ, содержащие давление идеального газа
Уравнение Менделеева — Клапейрона (еще один вариант уравнения состояния):
где $\frac
Определение работы газа в термодинамике:
Соответственно, первое начало термодинамики для идеального газа в дифференциальном виде запишем как:
\[\delta Q=pdV+\frac\nu RdT\left(10\right),\]
где $i$ — число степеней свободы молекулы газа; $\delta Q$ — элементарное количество теплоты, которое получает идеальный газ; $\frac\nu RdT=dU$ — изменение внутренней энергии термодинамической системы.\textit
Примеры задач с решением
Задание. В идеальном газе проводят процесс, при котором $p=\frac
Решение. Внутренняя энергия идеального газа для любого процесса равна:
Состояние идеального газа описывает уравнение Менделеева — Клайперона:
\[pV=\nu RT\ \left(1.2\right).\]
Подставим правую часть уравнения, которое описывает заданный в условиях задачи процесс ($p=\frac
Получим из (1.3), что внутренняя энергия вычисляется как:
Сравним выражения для внутренней энергии (1.1) и (1.4), имеем:
Для одноатомного газа $i=3$; для двухатомного газа (без учета колебаний молекул) $i=5$.
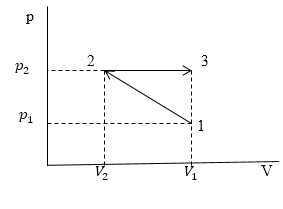
Задание. На рис.1 представлены процессы, проводимые с постоянной массой идеального газа, укажите, как изменяются давления в процессах?
Решение. Уравнение процесса можно аналитически описать уравнением:
где $A$ и $B$ положительные постоянные величины.
Состояние газа определим при помощи уравнения Менделеева — Клапейрона:
\[pV=\nu RT\ \left(2.2\right).\]
Вместо объема подставим уравнение процесса в (2.2):
Раздели обе части (2.3) на температуру:
Из уравнения (2.4) следует, что при увеличении температуры $\frac
Ответ. Давление в заданном процессе уменьшается.
Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
Свойства реальных газов рассматриваются на примере поведения физической модели «идеальный газ», в которой молекулы представлены в виде материальных точек, отсутствуют силы межмолекулярного взаимодействия, взаимодействие молекул происходит только при их соударениях и со стенками сосуда и является упругим.
Связь термодинамических макропараметров газа (p-давление,V-объем, T-температура) с его микропараметрами (m-масса молекул, -средняя квадратичная скорость молекул, -средняя кинетическая энергия молекул, n-концентрация молекул) устанавливает основное уравнение МКТ идеального газа.
Реальные газы при не слишком низких температурах и достаточно малых давлениях по своим свойствам близки к идеальному газу.
Давление идеального газа
Читайте также:
- Абсолютное давление (p )
- Б. Давление газа в сосуде растет с повышением температуры.
- Введение. Законы идеального газа. Уравнение Менделеева-Клайперона
- Влияние различных факторов на давление грунта на подпорную стенку
- Вне идеального состояния
- Внутренняя энергия идеального газа.
- Внутренняя энергия тела. Способы ее изменения. Виды теплообмена. Внутренняя энергия идеального газа
- Гидростатическое давление
- ГНОСЕОЛОГИЧЕСКИЙ ПОДХОД К СОЗНАНИЮ. ПОНЯТИЕ ИДЕАЛЬНОГО.
- Горные породы — коллекторы нефти и газа.
- Давление
- Давление в жидкости и газе. Закон Паскаля
Давление газа. Основное уравнение МКТ идеального газа
Идеальный газ. Давление газа. Понятие вакуума. Манометры
Идеальный газ – это модель реального газа, которая обладает следующими свойствами:
1. Молекулы пренебрежимо малы по сравнению со средним расстоянием между ними.
2. Молекулы ведут себя подобно маленьким твердым шарикам: они упруго сталкиваются между собой и со стенками сосуда, никаких других взаимодействий между ними нет.
3. Молекулы находятся в непрекращающемся хаотическом движении.
Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу.
Давление газа определяется столкновением молекул газа со стенками сосуда.
В СИ за единицу давления принимают 1 Па.
Давление, при котором на площадь 1 м 2 действует сила давления в 1 Н, называется Паскалем.
1мм.рт.ст. = 133 Па
1атм = 1ž 10 5 Па
В физике под вакуумом понимают обычно такие разрежения, когда средний свободный пробег молекул газа соизмерим с размерами сосуда.
Манометр — прибор, измеряющий давление жидкости или газа
Принцип действия манометра основан на уравновешивании измеряемого давления силой упругой деформации трубчатой пружины или более чувствительной двухпластинчатой мембраны, один конец которой запаян в держатель, а другой через тягу связан с трибко-секторным механизмом, преобразующим линейное перемещение упругого чувствительного элемента в круговое движение показывающей стрелки.
Идеальный газ. молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударениях молекул друг с другом и со стенками сосуда действуют силы отталкивания.
молекулы идеального газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела.
При столкновении молекулы со стенкой сосуда проекция вектора скорости на ось ОХ, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю (рис.).
Поэтому в результате столкновения молекулы со стенкой проекция ее импульса на ось ОХ изменяется от до . Изменение импульса молекулы показывает, что на нее при столкновении действует сила , направленная от стенки. Изменение импульса молекулы равно импульсу силы :
.
Во время столкновения молекула действует на стенку с силой , равной по третьему закону Ньютона силе по модулю и направленной противоположно.
Молекул газа очень много, и удары их о стенку следуют один за другим с очень большой частотой. Среднее значение геометрической суммы сил, действующих со стороны отдельных молекул при их столкновениях со стенкой сосуда, и является силой давления газа. Давление газа равно отношению модуля силы давления к площади стенки S:
.
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяло вычислить давление газа, если известны масса m молекулы газа, среднее значение квадрата скорости молекул и концентрация n молекул:
.
Уравнение называют основным уравнением молекулярно-кинетической теории.
.
Дата добавления: 2014-12-16 ; Просмотров: 2435 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Давление идеального газа
Прежде чем вести речь о том, что такое давление идеального газа, следует уточнить само содержание понятия «идеальный газ». А понятие это характеризует математическую модель, универсальную формулу, предполагающую, что распределение потенциальной и кинетической энергии взаимодействующих молекул таково, что величиной потенциальной энергии можно пренебречь. Химико-физический смысл состоит в том, что предполагается абсолютная упругость стенок сосудов, в которых находится газ, а кроме того, признается ничтожной величина сил притяжения молекул, импульсов их удара о стенки сосуда и друг о друга.
Такое понимание сущности идеального газа находит очень широкое применение в области решения проблем термодинамики газов.
В физическом смысле различаются разновидности идеального газа: классический, свойства которого определяются классическими законами механики, и квантовый, характер которого выводится из принципов квантовой механики.
Первым вывел общее уравнение великий французский физик Бенуа́ Клапейро́н. Он же разработал и основные принципиальные положения учения об идеальном газе, которые положены в основу всех современных теорий, изучающих различные газы.
Исходным положением этого учения является вывод о том, что давление идеального газа является величиной неизменной при линейном характере зависимости его объема от температуры. При этом необходимо учитывать некоторые условные допущения:
— диаметр молекулы идеального газа мал до допустимости пренебрежения его величиной;
— импульс между молекулами может передаваться только при соударениях, таким образом, можно пренебречь и силой притяжения между ними;
— суммарная величина энергии молекул газа признается константой, при отсутствии теплообмена и работы, совершаемой над этим газом. В данном случае давление идеального газа зависит от суммы величин импульсов, которые создаются при столкновении молекул со стенками сосуда.
За время существования учения многие ученые занимались исследованием физико-химической природы газов, причем подходы у многих из них были неодинаковые. Это привело к тому, что в физической теории рассматривают классификацию идеального газа с точки зрения тех закономерностей, которые положил в основание своего исследования тот или иной физик – Ферми-газ, Бозе-газ и другие. Так, например, согласно эквивалентному подходу, рассматриваемый газ одновременно удовлетворяет законам и Бойля-Мариотта и Гей-Люссака: pV = bT, где р – давление, Т — абсолютная температура. Формула Менделеева дает уже более пространное представление о свойствах: pV = m/М х RT, где обозначены: R — газовая постоянная, M — молярная масса, m – масса.
Одним из наиболее ранних и разработанных учений о свойствах газов было описание такого свойства как давление идеального газа. Но в этой концепции были некоторые недочеты, связанные с односторонним подходом к исследованию. Так, даже измерив величину давления, мы не сможем выяснить параметры средних значений кинетической энергии каждой из отдельно взятых молекул, а также концентрацию этих молекул в сосуде. Поэтому требуется еще некий параметр, с помощью использования которого можно решить возникшую задачу. В качестве такой величины физиками была предложена температура. Эта скалярная величина в термодинамике дает представление о том, в каком тепловом состоянии находится система и какова ее динамика. Но в теории газов температура имеет важное значение и как молекулярно-кинетический параметр, потому что описывает поведение молекул газа в сосуде, а также отражает их среднюю кинетическую энергию. Это значение называется константой Больцмана.
Чтобы при поиске формулы давления не входить в сложности высшей математики, необходимо искусственно ввести некоторые упрощения:
— форму молекул представим в виде шара;
— расстояние между молекулами представим бесконечно большим, исключающим действие сил притяжения;
— скорости движения молекул установим на усредненном уровне;
— представим стенки сосуда абсолютно упругими.
Отсюда можно вывести формулу, в которой давление идеального газа будет представлять собой частное от деления величины силы, действующей перпендикулярно на стенку сосуда, на площадь поверхности, на которую эта сила действует: p = F/S.
В тех же случаях, когда наши упрощения не действуют, чтобы установить, как изменится давление идеального газа, в эту простую формулу необходимо будет вводить дополнительные значения.
Давление идеального газа
Что такое давление
Давление (p) важный макроскопический параметр, который характеризует состояние системы. Если кроме давления для данной массы газа известна температура или объем, то состояние системы определено однозначно, т.е. все остальные параметры можно рассчитать, используя законы и уравнения МКТ.
Это физическая величина, которая определяется как:
где $F_n$ проекция силы на нормаль к поверхности S, на которую эта сила действует, S — площадь тела.
Давление газа
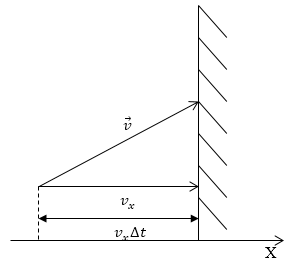
Как уже неоднократно отмечалось, давление газа возникает в результате ударов молекул о стенки сосуда. Если мы считаем, что молекулы взаимодействуют со стенкой по законам абсолютно упругого удара, то частица передает стенке импульс, равный изменению импульса самой молекулы. Направим ось Х перпендикулярно стенке (рис.1), в этом случае изменение импульса стенки при ударе одной молекулой:
где $m_0$- масса молекулы.
Поток импульса, который передается стенке за счет ударов молекулами, которые движутся со скоростями близкими к v, направлен к стенке, равен $nf(v)m_0
Попробуй обратиться за помощью к преподавателям
В результате непосредственного интегрирования получаем:
Так как мы уже отмечали, что рассматриваем единичную площадку стены в течение времени. равном 1с, то можно записать, что давление будет равно:
Давление газа изотропно, это величина скалярная.
При постоянном объеме давление газа массы m подчиняется закону Шарля:
где $p_0$- давление газа при температуре $T_0=273\ К$.
Давление смеси идеальных газов равно сумме их парциальных давлений:
Уравнение (7) имеет название — это закон Дальтона.
Парциальным давлением называют давление компоненты смеси газа, каким оно бы было, если бы других газов в смеси не было.
Ряд важных уравнений молекулярной физики, в которые входит давление:
- Уравнение состояния идеального газа(1): $p=nkT$(8).
- Уравнение состояния идеального газа(2) в виде уравнения Менделеева — Клайперона: $pV=\nu RT$(9).
- Основное уравнение МКТ: \[p=\fracn\left\langle E_k\right\rangle \left(10\right).\]
- Работа газа: \[dA=pdV\ \left(11\right).\]
Задай вопрос специалистам и получи
ответ уже через 15 минут!
Задание: В процессе сжатия 1-2 с линейной зависимостью р(V). Давление идеального газа возросло в 3 раза. Затем газ сжали в изобарном процессе 2-3 до первоначального объема. Найти отношение работ, совершенных газом в процессах расширения и сжатия. Температуры в состояниях 1 и 2 считать одинаковыми.
Работу газа (или над газом) можно рассчитать по формуле:
Если мы рассматриваем процесс (как в условиях нашей задачи) в осях p(V), то исходя из геометрического смысла интеграла работа A будет равна площади криволинейной трапеции (в общем случае), а в нашем площади прямоугольника, когда газ расширяется и площади трапеции, когда газ сжимают. Найдем эти площади.
Из условий задачи имеем:
Ответ: Работа, которую совершает газ в процессе 2-3 в 1,5 больше, чем работа по сжатию газа при заданных условиях.
Задание: Определите, как изменяется давление постоянной массы идеального газа, если в процессе объем увеличивают, температура уменьшается?
За основу решения возьмем уравнение Менделеева — Клайперона:
Выразим из него давление:
Ответ: В данном процессе давление уменьшается.
Задание: В процессе, график которого приведен на рисунке (рис.3) давление $p\sim T^n.\ $Найти значение n, если масса газа постоянна.
Из рисунка имеем зависимость p(V):
\[p\sim V\ \left(3.1\right)\]
Из уравнения Менделеева — Клайперона:
Используем (3.1) заменив объем, получим:
\[p^2\sim T\ \left(3.3\right)\]
Ответ: Получили $p\sim T^>$, следовательно, $n=\frac.$
Так и не нашли ответ
на свой вопрос?
Просто напиши с чем тебе
нужна помощь
Давление газа с точки зрения молекулярно-кинетической теории. Молекулярно-кинетический смысл абсолютной температуры
Давление газа с точки зрения молекулярно-кинетической теории.
Давление газа на стенку сосуда есть результат ударов мапе-кул газа об эту стенку. При каждом ударе молекула газа действует на стенку с определенной (с макроскопической точки зрения бесконечно малой) силой. Обратно направленная сила, с которой действует на молекулу стенка сосуда, заставляет молекулу отражаться от стенки. Если бы в сосуде содержалось всего несколько молекул, го пх удары следовали бы друг за другом редко и беспорядочно, п нельзя было бы говорить ни о какой регулярной силе давления, действующей на стенку. Мы имели бы дело с отдельными практически мгновенными бесконечно малыми толчками, которым время от времени подвергалась бы стенка. Если же число молекул в сосуде очень велико, то будет велико и числе ударов их о стенку сосуда. Удары станут следовать непрерывно друг за другом. Одновременно о стенку сосуда будет ударяться громадное количество молекул. Бесконечно малые силы отдельных ударов складываются в конечную и почти постоянную силу, действующую на стенку. Эта сила, усредненная по времени, и есть давление газа, с которым имеет дело макроскопическая физика.
При своем движении молекулы газа ударяются о стенки сосуда, в котором находится газ, создавая тем самым давление газа на стенки. Если газ находится в равновесии, то все направляющие движения молекул равновероятны.
Пусть в единице объема содержится n0 молекул. При абсолютно упругом ударе молекулы об стенку ее импульс изменяетмся на 2m0v. Ясно, что за время t до стенки долетят и упруго отразятся от нее все молекулы, находящиеся внутри параллелепипеда с основанием S и высотой vt.
Таких молекул будет: n = (1/6) n0 S v t ; следовательно общее изменение импульса молекул, долетевших за время t до стенки и упруго-отразившихся от нее будет: 2m0 v n = (1/3) n0 m0 v (ст.2) S t ; Это изменение импульса равно импульсу силы, действующей со стороны стенки на молекулы, а следовательно, согласно третьему закону Нбютона со стороны молекул на стенки: (1/3) n0 m0 v (ст.2) S t = F t ; F = (1/3) m0 v (ст.2) n0 S ; P = (1/3) n0 m0 v (ст.2) — основное уравнение.
Термодинамическая температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражаестя следующей формулой:
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
kB = 1.380 6505(24) × 10−23 Дж/K — постоянная Больцмана
T — термодинамическая температура, К
Абсолютная температура – есть величина, пропорциональная средней энергии поступательного движения молекул.
- http://fizclass.ru/idealnyj-gaz-osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-idealnogo-gaza/
- http://studopedia.su/13_163812_davlenie-idealnogo-gaza.html
- http://studfiles.net/preview/5276108/page:2/
- http://www.webmath.ru/poleznoe/fizika/fizika_159_davlenie_idealnogo_gaza.php
- http://fizclass.ru/idealnyj-gaz-osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-idealnogo-gaza/
- http://studopedia.su/13_163812_davlenie-idealnogo-gaza.html
- http://autogear.ru/article/212/57/davlenie-idealnogo-gaza/
- http://spravochnick.ru/fizika/molekulyarnaya_fizika/davlenie_idealnogo_gaza/
- http://mydocx.ru/1-14696.html