Диссоциация оснований. Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-ионы OH : NaOH Na + + OH ; Ca(OH)2 CaOH + + OH ; CaOH + Ca 2+ + OH .
Ступенчатость диссоциации обусловливает возможность образования основных и кислых (см. ниже) солей.
Диссоциация кислот. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода H + . HCl H + + Cl ; HNO3 H + + NO3 ; H2SO4 H + + HSO4 — ; HSO4 H + + SO4 2 ; H3PO4 H + + H2PO4 ; H2PO4 H + + HPO4 2 ; HPO4 2 H + + PO4 3 .
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды дис-социируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H + и гидроксид-анионы OH : H + + MeO ⇄ MeOH ⇄ Me + + OH .
К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома Cr(OH)3, свинца Pb(OH)2 и др.
1. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка. Напри-мер, Na2SO4 2 Na + + SO4 2 ; Ca3(PO)4 3 Ca 2+ + 2 PO4 3 .
2.Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода и кислотного остатка: KHSO3 K + + HSO3 ( = 1).
Сложный анион диссоциирует частично: HSO3 ⇄ H + + SO3 2 ( : Al(OH)2Cl Al(OH)2 + + Cl ( = 1).
Сложный катион диссоциирует частично: Al(OH)2 + ⇄ AlOH 2+ + OH ( 2+ ⇄ Al 3+ + OH ( + + Al 3+ + 2 SO4 2 ;
Сложные соли диссоциируют на катион металла и анионы кислотных остатков. Например, ZnClNO3 Zn 2+ + Cl + NO3 ;
ОВР-реакции, протекающие с изменением степени окисления.
Окисление – это процесс отдачи электронов при этом происходит понижение степени окисления.
Восстановление – это процесс присоединения электронов, при этом происходит понижение степени окисления.
Реакции, в кот. ок-ль. и восст-ль предс. собой различные ве-ва наз. межмолеклярными. Если ок-ль и восс-ль атомы одной молекулы — внутримолекулярные.
Под степенью окисления (окислительным числом) понимают условный заряд атома в соединении, вычисленный из предположения, что в молекуле все связи ионные. Степень окисления указывает, сколько электронов оттянуто от атома (положительная степень окисления) или притянуто к нему от другого атома (отрицательная степень окисления). Мера удаления или приближения электронов к атому в степени окисления не отражена.Восстановители
а) Металлы как простые вещества: K 0 , Na 0 , Ca 0 , Al 0 и др.
б) Простые анионы неметаллов: S 2 , Cl , J , Br , Se 2 и др.
в) Сложные анионы и молекулы, содержащие электроположитель-ные элементы в промежуточной степени окисления: S +4 O3 2 , N +3 O2 , As +3 O3 3 , Cr +3 O2 , [Fe +2 (CN)6] 4 , C +2 O, N +2 O, S +4 O2 и др.
г) Простые катионы в низшей степени окисления: Fe 2+ , Sn 2+ , Cr 3+ , Cu + , Mn 2+ , As 3+ и др.
д) Некоторые простые вещества:
е) Катод при электролизе.
а) Неметаллы как простые вещества с большой электроотрицательностью: F2, O2, Cl2 и др.
б) Простые катионы в высокой степени окисления: Sn 4+ , Fe 3+ , Cu 2+ и др., а также H + .
г) Сложные ионы и молекулы, содержащие атомы неметаллов в положительной степени окисления: H2S +6 O4, S +6 O3, HOCl +1 , HCl +5 O3,
д) Анод при электролизе.
В соединениях, когда атомы находятся в промежуточной степени окисления, последние могут проявлять как восстановительные, так и окислительные свойства (окислительно-восстановительная двойствен-ность):
Применяют два метода составления уравнений реакций окисления-восстановления:
Теория электрической диссоциации
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблукови В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс .
Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения.
Основные положения ТЭД (Теории электролитической диссоциации):
Молекулы распадаются на положительно и отрицательно заряженные ионы (простые и сложные).
Под действием электрического тока катионы (положительно заряженные ионы движутся к катоду(-), а анионы (отрицательно заряженные ионы) к аноду(+)
Степень диссоциации зависит от природы вещества и растворителя, концентрации, температуры.
Если степень диссоциации зависит от природы вещества, то можно судить, что существует разграничение между определёнными группами веществ.
Большая степень диссоциации присуща сильным электролитам (большинству оснований, солям, многим кислотам). Стоит учесть, что распад на ионы – обратимая реакция. Так же стоит сказать, что в данной теме не будут разобраны примеры диссоциации двойных и основных солей, их диссоциация описана в теме “соли”.
Примеры сильных электролитов:
NaOH, K2SO4, HClO4
Уравнения диссоциации:
NaOH⇄Na + +OH —
Количественной характеристикой силы электролитов является степень диссоциации (α) – отношение молярной концентрации продиссоциировавшего электролита к его общей молярной концентрации в растворе.
Степень диссоциации выражается в долях единицы или в процентах. Интервал значений – от 0 до 100%.
α = 0% относится к неэлектролитам (диссоциация отсутствует)
У каждой ступени диссоциации своя степень диссоциации.
Например, диссоциация солей CuCl2, HgCl2:
CuCl2⇄Cu 2+ +2Cl — диссоциация протекает полностью
А в случае с хлоридом ртути диссоциация идёт неполностью и то не до конца.
Возвращаясь же к раствору серной кислоты, стоит сказать, что степень диссоциации обеих ступеней разбавленной кислоты гораздо больше, чем у концентрированной. При диссоциации концентрированного раствора очень много молекул вещества и большая концентрация гидроанионов HSO4 — .
У многоосновных кислот и многокислотных оснований диссоциация идёт в несколько ступеней (в зависимости от основности).
Перечислим сильные и слабые кислоты и приступим к уравнениям ионного обмена:
Сильные кислоты ( HCl, HBr, HI, HClO3, HBrO3, HIO3, HClO4, H2SO4, H2SeO4,HNO3, HMnO4, H2Cr2O7)
Химические реакции в растворах и расплавах электролитов протекают с участием ионов. В таких реакциях степени окисления элементов не изменяются, и сами реакции называются реакциями ионного обмена.
Реакции ионного обмена будут протекать до конца (необратимо) , если образуются малорастворимые или практически нерастворимые вещества (они выпадают в осадок), летучие вещества (выделяются в виде газов) или слабые электролиты (например, вода).
Реакции ионного обмена принято писать в три стадии:
1. Молекулярное уравнение
2. Полное ионное уравнение
3. Сокращенное ионное уравнение
При написании обязательно указывать осадки и газы, а так же руководствоваться таблицей растворимости.
Реакции, где все реагенты и продукты получились растворимые в воде, не протекают.
Сокращённое ионное уравнение получается с помощью вычёркивания одинаковых ионов из обеих частей полного ионного уравнения.
Если реакция ионного обмена идёт между двумя солями с образованием осадка, то следует брать два хорошо растворимых реагента. То есть, реакция ионного обмена пойдёт если растворимость реагентов будет выше, чем у одного из продуктов.
Иногда при написании реакций ионного обмена пропускают полное ионное уравнение и сразу пишут сокращенное.
Для получения осадка малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты в их концентрированных растворах.
Например:
2KF+FeCl2→FeF2↓+2KCl
Данные правила подбора реагентов для осаждения продуктов справедливы только для солей.
mozok.click
Электролитическая диссоциация кислот, оснований и солей в водных растворах
Электролитическая диссоциация кислот
При растворении в воде кислоты, соли и основания диссоциируют на положительно и отрицательно заряженные ионы (катионы и анионы). Определим характерные общие признаки диссоциации электролитов каждого класса соединений.
Кислоты, как вы помните, состоят из Гидрогена и кислотного остатка, соединенных ковалентной полярной связью. В предыдущем параграфе на примере растворения гидроген хлорида мы рассмотрели, как под действием молекул воды полярная связь превращается в ионную, и кислота распадается на катионы Гидрогена и хлорид-ионы.
Таким образом, с точки зрения теории электролитической диссоциации Аррениуса,
Кислоты — это электролиты, при диссоциации которых образуются катионы Гидрогена и анионы кислотного остатка.
Подобно хлоридной кислоте протекает диссоциация и других кислот, например нитратной:
При диссоциации молекулы сульфатной кислоты число катионов Гидрогена вдвое превышает число анионов кислотного остатка — сульфат-ионов. Заряд аниона равен -2 (в формулах ионов записывают «2-»):
Названия анионов, образующихся при диссоциации кислот, совпадают с названиями кислотных остатков. Они приведены в таблице растворимости на форзаце.
Легко заметить, что при диссоциации различных кислот образуются различные анионы, но катионы только одного типа — катионы Гидрогена H+. Значит, именно катионы Гидрогена определяют характерные свойства кислот — кислый вкус, изменение окраски индикаторов, реакции с активными металлами, основными оксидами, основаниями и солями.
Многоосновные кислоты диссоциируют ступенчато, отщепляя ионы Гидрогена последовательно, друг за другом. Например, в растворе сульфатной кислоты протекают следующие процессы:
Как видно из приведенных уравнений диссоциации многоосновной кислоты, анионы, образующиеся при ступенчатой диссоциации на первой стадии, содержат ионы Гидрогена. Это отражено в названии анионов: HSO — — гидрогенсульфат-ион.
Электролитическая диссоциация ортофосфатной кислоты проходит в три стадии:
Суммарное уравнение диссоциации ортофосфатной кислоты имеет вид:
Таким образом, каждой многоосновной кислоте соответствует несколько анионов, и все они одновременно присутствуют в растворе.
Обратите внимание, что в некоторых уравнениях диссоциации стоят двунаправленные стрелки. Что они означают, вы узнаете в следующем параграфе.
Электролитическая диссоциация оснований
Основания состоят из катионов металлического элемента и гидроксид-анионов. При диссоциации оснований эти ионы переходят в раствор. Число гидроксид-ионов, образующихся при диссоциации, равно заряду иона металлического элемента. Таким образом, с точки зрения теории электролитической диссоциации
Основания — это электролиты, которые диссоциируют на катионы металлического элемента и гидроксид-анионы.
Рассмотрим уравнения диссоциации оснований на примере диссоциации натрий и барий гидроксидов:
При диссоциации оснований образуются анионы одного типа — гидроксид-ионы, определяющие все характерные свойства растворов щелочей: способность менять окраску индикаторов, реагировать с кислотами, кислотными оксидами и солями.
Электролитическая диссоциация солей
Соли образованы катионами металлического элемента и анионами кислотного остатка. При растворении солей в воде эти ионы переходят в раствор.
Соли — это электролиты, которые диссоциируют на катионы металлического элемента и анионы кислотного остатка.
Рассмотрим диссоциацию солей на примере диссоциации калий нитрата:
Аналогично диссоциируют и другие соли, например нитрат кальция и калий ортофосфат:
В уравнениях диссоциации солей заряд катиона по абсолютной величине равен степени окисления металлического элемента, а заряд аниона — сумме степеней окисления элементов в кислотном остатке. Например, купрум(П) сульфат распадается на ионы
а феррум(Ш) нитрат — на ионы
Заряд катионов металлических элементов в большинстве случаев можно определить по Периодической системе. Заряды катионов металлических элементов главных подгрупп обычно равны номеру группы, в которой расположен элемент:
Металлические элементы побочных подгрупп обычно образуют несколько ионов, например Fe 2 +, Fe 3 +.
Заряды кислотных остатков проще определять по числу ионов Гидрогена в составе молекулы кислоты, как вы это делали в 8 классе. Заряды некоторых кислотных остатков приведены в таблице растворимости на форзаце.
Обратите внимание, что в уравнениях диссоциации кислот, оснований и солей суммарный заряд катионов и анионов должен быть равен нулю, поскольку любое вещество является электронейтральным.
Ступенчатая диссоциация обусловливает возможность существования кислых и основных солей. Кислые соли содержат ионы Гидрогена, как кислоты. Именно поэтому такие соли называют кислыми. А в основных солях содержатся гидроксид-ионы, как в основаниях.
На первой стадии диссоциации сульфатной кислоты образуется гидрогенсульфат-ион HSO-, благодаря чему существуют кислые соли: NaHSO4 (натрий гидрогенсульфат), Al(HSO4)3 (алюминий гидрогенсульфат) и др. Для ортофосфатной кислоты также характерны кислые соли K2HPO4 (калий гидрогенортофосфат) или KH2PO4 (калий дигидрогенортофосфат).
В растворах кислые соли диссоциируют в две стадии:
Кислые соли характерны только для многоосновных кислот, поскольку они диссоциируют ступенчато. Единственным исключением является одноосновная кислота — флуоридная. Благодаря водородным связям в растворе этой кислоты присутствуют частицы H2F2, и флуоридная кислота может образовывать кислую соль состава KHF2.
Некоторые нерастворимые гидроксиды образуют катионы, в которых имеется гидроксид-ион. Например, алюминий содержится в составе катиона AlOH 2+ , благодаря чему существует соль состава AlOHCl2 (алюминий гидроксохлорид). Такую соль называют основной.
100. Дайте определение кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
101. В чем особенность диссоциации многоосновных кислот по сравнению с одноосновными? Объясните на примере сульфатной кислоты.
Задания для усвоения материала
102. В результате диссоциации молекулы кислоты образовался ион с зарядом 3—. Сколько ионов Гидрогена при этом образовалось?
103. Составьте уравнения электролитической диссоциации кислот: карбонатной, бромидной, нитритной. Назовите образующиеся анионы.
104. Какие из приведенных кислот будут диссоциировать ступенчато: HCl, H2CO3, HNO3, H2S, H2SO3? Ответ подтвердите уравнениями реакций.
105. Составьте уравнения диссоциации солей: магний нитрата, алюминий хлорида, барий бромида, натрий карбоната, натрий ортофосфата.
106. Приведите по одному примеру солей, при диссоциации которых количеством вещества 1 моль образуется: а) 2 моль ионов; б) 3 моль ионов; в) 4 моль ионов; г) 5 моль ионов. Запишите уравнения диссоциации.
108. Составьте уравнения электролитической диссоциации веществ: калий гидроксида, барий сульфида, феррум(Ш) нитрата, магний хлорида, алюминий сульфата.
109. Составьте формулу вещества, при диссоциации которого образуются ионы Кальция и гидроксид-ионы.
110. Из перечня веществ выпишите отдельно электролиты и неэлектролиты: HCl, Ca, Cr2(SO4)3, Fe2O3, Mg(OH)2, CO2, Sr(OH)2, Sr(NO3)2, P2O5, H2O. Составьте уравнения диссоциации электролитов.
111. При диссоциации некоего нитрата образовался 1 моль катионов с зарядом 2+. Какое количество вещества нитрат-ионов при этом образовалось?
112. Составьте формулы и запишите уравнения диссоциации феррум(П) сульфата и феррум(Ш) сульфата. Чем отличаются эти соли?
113. Приведите по одному примеру уравнений диссоциации солей в соответствии со схемами (буквой М обозначен металлический элемент, а Х — кислотный остаток): а) МХ ^ М 2+ + Х 2- ; б) МХ3 ^ М 3+ + 3Х — ;
114. В растворе присутствуют ионы K+, Mg 2 +, NO-, SO4 — . Какие вещества растворили? Приведите два варианта ответа.
115*. Составьте уравнения диссоциации тех электролитов, которые образуют хлорид-ионы: CrCl3, KClO3, BaCl2, Ca(ClO)2, HClO4, MgOHCl.
ОСНОВАНИЯ, КИСЛОТЫ И СОЛИ В ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Читайте также:
- A-аминокислоты. Пептиды
- I. МЕХАНИКА И ЭЛЕМЕНТЫ СПЕЦИАЛЬНОЙ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ
- I. МЕХАНИКА И ЭЛЕМЕНТЫ СПЕЦИАЛЬНОЙ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ
- III. Методы исследования в области теории исторической науки
- N В этом случае образуется больше ксантина и, следовательно, мочевой кислоты
- N Оценивается базальная и стимулированная секреция соляной кислоты (стимулируют пантагастрином)
- А. Изучение конкурентоспособности производителя исходя из теории равновесия
- А. Теории трансакционного спроса на деньги.
- Австрийская школа экономической теории
- Аксиоматический способ построения теории
- АКСИОМЫ ТЕОРИИ ВЕРОЯТНОСТЕЙ
- Альтернативные (современные) теории мировой торговли
Основания. Название «основания» первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Водные растворы таких оснований, как NаОН, КОН и Ва(ОН)2, обладают сильнощелочными свойствами, поэтому эти вещества и некоторые другие называют щелочами.
С точки зрения теории электролитической диссоциации основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов ОН — .
В общем виде уравнение электролитической диссоциации основания имеет вид:
NаОН « Na + + OH — ; Ва(ОН)2 « Ba 2+ + 2OH — ; NH3·H2O « NH4 + + OH — .
Гидроксиды металлов типа NаОН и Ва(ОН)2, представляющие собой ионные кристаллы, являются сильными электролитами, а гидрат аммиака (ковалентное соединение) — это слабое основание.
Некоторые из щелочей аналогично диссоциируют и при плавлении, например КОН.
Большинство же основных гидроксидов разлагаются при нагревании на оксиды и воду еще до плавления.
Основания — гидроксиды металлов — могут быть получены при взаимодействии неблагородных металлов с водой или основных оксидов с водой: 2Nа + 2Н2О = 2 NаОН + Н2, СаО + Н2О = Са(ОН)2.
Оксиды металлов, которые подобным путем образуют основания, раньше называли основными ангидридами.
Типичные свойства оснований по Аррениусу связаны с тем, что они поставляют в водный раствор гидроксид-ионы ОН — . На этом основано обнаружение щелочей с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами щелочей в синий цвет.
Кислоты. Кислоты исторически получили такое название из-за кислого вкуса водных растворов таких веществ, как хлороводород или уксусная кислота.
С точки зрения теории электролитической диссоциации
кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н + ,
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Таким образом, характеристической составной частью всех кислот является водород, способный диссоциировать в водный раствор.
кислота — это водородсодержащее соединение, водород которого может быть замещен на металл с образованием соли: Мg + Н2SO4 = МgSO4 + Н2
Следует различать кислородсодержащие кислоты и бескислородные кислоты.
Все кислоты являются потенциальными электролитами в водном растворе. Под воздействием полярных молекул воды они отщепляют катионы водорода, которые мгновенно гидратируются водой и образуют катионы оксония Н3О + , так как простые катионы водорода Н + , являющиеся по существу индивидуальными протонами р + , не способны к существованию в водном растворе. Среди кислот есть как сильные электролиты (Н2SО4, НМО3, НС1), так и слабые (Н2СO3, Н2S).
Кислородсодержащие кислоты могут быть получены взаимодействием кислотных оксидов с водой: СО2 + Н2О = Н3СО3; SО3 + Н2О = Н2SО4.
Ранее такие оксиды неметаллов называли кислотными ангидридами. Многим неметаллам, ввиду многообразия их степеней окисления, отвечает несколько кислородсодержащих кислот. Для хлора известны: НСlO4 — хлорная кислота, НСlO2 — хлористая кислота, НС1О3 — хлорноватая кислота, НСlO — хлорноватистая кислота.
Металлы, которые проявляют несколько степеней окисления, также могут образовывать кислотные оксиды и кислоты.
Многоосновные кислоты, содержащие в молекулах по два или несколько атомов водорода, способных замещаться на атомы металла, обычно являются слабыми электролитами и диссоциируют ступенчато, причем каждая следующая стадия протекает в значительно меньшей степени, чем предыдущая: Н3PO4 « н + + н2РО4 —
Типичные свойства кислот по Аррениусу связаны с тем, что они поставляют в водный раствор катионы водорода Н + (Н3О + ). На этом основано обнаружение кислот с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами кислот в красный цвет.
Соли. С точки зрения теории электролитической диссоциации соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка: BaС12 = Ba 2+ + 2С1.
Дата добавления: 2014-01-07 ; Просмотров: 1662 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определе н ия и описывают свойства кислот , оснований и солей .
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н 3 РО 4
Н 2 РО — 4
НРО 2- 4
Диссоциация многоосновной кислоты протекает главным образом по первой ступени , в меньшей степени по второй и лишь в незначительной степени — по третьей . Поэтому в водном растворе , например , фосфорной кислоты наряду с молекулами Н3РО 4 имеются ионы ( в последовательно уменьшающихся количествах ) Н 2 РО 2- 4 , НРО 2- 4 и РО 3- 4 .
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
KOH 
Основания, растворимые в воде называются щелочами . Их немного . Это основания щелочных и щелочноземельных металлов : LiOH , NaОН , КОН , Rb ОН , С s ОН , Fr ОН и Са ( ОН )2, Sr ( ОН )2, Ва ( ОН )2, R а ( ОН )2, а также N Н 4 ОН . Большинство оснований в воде малорастворимо .
Кислотность основания определяется числом его гидроксильных групп ( гидроксогрупп ). Например , N Н 4 ОН — однокислотное основание , Са(ОН)2 — двухкислотное , F е ( ОН )3 — трехкислотное и т . д . Двух — и многокислотные основания диссоциируют ступенчато
Ca(ОН)2
Ca(OH) + 
Однако имеются электролиты , которые при диссоциации одновременно образуют катионы водорода , и гидроксид — ионы . Эти электролиты называются амфотерными или амфолитами . К ним относятся вода , гидроксиды цинка , алюминия , хрома и ряд других веществ . Вода , например , диссоциирует на ионы Н + и ОН — ( в незначительных количествах ):
Н 2 O 
Следовательно , у нее в равной мере выражены и кислотные свойства , обусловленные наличием катионов водорода Н + , и щелочные свойства , обусловленные наличием ионов ОН — .
Диссоциацию амфотерного гидроксида цинка Zn ( ОН )2 можно выразить уравнением
2ОН — + Zn 2+ + 2 Н 2 О 
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония ( NH + 4) и анионы кислотных остатков
(NH4)2SO4
Так диссоциируют средние соли . Кислые же и основные соли диссоциируют ступенчато . У кислых солей вначале отщепляются ионы металлов , а затем катионы водорода . Например :
KHSO 4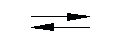
HSO — 4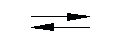
У основных солей вначале отщепляются кислотные остатки , а затем гидроксид — ионы .
Mg ( OH ) Cl 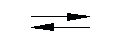
Mg ( OH ) + 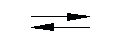
НCl 
Основностъ кислоты определяется числом катионов водорода , вторые образуются при диссоциации . Так , Н Cl , H N O 3 — однооснов н ые кислоты — образуется один катион водорода ; Н2 S , Н2СО 3 , Н2 SO 4 — д вухосновные , а Н 3 РО4 , Н 3 АsО 4 — трехосновные , так как образуются соответственно два и три катиона водорода . Из четырех атомов водорода , содержащихся в молекуле уксусной кислоты СН 3 СООН , только один , входящий в карбоксильную группу — СООН , способен отщепляться в виде катиона Н + , — уксусная кислота одноосновная .
Двух — и многоосновные кислоты диссоциируют ступенчато ( постепенно ).
Дать определение кислотам с точки зрения электрической диссоциации
Кислоты. Для кислот характерны следующие общие свойства:
а) способность взаимодействовать с основаниями с образованием солей;
б) способность взаимодействовать с некоторыми металлами с выделением водорода;
в) способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации любой кислоты образуются иокы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, мы должны объяснить присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т. д. С устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых — в меньшей. Чем лучше кислота диссоциирует, т. е. чем больше ее константа диссоциации, тем она сильнее.
Сравнивая данные, приведенные в табл. 12 и 14, можно заметить, что величины констант диссоциации кислот изменяются в очень широких пределах. В частности, константа диссоциации циановодорода много меньше, чем уксусной кислоты. И хотя обе эти кислоты — слабые, все же уксусная кислота значительно сильнее циановодорода. Величины первой и второй констант диссоциации серной кислоты показывают, что в отношении первой ступени диссоциации — сильная кислота, а в отношении второй — слабая. Кислоты, константы диссоциации которых лежат в интервале , иногда называют кислотами средней силы. К ним, в частности, относятся ортофосфорная и сернистая кислоты (в отношении диссоциации по первой ступени).
Основания. Водные растворы оснований обладают следующими общими свойствами:
а) способностью взаимодействовать с кислотами с образованием солей;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
в) своеобразным «мыльным» вкусом.
Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов, то ясно, что носителем основных свойств является гидроксид-ион. Поэтому с точки зрения теории электролитической диссоциации основания — это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов.
Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
а при взаимодействии с гидроксидом натрия — цинкат натрия;
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами. К таким гидроксидам кроме гидроксида цинка относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. Если обозначить амфо-терный электролит формулой ROH, то его диссоциацию можно выразить схемой:
Таким образом, в растворе амфотериого электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания.
Явление амфотерности наблюдается также среди некоторых органических соединений. Важную роль оно играет в биологической химии; например, белки — амфотерные электролиты.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионоз, образующих соль.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы . Например, при растворении гидрокарбоната натрия диссоциация протекает согласно следующим уравнениям:
При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы . Например, при растворении хлорида гидроксомагния диссоциация протекает согласно уравнениям:
Таким образом, теория электролитической диссоциации объясняет общие свойства кислот присутствием в их растворах ионов водорода, а общие свойства оснований — присутствием в их растворах гидроксид-ионов. Это объяснение не является, однако, общим. Известны химические реакции, протекающие с участием кислот и оснований, к которым теория электролитической диссоциации неприменима.
В частности, кислоты и основания могут реагировать друг с другом, не будучи диссоциированы на ноны. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Кроме того, известны вещества, не имеющие в своем составе гидроксогрупп, но проявляющие свойства основании. Например, аммиак взаимодействует с кислотами и образует соли (соли аммония), хотя в его составе нет групп ОН. Так, с хлороводородом он образует типичную соль — хлорид аммония:
Изучение подобного рода реакций, а также реакций, протекающих в иеводиых средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теории кислот и оснований принадлежит протонная теория, выдвинутая в 1923 г.
Согласно протонной теории, кислотой является донор протона, т. е. частниа (молекула или ион), которая способна отдавать ион водорода — прогон, а основанием — акцептор протона, т. е. частица (молекула или ион), способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Связанные этим соотношением основание и кислота называются сопряженными. Например, является основанием, сопряженным кислоте .
Реакцию между кислотой и основанием протонная теория представляет схемой:
Например, в реакции
ион — основание, сопряженное кислоте , а ион — кислота, сопряженная основанию .
Существенным в протонной теории является то положение, что вещество проявляет себя как кислота или как основание в зависимости от того, с каким другим веществом оно вступает в реакцию. Важнейшим фактором при этом является энергия связи вещества с протоном. Так, в ряду эта энергия максимальна для и минимальна для HF. Поэтому в смеси с вода функционирует как кислота, а в смеси с HF — как основание:
Щелочи в свете представлений об электролитической диссоциации. Химические свойства щелочей
1. Щелочи в свете представлений об электролитической диссоциации. Химические свойства щелочей: взаимодействие с кислотами, кислотными оксидами, солями (на примере гидроксида натрия или гидроксида кальция)
Щёлочи — это растворимые основания.
С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т. е. основные гидроксиды:
Более строгая формулировка: отщепляющие в качестве анионов (отрицательных ионов) только гидроксид-ионы.
Растворы щелочей окрашивают индикатор фенолфталеин (сокращенно ф-ф) в малиновый цвет.
Лакмус окрашивают в синий, метилоранж — в желтый, но это в школьной лаборатории видно плохо, не дает возможности отличить от нейтрального раствора.
Щёлочи реагируют с кислотами с образованием соли и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O
Щёлочи реагируют с кислотными оксидами с образованием соли и воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O (известковое тесто при неправильном хранении поглощает углекислый газ, образуется карбонат кальция)
Щелочи реагируют с растворами солей, если в результате реакции образуется осадок:
Например, при сливании с растворимыми солями меди (II) выпадает синий осадок гидроксида меди (II).
При нагревании солей аммония со щелочами выделяется газообразный аммиак:
2. Задача. Вычисление массы исходного вещества, если известно количество вещества одного из продуктов реакции.
Пример:
Сколько граммов соляной кислоты необходимо для получения 4 моль хлорида цинка?
- Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
x моль 4 моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль - Составляем пропорцию:
x моль — 4 моль
2 моль — 1 моль - Находим x:
x = 4 моль • 2 моль / 1 моль = 8 моль - Находим молярную массу соляной кислоты: M (HCl) = 1 + 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых, кроме хлора, который берется 35,5) - Находим требуемую массу соляной кислоты: m (HCl) = M • n = 36,5 г/моль • 8 моль = 292 г
mozok.click
Электролитическая диссоциация кислот, оснований и солей в водных растворах
Электролитическая диссоциация кислот
При растворении в воде кислоты, соли и основания диссоциируют на положительно и отрицательно заряженные ионы (катионы и анионы). Определим характерные общие признаки диссоциации электролитов каждого класса соединений.
Кислоты, как вы помните, состоят из Гидрогена и кислотного остатка, соединенных ковалентной полярной связью. В предыдущем параграфе на примере растворения гидроген хлорида мы рассмотрели, как под действием молекул воды полярная связь превращается в ионную, и кислота распадается на катионы Гидрогена и хлорид-ионы.
Таким образом, с точки зрения теории электролитической диссоциации Аррениуса,
Кислоты — это электролиты, при диссоциации которых образуются катионы Гидрогена и анионы кислотного остатка.
Подобно хлоридной кислоте протекает диссоциация и других кислот, например нитратной:
При диссоциации молекулы сульфатной кислоты число катионов Гидрогена вдвое превышает число анионов кислотного остатка — сульфат-ионов. Заряд аниона равен -2 (в формулах ионов записывают «2-»):
Названия анионов, образующихся при диссоциации кислот, совпадают с названиями кислотных остатков. Они приведены в таблице растворимости на форзаце.
Легко заметить, что при диссоциации различных кислот образуются различные анионы, но катионы только одного типа — катионы Гидрогена H+. Значит, именно катионы Гидрогена определяют характерные свойства кислот — кислый вкус, изменение окраски индикаторов, реакции с активными металлами, основными оксидами, основаниями и солями.
Многоосновные кислоты диссоциируют ступенчато, отщепляя ионы Гидрогена последовательно, друг за другом. Например, в растворе сульфатной кислоты протекают следующие процессы:
Как видно из приведенных уравнений диссоциации многоосновной кислоты, анионы, образующиеся при ступенчатой диссоциации на первой стадии, содержат ионы Гидрогена. Это отражено в названии анионов: HSO — — гидрогенсульфат-ион.
Электролитическая диссоциация ортофосфатной кислоты проходит в три стадии:
Суммарное уравнение диссоциации ортофосфатной кислоты имеет вид:
Таким образом, каждой многоосновной кислоте соответствует несколько анионов, и все они одновременно присутствуют в растворе.
Обратите внимание, что в некоторых уравнениях диссоциации стоят двунаправленные стрелки. Что они означают, вы узнаете в следующем параграфе.
Электролитическая диссоциация оснований
Основания состоят из катионов металлического элемента и гидроксид-анионов. При диссоциации оснований эти ионы переходят в раствор. Число гидроксид-ионов, образующихся при диссоциации, равно заряду иона металлического элемента. Таким образом, с точки зрения теории электролитической диссоциации
Основания — это электролиты, которые диссоциируют на катионы металлического элемента и гидроксид-анионы.
Рассмотрим уравнения диссоциации оснований на примере диссоциации натрий и барий гидроксидов:
При диссоциации оснований образуются анионы одного типа — гидроксид-ионы, определяющие все характерные свойства растворов щелочей: способность менять окраску индикаторов, реагировать с кислотами, кислотными оксидами и солями.
Электролитическая диссоциация солей
Соли образованы катионами металлического элемента и анионами кислотного остатка. При растворении солей в воде эти ионы переходят в раствор.
Соли — это электролиты, которые диссоциируют на катионы металлического элемента и анионы кислотного остатка.
Рассмотрим диссоциацию солей на примере диссоциации калий нитрата:
Аналогично диссоциируют и другие соли, например нитрат кальция и калий ортофосфат:
В уравнениях диссоциации солей заряд катиона по абсолютной величине равен степени окисления металлического элемента, а заряд аниона — сумме степеней окисления элементов в кислотном остатке. Например, купрум(П) сульфат распадается на ионы
а феррум(Ш) нитрат — на ионы
Заряд катионов металлических элементов в большинстве случаев можно определить по Периодической системе. Заряды катионов металлических элементов главных подгрупп обычно равны номеру группы, в которой расположен элемент:
Металлические элементы побочных подгрупп обычно образуют несколько ионов, например Fe 2 +, Fe 3 +.
Заряды кислотных остатков проще определять по числу ионов Гидрогена в составе молекулы кислоты, как вы это делали в 8 классе. Заряды некоторых кислотных остатков приведены в таблице растворимости на форзаце.
Обратите внимание, что в уравнениях диссоциации кислот, оснований и солей суммарный заряд катионов и анионов должен быть равен нулю, поскольку любое вещество является электронейтральным.
Ступенчатая диссоциация обусловливает возможность существования кислых и основных солей. Кислые соли содержат ионы Гидрогена, как кислоты. Именно поэтому такие соли называют кислыми. А в основных солях содержатся гидроксид-ионы, как в основаниях.
На первой стадии диссоциации сульфатной кислоты образуется гидрогенсульфат-ион HSO-, благодаря чему существуют кислые соли: NaHSO4 (натрий гидрогенсульфат), Al(HSO4)3 (алюминий гидрогенсульфат) и др. Для ортофосфатной кислоты также характерны кислые соли K2HPO4 (калий гидрогенортофосфат) или KH2PO4 (калий дигидрогенортофосфат).
В растворах кислые соли диссоциируют в две стадии:
Кислые соли характерны только для многоосновных кислот, поскольку они диссоциируют ступенчато. Единственным исключением является одноосновная кислота — флуоридная. Благодаря водородным связям в растворе этой кислоты присутствуют частицы H2F2, и флуоридная кислота может образовывать кислую соль состава KHF2.
Некоторые нерастворимые гидроксиды образуют катионы, в которых имеется гидроксид-ион. Например, алюминий содержится в составе катиона AlOH 2+ , благодаря чему существует соль состава AlOHCl2 (алюминий гидроксохлорид). Такую соль называют основной.
100. Дайте определение кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
101. В чем особенность диссоциации многоосновных кислот по сравнению с одноосновными? Объясните на примере сульфатной кислоты.
Задания для усвоения материала
102. В результате диссоциации молекулы кислоты образовался ион с зарядом 3—. Сколько ионов Гидрогена при этом образовалось?
103. Составьте уравнения электролитической диссоциации кислот: карбонатной, бромидной, нитритной. Назовите образующиеся анионы.
104. Какие из приведенных кислот будут диссоциировать ступенчато: HCl, H2CO3, HNO3, H2S, H2SO3? Ответ подтвердите уравнениями реакций.
105. Составьте уравнения диссоциации солей: магний нитрата, алюминий хлорида, барий бромида, натрий карбоната, натрий ортофосфата.
106. Приведите по одному примеру солей, при диссоциации которых количеством вещества 1 моль образуется: а) 2 моль ионов; б) 3 моль ионов; в) 4 моль ионов; г) 5 моль ионов. Запишите уравнения диссоциации.
108. Составьте уравнения электролитической диссоциации веществ: калий гидроксида, барий сульфида, феррум(Ш) нитрата, магний хлорида, алюминий сульфата.
109. Составьте формулу вещества, при диссоциации которого образуются ионы Кальция и гидроксид-ионы.
110. Из перечня веществ выпишите отдельно электролиты и неэлектролиты: HCl, Ca, Cr2(SO4)3, Fe2O3, Mg(OH)2, CO2, Sr(OH)2, Sr(NO3)2, P2O5, H2O. Составьте уравнения диссоциации электролитов.
111. При диссоциации некоего нитрата образовался 1 моль катионов с зарядом 2+. Какое количество вещества нитрат-ионов при этом образовалось?
112. Составьте формулы и запишите уравнения диссоциации феррум(П) сульфата и феррум(Ш) сульфата. Чем отличаются эти соли?
113. Приведите по одному примеру уравнений диссоциации солей в соответствии со схемами (буквой М обозначен металлический элемент, а Х — кислотный остаток): а) МХ ^ М 2+ + Х 2- ; б) МХ3 ^ М 3+ + 3Х — ;
114. В растворе присутствуют ионы K+, Mg 2 +, NO-, SO4 — . Какие вещества растворили? Приведите два варианта ответа.
115*. Составьте уравнения диссоциации тех электролитов, которые образуют хлорид-ионы: CrCl3, KClO3, BaCl2, Ca(ClO)2, HClO4, MgOHCl.
- http://www.teslalab.ru/articles/chemistry/35/
- http://mozok.click/838-elektroliticheskaya-dissociaciya-kislot-osnovaniy-i-soley-v-vodnyh-rastvorah.html
- http://studopedia.su/9_81279_osnovaniya-kisloti-i-soli-v-teorii-elektroliticheskoy-dissotsiatsii.html
- http://www.himhelp.ru/section23/section6/section41/47.html
- http://alnam.ru/book_chem.php?id=85
- http://staminaon.com/ru/chemistry/chemistry_9-13.htm
- http://mozok.click/838-elektroliticheskaya-dissociaciya-kislot-osnovaniy-i-soley-v-vodnyh-rastvorah.html
















