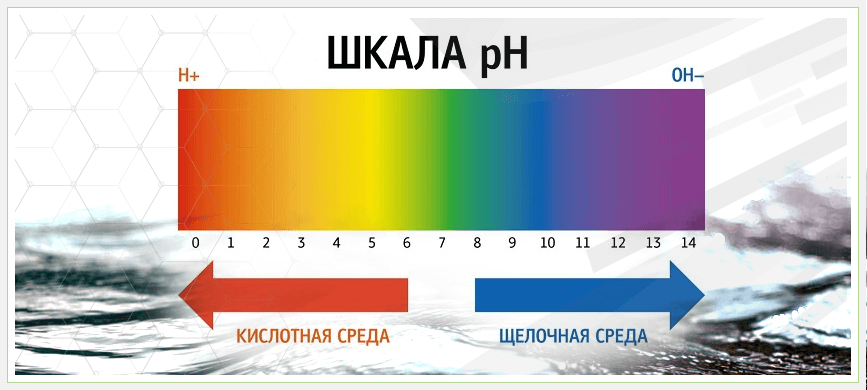
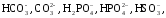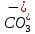Вода является основным жизненно важным элементом, без которого невозможно здоровое функционирование не только человеческого организма, но и всего живого на планете. Однако нередко случается так, что та вода, которая поступает в жилища людей или на промышленные предприятия, является настолько засоренной и непригодной для употребления и использования, что остро нуждается в проверке на несколько основных показателей и срочной очистке. Для того чтобы произвести правильную и эффективную очистку воды для бытового использования, сначала нужно понять из чего она состоит, выяснить определение щелочности воды ГОСТ и то, какие патогенные реакции и химические процессы загрязнение может вызвать при попадании в организм.
Для того чтобы понять важность своевременной проверки жидкостей на пригодность и определение щелочности воды, нужно также понимать, насколько важна и необходима жидкость для человеческого организма. Важность этого элемента и его необходимость человек может не замечать и принимать как данность. Однако от жидкости в теле человека зависит множество реакций и функций. Крепкое и здоровое тело – результат употребление здоровых продуктов питания и воды. Поэтому от чистоты и качества состава жидкости зависит напрямую длительность и качество жизни каждого человека. В воде, которую мы ежедневно употребляем в пищу или в чистом виде, может содержаться большое количество патогенных веществ и микроэлементов, бактерий и вирусов, которые при повышенной концентрации могут спровоцировать появление побочных заболеваний, инфекций, раковых опухолей и эпидемий.
Важно помнить, что отказаться от воды нельзя, поскольку человеческий организм состоит по большей части из жидкостей, запасы которых нужно постоянно пополнять. Поэтому избежать проблемы загрязнения и очистки воды невозможно. Международные организации постоянно работают над тем, чтобы придумать максимально эффективные и действенные способы как определить щелочность воды, проверить и очистить жидкости, дабы каждый человек мог быть уверенными в том, что употребляет максимально качественный фильтрованный продукт без наличия побочных примесей, бактерий и тяжелых металлов.
Для того чтобы понять, зачем нужно очищать и делать анализ воды на щелочность, стоит сначала разобраться в том, какие основные свойства и критерии воды считаются жизненно важными для человеческого функционирования и здоровья. В настоящее время существует несколько стандартизирующих организаций, которые могут определить качество воды и нормы ее загрязненности:
- правила санитарного характера, которые устанавливает научное сообщество микробиологов и химиков Российской Федерации (ГОСТ щелочности воды, СанПиН РФ);
- стандарты качества воды и нормы ее очистки, которые регламентируются международными организациями по охране окружающей среди и здравоохранения (ВОЗ);
- нормы и рамки здорового очищения и состава воды, которые были оговорены научными сообществами и организациями стран Европейского Союза.
Все вышеуказанные инстанции диктуют своеобразные правила и стандарты кислотности, определение общей щелочности воды, которую человек употребляет в бытовых или промышленных целях. Согласно многолетним исследованиям и научным экспериментам, максимально допустимым показателем щелочности питьевой воды принято считать pH от 7 до 7,5 ммоль/л. При этом жесткость жидкости не должна превышать показатель в 7 ммоль на литр. Минералы и соли побочного характера в воде должны быть в концентрации не выше 1 г на литр. В таком же количестве в воде допускается содержание побочных химических элементов, биологических и физических примесей, металлов и солей. Однако, стоит отметить, что все международные организации и регламенты полностью отрицают регламентированное наличие в питьевой воде бактерий или вирусов патогенного характера функционирования, поскольку их присутствие может стать причиной появления эпидемий и массовых заражений людей различного рода инфекциями и заболеваниями.
Щелочность питьевой воды в норме или, другими словами, кислотность воды, является специальным понятием, которое отображает наличие в воде активных ионов водорода, без которых невозможно осуществление многих химических и биологических реакций. Важно отметить, что впервые понятие щелочности воды единицы измерения было выведено и оформлено в единый показатель лишь в 1909 году датским ученым. Тогда для определения кислотности воды был введен символ pH. На что влияет щелочность воды? Примеси водорода в жидкости можно встретить практически везде, щелочь также присутствует в организме человека, что подтверждает важность данного химического понятия и его открытия. В начале двадцатого века было проведено много химических и микробиологических исследований, которые доказали наличие активной концентрации ионов водорода в человеческих тканях и жидкостях. Из этого следует, что от правильной нормы щелочности воды зависит напрямую слаженное и здоровое функционирование человеческого организма и всех его систем.
Щелочность питьевой воды является регламентированным и строго контролируемым показателем, рамки которого устанавливает и контролирует каждая страна. Прибор для определения кислотности и щелочности воды сигнализирует о том, что кислотность питьевой воды может отличаться от регламентированной кислотности воды для промышленных целей. В зависимости от типа производства и целей использования жидкости, многие предприятия имеют специальные буферы, в которых стабильно поддерживается постоянный уровень концентрации ионов водорода, необходимый для осуществления химических или биологических реакций.
Питьевая вода, согласно регламентированным международным рамкам, должна содержать водород в концентрации не более 9 единиц. Превышение этой нормы считается опасным для человеческого здоровья, поскольку из-за перенасыщения тканей тела водородом в жидкостях происходят необратимые химические реакции, которые влекут за собой биологические деформации и развитие патологий.
В последние несколько лет японские микробиологи и ученые проводили эксперименты и пытались определить, как снизить щелочность воды и как влияет повышенный уровень щелочности на функционирование и здоровье человека. В результате исследований прибор для измерения щелочности воды показал, что при постоянном употреблении воды с повышенной кислотностью на протяжении нескольких лет, продолжительность жизни и показатели здоровья человека могут понизиться на 20-30%. Из-за усиленной кислотной среды в организме человека может появиться много злокачественных образований, воспалений и паразитирующих инфекций.
Как определить удовлетворительный уровень щелочности?
Поскольку из воды и жидких веществ состоит основная часть человеческих тканей и органов, употребление жидкого вещества является необходимым ритуалом, без которого невозможно прожить ни единого дня. По этой причине очень важно постоянно следить за составом и качеством воды, которая употребляется ежедневно. Малейшие сбои и отклонения от регламентированных рамок могут губительно сказаться на организме и его функционировании, спровоцировать появление многих опасных и даже неизлечимых недугов.
Как определить щелочность воды в домашних условиях? Максимально пригодной и полезной для повседневного употребления человеком считается вода со щелочным показателем не выше 7,5-8,5. Такая норма называется слабой кислотностью и сигнализирует о нейтральном содержании активных ионов водорода, количество которых удовлетворяет все жизненно важные потребности и функции организма. Щелочность — как повысить щелочность воды? Очищается вода от лишней кислотности специальными фильтрующими установками или с помощью химических добавок. Если у человека нет возможности осуществлять регулярную очистку воды, использовать методику определения щелочности котловой воды и производить контроль ее качества, стоит приобретать уже очищенную воду в таре, которая продается в супермаркетах.
Правильная щелочность воды может повлиять на следующие факторы:
- Обменные процессы. Техника определения щелочности воды, видео которой мы привели выше, говорит о том, что стабилизация концентрации ионов водорода в воде приводит к тому, что в человеческом организме налаживаются обменные процессы и восстанавливается бактериальная флора желудочно-кишечного тракта.
- Умственная деятельность.Измеритель щелочности воды помог установить, что из-за нормированного поступления щелочности мозг человека работает слаженно, поскольку в него поступает достаточное количество кислорода и полезных веществ.
- Иммунитет. Благодаря поступлению в организм правильного количества щелочи стабилизируется иммунная система и налаживается работа эндокринной железы.
От качества и чистоты воды зависит активность человека, его хорошее самочувствие и светлое настроение на каждый день.
Что такое щелочность воды и расчет pH
В таблицах СанПиН РФ («Питьевая вода») предельно допустимая концентрация по щелочным показателям не указывается, поэтому большинство источников при определении нормы щёлочности воды ссылаются на стандарты ВОЗ, директиву ЕС или санитарные правила стран со сходным нормативным порядком.
Так, величина в 30 мг НСО3-/л устанавливается в ЕС-директиве при определении качества предназначенной для потребления человеком воды. В украинских актуальных правилах ГСанПиН для водопроводной воды параметр не устанавливается, а величина в 3 указывается только для фасованной и бюветной воды. Приведённые в российских тематических источниках значения чаще всего варьируются в пределах от 0,5 до тех же 6,5 ммоль/м 3 .
При этом существует ГОСТ 31957-2012 – Межгосударственный стандарт, подписанный органами по стандартизации 6 стран и модифицированный по отношению к другим международным стандартам. Россия, наряду с Арменией, Казахстаном, Киргизией, Таджикистаном, Узбекистаном, входит в число стран, подписавших документ, в котором описываются методы определения щёлочности в концентрации 0,1-100 ммоль/дм 3 .
Определение и содержание понятия
Щёлочностью воды («Щ» в формулах) называют сумму содержащихся в ней веществ – гидроксильных ионов/анионов слабых кислот, – вступающих с сильными кислотами в реакцию с разделением на:
Единица измерения – миллиграмм-эквивалент кислоты, записывающийся как мг-экв/л. Общая щёлочность как сумма анионов слабых кислот – силикатов, боратов, карбонатов, гидрокарбонатов, сульфидов, гидросульфидов, сульфитов, гидросульфитов, фосфатов, анионов гуминовых кислот) – это способность связывать сильные кислоты (их эквивалентное количество). Концентрация некоторых ионов незначительна, поэтому, когда говорят об общей щёлочности, то имеют в виду, главным образом, карбонатный тип (определяющийся ионами угольной кислоты), где гидролизованные анионы образуют гидроксид-ионы:
Щелочной показатель для поверхностных вод связывают с присутствием в них в основном гидрокарбонатов щелочноземельных металлов (и щелочных – в меньшей степени), и для природных вод с pH 8,5 происходит возникновение гидратного типа.
Щелочной параметр необходим для:
- определения содержания карбонатов, а также баланса угольной кислоты (вместе с рН),
- дозирования химических веществ, применяемых в водоснабжении,
- реагентной очистке,
- установлении пригодности водоресурса для ирригации (при избытке щелочноземельных металлов).
Северные районы России с низкими щелочными показателями и pH для природной воды характеризуются повышенной коррозионной агрессивностью, от которой страдают трубопроводы и конструкции из черных металлов и бетона.
По мнению японских исследователей, в районах, где пьют более щелочную воду (выше показателя 6,5, но ниже 9) продолжительность жизни выше на 20-30%. В целом щелочные показатели должны быть достаточными для прохождения химической коагуляции, однако при этом они не должны быть слишком высокими, чтобы не провоцировать физиологические расстройства у водопотребителей. Минимальные щелочные значения составляют +/- 30 мг/л, а максимальные в пределах 450-500 мг/л.
Распространившееся среди обладателей различных модифицированных аэраторов мнение об их влиянии на щелочные свойства гидропотока не подтверждается. Эти аэраторы-экономители ( http://water-save.com/ ) позволяют сократить водорасход, но не влияют на химические характеристики водоресурса.
Методы определения концентрации карбонатов
В межгосударственном стандарте описаны 2 титриметрических метода расчёта щёлочности воды:
- Свободная и общая щёлочность. Для питьевой – расфасованной (негазированной) и из источников питьевого водоснабжения, – природной, а также сточной вод путём титрования (постепенного смешивания) до значения pH 8,3, а также 4,5. Полученные значения применяются для расчётов концентрации карбонатов (в диапазоне 6-6000 мг/дм 3 ) и гидрокарбонатов (6,1-6100 мг/дм 3 ).
- Карбонатная щёлочность. Для воды питьевой, природной, технической на разных стадиях технологических процессов путём титрования до pH 5,4 ед.
Конечная точка титрования определяется при изменении значения на рН-метре или окраски индикатора:
- рН-переход от розового к бесцветному при 8,3-8,0 даёт величину параметра «по фенолфталеину»,
- рН-переход от оранжевого к жёлтому при 4,4 даёт величину параметра «по метиловому оранжевому».
Равным нулю параметр принимается, если для анализируемой пробы рН
Что такое щелочность воды с химической точки зрения
Щелочность — Суммарная концентрация (С) гидроксил ионов в исследуемом растворе, обусловленная присутствием гидроксидов, карбонатов, бикарбонатов, фосфатов, силикатов, гуматов, выраженная в единицах молярной концентрации эквивалента кислоты С (1НСl) ммоль/дм3… … Словарь-справочник терминов нормативно-технической документации
щелочность А — 3.1 щелочность А: Показатель количественной оценки свойств водной среды реагировать с ионами водорода. Примечания 1 Щелочность воды является функцией концентрации гидрокарбоната, карбоната и гидроксида. Обычно акцепторы протона (X) не карбонатная … Словарь-справочник терминов нормативно-технической документации
щелочность, A — 3.1 щелочность, A (alkalinity, А): Показатель количественной оценки свойств водной среды реагировать с ионами водорода. Примечание Щелочность воды является функцией концентрации гидрокарбоната, карбоната и гидроксида. Обычно акцепторы протона (X) … Словарь-справочник терминов нормативно-технической документации
Щелочность морской воды — свойство морской воды, определяемое содержанием в ней анионов слабых кислот и катионов, эквивалентных этим кислотам. Численно равна количеству миллиграмм эквивалентов сильной кислоты, необходимому для нейтрализации 1 литра морской воды до… … Морской словарь
ВОДЫ ФРУКТОВЫЕ — и ягодные, газированные прохладительные напитки, обычно приготовляются из фруктовых и ягодных сиропов и чистой воды, насыщенной COs. Готовый сироп разливается в бутылки 40» (на бутылку емкостью в 240 куб. см берется 15 20 з сиропа), а затем … Большая медицинская энциклопедия
ЩЕЛОЧНОСТЬ морской воды — свойство морской воды, определяемое содержанием в ней анионов слабых кислот и катионов, эквивалентных этим кислотам. Общая Щелочность практически определяется двумя составляющими карбонатной Щелочностью, зависящей от суммарного содержания… … Морской энциклопедический справочник
Щелочность — Щёлочи гидроксиды щелочных и щёлочноземельных металлов. К щелочам относят растворимые в воде основания. При диссоциации щелочи образуют ионы OH и ион металла. К щелочам относятся гидроксиды металлов подгрупп Iа и IIа периодической системы,… … Википедия
АНАЛИЗ ВОДЫ — производится с целью выяснения качества воды и определения возможности использования ее для снабжения рыбоводных прудов. А. в. проводится четыре раза в год: весной (в период весеннего половодья), в середине лета (июль), осенью (в период осеннего… … Прудовое рыбоводство
МЕТОДЫ ГИДРОХИМИЧЕСКОГО АНАЛИЗА МОРСКОЙ ВОДЫ — химические и физико химические методы, используемые в океанологии для определения компонентов химического состава морской воды. При анализе проб морской воды устанавливают соленость, содержание растворенных газов (см. Газы) и биогенных элементов… … Морской энциклопедический справочник
свободная щелочность А р — 3.3 свободная щелочность А р: Щелочность, определяемая титрованием пробы воды до значения рН 8,3. Примечания 1 Свободная щелочность обусловлена содержанием в пробе воды гидроксид ионов и половины содержания карбонат ионов: Ар ≈ с (СО32 ) с… … Словарь-справочник терминов нормативно-технической документации
Щёлочность воды
Под щёлочностью воды понимают способность некоторых её компонентов связывать эквивалентное количество сильных кислот. Иными словами, это способность воды нейтрализовать их коррозионное воздействие.
Общая щёлочность – это общее число находящихся в воде гидроксильных ионов (ОН-) и анионов слабых кислот. То есть карбонатов, гидрокарбонатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов. В процессе их гидролиза, образуются сильные гидроксильные ионы.
Как правило, в природных водоёмах, из-за контакта с атмосферам воздухом, известняками, а так же из-за дыхательной деятельности всех водных организмов, преобладают карбонаты и гидрокарбонаты. Они вносят существенный вклад в общий уровень минерализации воды. Иногда, при рН>8.5 возникает гидратная щёлочность.
Щёлочность пробы воды измеряется в ммоль/л и определяется величиной сильной кислоты (обычно используют соляную кислоту), израсходованной для нейтрализации 1 дм 3 жидкости. В естественной среде кислотность воды, как правило, в пределах нормы и образуется из-за находящихся в ней слабых органических кислот. Параметры кислотности воды вычисляют для очистки химических стоков и подготовки воды, используемой в производстве, животноводстве и сельском хозяйстве.
Для определения щёлочности воды, необходимо провести химический анализ воды.
Щелочность
Щелочностью называется содержание в воде веществ, вступающих в реакцию с сильными кислотами. К этим веществам относятся:
– слабые основания: аммиак, анилин, пиридин и т.п.;
– анионы слабых кислот: 
Различают три формы щелочности: свободную, карбонатную и общую.
Свободная щелочность обусловлена гидроксильными и карбонатными ионами. Ее определяют количеством кислоты, идущей на титрование воды до pH 8,3.
Карбонатная щелочность зависит от наличия в воде только ионов угольной кислоты, т.е. карбонатных и гидрокарбонатных ионов, и определяется количеством кислоты, идущей на титрование воды до pH ≈ 4.
Общая щелочность обусловлена присутствием в воде анионов слабых кислот органического и неорганического происхождения, а также гидроксильных ионов.
В пресных незагрязненных водах карбонатная щелочность настолько велика по сравнению со щелочностью, вносимой другими анионами, что ее можно принимать равной общей щелочности.
Основным источником карбонатных и гидрокарбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, доломитов. Например,
СаСО3 + Н2О + СО2 ↔ Са 2+ + 2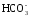
МgCO3 + Н2О + СО2 ↔ Mg 2+ + 2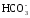
Некоторая часть гидрокарбонатных ионов появляется в результате метаморфизации продуктов химического выветривания изверженных пород:
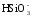
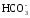
OH – + CO2 → 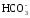
Значительные количества гидрокарбонатных ионов поступают с атмосферными осадками и грунтовыми водами.
Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние, образуя малорастворимые соединения с ионами кальция, могут выпадать в осадок:
Са 2+ + 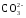
Этот процесс имеет очень важное значение в природе, поскольку от него зависит образование толщ карбонатных пород.
В поверхностных водах гидрокарбонатные и карбонатные ионы присутствуют главным образом в растворенном состоянии. Некоторая часть карбонатных ионов может находиться во взвешенном состоянии и близком к коллоидному состоянию в виде высокодисперсных частиц карбоната кальция.
В растворе между гидрокарбонатными и карбонатными ионами существует подвижное равновесие, определяемое константами диссоциации, характеризующими первую и вторую ступень диссоциации угольной кислоты
Н2СО3 ↔ Н + + 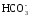

В речных водах содержание гидрокарбонатных ионов колеблется от 30 до 400 мг/дм 3 , в озерах – от 1 до 500 мг/дм 3 . Концентрация их в морских водах колеблется в более узких пределах от 100 до 200 мг/дм 3 , в атмосферных осадках она составляет 30 – 100 мг/дм 3 , в грунтовых водах − от 150 до 300 мг/дм 3 . В подземных водах их содержание заметно возрастает от 150 до 900 мг/дм 3 .
Щелочность является важной характеристикой поверхностных вод, по которой можно судить о важнейших гидрохимических и геохимических процессах, таких как формирование химического состава вод, эрозия земной поверхности, образование карбонатных пород и т.д.
В технике величина щелочности весьма существенна, поскольку от нее зависит коррозия бетона и выпадение карбонатной накипи в котлах, питающих различные паросиловые установки.
Для определения щелочности вод используют следующие методы: прямого титрования, обратного титрования и потенциометрические.
Методы прямого титрования основаны на титровании пробы воды сильной кислотой (НСl, H2SO4) в присутствии различных индикаторов, имеющих переход окраски в точке эквивалентности в области рН от 3 до 4. К ним относятся метиловый оранжевый, бромфеноловый синий, метиловый желтый. Недостатком этого наиболее простого и быстрого метода являются неопределенность значения рН в конечной точке титрования. Для определения свободной щелочности обычно используют фенолфталеин, имеющий интервал перехода рН и окраски индикатора 8,2 – 10,0.
Более точны методы обратного титрования, которые основаны на прибавлении к пробе воды избытка сильной кислоты и его титриметрическом определении в присутствии индикатора. Эти методы находят наибольшее распространение, однако при анализе вод с низкой величиной щелочности (менее 10 мг/дм 3 
В этих случаях предпочтительны различные варианты потенциометрических методов, в которых пробу исследуемой воды титруют сильной кислотой до определенного значения рН, определяемого с помощью рН-метра. На результаты не оказывают влияние следы активного хлора, мутность и окраска воды.
Основные показатели качества воды
Мутность и прозрачность
Мутность – показатель качества воды, обусловленный присутствием в воде нерастворенных и коллоидных веществ неорганического и органического происхождения. Причиной мутности поверхностных вод являются илы, кремниевая кислота, гидроокиси железа и алюминия, органические коллоиды, микроорганизмы и планктон. В грунтовых водах мутность вызвана преимущественно присутствием нерастворенных минеральных веществ, а при проникании в грунт сточных вод – также и присутствием органических веществ. В России мутность определяют фотометрическим путем сравнения проб исследуемой воды со стандартными суспензиями. Результат измерений выражают в мг/дм3 при использовании основной стандартной суспензии каолина или в ЕМ/дм3 (единицы мутности на дм3) при использовании основной стандартной суспензии формазина. Последнюю единицу измерения называют также Единица Мутности по Формазину (ЕМФ) или в западной терминологии FTU (Formazine Turb >
ВОЗ по показаниям влияния на здоровье мутность не нормирует, однако с точки зрения внешнего вида рекомендует, чтобы мутность была не выше 5 NTU (нефелометрическая единица мутности), а для целей обеззараживания – не более 1 NTU.
Мера прозрачности – высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена). Результаты выражаются в сантиметрах.
Характеристика вод по прозрачности (мутности)
Цветность – показатель качества воды, обусловленный главным образом присутствием в воде гуминовых и фульфовых кислот, а также соединений железа (Fe3+). Количество этих веществ зависит от геологических условий в водоносных горизонтах и от количества и размеров торфяников в бассейне исследуемой реки. Так, наибольшую цветность имеют поверхностные воды рек и озер, расположенных в зонах торфяных болот и заболоченных лесов, наименьшую – в степях и степных зонах. Зимой содержание органических веществ в природных водах минимальное, в то время как весной в период половодья и паводков, а также летом в период массового развития водорослей – цветения воды — оно повышается. Подземные воды, как правило, имеют меньшую цветность, чем поверхностные. Таким образом, высокая цветность является тревожным признаком, свидетельствующим о неблагополучии воды. При этом очень важно выяснить причину цветности, так как методы удаления, например, железа и органических соединений отличаются. Наличие же органики не только ухудшает органолептические свойства воды, приводит к возникновению посторонних запахов, но и вызывает резкое снижение концентрации растворенного в воде кислорода, что может быть критично для ряда процессов водоочистки. Некоторые в принципе безвредные органические соединения, вступая в химические реакции (например, с хлором), способны образовывать очень вредные и опасные для здоровья человека соединения.
Цветность измеряется в градусах платино-кобальтовой шкалы и колеблется от единиц до тысяч градусов – Таблица 2.
Характеристика вод по цветности
Вкус и привкус
Вкус воды определяется растворенными в ней веществами органического и неорганического происхождения и различается по характеру и интенсивности. Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе, согласно ГОСТ 3351-74*.
Качественную характеристику оттенков вкусовых ощущений – привкуса – выражают описательно: хлорный, рыбный, горьковатый и так далее. Наиболее распространенный соленый вкус воды чаще всего обусловлен растворенным в воде хлоридом натрия, горький – сульфатом магния, кислый – избытком свободного диоксида углерода и т.д. Порог вкусового восприятия соленых растворов характеризуется такими концентрациями (в дистиллированной воде), мг/л: NaCl – 165; CaCl2 – 470; MgCl2 – 135; MnCl2 – 1,8; FeCl2 – 0,35; MgSO4 – 250; CaSO4 – 70; MnSO4 – 15,7; FeSO4 – 1,6; NaHCO3 – 450.
По силе воздействия на органы вкуса ионы некоторых металлов выстраиваются в следующие ряды:
O катионы: NH4+ > Na+ > K+; Fe2+ > Mn2+ > Mg2+ > Ca2+;
O анионы: ОН- > NO3- > Cl- > HCO3- > SO42- .
Характеристика вод по интенсивности вкуса
Запах – показатель качества воды, определяемый органолептическим методом с помощью обоняния на основании шкалы силы запаха. На запах воды оказывают влияние состав растворенных веществ, температура, значения рН и целый ряд прочих факторов. Интенсивность запаха воды определяют экспертным путем при 20 °С и 60 °С и измеряют в баллах, согласно требованиям.
Следует также указывать группу запаха по следующей классификации:
По характеру запахи делят на две группы:
- естественного происхождения (живущие и отмершие в воде организмы, загнивающие растительные остатки и др.)
- искусственного происхождения (примеси промышленных и сельскохозяйственных сточных вод).
Запахи второй группы (искусственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Запахи естественного происхождения
Интенсивность запаха по ГОСТ 3351-74* оценивают в шестибальной шкале – см. следующую страницу.
Характеристика вод по интенсивности запаха
Водородный показатель (рН)
Водородный показатель (рН) — характеризует концентрацию свободных ионов водорода в воде и выражает степень кислотности или щелочности воды (соотношение в воде ионов Н+ и ОН- образующихся при диссоциации воды) и количественно определяется концентрацией ионов водорода pH = — Ig [H+]
Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН 9,5
Контроль над уровнем рН особенно важен на всех стадиях водоочистки, так как его «уход» в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий. Оптимальная требуемая величина рН варьируется для различных систем водоочистки в соответствии с составом воды, характером материалов, применяемых в системе распределения, а также в зависимости от применяемых методов водообработки.
Обычно уровень рН находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. Так, в речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3. Поэтому ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Вместе с тем известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
Кислотность
Кислотностью называют содержание в воде веществ, способных вступать в реакцию с гидроксид-ионами (ОН-). Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции.
В обычных природных водах кислотность в большинстве случаев зависит только от содержания свободного диоксида углерода. Естественную часть кислотности создают также гуминовые и другие слабые органические кислоты и катионы слабых оснований (ионы аммония, железа, алюминия, органических оснований). В этих случаях pH воды не бывает ниже 4.5.
В загрязненных водоемах может содержаться большое количество сильных кислот или их солей за счет сброса промышленных сточных вод. В этих случаях pH может быть ниже 4.5. Часть общей кислотности, снижающей pH до величин 7 выступает в виде иона HS-;
O при pH = 5 : 7 может быть в виде, как H2S, так и HS-.
воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:
Сероводород придает воде неприятный запах, приводит к развитию серобактерий и вызывает коррозию. Сероводород, преимущественно присутствующий в подземных водах, может быть минерального, органического или биологического происхождения, причем в виде растворенного газа или сульфидов. То, под каким видом проявляется сероводород, зависит от реакции pH:
- при pH 7 выступает в виде иона HS-;
- при pH = 5 : 7 может быть в виде, как H2S, так и HS-.
Сульфаты (SO42-) – наряду с хлоридами являются наиболее распространенными видами загрязнения в воде. Они поступают в воду вследствие вымывания осадочных горных пород, выщелачивания почвы и иногда вследствие окисления сульфидов и серы – продуктов расклада белка из сточных вод. Большое содержание сульфатов в воде может быть причиной болезней пищеварительного тракта, а также такая вода может вызывать коррозию бетона и железобетонных конструкций.
Двуокись углерода
Двуокись углерода (CO2) – в зависимости от реакции pH воды может быть в следующих видах:
- pH 10,5 – в основном в виде иона карбоната CO32-.
Агрессивная двуокись углерода – это часть свободной двуокиси углерода (CO2), которая необходима для удержания растворенных в воде углеводородов от разложения. Она очень активна и вызывает коррозию металлов. Кроме того, приводит к растворению карбоната кальция СаСО3 в строительных растворах или бетоне и поэтому ее необходимо удалять из воды, предназначенной для строительных целей. При оценке агрессивности воды, наряду с агрессивной концентрацией двуокиси углерода, следует также учитывать содержание солей в воде (солесодержание). Вода с одинаковым содержанием агрессивного CO2, тем более агрессивна, чем выше ее солесодержание.
Растворенный кислород
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями. Содержание растворенного кислорода зависит от температуры, атмосферного давления, степени турбулизации воды, минерализации воды и др. В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л. В артезианской воде кислород практически отсутствует.
Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания и называется степенью насыщения кислородом. Этот параметр зависит от температуры воды, атмосферного давления и уровня минерализации. Вычисляется по формуле: M = (ax0,1308×100)/NxP, где
М – степень насыщения воды кислородом, %;
а – концентрация кислорода, мг/дм3;
Р – атмосферное давление в данной местности, МПа.
N – нормальная концентрация кислорода при данной температуре и общем давлении 0,101308 МПа, приведенная в следующей таблице:
Растворимость кислорода в зависимости от температуры воды
Окисляемость
Окисляемость – это показатель, характеризующий содержание в воде органических и минеральных веществ, окисляемых сильным окислителем. Окисляемость выражается в мгO2 необходимого на окисление этих веществ, содержащихся в 1 дм3 исследованной воды.
Различают несколько видов окисляемости воды: перманганатную (1 мг KMnO4 соответствует 0,25 мг O2), бихроматную, иодатную, цериевую. Наиболее высокая степень окисления достигается бихроматным и иодатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах – как правило, бихроматную окисляемость (называемую также ХПК – химическое потребление кислорода). Окисляемость является очень удобным комплексным параметром, позволяющим оценить общее загрязнение воды органическими веществами. Органические вещества, находящиеся в воде весьма разнообразны по своей природе и химическим свойствам. Их состав формируется как под влиянием биохимических процессов протекающих в водоеме, так и за счет поступления поверхностных и подземных вод, атмосферных осадков, промышленных и хозяйственно-бытовых сточных вод. Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды.
Поверхностные воды имеют более высокую окисляемость, а значит в них содержится высокие концентрации органических веществ по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2-3 мг О2/дм3, реки равнинные – 5-12 мг О2/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3.
Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2/дм3 (исключения составляют воды в районах нефтегазовых месторождений, торфяников, в сильно заболоченных местностях, подземных вод северной части РФ).
Электропроводность
Электропроводность – это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от степени минерализации (концентрации растворенных минеральных солей) и температуры. Благодаря этой зависимости, по величине электропроводности можно с определенной степенью погрешности судить о минерализации воды. Такой принцип измерения используется, в частности, в довольно распространенных приборах оперативного измерения общего солесодержания (так называемых TDS-метрах).
Дело в том, что природные воды представляют собой растворы смесей сильных и слабых электролитов. Минеральную часть воды составляют преимущественно ионы натрия (Na+), калия (K+), кальция (Ca2+), хлора (Cl–), сульфата (SO42–), гидрокарбоната (HCO3–).
Этими ионами и обуславливается в основном электропроводность природных вод. Присутствие же других ионов, например трехвалентного и двухвалентного железа (Fe3+ и Fe2+), марганца (Mn2+), алюминия (Al3+), нитрата (NO3–), HPO4–, H2PO4– и т.п. не столь сильно влияет на электропроводность (конечно при условии, что эти ионы не содержатся в воде в значительных количествах, как например, это может быть в производственных или хозяйственно-бытовых сточных водах). Погрешности же измерения возникают из-за неодинаковой удельной электропроводимости растворов различных солей, а также из-за повышения электропроводимости с увеличением температуры. Однако, современный уровень техники позволяет минимизировать эти погрешности, благодаря заранее рассчитанным и занесенным в память зависимостям.
Электропроводность не нормируется, но величина 2000 мкС/см примерно соответствует общей минерализации в 1000 мг/л.
Окислительно-восстановительный потенциал (редокс-потенциал, Eh)
Окислительно-восстановительный потенциал (мера химической активности) Eh вместе с рН, температурой и содержанием солей в воде характеризует состояние стабильности воды. В частности этот потенциал необходимо учитывать при определении стабильности железа в воде. Eh в природных водах колеблется в основном от -0,5 до +0,7 В, но в некоторых глубоких зонах Земной коры может достигать значений минус 0,6 В (сероводородные горячие воды) и +1,2 В (перегретые воды современного вулканизма).
Подземные воды классифицируются:
- Eh > +(0,1–1,15) В – окислительная среда; в воде присутствует растворенный кислород, Fe3+, Cu2+, Pb2+, Mo2+ и др.
- Eh – 0,0 до +0,1 В – переходная окислительно-восстановительная среда, характеризуется неустойчивым геохимическим режимом и переменным содержанием кислорода и cероводорода, а также слабым окислением и слабым восстановлением разных металлов;
- Eh
Повышение щелочности питьевой воды
Сегодня проблема чистой питьевой воды выходит на первый план на многих политических саммитах. Вода – основа жизни, а потому та вода, что поступает к нам в организм, должна соответствовать строгим критериям качества по химическому составу и физическим характеристикам, необходимым для здоровья каждой клетки организма человека. В этом разделе мы кратко расскажем о таком важном показателе качества питьевой воды, как щелочность, а также о возможности и в некоторых случаях необходимости контролируемого изменения этого показателя.
Щелочность и рН — показатели качества питьевой воды

Щелочность воды определяется как содержание в воде веществ, реагирующих с сильными кислотами. К таким веществам относятся:
- сильные основания,
- слабые основания,
- анионы слабых кислот, в том числе карбонат-ионы (CO3 2- ) и гидрокарбонат-ионы (HCO3 — ).
Общая щелочность питьевых вод практически полностью обусловлена концентрацией гидрокарбонат-ионов, называемых также бикарбонат-ионами.
Низкая щелочность воды приводит к нестабильности водородного показателя (рН) и часто сопровождается недопустимо низкими для питьевой воды значениями рН (напомним, что рН – десятичный логарифм концентрации ионов водорода, взятый с противоположным знаком; поэтому, чем выше эта концентрация, т.е., чем более кислая среда, тем ниже значение рН). В соответствии с современными представлениями, щелочность должна быть не менее 0,5 мг-экв./л, что соответствует примерно 30 мг/л гидрокарбонат-ионов. В свою очередь, показатель рН должен находиться в пределах от 6,5 до 8,5.
Зачем повышать щелочность питьевой воды
Вода не всегда соответствует нормируемым санитарными показателям, в том числе по щелочности и рН. Высокая гидрокарбонатная щелочность характерна для некоторых минеральных вод. Обычные же питьевые воды из поверхностных источников, и, тем более, питьевые воды после очистки мембранными методами, характеризуются низкой или даже нулевой щелочностью. В таком случае вода может иметь выраженную кислую реакцию (рН 3
Виды кислотности и щелочности воды.
Кислотностью воды называют содержание в ней веществ, способных вступать в химическую реакцию с гидроксид-ионами ОН-. Кислотность воды определяется эквивалентным количеством гидроксида, необходимого для реакции. На кислотность влияют содержащиеся в воде органические кислоты и катионы металлов и органических оснований. Обозначается кислотность воды pH. pH=7 обозначает нейтральную среду, pH 7 – щелочную.
Щелочность водымг-экв/л, определяется суммой содержащихся в воде гидроксильных ионов и анионов слабых кислот — угольной, органических, а также бикарбонатных и карбонатных ионов.
Активная щелочность обусловлена наличием свободных гидроксид-ионов. Общая щелочность обусловлена ещё и солями слабых кислот и сильных оснований, гидроксирующихся с образованием свободных гидроксид-ионов.
Различают бикарбонатную, карбонатную и гидратную щелочность.
Под щелочностью природных или очищенных вод понимают способность некоторых их компонентов связывать эквивалентное количество сильных кислот. Щелочность обусловлена наличием в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов). Их сумма называется общей щелочностью. Ввиду незначительной концентрации трех последних ионов общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы, гидролизуясь, образуют гидроксид-ионы:
CO32- + H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
Щелочность определяется количеством сильной кислоты, необходимой для нейтрализации 1 дм3 воды. Щелочность большинства природных вод определяется только гидрокарбонатами кальция и магния, pH этих вод не превышает 8,3.
Определение щелочности полезно при дозировании химических веществ, необходимых на обработку вод для водоснабжения, а также при реагентной очистке некоторых сточных вод.
47. Металлы. Нахождение металлов в природе, способы получения, применение. Мета́ллы — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.Характерные свойства металлов:Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита). Хорошая электропроводность.Возможность лёгкой механической обработки (см.: пластичность; однако, некоторые металлы, например германий и висмут, непластичны).Высокая плотность (обычно металлы тяжелее неметаллов).Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы).Большая теплопроводность.В реакциях чаще всего являются восстановителями.Нахождение в природе:Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платинаотносятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).Известно, что организм человека на 3 % состоит из металлов[источник не указан 412 дней]. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах.Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.Существуют несколько основных способов получения —металлов.
Восстановление:— из их оксидов углем или оксидом углерода (II) ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия 4Аl + ЗМnО2 = 2А12О3 + ЗМn
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем) 2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей СuСl2, — Сu2+ 2Сl
Катод (восстановление): Анод (окисление):
Сu2+ 2е- = Сu0 2Cl — 2е- = Сl°2
Применение металлов: металлургическая промышленность, с/х, медицина, строительство, атомная техника, электротехника, теплообменная аппаратура, отражатели, зеркала, авиационная и ракетная техника, нити и спирали накаливания финансовая отрасль (золотой запас государства), ювелирные изделия, электротехника (провода), теплообменники, вакуумные аппараты, химическая промышленность, компьютерная техника.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Щелочность воды: что это такое, норма, расчет
Когда заходит речь о качестве питьевой воды, мы, прежде всего, обращаем внимание на отсутствие вредных примесей, цвет, запах и т.п. А вот о важности такого показателя как щёлочность воды знают далеко не все. В этой статье мы попробуем разобраться, почему норма щёлочности воды так важна для нашего с вами здоровья, как она определяется и как достичь оптимальных показателей щёлочности воды.
Определение щёлочности: немного теории
Для начала попробуем разобраться, что же собственно такое «щёлочность воды». Справочная литература предлагает такое определение щёлочности: это общее число содержащихся в воде гидроксильных ионов, а также анионов слабых кислот. Щёлочность воды может быть гидратная, карбонатная, бикарбонатная, в зависимости от наличия в ней определённых веществ. Также следует разграничить понятие «щёлочность воды» и её водородный показатель (pH). Он показывает концентрацию в воде свободных ионов водорода. Если pH низкий ( 7) – о щелочной. Взаимосвязь pH и щёлочности прямопропорциональна: чем больше щёлочность воды, тем выше показатель pH. Щёлочность измеряется в ммоль/дм3, а рН – просто число единиц.
Согласно Государственным санитарным нормам, оптимальный показатель pH для питьевой воды от 6,5 до 8,5 единиц. Это совпадает с требованиями, применяющимися для контроля качества питьевой воды в США. Нормативы ЕС в этом вопросе отличаются несущественно (от 6,5 до 9,5). Показатель дистиллированной воды – 7 единиц. Это условно нейтральная вода. Показатели pH питьевой воды строго контролируются во всех странах.
А вот нормы щёлочности воды украинскими Государственными санитарными нормами не регулируются. Хотя и учитываются на предприятиях водоснабжения для правильного расчета реагентов, которые используют для обработки воды.
Относительно расчёта щёлочности воды стоит отметить, что оптимальные нормы немного отличаются в зависимости от того, для каких нужд используется вода.
Значение нормы щёлочности воды
Давайте попробуем разобраться, почему такое большое значение придаётся нормам щёлочности воды? Оказывается, от щёлочности воды напрямую зависит состояние нашего организма. Оптимальная норма щёлочности воды поможет наладить такие функции организма:
- обменные процессы
- восстановление микрофлоры кишечника
- активизация мозговой деятельности за счёт обогащения мозга кислородом
- укрепление иммунитета
Это неудивительно, поскольку в самом организме человека преобладают нейтральные или слабощелочные жидкости. Интересно, что pH человеческой крови составляет 7,43 (т.е. практически нейтрален).
Поэтому очень важным является определение щёлочности питьевой воды и контроль этих показателей.
Японские учёные установили, что если человек постоянно употребляет воду щёлочностью 6,5 – 7, то продолжительность жизни увеличивается на 20 – 30%. Дело в том, что кислая среда (низкая щёлочность воды) создаёт идеальные условия для развития различных болезней.
Для поддержания нормального кислотно-щелочного баланса и хорошего самочувствия важно «не закислять» организм. Но проблема в том, что большинство продуктов имеют кислую среду. А значит, для поддержания баланса важно пить воду, именно она способствует тому, что кровь может переносить больше кислорода. Но полезна не всякая вода. В первую очередь нужно обращать внимание на её щёлочность. Лучше, если она близка к нейтральной. Государственные санитарные нормы регламентируют щёлочность питьевой бутилированной воды и воды из бюветов на уровне 6,5 ммоль/дм3. Норма щёлочности воды, поступающей в централизованные водопроводные системы, регулируется ещё на этапе водоподготовки. Повышенная кислотность может наблюдаться в сильно загрязнённых природных водах (например, после сброса отходов промышленных предприятий, когда в воду попадает большое количество сильных кислот и их солей).
Кстати, вода повышенной щёлочности также не слишком полезна. Так, после водных процедур в такой воде может появляться:
- зуд на коже
- высыпания
- раздражения на слизистых
Расчёт щёлочности воды и регулирование уровня рН
В разных регионах уровень pH водопроводной воды колеблется от 5,5 до 10 единиц. При необходимости этот показатель можно и нужно регулировать. Для измерения рН в домашних условиях можно использовать специальные тестеры. А вот для определения щёлочности воды понадобиться сдать образцы на анализ в специализированную лабораторию. После того, как вы получите результаты исследования, специалисты «УкрХимАнализ» дадут необходимые рекомендации. Если вода имеет повышенную щёлочность, то эффективным способом её снижения может стать фильтр. Хорошо справляются с данной проблемой, в частности, системы обратного осмоса. Они помогают не только снизить щёлочность воды, но и нормализовать её состав в целом, уменьшить минерализацию и жёсткость.
- http://hitropop.com/voda/normy/norma-shelochnosti.html
- http://gidrogeology.academic.ru/2432/%D0%A9%D0%95%D0%9B%D0%9E%D0%A7%D0%9D%D0%9E%D0%A1%D0%A2%D0%AC_%D0%92%D0%9E%D0%94%D0%AB
- http://voda.kr-company.ru/analiz/issleduemye-pokazateli/shhjolochnost/
- http://studfiles.net/preview/2953348/
- http://vodeco.ru/general-water/osnovnie-pokazateli.html
- http://www.severyanka.spb.ru/povyshenie-shelochnosty-pitievoy-vody/
- http://cyberpedia.su/13x172c0.html
- http://himanaliz.ua/shhelochnost-vody-norma/