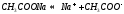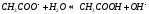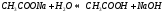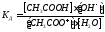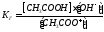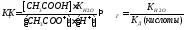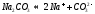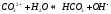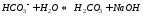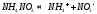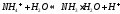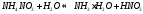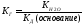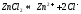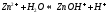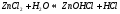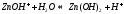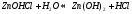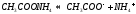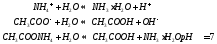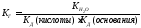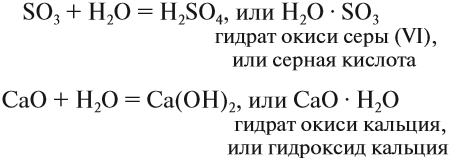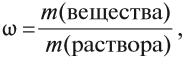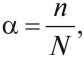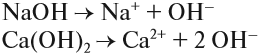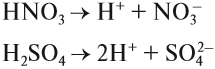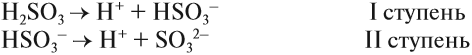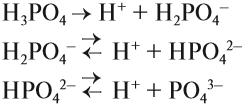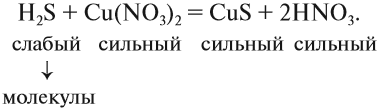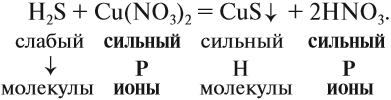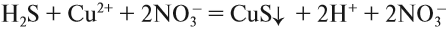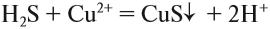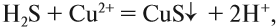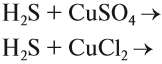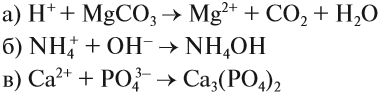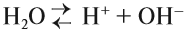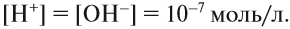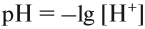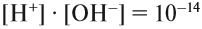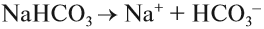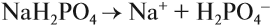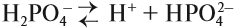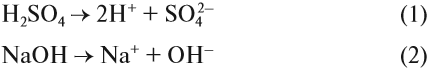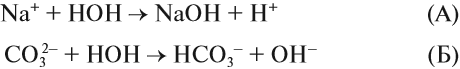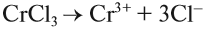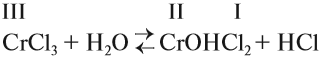Значение растворов для химии невозможно переоценить. Огромное количество химических реакций происходит в растворах, а растворимость — одно из важнейших свойств вещества. Растворы изучает физическая химия. Раствор — это гомогенная, то есть однородная смесь переменного состава, которая состоит из растворителя, растворенного вещества и продуктов, получившихся в результате их взаимодействия. При этом каждый из компонентов распределяется в массе другого в виде молекул, ионов или атомов.
Под переменным составом раствора понимается следующее: соотношение веществ, смешанных друг с другом, способно в определенных пределах непрерывно изменяться. Раствор соли можно упаривать или разбавлять водой, но жидкости, полученные при этом, все равно будут называться растворами соли.
Растворитель отличается от растворенного вещества тем, что его агрегатное состояние при образовании раствора не изменяется. Обычно речь идет о растворе твердого вещества в жидкости, тогда жидкость и есть растворитель. Если же смешивается газ с газом, жидкость с жидкостью, твердое вещество с твердым, то растворителем является тот компонент, количество которого преобладает.
Образование раствора связано с интенсивностью межатомного, межмолекулярного или межионного взаимодействия частиц разных веществ. Процесс взаимодействия растворяемого вещества с водой называется гидратацией, что является частым случаем сольватации — взаимодействия частиц растворенного вещества с частицами растворителя. При гидратации образуются гидраты. Кристаллогидратами называются кристаллы, в состав которых входят молекулы воды такая вода носит название кристаллизационной. Образование водородных и других связей энергетически выгодно, и потому гидратация сопровождается выделением энергии. Ее часть идет на разрушение кристаллической решетки, а избыток выделяется в виде тепла. Так, при растворении твердого гидроксида натрия NaOH раствор сильно разогревается. Но если для разрушения кристаллической решетки расходуется больше энергии, чем выделяется при образовании гидратов, то раствор сильно охладится. Так происходит, например, при растворении в воде твердого нитрата аммония NH4N03.
Таким образом, вещество в растворе находится в новом состоянии — в виде гидратов. Значит, растворение не только физический, но и химический процесс.
В быту раствором называют только жидкое вещество, например раствор соли в воде или золота в ртути. Но в химической практике растворы — это гомогенные системы, в которых растворитель бывает жидким, твердым или газообразным. Смесь цемента с водой и песком тоже называют раствором, хотя с точки зрения химии это раствором не является.
Растворами называются гомогенные системы, содержащие не менее двух веществ. Могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Как правило, вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем , а компонент, взятый в недостатке — растворенным веществом .
В зависимости от агрегатного состояния растворителя различают газообразные , жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жид костей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ, конечно же, является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол, четыреххлористый углерод и др.
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие — в ограниченных (хлорид натрия и вода).
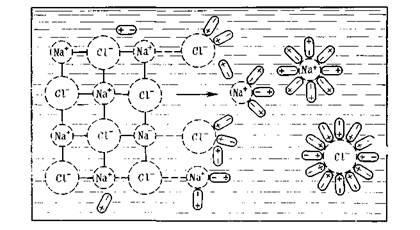
Сущность процесса образования раствора можно показать на примере растворения твердого вещества в жидкости. С точки зре ния молекулярно-кинетической теории растворение протекает следующим образом: при внесении в растворитель какого-либо твердого вещества, например, поваренной соли, частицы ионов Na + и Cl — , находящиеся на поверхности, в результате колебательного движения, увеличивающегося при соударении с частицами растворителя, могут отрываться и переходить в растворитель. Этот процесс распространяется на следующие слои частиц, которые обнажаются в кристалле после удаления поверхностного слоя. Так постепенно частицы, образующие кристалл (ионы или молекулы), переходят в раствор. На рис дана наглядная схема разрушения ионной кристаллической решетки Na С l при растворении в воде, состоящей из полярных молекул.
Частицы, перешедшие в раствор, вследствие диффузии распределяются по всему объему растворителя. С другой стороны, по мере увеличения концентрации частицы (ионы, молекулы), находящиеся в непрерывном движении, при столкновении с твердой поверхностью еще не растворившегося вещества могут задерживаться на ней, т.е. растворение всегда сопровождается обратным явлением — кристаллизацией . Может наступить такой момент, когда одновременно выделяется из раствора столько же частиц (ионов, молекул), сколько их переходит в раствор — наступает равновесие.
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные , ненасыщенные и пересыщенные . По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные .
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным , а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным .
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) — величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным . Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы — растворы с небольшим содержанием растворенного вещества; концентрированные растворы — растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе.
Сравнивая растворимость различных веществ, мы видим, что насыщенные растворы малорастворимых веществ являются разбавленными, а хорошо растворимых веществ — хотя и ненасыщенные, но довольно концентрированными.
В зависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на молекулярные (растворы неэлектролитов ) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток.
Растворы — физико-химические системы. Концентрация растворов. Сущность процесса растворения.
Растворами называют состоящие из двух или нескольких веществ гомогенные системы, состав которых может изменяться в довольно широких пределах. Свойства растворов (плотность, температура кипения, температура замерзания, вязкость и др.), как правило, изменяются постоянно, плавно.
Растворы сходны как с механическими смесями частиц, так и с индивидуальными химическими соединениями. От первых они отличаются тем, что любой макроскопический объем раствора обладает таким же химическим составом и физическими свойствами, как и вся его масса. От химических соединений растворы отличаются тем, что их состав может изменяться в зависимости от количеств взятых компонентов и они не подчиняются закону кратных отношений. Так, состав водного раствора хлорида натрия может произвольно меняться в пределах, допустимых его растворимостью. В 100 г воды при 293 К можно растворить любое количество NaCl в пределах от 0 до 36,8 г, что соответствует предельной растворимости соли при данной температуре. Растворы отличаются от химических соединений также и природой связи. Если для химических соединений характерны в основном ионная и ковалентная связи, то для растворов характерны более слабые ван-дер-ваальсовы, а в некоторых случаях и водородные связи.
В отличие от простого смешивания при растворении веществ происходит определенное взаимодействие между частицами, образующими раствор. Вещество, которое при растворении не меняет своего агрегатного состояния или же входит в состав раствора в преобладающем количестве, обычно называют растворителем. Необходимо отметить, что понятия «растворитель» и «растворенное вещество» имеют смысл лишь в том случае, когда концентрация растворенного вещества в растворителе невелика. Если взять раствор, содержащий 50% спирта и 50% воды, то его в одинаковой мере можно рассматривать как раствор спирта в воде и воды в спирте. В подобных случаях удобнее говорить о компонентах раствора.
По агрегатному состоянию растворы делят на три группы: 1) растворы газов в газах (газовые смеси); 2) жидкие растворы; 3) твердые растворы (изучаются с фазовыми равновесиями).
Пример твердых растворов — сплавы различных металлов, пример газообразных — воздух.
Жидкие растворы в свою очередь подразделяются на растворы газов в жидкостях, растворы жидкостей в жидкостях, растворы твердых тел в жидкостях.
Особое значение имеют водные растворы, так как подавляющее большинство процессов в природе совершается в водной среде. Водные растворы играют исключительно важную роль во всех процессах, протекающих в почвах, а также в животных и растительных организмах. Все природные воды (морская, речная, воды минеральных источников и т. п.) представляют собой не что иное, как растворы различных солей. Различные биологические жидкости: плазма крови, лимфа, соки растительных организмов и другие — также содержат в растворенном состоянии органические и неорганические вещества. Иными словами, растворы — наиболее распространенные системы в природе, и потому учение о растворах является важным разделом физической химии.
Процесс растворения нельзя рассматривать как простое механическое распределение одного вещества в другом. При растворении имеет место физико-химическое взаимодействие растворяемого вещества с молекулами растворителя. Процесс растворения часто сопровождается выделением или поглощением теплоты (теплота растворения), а также уменьшением или увеличением объема раствора. Так, растворение серной кислоты или гидроксида натрия в воде сопровождается таким же тепловым эффектом, как и обычные химические реакции. Это свидетельствует о том, что молекулы (или ионы) растворенного вещества образуют с молекулами растворителя химические соединения. Эти соединения называют сольватами, а процесс их образования — сольватацией; в случае, когда растворителем является вода, их называют гидратами, а процесс их образования — гидратацией.
Когда учение о растворах выделилось в самостоятельный раздел химии, определились две точки зрения на природу растворов, две теории растворов — физическая и химическая.
Основы физической теории растворов были заложены уже во второй половине XIX в. Сванте Аррениусом и Вант-Гоффом. Согласно этой теории процесс растворения рассматривается как чисто физический процесс равномерного распределения частиц растворяемого вещества по всему объему растворителя, который представляет собой некую индифферентную среду. При этом допускают, что никакого взаимодействия между молекулами растворителя и частицам растворенного вещества не существует. Физическая теория растворов подкреплялась тем, что целый ряд свойств растворов — повышение температуры кипения, понижение температуры замерзания, давление пара, осмотическое давление — действительно зависит только от концентрации растворенного вещества, но не зависит от его природы. Таким образом, растворы, согласно этой теории, представляются как однородные смеси молекул, в которых состояние растворенного вещества подобно состоянию газа.
Однако по мере накопления фактического материала постепенно физическая теория растворов уступила место так называемой гидратной теории, основоположником которой был Д. И. Менделеев Значительный вклад в эту теорию позднее внесли И. А. Каблуков, Н. С. Курнаков и другие советские ученые.
Д. И. Менделеев на основании исследований свойств водных растворов серной кислоты, этилового спирта и других веществ пришел к выводу, что между молекулами компонентов раствора существует взаимодействие, приводящее к образованию нестойких соединений частиц растворенного вещества с молекулами растворителя. Так, в растворах серной кислоты Менделеев установил наличие гидратов следующего состава: H2SO4·H2O, Н2SО4·2Н2О, H2SO4·4H2O и др. Он установил также, что соединение молекул или ионов растворяемого вещества с молекулами растворителя осуществляется главным образом за счет водородной связи или же вследствие электростатического взаимодействия полярных молекул веществ.
Наиболее изучены разбавленные растворы. В них частицы растворенного вещества настолько отделены друг от друга молекулами растворителя, что взаимодействие между ними выражено очень слабо и природа растворенного вещества практически не оказывает влияния на свойства разбавленного раствора. Аналогично свойствам газа свойства разбавленных растворов не зависят от состава частиц растворенного вещества и их размеров, а только от числа частиц в единице объема, т. е. от концентрации. Процесс растворения является сложным физико-химическим процессом, в котором наиболее ярко проявляется взаимодействие между частицами (молекулами или ионами) различной химической природы.
На процессы растворения многих веществ, находящихся в различных агрегатных состояниях, большое влияние оказывает полярность молекул растворителя и растворенного вещества. Она выражается в том, что в силу неравномерного распределения электрических зарядов в одной части молекулы могут преобладать положительные заряды, а в другой отрицательные. Полярность отражается на многих свойствах молекул.
В жидкостях полярные молекулы взаимно ориентируются, образуя ассоциаты различной величины и прочности. Это явление имеет место при растворении веществ, состоящих из полярных молекул, в неполярных растворителях. В качестве примера можно указать такие вещества, как бензойная кислота С6Н5СООН, этиловый спирт С2Н5ОН и др., молекулы которых, находясь в растворенном состоянии в бензоле (неполярная жидкость), в большей или меньшей степени ассоциированы по две и более в одну частицу.
В растворе всякая заряженная частица, будь то ион или полярная молекула, окружается сольватной оболочкой, которая состоит из ориентированных соответствующим образом молекул растворителя. Если растворителем является вода, то употребляют термин гидратная оболочка, а само явление носит название гидратации.
Степень гидратации различных ионов и молекул неодинакова и зависит как от величины зарядов этих частиц, так и от их размеров. Чем больше заряд и меньше размеры, т. е. чем выше удельная плотность заряда, тем сильнее выражена гидратация. Таким образом, гидратные оболочки удерживаются электростатическими силами притяжения.
Полярные группы молекул растворенного вещества могут образовать также водородные связи с молекулами воды.
Способностью гидратироваться при растворении обладают не только кристаллические, но также газообразные и жидкие вещества. Гидраты (сольваты) являются соединениями все же менее прочными, чем обычные химические соединения. Они легко могут разрушаться даже при незначительном повышении температуры.
Процесс растворения веществ обусловлен взаимодействием частиц растворенного вещества с молекулами растворителя. Механизм растворения твердых тел в жидкости состоит в основном из трех стадий. В качестве примера рассмотрим растворение кристалла хлорида натрия, который состоит из электростатически связанных ионов натрия и хлора. Как известно, между ионами Na + и Сl — имеет место ионная связь, между молекулами воды действуют силы Ван-дер-Ваальса и водородная связь, а между ионами натрия и хлора, с одной стороны, и полярными молекулами воды — с другой стороны, возникает ионно-дипольная связь. Все эти виды связи как бы конкурируют между собой. При погружении кристалла в воду полярные молекулы Н2О ориентируются таким образом, что к иону Na + они обращены своими отрицательными полюсами, а к иону Сl — — положительными (рис. 4.1), т. е. происходит явление гидратации этих ионов.
Рис. 4.1. Схема растворения кристалла поваренной соли в воде
Образованная в результате гидратации ионно-дипольная связь оказывается прочнее, чем межионная связь Na + — Сl — . В результате теплового движения происходит полный разрыв этой связи у ионов, расположенных у поверхности кристалла.
На второй стадии растворения происходит гидратация тех ионов, которые полностью перешли в раствор. Третья стадия растворения— это самопроизвольный процесс диффузии гидратированных ионов по всему объему растворителя.
Многие кристаллические вещества, относящиеся к неэлектролитам, также обладают высокой растворимостью в воде, что объясняется присутствием в их молекулах полярных групп, способных гидратироваться.
Из рассмотренного выше механизма растворения видно, что на разрушение кристаллической решетки необходимо затратить какое-то количество энергии. С другой стороны, гидратация ионов (или полярных молекул) растворяемого вещества сопровождается выделением энергии в виде теплоты. Таким образом, тепловой эффект растворения является суммой двух слагаемых: а) энергии гидратации (в общем случае — сольватации) и б) энергии кристаллической решетки.
Процесс гидратации всегда сопровождается выделением теплоты. Подсчитано, что энергия гидратации составляет примерно 142 кДж/моль в том случае, если к каждому иону присоединяется по одной молекуле воды. Процесс разрушения кристаллической решетки, наоборот, является эндотермическим, т.е. он протекает с поглощением теплоты. Суммарный тепловой эффект растворения складывается из алгебраических величии энергии разрушения кристаллической решетки твердого вещества и перевода его в жидкое состояние и энергии гидратации. Если затраты энергии на растворение какого-либо вещества больше выделяющейся энергии гидратации, то процесс растворения будет эндотермичным. Если же теплота гидратации больше теплоты, необходимой для разрушения кристаллической решетки, то процесс растворения будет экзотермичным. Так, при растворении гидроксида натрия NaOH температура раствора повышается почти до 373 К, а при растворении роданида аммония NH4SCN понижается до 253 К.
Дата добавления: 2016-02-20 ; просмотров: 4186 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Теории растворов.
Существует 2 теории растворов: физическая и химическая.
Физическая теория растворов.
Была открыта Якобом Г. Вант-Гоффом и Свате А.Аррениусом.
Суть теории растворов: растворитель – химическая индифферентная среда, в которой равномерно распределены частицы растворенного вещества. Теория не предполагает наличие межмолекулярных связей между растворителем и растворенным веществом.
Под эту теорию подходят только идеальные растворы, где компоненты растворителя никак не воздействуют на растворимое соединение. Примером являются газовые растворы, где нереагирующие между собой газы смешиваются друг с другом в неограниченных количествах. Все физические данные (температура кипения и плавления, давление, теплоемкость) вычисляется исходя из свойств всех соединений, входящих в состав.
По закону Дальтона: общее давление газовой смеси равно сумме парциальных давлений ее компонентов:
Химическая теория растворов.
Химическую (сольватную) теорию растворов описал Д.И. Менделеев. Суть заключается в следующем: частицы растворителя и растворенного вещества реагируют друг с другом, в результате чего получаются нестойкие соединения переменного состава – гидраты (сольваты). Основные связи тут – водородные.
Вещество может распадаться на слои (растворяться) в случае полярного растворителя (воды). Ярким примером является растворение поваренной соли.
Также может проткать реакция между компонентами смеси:
В ходе процесса растворения происходит изменение состава и объема реакционной смеси, т.к. протекают 2 процесса: разрушение структуры растворяемого вещества и химическая реакция между частицами. Оба процесса идут с изменением энергии.
Тепловые эффекты могут быть экзотермическими и эндотермическими (с выделением и поглощением энергии).
Соединения с частицами растворителя называются гидратами.
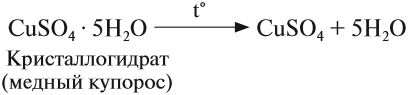
Кристаллические вещества, в состав которых входят гидраты, называются кристаллогидратами и имеют различную окраску. Например, кристаллогидрат сульфата меди: CuSO4 ·5H2О. Раствор кристаллогидрата синий. Если рассмотреть кристаллогидрат кобальта CoCl2· 6H2O, то он обладает розовым цветом, CoCl2· 4H2O – красный, CoCl2 ·2H2O — сине-фиолетовый, CoCl2 ·H2О – темно-синий, а безводный раствор хлорида кобальта – бледно-синего цвета.
Теории растворов
Физическая теория растворов (Вант – Гофф, Аррениус – ученые внесшие вклад в развитие) рассматривала, растворитель, как инертную среду и приравнивала растворы к простым механическим смесям.
Недостатки теории: а) не объясняла энергетический эффект растворителя; б) не объясняла изменения объема в процессе растворения; в) не объясняла изменение окраски в процессе растворения
Химическая теория растворов (Д.И.Менделеев) Растворы рассматривались, как химические соединения. Однако, в растворах нет строгого соотношения между веществом и растворителем, т.е. растворы не подчиняются закону постоянства состава. Кроме того в свойствах растворов можно обнаружить многие свойства, его отдельных компонентов, чего не наблюдается в случае химического соединения.
Физико-химическая теория растворов (Каблуков) С этой точки зрения растворы занимают промежуточное положение, между механическими смесями и химического соединения.
Процесс растворения тесно связан с диффузией, под влияние растворителя от поверхности твердого вещества, постепенно отрываются молекулы или ионы и в растворе диффузий распределяются по всему объему растворителя. С поверхности затем снимается новый слой молекул и т.д. Перешедшие в растворе ионы остаются связанными с молекулами воды и образуют гидраты ионов. В общем случае любого растворителя эти соединения называют сольватами ионов. Одновременно происходит обратный процесс выделения молекул из раствора. Обратный процесс тем больше, чем выше концентрация раствора при динамическом равновесии, сколько молекул растворяются, столько же выделяется из раствора.
5.Гидролиз растворов солей. Степень гидролиза и факторы, влияющие на нее. Типичные случаи гидролиза (показать на примерах).
Взаимодействие ионов соли с водой приводящее к образованию слабого электролита называется гидролизом соли. Различают несколько случаев гидролиза:
Соль сильного основания и слабой кислоты. (CH3COONa, NaCO3, KCN, Na2S)
В водном растворе соль сначала диссоциирует на катионы и анионы
диссоциация:
Анион слабой кислоты взаимодействует с водой, создавая щелочную среду (гидролиз по аниону):
гидролиз:
молекулярное уравнение гидролиза:
Константа диссоциации уравнения гидролиза:
т.к. 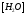
т.к. Кводы = [H + ]·[OH — ], то [OH — ]= Кводы/[H + ]
Т.е. чем слабее кислота, тем меньше ее Кд, тем сильнее будет гидролизована соль.
Гидролиз солей многоосновных кислот протекает ступенчато:
1 ступень:
2 ступень:
В растворах обычной концентрации гидролиз этой соли идет лишь по первой ступени с образованием кислой соли. В сильно разбавленных растворах гидролиз частично идет по 2 ступени с образованием свободной угольной кислоты. Гидролиз по 2 ступени не значителен, т.к. велика концентрация ионов ОН.
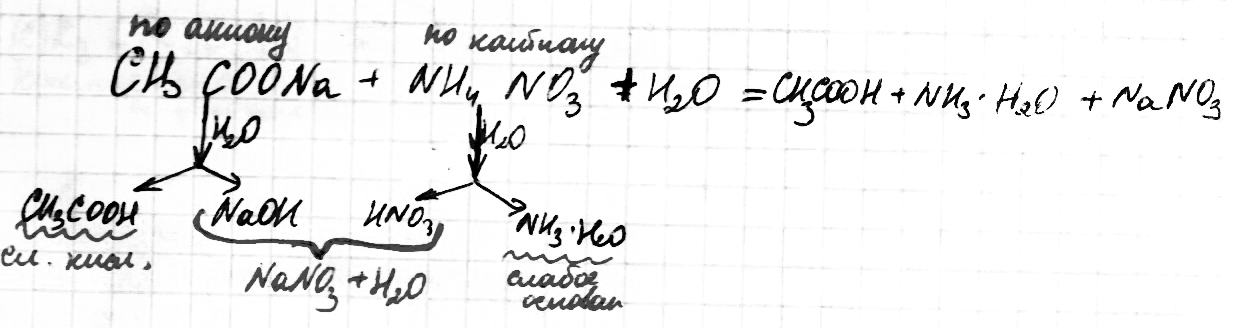
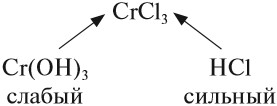
Соль слабого основания и сильной кислоты (nh4no3, ZnCl2, Al2(so4)3)
диссоциация:
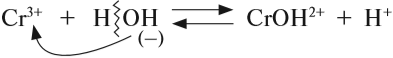
Катион слабого основания взаимодействует с водой, создавая кислую среду:
гидролиз:
молекулярное уравнение гидролиза:
Чем слабее основание, тем сильнее будет гидролизована соль.
Соли многокислотных оснований гидролизуются ступенчато:
1 ступень:
2 ступень:
В обычных условиях гидролиз этой соли идет только по первой ступени.
В данном случае гидролизу подвергается и катион, и анион соли (гидролиз по катиону и аниону)
Диссоциация:
Среда гидролиза определяется тем ионом соли, у которого степень гидролиза выше (кислая, щелочная, нейтральная)
Эти соли при растворении в воде не гидролизуются, их растворы имеют нейтральную реакцию.
Полный (совмещенный) гидролиз
Протекает при сливании 2х растворов разных солей, причем одна из солей гидролизована по катиону, а другая по аниону, при этом образуется слабая кислота и слабое основание.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
h связано с КГ уравнением аналогичным закону разбавления Оствальда
Урок 6. Растворы
Понятие о растворах
Нет на Земле человека, который никогда не видел бы растворов. А что это такое?
Раствор — это однородная (гомогенная) смесь двух или более компонентов (составных частей, или веществ).
Что такое однородная смесь? Однородность смеси предполагает, что между составляющими её веществами отсутствует поверхность раздела. В этом случае невозможно, по крайней мере, визуально, определить, сколько веществ образовало данную смесь. Например, глядя на стакан водопроводной воды, трудно предположить, что в ней, кроме молекул воды, содержится еще добрый десяток ионов и молекул (О2, СО2, Са 2+ и другие). И никакой микроскоп не поможет увидеть эти частицы.
Но отсутствие поверхности раздела — не единственный признак однородности. В однородной смеси состав смеси в любой точке одинаков. Поэтому для получения раствора нужно тщательно перемешать образующие его компоненты (вещества).
Растворы могут иметь разное агрегатное состояние:
- газообразное (например, смесь газов: О2, N2, СО2, Аr образуют воздух);
- жидкое (например, одеколон, сироп, рассол);
- твёрдое (например, сплавы).
Одно из веществ, которые образуют раствор, называется растворителем. Растворитель имеет то же агрегатное состояние, что и раствор. Так, для жидких растворов — это жидкость: вода, масло, бензин и т. д. Чаще всего на практике применяются водные растворы. О них и пойдет далее речь (если не будет сделана соответствующая оговорка).
Что происходит при растворении различных веществ в воде? Почему одни вещества хорошо растворяются в воде, а другие — плохо? От чего зависит растворимость — способность вещества растворяться в воде?
Представим себе, что в стакан тёплой водой положили кусочек сахара. Полежал он, уменьшился в размерах и… исчез. Куда? Неужели нарушается Закон сохранения вещества (его массы, энергии)? Нет. Сделайте глоток полученного раствора, и вы убедитесь, что вода сладкая, сахар не исчез. Но почему его не видно?
Дело в том, что в ходе растворения происходит дробление (измельчение) вещества. В данном случае кусочек сахара распался на молекулы, а их мы видеть не можем. Да, но почему сахар, лежащий на столе, не распадается на молекулы? Почему кусочек маргарина, опущенный в воду, тоже никуда не исчезает? Дело в том, что дробление растворяемого вещества происходит под действием растворителя, например воды. Но растворитель сможет «растащить» кристалл, твёрдое вещество на молекулы, если сумеет «уцепиться» за эти частицы. Другими словами, при растворении вещества должно быть взаимодействие между веществом и растворителем. Такое взаимодействие между веществом и растворителем называется сольватацией, а в случае воды — гидратацией.
Когда возможно такое взаимодействие? Только в том случае, когда строение веществ (и растворяемого, и растворителя) похоже, подобно. Издавна известно правило алхимиков: «подобное растворяется в подобном». В наших примерах молекулы сахара полярны, и между ними и полярными молекулами воды существуют определённые силы взаимодействия. Такие силы отсутствуют между неполярными молекулами жира и полярными молекулами воды. Поэтому жиры в воде не растворяются. Таким образом, растворимость зависит от природы растворяемого вещества и растворителя.
В результате взаимодействия между растворяемым веществом и водой образуются соединения — гидраты. Это могут быть очень прочные соединения:
Такие соединения существуют как индивидуальные вещества: основания, кислородсодержащие кислоты*.
Их общее название — гидроксиды.
Естественно, при образовании таких прочных соединений возникают прочные химические связи, выделяется теплота. Так, при растворении СаО (негашёная известь) в воде выделяется так много теплоты, что смесь закипает.
Но почему при растворении сахара или соли в воде полученный раствор не нагревается? Во-первых, далеко не все гидраты так прочны, как серная кислота или гидроксид кальция. Существуют гидраты солей (кристаллогидраты), которые легко разлагаются при нагревании:
Многие гидраты не выделены в свободном виде, а это означает, что при их образовании выделяется сравнительно мало теплоты.
Во-вторых, всегда при растворении, как уже упоминалось, идёт процесс дробления. А на это, естественно, затрачивается энергия, поглощается теплота.
Поскольку оба процесса происходят одновременно, раствор может нагреваться или охлаждаться в зависимости от того, какой процесс преобладает.
Вопрос. Какой процесс: дробление или гидратация преобладает в каждом случае:
- при растворении серной кислоты в воде, если раствор нагрелся;
- при растворении нитрата аммония в воде, если раствор охладился;
- при растворении поваренной соли в воде, если температура раствора практически не изменилась в ходе растворения.
Поскольку при растворении изменяется температура раствора, естественно предположить, что растворимость зависит от температуры. Действительно, растворимость большинства твёрдых веществ увеличивается при нагревании. Растворимость газов при нагревании уменьшается. Поэтому твёрдые вещества обычно растворяют в тёплой или горячей воде, а газированные напитки хранят на холоде.
Растворимость (способность растворяться) веществ не зависит от измельчения вещества или интенсивности перемешивания. Но, измельчая вещество, перемешивая готовый раствор, можно ускорить процесс растворения. Таким образом, изменяя условия получения раствора, можно получать растворы разных составов. Естественно, существует предел, достигнув которого легко обнаружить, что вещество больше не растворяется в воде. Такой раствор называется насыщенным. Для хорошо растворимых веществ насыщенный раствор будет содержать много растворённого вещества. Так, насыщенный раствор KNO3 при 100 °C содержит 245 граммов соли на 100 граммов воды (в 345 граммах раствора), это концентрированный раствор. Насыщенные растворы плохо растворимых веществ содержат ничтожные массы растворённых соединений. Так, насыщенный раствор хлорида серебра содержит 0,15 мг AgCl в 100 г воды. Это очень разбавленный раствор.
Таким образом, если раствор содержит много растворённого вещества по отношению к растворителю, то он называется концентрированным, если вещества мало — то разбавленным. Очень часто от состава раствора зависят его свойства, а значит, и применение.
Так, разбавленный раствор уксусной кислоты (столовый уксус) используют как вкусовую приправу, а концентрированный раствор этой кислоты (уксусная эссенция) может вызвать смертельный ожог при неосторожном применении (приёме внутрь).
Для того чтобы точно отразить состав растворов, используют величину, равную массовой доле растворенного вещества ω:
где m(вещества) — масса растворённого вещества в растворе; m(раствора) — общая масса раствора, содержащая растворённое вещество и растворитель.
Так, если 100 граммов уксуса содержат 6 граммов уксусной кислоты, то речь идёт о 6 %-ном растворе уксусной кислоты (это — столовый уксус). Способы решения задач с использованием понятия массовой доли растворённого вещества рассмотрены в уроке 30.2.
Электролитическая диссоциация
Всем известно, что металлы проводят электрическим ток. А проводят ли электрический ток растворы? Если бы мы попытались ответить на этот вопрос при помощи опыта, то убедились бы, что раствор сахара не проводит электрический ток, а раствор поваренной соли проводит. Почему? Может быть, исходные вещества — вода или сухой хлорид натрия — электропроводны? Но аналогичный опыт показывает — эти вещества, каждое само по себе, электрический ток проводить не могут.
Для того чтобы объяснить результаты этих опытов и понять смысл явления, необходимо ответить на вопрос: почему вообще некоторые вещества, например металлы, проводят электрический ток? Это происходит потому, что в металлах имеются «свободные» заряженные частицы — электроны. С направленным движением этих заряженных частиц связана электропроводность металлов. Таким образом, если раствор NаСl проводит электрический ток, то, значит, в этом растворе тоже образуются какие-то заряженные частицы. Если раствор сахара не проводит электрический ток, значит, в растворе сахара заряженных частиц не образуется. Исходя из этого, такие вещества называют:
- NаСl — электролит;
- Сахар — неэлектролит.
Итак: ЭЛЕКТРОЛИТЫ — это вещества, растворы (и расплавы) которых проводят электрический ток. А ПОЧЕМУ?
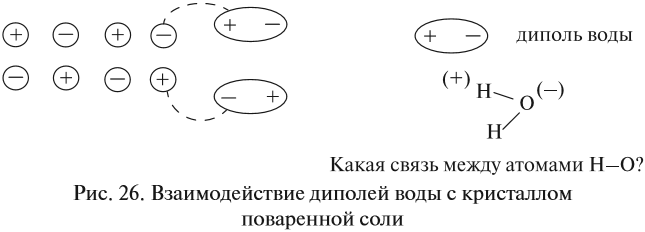
Теперь нам осталось выяснить: откуда в растворе NаСl появились заряженные частицы? Вспомните, какой тип химической связи имеется в кристалле поваренной соли? Ионная связь! То есть связь между заряженными частицами — ионами. Значит, хлорид натрия состоит из разноимённо заряженных частиц! Но почему тогда сухой хлорид натрия не проводит электрический ток? Потому что между ионами в кристалле существуют достаточно сильные электростатические взаимодействия. А в воде? Посмотрите на рис. 26.
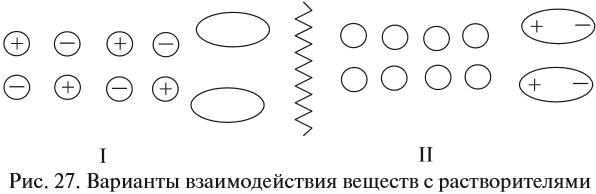
Между ионами соли и молекулами воды возникают довольно значительные силы электростатического взаимодействия. В результате молекулы воды «растаскивают» кристалл на «кусочки» (ионы). Будут ли возникать такие взаимодействия в следующих случаях (рис. 27)?
Очевидно, нет! В обоих случаях или растворитель (случай I), или вещество (случай II) неполярны, и взаимодействия, притяжение частиц друг к другу, ничтожны.
Вывод. Взаимодействие между веществом и растворителем возможно, если и вещество, и растворитель имеют достаточно полярные связи.
Следствием такого взаимодействия является диссоциация — распад вещества на ионы. При этом образуются положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы.
Электролитическая диссоциация — процесс распада электролитов на ионы под действием полярных молекул растворителя (чаще всего — воды).
Задание 6.1. Будут ли проводить электрический ток:
- раствор НСl в воде;
- раствор NаСl в бензине;
- раствор азота в воде;
- 100 %-ная серная кислота?
Если вы всё правильно поняли и правильно ответили, то электропроводность возникнет только в первом случае, а в остальных случаях отсутствуют необходимые для этого условия. Попробуйте сформулировать, какие это условия? Итак.
Вещества, способные в растворах или расплавах распадаться на ионы и, как следствие, проводить в этом состоянии электрический ток, называются электролитами.
К электролитам относят:
Это могут быть как неорганические, так и органические вещества. Правда, большинство органических веществ являются неэлектролитами. Это углеводороды (бензин), углеводы (сахар), спирты (глицерин) и другие (см. уроки 17–28 данного самоучителя).
Задание ЕГЭ. Электролитом является каждое из двух веществ:
- глюкоза и этиловый спирт;
- ацетат натрия и гидроксид калия;
- уксусная кислота и бензол;
- сахар и повареная соль.
Задание ЕГЭ. Электрический ток проводят:
- спиртовой раствор йода,
- расплав парафина,
- расплав ацетата калия,
- водный раствор глюкозы.
Если проверить электропроводность растворов электролитов одного класса, например кислот, то окажется, что в одном случае лампочка вспыхивает ярко, в другом — еле светится. Если принять во внимание, что концентрация веществ в обоих растворах одинакова, — как можно объяснить наблюдения?
Объяснение одно — в первом случае образуется большее число ионов (заряженных частиц), во втором — меньшее. То есть в первом случае электролитическая диссоциация идёт в значительней степени. Такие электролиты называются сильными, и в их растворах много ионов или почти нет (а иногда и совсем нет) молекул. Эти вещества построены по ионному типу или содержат сильнополярные ковалентные связи.
К СИЛЬНЫМ электролитам относятся:
- почти все соли;
- кислоты: НСl, НВr, НI, НNО3, Н2SО4, HClO4 и др.;
- щёлочи (кроме NН4ОН).
Вопрос. Что такое «щёлочь»? (В случае затруднений — см. урок 2.3.)
В растворах слабых электролитов много молекул вещества и мало ионов; электролитическая диссоциация идёт не полностью.
К слабым электролитам относятся:
Фосфорная и сернистая кислоты — электролиты средней силы.
Задание 6.2. Выучите наизусть формулы сильных и слабых электролитов. Вспомните их названия.
Силу электролита можно оценить при помощи степени диссоциации α, которая показывает, какая часть растворённых молекул распалась на ионы:
где n — число молекул, распавшихся на ионы; N — общее число молекул электролита в растворе.
В разбавленных растворов сильных электролитов степень диссоциации α = 1 (или близка к этой величине), т. е. молекул практически нет. Для слабых электролитов α + ) и анион ОН – :
Задание 6.4. Составьте уравнения диссоциации гидроксида калия; гидроксида аммония, гидроксида бария.
КИСЛОТЫ диссоциируют на катион водорода и анион кислотного остатка:
Задание 6.5. Составьте уравнения диссоциации соляной кислоты, серной кислоты, фосфорной кислоты.
Для многоосновных кислот диссоциация может происходить ступенчато. Это означает, что на каждой стадии отщепляется только один ион водорода. Например:
Задание 6.6. Составьте уравнения ступенчатой (постадийной) диссоциации фосфорной кислоты.
Вопрос. Какой из этих процессов идёт в большей степени, то есть какие ионы образуются в большей степени: Н2РО4 – , НРО4 2– или РО4 3– ?
Поскольку отрыв катиона от двухзарядного аниона в высшей степени затруднён (более реальным кажется обратный процесс), то последний процесс практически не происходит. Поэтому по первой стадии Н3РО4 диссоциирует как сильная кислота, а по последней — как очень слабая, причём в растворе фосфорной кислоты фосфат-ионов РО4 3– практически нет.
В целом, сила кислоты определяется:
- её составом;
- степенью окисления центрального атома (чем она больше, тем сильнее кислота);
- стадией диссоциации её.
Вопрос. Предположите, какая кислота более сильная:
- азотная или азотистая;
- серная или сернистая?
Задание ЕГЭ. Какие суждения о диссоциации кислот в водных растворах верны?
- Кислоты в воде диссоциируют с образованием в качестве катиона только иона Н + .
- Среди анионов, образующихся при диссоциации кислот, могут присутствовать разные кислотные остатки.
Разумеется, верны оба суждения.
Задание ЕГЭ. В каком из растворов с одинаковой молярной концентрацией содержание фосфат-ионов наибольшее:
Сила оснований также зависит от заряда иона (валентности) металла: чем он больше, тем слабее электролит (при прочих равных условиях). Так, гидроксид кальция слабее гидроксида натрия, а гидроксид железа (III) слабее гидроксида железа (II).
Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильныхи одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
2. Для сильных электролитов определить растворимость (по таблице растворимости):
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H + написать формулу сильной кислоты;
- ионов ОH — написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.
Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н + и 1 моль гидроксид-анионов ОН – . Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: [Н + ] — равновесная концентрация ионов водорода, моль/л; [OH – ] — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
* Логарифм (lg) — это величина, равная показателю степени при основании 10. Например: lg 100 = lg 10 2 = 2.
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10 –6 моль/л или 10 –2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН – , и одновременно уменьшается концентрация ионов Н + . Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН – составит 10 –3, то [H + ] = 10 –11 , т. е.
рН > 7, среда щелочная.
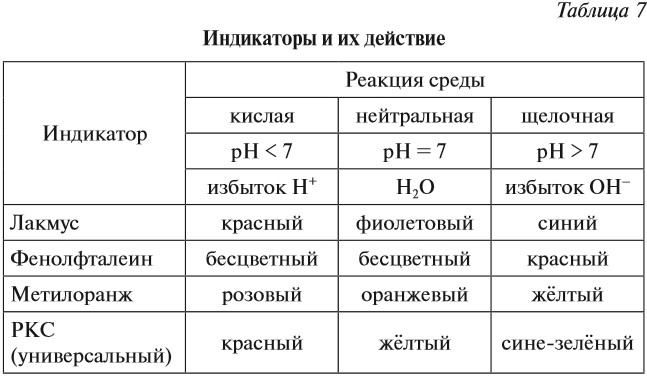
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н + или ОН – .
Ионы Н + или ОН – действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН + ] = 10 –4 моль/л;
- в растворе есть избыток ОН – ;
- рН = 7;
- [ОН – ] = 10 –8 моль/л;
- в растворе есть НNО3;
- [ОН – ] = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н + или ОН – могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н + или ОН – ?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н + , возникает кислая среда.
Кроме того, ионы Н + или ОН – могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?
Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты? гидроксида натрия? сульфата натрия? карбоната натрия? В первых двух случаях можно уверенно сказать «да», так как при диссоциации образуются:
ионы водорода (уравнение 1) или гидроксид-анионы (уравнение 2), а индикаторы реагируют именно на избыток ионов Н + или ОН – . Но при диссоциации упомянутых солей:
ионы Н + и ОН – не образуются! Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата натрия — нет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н + или ОН – .
Гидролиз солей — это процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
Вспомните, что такое «сильный электролит», «слабый электролит», и ответьте на вопрос: какой из этих процессов (А или Б) НЕВОЗМОЖЕН в растворе?
Очевидно, невозможен процесс (А), так как молекул сильного электролита NаОН в растворе НЕТ, есть только ионы Na + и ОН – , другими словами, связывания ионов не происходит.
Следовательно, происходит процесс (Б), и краткое ионномолекулярное уравнение гидролиза карбоната натрия выглядит так:
pH > 7, среда щелочная, лакмус синий.
И действительно, в растворе карбоната натрия лакмус становится синим. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий СЛАБОМУ электролиту и в результате его взаимодействия с водой образуется СЛАБЫЙ электролит (вспомните условия протекания ионных процессов).
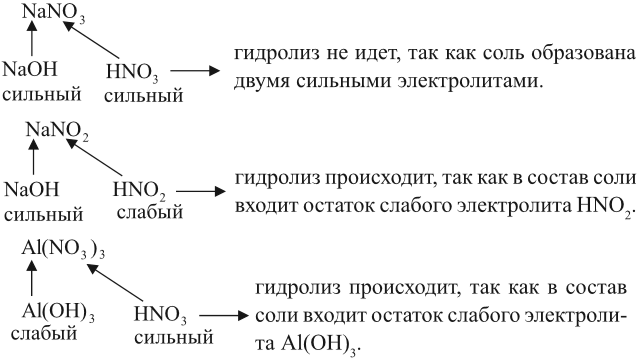
Вывод. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
Задание 6.12. Определите, происходит ли гидролиз в растворах хлорида железа (III), силиката натрия, нитрата калия. Ответ поясните.
Алгоритм составления уравнений реакции гидролиза:
1. Определить какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
3. Для иона слабого электролита составить уравнение реакции взаимодействия с одной молекулой воды (уравнение гидролиза):
- из молекулы воды притягивается противоположно заряженный нон, в данном случае ОН – ;
- сумма зарядов до и после реакции равна:
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н + , значит, среда кислая, рН – );
составить полученные формулы по валентности (валентность = заряду иона!):
Задание 6.13. Составить уравнения реакций гидролиза для: сульфата алюминия; силиката калия; хлорида натрия; нитрата меди (II); сульфида калия.
Задание 6.14. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца (II), сульфата калия, сульфида натрия?
Растворы — это однородная смесь двух или более компонентов. При образовании растворов в результате сольватации происходит дробление растворяемого вещества до молекул или ионов.
Истинный раствор — это однородная смесь молекул и ионов различных веществ.
Электролиты это вещества, которые в водных растворах распадаются на ионы (диссоциируют). Уравнения реакций для таких веществ составляют с учётом этого процесса в ионно-молекулярной форме. Реакции ионного обмена, в том числе гидролиз, осуществимы, если происходит связывание ионов, т. е. образуется осадок, газ или слабый электролит.
- http://www.himhelp.ru/section23/section6/section38/
- http://helpiks.org/7-14655.html
- http://www.calc.ru/Teorii-Rastvorov.html
- http://studfiles.net/preview/2823909/page:5/
- http://himi4ka.ru/samouchitel-po-himii/urok-6-rastvory.html