Всем нам практически ежедневно приходится сталкиваться с тем или иным проявлением процессом горения. В нашей статье мы хотим более подробно рассказать какие особенности включает в себя данный процесс с научной точки зрения.
Горение является основной составляющим процессом на пожаре. Пожар начинается с возникновения горения, его интенсивность развития как правило путь пройденный огнем, то есть скорость горения, а тушение заканчивается прекращением горения.
Под горением обычно понимают экзотермическую реакцию между горючим и окислителем, сопровождающуюся, по крайней мере, одним из трех следующих факторов: пламенем, свечением, дымообразованием. Из-за сложности процесса горения указанное определение не является исчерпывающим. В нем не учтены такие важнейшие особенности горения, как быстрое протекание лежащей в его основе экзотермической реакции, ее самоподдерживающийся характер и способность к самораспространению процесса по горючей смеси.
Различие между медленной экзотермической окислительно-восстановительной реакцией (коррозия железа, гниение) и горением заключается в том, что последняя протекает настолько быстро, что теплота производится быстрее, чем рассеивается. Это приводит к повышению температуры в зоне реакции на сотни и даже тысячи градусов, к видимому свечению и образованию пламени. По сути так образуется пламенное горение.Если происходит выделение тепла но пламя при это отсутствует, то этот процесс называется тлением.И в том и в другом процессе происходит образование дыма – аэрозоля полного или неполного сгорания веществ. Стоит отметить, что при горении некоторых веществ пламени не видно, а также отсутствует и выделение дыма, к таким веществам относится водород. Слишком быстрые реакции (взрывчатое превращение) также не входят в понятие горения.
Необходимым условием для возникновения горения является наличие горючего вещества, окислителя (при пожаре его роль выполняет кислород воздуха) и источника зажигания. Для непосредственного возгорания необходимо наличие критических условий по составу горючей смеси, геометрии и температуре горючего материала, давлению и др. После возникновения горения в качестве источника зажигания выступает уже само пламя или зона реакции.
Например, метан способен окисляться кислородом с выделением тепла до метилового спирта и муравьиной кислоты при 500-700 К. Однако, чтобы реакция продолжилась, необходимо пополнение теплоты за счет внешнего подогрева. Горением это не является. При нагревании реакционной смеси до температуры выше 1000 К скорость окисления метана возрастает настолько, что выделяющегося тепла становится достаточно для дальнейшего продолжения реакции, необходимость в подводе теплоты извне исчезает, начинается горение. Таким образом, реакция горения, возникнув, способна сама себя поддерживать. Это главная отличительная особенность процесса горения. Другая, связанная с ней особенность — способность пламени, являющегося зоной химической реакции, самопроизвольно распространяться по горючей среде или горючему материалу со скоростью, определяемой природой и составом реакционной смеси, а также условиями процесса. Это основной механизм развития пожара.
Типичная модель горения построена на реакции окисления органических веществ или углерода кислородом воздуха. Множество физических и химических процессов сопровождают горение. Физика это перенос тепла в систему. Окислительные и восстановительные реакции это составляющая природы горения со стороны химии. Отсюда из понятия горение вытекают самые разные химические превращения, включая разложение исходных соединений, диссоциации и ионизации продуктов.
Совокупность горючего вещества или материала с окислителем представляет собой горючую среду. В результате разложения горючих веществ под воздействием источника зажигания происходит образование газопаровоздушной реакционной смеси. Горючие смеси, которые по составу (соотношению компонентов горючего и окислителя) отвечают уравнению химической реакции, называются смесями стехиометрического состава. Они наиболее опасны в пожарном отношении: легче воспламеняются, интенсивнее горят, обеспечивая полное сгорание вещества, в результате чего выделяют максимальное количество теплоты.
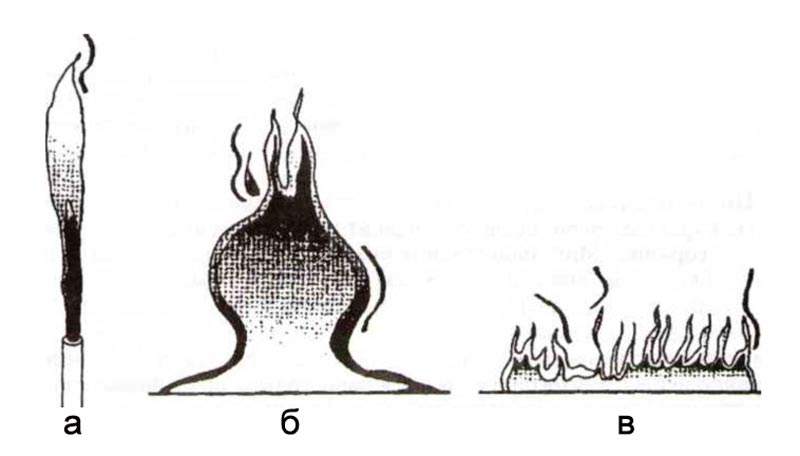
Рис. 1. Формы диффузионных пламен
а – горение реактивной струи, б – горение разлитой жидкости, в – горение лесной подстилки
По соотношению количества горючего материала и объема окислителя различают бедные и богатые смеси: бедные содержат в изобилии окислитель, богатые — горючий материал. Минимальное количество окислителя, необходимое для полного сгорания единицы массы (объема) того или иного горючего вещества, определяется по уравнению химической реакции. При горении с участием кислорода требуемый (удельный) расход воздуха для большинства горючих веществ находится в пределах 4-15 м 3 /кг. Горение веществ и материалов возможно только при обусловленном содержании в воздухе их паров или газообразных продуктов, а также при концентрации кислорода не ниже заданного предела.
Так, для картона и хлопка самопотухание наступает уже при 14 об. % кислорода, а полиэфирной ваты — при 16 об. %. В процессе горения, как и в других химических процессах, обязательны два этапа: создание молекулярного контакта между реагентами и само взаимодействие молекул горючего с окислителем с образованием продуктов реакции. Если скорость превращения исходных реагентов определяется диффузионными процессами, т.е. скоростью переноса (пары горючих газов и кислорода переносятся в зону реакции за счет градиента концентраций в соответствии с законами диффузии Фика), то такой режим горения называется диффузионным. На рис. 1 приведены различные формы диффузионных пламен. При диффузионном режиме зона горения размыта, и в ней образуется значительное количество продуктов неполного сгорания. Если же скорость горения зависит только от скорости химической реакции, которая значительно выше скорости диффузии, то режим горения называется кинетическим. Ему свойственны более высокие скорости и полнота сгорания и как следствие высокие скорости тепловыделения и температура пламени. Этот режим имеет место в предварительно перемешанных смесях горючего и окислителя. Отсюда, если реагенты в зоне химической реакции находятся в одинаковой (обычно газовой) фазе, то такое горение называют гомогенным, при нахождении горючего и окислителя в зоне реакции в разных фазах — гетерогенным. Гомогенным является горение не только газов, но и жидкостей, а также большинства твердых веществ и материалов. Объясняется это тем, что в зоне реакции горят не сами материалы, а их пары и газообразные продукты разложения. Наличие пламени является отличительным признаком гомогенного горения.
Примерами гетерогенного горения служат горение углерода, углистых остатков древесины, нелетучих металлов, которые даже при высоких температурах остаются в твердом состоянии. Химическая реакция горения в этом случае будет происходить на поверхности раздела фаз (твердой и газообразной). Отметим, что конечными продуктами горения могут быть не только оксиды, но и фториды, хлориды, нитриды, сульфиды, карбиды и др.
Характеристики процесса горения разнообразны. Их можно подразделить на следующие группы: форма, размер и структура пламени; температура пламени, его излучательная способность; тепловыделение и теплота сгорания; скорость горения и концентрационные пределы устойчивого горения и др.
Всем известно, что при горении образуется свечение которое сопровождает пламя продукта горения.
Рассмотрим две системы:
- газообразная система
- конденсированная система
В первом случае при возникновении горения весь процесс будет происходить в пламени, во втором же случае часть реакций будет происходить в самом материале, либо его поверхности. Как упоминалось выше существуют газы которые могут гореть без пламени, но если рассматривать твердые вещества существуют также группы металлов которые также способны гореть без проявления пламени.
Часть пламени с максимальным значением, где происходят интенсивные превращения, называется фронтом пламени.
Теплообменные процессы и диффузия активных частиц из зоны горения которые являются ключевыми механизмами движения фронта пламени по горючей смеси.
Скорость распространения пламени принято разделять на:
- дефлаграционное (нормальное), протекающее с дозвуковыми скоростями (0,05-50 м/с)
- детонационное, когда скорости достигают 500-3000 м/с.
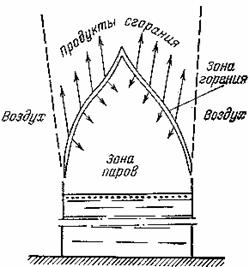
Рис. 2. Ламинарное диффузионное пламя
В зависимости от характера скорости движения газового потока, создающего пламя, различают ламинарные и турбулентные пламена. В ламинарном пламени движение газов происходит в разных слоях, все процессы тепло-, массоообмена происходят путем молекулярной диффузии и конвекции. В турбулентных пламенах процессы тепло-, массообмена осуществляются в основном за счет макроскопического вихревого движения. Пламя свечи — пример ламинарного диффузионного пламени (рис. 2). Любое пламя высотой более 30 см будет уже обладать случайной газовой механической неустойчивостью, которая проявляется видимыми завихрениями дыма и пламени.
Рис. 3. Переход ламинарного потока в турбулентный
Очень наглядным примером перехода ламинарного потока в турбулентный является струйка сигаретного дыма (рис. 3), которая, поднявшись на высоту около 30 см, приобретает турбулентность.
При пожарах пламена имеют диффузионный турбулентный характер. Присутствие турбулентности в пламени усиливает перенос тепла, а смешивание влияет на химические процессы. В турбулентном пламени выше также скорости горения. Это явление делает затруднительным перенос поведения мелкомасштабных пламен на крупномасштабные, имеющих большую глубину и высоту.
Экспериментально доказано, что температура горения веществ в воздухе гораздо ниже температуры горения в атмосферной кислородной среде
В воздухе температура будет колебаться от 650 до 3100 °С, а в кислородной показатели температуры возрастут на 500-800 °С.
Введение
Более 90% всех ЧС представляют собой пожары или сопровождаются пожарами после их возникновения. Пожары — самые распространенные чрезвычайные происшествия. Процесс вредного воздействия пожара и явлений, его сопровождающих (взрывы, обрушение конструкций, выход из строя технологических установок, разрыв трубопроводов, разрушение резервуаров и т.д.), является многосторонним. Он может включать в себя радиационное и химическое загрязнение атмосферы, почвы, гибель флоры и фауны, сопровождаться потреблением кислорода воздуха, образованием продуктов сгорания, в т.ч. и токсичных, и поступлением их в атмосферу, использованием воды для целей пожаротушения, распространением водяных паров и отработанной воды с растворенными в них токсичными продуктами на обширную территорию. Масштабы такого загрязнения иногда выходят за пределы страны (например, авария на Чернобыльской АЭС).
При сгорании 1 кг древесины, например, в среднем расходуется около 4,2 м3 воздуха, объем продуктов сгорания при этом составляет около 4,9 м3, а для нефти эти показатели составляют, соответственно, 11,8 и 11,9 м3.
Горение есть главный и основной процесс на пожаре, и тушение пожара, с физической точки зрения, всегда сводится к прекращению горения во всех его видах и формах.
Горение — один из первых сложных физико-химических процессов, с которым человек встретился еще на заре своего развития. Процесс, овладев которым, он получил огромное превосходство над окружающими его живыми существами и силами природы.
Горение — одна из форм (главных) получения и преобразования энергии, основа многих технологических процессов производства. Поэтому человек постоянно изучает и познает процессы горения.
История науки о горении начинается с открытия М.В. Ломоносова: «Горение есть соединение веществ с воздухом». Это открытие послужило основанием для открытия закона сохранения массы веществ при их физических и химических превращениях. Лавуазье уточнил определение процесса горения: «Горение есть соединение веществ не с воздухом, а с кислородом воздуха».
В дальнейшем существенный вклад в изучение и развитие науки о горении внесли советские и российские ученые А.В. Михельсон, Н.Н. Семенов, Я.В. Зельдович, Ю.Б. Харитон, И.В. Блинов и др.
В основе процессов горения лежат экзотермические окислительно-восстановительные реакции, которые подчиняются законам химической кинетики, химической термодинамики и др. фундаментальным законам природы (закону сохранения массы, энергии и т.д.).
Из курса химии известно, что в основе процесса горения лежат окислительно-восстановительные реакции, при которых происходит переход электронов от восстановителей к окислителям, что сопровождается изменением степеней окисления соответствующих атомов.
В результате передачи электронов изменяется структура внешнего (валентного) электронного уровня атомов. Каждый атом при этом переходит в наиболее устойчивое в данных условиях состояние.
В химических процессах электроны могут полностью переходить из электронной оболочки атомов одного вида в оболочку атомов другого вида.
Горение — это химическая реакция окисления, сопровождающаяся выделением большого количества тепла и обычно свечением.
Можно дать и более точное определение процессу горения, отражающее его сущность: «Горением называется сложный физико-химический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с окислителем (кислородом воздуха), превращаясь в продукты горения, и который сопровождается интенсивным выделением тепла и световым излучением».
Условия, необходимые для возникновения процесса горения (рис.): наличие горючего вещества (Г.В.); наличие окислителя (О.) — кислорода воздуха; наличие источника зажигания (И.З.).
Рис. Мнемоническая схема: классический треугольник пожара
Эти три условия являются основными, они между собой взаимосвязаны и взаимообусловлены.
Но их недостаточно для протекания процесса горения. Кроме этого, должны соблюдаться следующие условия:
а) горючее вещество должно быть нагрето до определенной температуры, при которой начнется процесс окисления;
б) чтобы нагреть горючее вещество до определенной температуры, необходима определенная мощность источника зажигания;
в) чтобы поддерживать процесс горения, необходимы определенные концентрации горючего и окислителя.
Горение — это комплекс взаимосвязанных химических и физических процессов. Важнейшие процессы при горении — тепло- и массоперенос. Наиболее общее свойство горения — это возникновение пламени и перемещение его по всей горючей смеси путем передачи тепла или диффузии активных частиц из зоны горения в свежую горючую смесь.
Пламя — это видимое проявление горения. Его называют также зоной горения. Это та часть пространства, где происходит превращение горючей смеси в продукты полного и неполного сгорания.
В условиях пожара главными параметрами процесса горения, приводящими к гибели людей и наносящими материальный ущерб, являются большое количество тепла, выделяемого в зоне горения, высокая температура, возникающая в результате интенсивного тепловыделения, и токсичный состав продуктов горения, который в значительной степени зависит от вида (природы) горящего материала и количества воздуха, участвующего в процессе горения. При пожаре горение всегда происходит при недостатке воздуха в зоне горения, что способствует образованию продуктов неполного горения (токсичной окиси углерода СО, частиц твердого углерода С (в виде сажи), делающими дым на пожаре черным и непрозрачным, и других продуктов пиролиза горючих веществ).
Согласно ГОСТу пожарэто неконтролируемое горение вне специального очага, наносящее материальный ущерб. Горение представляет собой сложный физико-химический процесс превращения горючих веществ и материалов в продукты сгорания, сопровождаемый интенсивным выделением тепла и световым излучением.
В основе горения в подавляющем большинстве случаев лежат быстротекущие химические реакции окисления сгораемых материалов кислородом воздуха, в первую очередь углерода с образованием СО2 (углекислый газ), и водорода с образованием Н2О ( водяной пар). При пожарах со свободным притоком воздуха его состав условно можно считать постоянным: 21% кислорода и 79% азота (по объему) или 23% и 77% (по весу).
Для всех пожаров характерны:
-горение с выделением тепла и продуктов сгорания;
-газообмен, осуществляемый по механизму конвективных газовых потоков, обеспечивающий приток кислорода воздуха в зону горения и отвод продуктов сгорания из нее;
-передача тепла из зоны горения в окружающее пространство, в том числе горючим материалам, без чего невозможен непрерывный процесс горения.
Виды горения при пожарах.
Под воздействием тепла источника зажигания газы, жидкости, твердые вещества и пыли ведут себя по разному. При пожарах различают два основных вида горения: гомогенное и гетерогенное.
При гомогенном горении окислитель и горючее находятся в газовой фазе. Помимо того, что гомогенное горение имеет место при сгорании горючего газа, все горючие жидкости перед воспламенением испаряются, образуя газообразную среду. Большинство твердых веществ в процессе нагрева при пожаре плавятся, разлагаются и испаряются, выделяя газообразные фракции. Полученная любым из этих превращений газообразная среда смешивается с воздухом и горит.
При гетерогенном горении горючее находится в твердом состоянии, а окислитель в газообразном, и реакция окисления горючего происходит в твердой фазе. Твердые вещества, превращенные в пыль (угольную, металлическую, текстильную), при перемешивании с воздухом образуют пожаровзрывоопасные пылевоздушные смеси.
Поскольку при горении на пожарах роль окислителя чаще всего выполняет кислород воздуха, окружающего зону протекания химических реакций, интенсивность горения определяется не скоростью протекания этих реакций, а скоростью поступления кислорода из окружающей среды в зону горения.
В пространстве, в котором развивается пожар, условно рассматривают три зоны: горения, теплового воздействия и задымления.
Зоной горения называется часть пространства, в которой происходит подготовка горючих веществ к горению (подогрев, испарение, разложение) и их горение.
Зоной теплового воздействия называется часть пространства примыкающая к зоне горения, в которой тепловое воздействие приводит к заметному изменению состояния материалов и конструкций и делает невозможным пребывание в ней людей без специальной защиты. Внешняя граница этой зоны соответствует температуре 60-70°С.
Зоной задымления называется часть пространства в которой от дыма создается угроза жизни и здоровью людей (статистика показывает, что большая часть людей на пожаре гибнет от удушья).
Участвующие в горении вещества и характеризующие их параметры.
По агрегатному состоянию участвующие в горении вещества подразделяют на газообразные, жидкие и твердые.
К газам относятся вещества, абсолютное давление паров которых при температуре 50°С равно или превышает 300кПа, или критическая температура которых менее 50°С.
К жидкостям — вещества, температура плавления (каплепадения) которых менее 50°С.
К твердым — вещества с температурой плавления (каплепадения) 50°С и выше. В твердых веществах особую группу составляют пыли, т.е. диспергированные вещества с размером частиц менее 850мкм.
По возможности возгорания вещества подразделяют на негорючие, трудногорючие и горючие. Негорючие (несгораемые) — это вещества и материалы, не способные гореть на воздухе. Трудногорючие (трудносгораемые) — это вещества и материалы, способные возгораться в воздухе от источника зажигания, но не способные самостоятельно гореть после его удаления. Горючие (сгораемые) — это вещества и материалы способные самовозгораться, а также возгораться от источника зажигания и самостоятельно гореть после его удаления.
Из группы горючих веществ выделяют легковоспламеняющиеся вещества и материалы, т.е. такие, которые способны воспламеняться от кратковременного (до 30 секунд) воздействия источника зажигания с низкой энергией (пламя спички, искра, сигарета и т.п.). К легковоспламеняющимся относятся жидкости с температурой вспышки не выше 61 град.С в закрытом тигле или 66 град.С в открытом тигле.
Вспышка — быстрое горение горючей смеси, не сопровождающееся образованием сжатых газов и не переходящее в стационарное горение.
Температурой вспышки называется самая низкая температура горючего вещества, при которой в условиях специальных испытаний над его поверхностью образуются пары или газы, способные вспыхивать от источника зажигания, но скорость их образования еще недостаточна для возникновения устойчивого горения.
Температурой воспламенения называется наименьшая температура вещества, при которой в условиях специальных испытаний вещество выделяет пары и газы с такой скоростью, что после их зажигания возникает устойчивое пламенное горение.
Температура самовоспламенения — самая низкая температура вещества, при которой в условиях специальных испытаний происходит резкое увеличение экзотермических реакций, заканчивающееся пламенным горением. Эта температура, не являясь физико-химической константой, существенно зависит от формы и объема вещества, а также ряда других факторов. Поэтому для определения температуры самовоспламенения используется специальная установка.
К основным параметрам пожара относятся: пожарная нагрузка, массовая скорость выгорания, скорость распространения пожара, температура пожара, интенсивность выделения тепла и др.
Пожарная нагрузка характеризует энергетический потенциал сгораемых материалов, приходящийся на единицу соответствующей площади (пола или участка земли). Пожарная нагрузка измеряется в единицах энергии или количества сгораемых материалов (в пересчете на древесину) на единице площади, например, Дж/м.кв (при пересчете на энергию, выделяющуюся при горении) или кг/м.кв (в пересчете на древесину — исходя из того, что при сгорании одного кг древесины выделяется 18,8 МДж энергии).
Пожарная нагрузка помещения состоит из постоянной (все сгораемые конструкции сооружения) и временной (находящиеся в помещении материалы). В зданиях пожарная нагрузка каждого этажа определяется отдельно и лимитируется соответствующими нормативами.
Массовая скорость выгорания — потеря массы горящего материала в единицу времени. Она зависит от отношения площади поверхности горения веществ к их объему, плотности упаковки, условий газообмена и других причин. (Например, скорость выгорания мебели 50 кг/м.кв.ч, бревен и крупных деревянных элементов 25 кг/м.кв.ч ; пиломатериалов в штабелях 400 кг/м.кв.ч). Чем больше скорость выгорания, тем выше температура, развиваемая при пожаре.
Скорость распространения пожара определяется скоростью распространения пламени по поверхности горючего материала. Она зависит от многих факторов (вида материала, способности к воспламенению, начальной температуры, направления газового потока, степени измельчения материала и др.). Кроме того она непостоянна во времени. На практике при проведении расчетов пользуются средними значениями этого параметра:
при горении легковоспламеняющихся горючих жидкостей 30 м/мин,
по штабелям пиломатериалов 4 м/мин,
по деревянным покрытиям 1 м/мин,
по пустотам деревянных конструкций до 2 м/мин.
Скорость распространения пламени по поверхности материалов варьируется в широких пределах в зависимости от угла наклона этой поверхности к горизонтали. При угле наклона 90 градусов скорость распространения пламени вниз меньше указанных значений в 2 раза, а вверх — в 8-10 раз больше.
При увеличении температуры скорость увеличивается, а при достижении температуры самовоспламенения материалов их поверхность охватывается пламенем почти мгновенно.
Значения скорости распространения пламени в различных газах при атмосферном давлении и комнатной температуре приведены ниже.
Углеводородо-воздушные смеси 0,3 -0,5 м/с, 18-30 м/мин
Водородо-воздушная смесь 2,8 м/с, 168 м/мин
Водородо-кислородная смесь 13,8 м/с, 828 м/мин
Ацителено-кислородная смесь 15,4 м/с, 924 м/мин
Что такое горение? Значение слова, суть химического процесса
Здесь читатель найдет ответ на вопрос о том, что такое горение. В этой статье мы рассмотрим этот процесс, ознакомимся с характеристиками и классификацией, изучим исторические сведения и определим место в природе и жизни человека. Также уделим внимание конкретным параметрам для определенных видов горения.
Когда человек слышит слово «горение», скорее всего, в его воображении возникает образ пламени, который охватывает что-либо. Этот процесс имеет исторически, даже эволюционно, огромное значение для человека.
Горение – химические процесс, в ходе которого исходный ряд веществ преобразуется в продукт сгорания. Это экзотермический тип реакции, при которой интенсивно выделяется тепло. Энергетические ресурсы, запасенные в веществах, участвующих в процессе горения, могут выделяться, принимать вид излучения света.
Общие сведения
Ответив на вопрос о том, что такое горение, человек смог сделать его главным ресурсом, из которого мы до сих пор черпаем энергию. Около 90 % всех энергетических ресурсов, производимых на Земле людьми, выпадают на процессы сжигания ископаемых видов топлива. Однако в обозримом будущем (приблизительно до 2040 года) этот показатель снизится на 10 %. Это связано с истощением ресурсов Земли, которые не подлежат восстановлению, а также загрязнением мира, явлением глобального потепления.
Горение – химический процесс, обычно идущий по пути разветвленно-цепного механизма. Здесь прогрессирует самостоятельное ускорение благодаря теплу, которое выделяется в ходе реакций. Особенностями, которые выделяют горение, можно считать наличие больших показателей выделения тепла и потребность в относительно огромных ресурсах, необходимых для активации реакции. Эти два фактора напрямую влияют на скорость, при которой она будет проходить.
Исторические факты
Кислород был открыт в первых годах 1770-х. Совершили открытие К. Шееле и Дж. Пристли. До этого события существовала теория флогистона, которая утверждала, что тела, подвергающиеся процессу горения, обладают особым началом «флогистоном». Спустя пять лет — в 1775 г., Лавуазье доказал, что горючее вещество не обладает такими элементами, а только присоединяет к себе кислородные молекулы, черпаемые из воздуха.
Буркеном и Шуманном в 1928 году была рассмотрена задача о явлении диффузионного пламени. Они показали, что при наличии скорости сгорания веществ, участвующих в реакции, выше скорости подвода реагентов, поставляемых диффузией, зона горения становится тонкой до бесконечности. Это значит, что в такой области процессов происходит автоматическое установление стехиометрического соотношения между веществами, отвечающими за окисление, и горючими материалами. Максимальные температурные показатели приближаются к адиабатическим.
Теория горения в своем современном виде началась с трудов Н.Н. Семенова, который изучал явление теплового взрыва. Это произошло в 1920 году. Через восемнадцать лет, в 1938 году, Д.А. Франком-Каменецким была развита теория тепловых взрывов.
Уже в 1940 году была развита общая теория детонации – ZND. Ее основателем считается Я.Б. Зельдович. Название происходит от имен З. Неймана, Деринга и, собственно, Зельдовича. Это связано с тем, что независимо друг от друга исследователи пришли к схожим итогам и выводам на основе своих экспериментов и вычислений.
Классификационные данные
Сущность процесса горения позволяет классифицировать его в соответствии с определенными параметрами. Например, в зависимости от скорости сгорания веществ, его делят на детонацию и дефлаграцию. Последнее бывает ламинарным и турбулентным. Детонация – только турбулентная.
Если газ – это исходный и основной компонент смеси, которая горит, то реакцию можно назвать гомогенной. Этот процесс характеризуется взаимодействием окислителя и горючего вещества в газофазном горении. Разделение горючих веществ и их постепенное слияние, вызывающее рассматриваемый процесс, называют диффузией. Гетерогенной можно назвать реакцию, в которой окислители и горючее имеют разное положение фазы. Кроме перечисленного выше, выделяют: процесс тления, беспламенное, холоднопламенное и (термо)ядерное горение.
Отвечая на вопрос о том, что такое горение, человек смог выделить в нем явление пламени, которое представляет собой зону, излучающую свет и образующуюся в ходе реакций горения. Ее температурные показатели определяются составом смесей и условиями, при которых протекает процесс. Сгорание природных газов позволяет разгонять температуру до двух тысяч кельвинов и выше.
Пламя многих видов топлива, основанных на углеводородах, обладает способностью к взаимодействию с электромагнитными полями. Это обуславливается наличием собственных частиц в заряженном состоянии. Посредством проведения экспериментов было доказано, что количество ионов в пламени может превышать в шесть порядков концентрацию анионов и катионов в процессах чистой термической ионизации. Главный механизм, отвечающий за образование ионов, — хемоионизация. Это сложный физико-химический процесс, который превращает исходные в продукты сгорания. В ходе экзотермической реакции выделяется большое количество тепла.
Теория горения
Суть процесса горения, несмотря на большой практический опыт и применение, исследовалась в течение многих лет и остается одной из самых сложных загадок человечества. Наука, изучающая явление горения, является междисциплинарной и располагается на стыке газодинамики, химической термодинамики, химкинетики, молекулярной и химической физики, а также материаловедения и моделирования с использованием компьютерных технологий.
Рассмотрим следующие положения теории горения: полноту сгорания и его термодинамический механизм. Положение полноты сгорания включает в себя информацию о том, что исходные компоненты горючих смесей характеризуются молярной и массовой долей элемента, а также начальными показателями давления и температуры. Подобрав вещество, способное в ходе сгорания и окисления полностью превратиться в продукт рассматриваемого явления, можно получить стехиометрическую реакцию. Смесь, обладающая избытком горючего вещества, что не может полностью разложиться из-за нехватки окислителей, именуется богатой. Вещество с нехваткой топливного ресурса называют бедным.
Термодинамические данные позволяют нам утверждать, что горение, протекающее адиабатическим путем при наличии постоянного показателя объема, сохранит полную энергию внутренней системы. Если имеется постоянное давление, то наблюдается энтальпия структурных компонентов. Условия, при которых протекает адиабатическое давление, практически применяются и реализуются в пламени, что распространяется свободными путями. При этом расчетом теплопотери пренебрегают.
Гетерогенность
Гетерогенные процессы наблюдаются в случае, когда взаимодействуют несколько фаз (от двух). Это могут быть газы и жидкости. Такое же явление можно отслеживать в «территории» границы разделения между фазами. В терминологии это слово используют для описания процессов горения, в которых окислительное и горючее вещество пребывают в разных состояниях фазы. Сюда относится даже испарение топлива, происходящее в газовой форме. Ярким примером может послужить взаимодействие угля и кислорода, содержащегося в воздухе. В ходе этого образуется угарный газ, который может подвергаться дальнейшему сгоранию в состоянии газа и превращаться в CO2.
Твердое топливо
Что такое горение твердого топлива? Чаще всего это процесс окисления веществ, используемых в различных снарядах и патронах. Например, это может быть артиллерийский или реактивный снаряд. Другое применение находит себя в конструировании и эксплуатации межконтинентальных ракет баллистического типа. Многоразовые шаттлы выводятся на орбиту Земли посредством применения ускорителей, основанных на твердом топливе.
Те вещества, что используются в качестве топлива для ракет, делятся на две формы: смесевую и баллиститную. В первом случае разделение горючего вещества и окислителя не наблюдается, а сгорание происходит послойным способом. Их именуют гомогенным порохом. Главный компонент – это нитроцеллюлоза, которую добывают путем желатинизации в толще нитроглицерина.
Общие данные о сгорании твердого топлива
Процесс разложения пороха включает в себя несколько этапов, которые отличаются типом экзотермической реакции, а именно проходят в двух фазах газа и конденсации. Проведение опытов с горением баллиститных порохов в пространстве вакуума и при показателе давления ниже двух мм.рт.ст. показало, что экзотермические реакции происходят лишь в приповерхностном уровне фазы конденсации. При диапазоне давления от пяти до двадцати мм.рт.ст. можно увидеть пламя, но заметное только в темноте, а реакции протекают в газовом этапе.
Медленный тип горения
Процессам горения свойственно наличие тления, которое является его медленной формой. Поддержание такого явления осуществляется благодаря теплу, выделяемому в ходе взаимодействия O2 и горячего соединения в конденсированной форме, а реакции протекают на ее поверхности и подвергаются аккумулированию. Типичная ситуация, при которой наблюдается данное явление, — это тление сигареты. Здесь можно наблюдать медленное распространение вдоль материала. Нехватка высоты температуры обуславливает отсутствие газофазного пламени, а в ходе большой потери тепла сигарета начинает гаснуть. Чаще всего тление можно наблюдать в пористом или волокнистом ряде веществ.
Твердофазный тип горения
Существует явление, которое можно наблюдать в порошках неорганической и органической природы. Оно характеризуется автоволновой экзотермической реакцией, в ходе которой заметное выделение газа не наблюдается, но образуются продукты в конденсированной форме. Однако это конечный результат реакции, а в промежутках между фазами отслеживается создание газов или жидкостей.
Самостоятельно распространяющийся высокотемпературный синтез на практике основывается именно на безгазовом или твердопламенном горении. Ниже расскажем о том, как охарактеризовать слово «горение».
Сведения о слове
Разбор слова «горение» по составу показывает нам, что оно образуется с помощью:
- корня — гор;
- суффикса — ени;
- окончания — е.
Это три составных элемента, которые включены в общую структуру термина.
Чтобы ответить на вопрос о том, как пишется слово «горение», достаточно вслух сказать его. Произношение слова совпадает с правописанием. Гласными буквами, образующими эту языковую единицу, являются: «о», «и», «е». Ударение ставим на первую «е». Проверочное слово у «горения» отсутствует, однако можно определить правильность написания путем чередования гласных «а» и «о». Их варьирование подчиняется правилам правописания корней «гор» и «гар».
Подводя итоги
Анализируя полученную информацию, скажем, что слово «горение» означает химический процесс, взаимосвязанный с физическими явлениями. Он является главным источником энергии для всего населения планеты и основывается на сжигании различного вида топлив. Включает в себя множество разновидностей и имеет огромное значение для людей. Горение играло немаловажную роль в истории развития человечества, а детальное изучение его позволило стремительно расти технологическому процессу.
Изучением данного процесса занималось огромное множество ученых, а на достижение, систематизацию и обобщение всей информации ушло огромнейшее количество времени. Величайшие умы различных эпох и поколений совершили ценные вклады в общее развитие теории горения. Однокоренные с «горением» слова — это: горько, горы, горе, пригореть и прочее. Чаще всего гласная «о» пишется в корне тогда, когда на нее не падает ударение.
Физико-химические основы процесса горения
Читайте также:
- Aрхитектурныe основы построения нейросистем на базе нейрочипа
- I. Понятие и основы правового регулирования государственных и муниципальных доходов
- I. Теоретические основы организации логопедических занятий.
- I. Теоретические основы формирования артикуляционной моторики у детей.
- I. Этапы процесса принятия решения
- If используется для разветвления процесса обработки данных на два направления.
- II. Основы конституционного строя
- II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
- II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
- II. Основы определения страхового тарифа.
- III. Внутренняя структура политического процесса с позиций отношений субъект объект, или субъект – субъект, изучался поведенческим подходом.
- III. Этапы процесса принятия решения
ГОРЕНИЕ ОРГАНИЧЕСКОГО ТОПЛИВА
Горением называется быстрый процесс экзотермического окисления горючего вещества, сопровождающийся выделением значительного количества тепловой энергии. Основой процесса горения является химическая реакция между окисляемым горючим веществом и окислителем— веществом, содержащим кислород или активные его соединения, с образованием его окислов. Горючим веществом могут быть: органическое топливо, некоторые металлы, углеводородные соединения и др.; окислителем — кислород, воздух (смесь 79 % азота и 21% кислорода), перекись водорода Н2О2, некоторые кислоты, например НNOз, и др. Для того чтобы процесс горения произошел, необходимо наличие горючего и окислителя, контакт между ними на молекулярном уровне, тепловые условия, достаточные для протекания химической реакции свысокими скоростями. Таким образом, процесс горения— это многофакторный, сложный физико-химический процесс взаимодействия химических, тепловых и гидродинамических факторов.
Особенностями процесса горения, отличающими его от родственных процессов окисления, являются: 1) высокая температура; 2) быстротечность во времени; 3) как правило, неизотермичность и переменность концентраций компонентов по мере их взаимодействия; 4) изменение структуры и формы поверхности реагирования во времени. По своей природе горение — процесс, протекающий всегда при непрерывном подводе горючего и окислителя в зону горения и отводе газообразных продуктов сгорания из нее. В связи сэтим независимо от технологии сжигания топлива закономерности горения горючего всреде окислителя являются объективно неизменными, определяющимися только начальными и граничными условиями его протекания.
Воснове процесса горения лежат химические реакции горючего с окислителем. Применительно к углеводородным горючим, которыми являются все виды органического топлива, чистый углерод и водород, целесообразно выделить следующие химические реакции, протекающие с выделением или поглощением теплоты, в КДж/моль:
а) первичные экзотермические химические реакции полного горения:
Реакции (2.8) и (2.9) являются экзотермическими, а (2.10)—эндотермической. Принципиальной особенностью всех реакций горения является их обратимость; ни одна из этих реакций не идет до конца, а лишь до состояния химического равновесия, при котором имеют место все компоненты реакции. Состояние химического равновесия зависит от температуры, давления и соотношения концентраций реагирующих веществ.
Направление изменения равновесия реакций под действием внешних факторов определяется принципом Ле-Шателье, согласно которому: если на систему, находящуюся в химическом равновесии, воздействовать извне, то в ней возникнут самопроизвольные процессы, стремящиеся ослабить это воздействие. Применительно к реакциям горения такими возможными факторами, влияющими на химическое равновесие реакций, являются: тепловыделение, сопровождающееся повышением температуры; возможное изменение давления и изменение концентрации какого-либо компонента реакции. Так, повышение температуры сопровождается торможением реакций, протекающих с большим тепловыделением, например, из реакций, описываемых уравнениями (2.1) и (2.5) преимущественное развитие приобретает реакция по уравнению (2.5). При очень высоких температурах (свыше 1600— 1800 °С) углерод топлива первично реагирует с кислородом в большей степени с образованием СО, а не СО2, как это имеет место при низких температурах (1000—1300°С). Повышение давления тормозит реакции, протекающие с увеличением объема, например реакции (2.4), (2.7), (2.10), и др. Если из системы, как это имеет место в топочных процессах, продукт реакции выводится и концентрация его снижается, то химическое реагирование стремится компенсировать это понижение концентрации, способствуя тем самым более полному протеканию реакций горения.
Кинетические основы процесса горения. В общем виде обратимая химическая реакция может быть записана стехиометрическим уравнением
где А1, А2и B1, B2— химические символы реагирующих веществ; vai, Va2 и Vbi, Vb2 — стехиометрические коэффициенты.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действия масс: в однородной среде при постоянной температуре скорость реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции (2.11) скорость прямой реакции в соответствии с законом действия масс может быть записана
где Са\, Са2, Св1 Св2, … — текущие концентрации реагирующих веществ; k1и k2— константы скорости прямой и обратной реакции (коэффициенты пропорциональности, зависящие от температуры и химической природы реагирующих веществ).
При химическом равновесии скорости прямой и обратной реакций уравниваются:
где kc— константа равновесия, также являющаяся постоянной величиной, характеризующая только возможность глубины протекания химической реакции при заданных давлении р и температуре Т.
Акты химического превращения исходных веществ в конечные продукты в результате реакции происходят вследствие соударения молекул, т. е. при их сближении, когда достаточно активно проявляется влияние сил отталкивания. При этом нормальная составляющая кинетической энергии соударяющихся молекул переходит в потенциальную и может быть затрачена на разрушение первоначальных связей в молекуле. Это произойдет, если образовавшаяся потенциальная энергия будет выше некоторого уровня, необходимого для разрушения первоначальных связей в молекуле. Такой уровень называется энергией активации Е.
Для того чтобы реакция между молекулами А и В произошла, необходимо:
где т — приведенная масса соударяющихся молекул; mаи твмассы молекул А и В;V — нормальная составляющая относительной скорости молекул.
Но не всякие столкновения молекул, при которых энергия столкновения превышает энергию активации Е, приведут к химической реакции; необходимо, чтобы соударяющиеся молекулы были должным образом соориентированы между собой так, чтобы удар одной молекулы о другую был в наиболее слабом участке ее структуры. В итоге скорость реакции, выраженную числом актов химического превращения в единице объема за единицу времени (закон Аррениуса), можно записать
где ka— коэффициент, пропорциональный доле активных столкновений молекул, приводящих к химической реакции, который называется предэкспоненциальным множителем; R — универсальная газовая постоянная; пАи пв — концентрации молекул веществ А и В в объеме; ке Е / ( RT ) — константа скорости реакции, так как k, слабо зависит от температуры по сравнению с экспонентой, в расчетах полагают k=const.
Применительно к ранее рассматриваемой реакции (2.11) скорость в соответствии с законом действия масс и законом Аррениуса может быть записана в виде
Для сложных реакций характерным является ход реакции через промежуточные этапы, в которых часто активными участками становятся активные центры — отдельные атомы, радикалы, молекулы. При сложной реакции выражение для ее скорости можно записать аналогично уравнению (2.12), однако в этом случае величины kи Е определяют на основании обработки опытных данных, а показатели степени vai и va2 подбирают таким образом, чтобы удовлетворить результатам эксперимента. В этом случае сумма показателей степени при концентрациях называется порядком реакции и выражает зависимость скорости реакции от давления; константу скорости такой реакции, удовлетворяющей закону Аррениуса, называют кажущейся или видимой. Размерность константы скорости реакции k зависит от порядка реакции; для реакций первого порядка (vai+va2+. = 1,0) ее размерность есть обратная величина времени (1/с); для реакции второго порядка (vai + +va2+». = 2,0) она равна м 3 /(моль·с).
В элементарной обратимой реакции энергии активации прямой (E1) и обратной (Е2) реакций можно рассматривать как некоторый потенциальный барьер, который надо преодолеть для ее совершения и перехода на новый энергетический уровень. Если прямая реакция экзотермична, то выделяется теплота реакции QP; для обратной реакции нужно преодолеть больший энергетический барьер Е2, и теплота реакции будет потребляться. Реакции горения органических топлив относятся к сложным реакциям, протекающим через активные центры, со значениями энергии активации Е от 42— 84 до 167—209 кДж/моль. Большой разброс значений энергии активации определяется большим разнообразием структуры и активности молекул органических веществ, используемых в качестве топлива.
Важной отличительной особенностью реакций горения является цепной механизм их протекания, характеризующийся тем, что реакция протекает не непосредственно между молекулами исходных веществ, а через промежуточные стадии, что позволяет обойти большой энергетический барьер, который потребовалось бы преодолеть для осуществления прямой реакции между исходными компонентами. В цепных реакциях различают: зарождение цепей — образование активного продукта, разветвление цепей — увеличение концентрации активного продукта в результате реакций с исходным веществом, обрыв цепей — процесс, при котором молекула активного продукта уничтожается. Реакция, при которой концентрация активного промежуточного продукта остается постоянной и равной равновесному его значению, называется неразветвленной цепной реакцией. Если в процессе реакции происходит увеличение активного промежуточного продукта, то суммарная скорость реакции непрерывно возрастает и наступает ее нестационарное протекание. Такая реакция называется разветвленной цепной реакцией. Характерным примером разветвленной реакции является окисление водорода
Реакция СО+02->2С02 протекает через промежуточные реакции с активными центрами Н и ОН, образующимися при наличии в среде небольших количеств Н20 или Н2. Реакцией продолжения цепи с одновременным получением конечного продукта является СО+ОН->С02+Н. Горение газообразных углеводородов также протекает по цепному механизму; активными центрами в них служат атомарные водород и кислород,
Тепловой поток от объема реагирующей смеси в окружающую среду, отнесенный к единице объема, принят в виде линейной функции относительно температуры
гдеа — коэффициент теплоотдачи, Вт/(м 2 -К); F и V — поверхность и объем сосуда, в котором находится горючая смесь, соответственно, м 2 и м 3 ; Т и То — температуры реагирующей смеси и стенок сосуда, К.
Диффузия и массообмен в процессе горения. Процесс горения будет стационарным, если кроме химической реакции и тепловых условий, обеспечивающих достаточную скорость ее протекания, вернее параллельно с химической реакцией, будет обеспечен непрерывный подвод горючего и окислителя в зону реакции и соответственно отвод продуктов сгорания из нее. Для протекания реакции необходимо перемешивание компонентов на молекулярном уровне, иными словами, необходим процесс массопереноса реагирующих компонентов в зону реакции и продуктов реакции из нее. Процесс массопереноса осуществляется в турбулентном потоке за счет турбулентной диффузии, а в неподвижной среде, ламинарном потоке и в пограничном слое потока — за счет молекулярной диффузии. Молекулярная диффузия при постоянных температуре и давлении происходит за счет градиента концентрации компонента и описывается законом Фика (аналогично закону Фурье для теплопроводности):
где gi — массовый поток компонента /, кг/(см 2 -С); D12— коэффициент молекулярной диффузии компонентов 1 и 2, см 2 /с; dCdx — градиент концентрации Сикомпонента 1 в направлении х, кг/см 4 .
Коэффициент диффузии D12 является функцией температуры и давления:
Коэффициент п может меняться от 2,5 (для низких температур) до 1,5 (для высоких температур). Для реакций горения при температурах до 1200—1500 К принимают л=2,0, а при более высоких — «=1,5. Значения коэффициента взаимной диффузии Di2> см 2 /с, при нормальных условиях (р = 101,3 кПа; Т=273 К) получены экспериментально для компонентов: кислород — азот — 0,181—0,187; кислород — воздух—0,178; кислород — Двуокись углерода —0,139; двуокись углерода — воздух— 0.138; двуокись углерода — азот—0,15; водяной пар — воздух—0,22; окись углерода — азот—0,192.
При неизотермических условиях диффузионный поток вещества зависит не только от градиента концентрации, Но и от градиента температуры. Термодиффузия (т. е. диффузия вещества, вызванная градиентом температур) обычно мала и имеет значение в расчетах только при горении водорода и его смесей.
В зависимости от фазового состояния реагирующих веществ при горении (твердое, жидкое, газообразное) химические реакции делят на: гомогенные, протекающие в объеме между компонентами, находящимися в одной, как правило, газообразной фазе, и гетерогенные, протекающие на поверхности раздела фаз — твердой, жидкой и газообразной. В соответствии с этими названиями реакций горение топлив также условно делят на гомогенное и гетерогенное горение. Примерами гомогенного горения являются: горение хорошо перемешанных газообразных компонентов, горение быстро испаряющихся жидких топлив в случае, когда перемешивание образовавшихся паров топлива с окислителем предшествует процессу горения. Примерами гетерогенного горения на поверхности раздела фаз могут служить: горение твердых топлив, горение капель тяжелых жидких топлив в случае, если фронт горения устанавливается на границе раздела паров топлива и окислителя, и др. В зависимости от характера реакций анализ процесса горения проводят в соответствии с разработанными моделями теорий гомогенного и гетерогенного горения.
Любой процесс горения топлив по своей сути является поточным процессом, поскольку для его протекания необходимы непрерывный подвод компонентов в зону реакции и отвод из нее продуктов сгорания. Подвод компонентов в зону реакции производится за счет диффузии молекул горючего и окислителя. При горении топлива в потоке газообразного окисления независимо от характера реакций (гомогенной или гетерогенной) возможна организация протекания процесса в ламинарном и турбулентном потоке, что существенно сказывается на закономерностях развития процесса. В связи с этим процесс горения подразделяют на ламинарное горение (т. е. горение в ламинарном потоке окислителя) и турбулентное горение (горение в турбулентном потоке окислителя).
ГОРЕНИЕ ТВЕРДОГО ТОПЛИВА
Твердое топливо является термически нестойким органическим веществом, процесс горения которого протекает через ряд стадий. Основной стадией, определяющей интенсивность всего процесса в целом, является стадия горения так называемого коксового остатка — углерода, оставшегося в частице топлива после завершения деструкции вещества исходного топлива и выхода летучих веществ. В основе процесса горения частиц углерода лежат гетерогенные химические реакции взаимодействия углерода с окружающими горящую частицу газами: 02, Н20, С02 и др.
В основе процесса горения частицы углерода, движущейся в потоке воздуха, лежит модель, согласно которой угольные частицы малых размеров приобретают скорость, близкую к скоростям движения потока воздуха. При таком условии вынужденный конвективный перенос массы отсутствует и частица выгорает равномерно.
При этом возможны четыре режима взаимодействия углерода с кислородом воздуха в зависимости от температуры среды (рис.). Основными реакциями в модели считаются реакции углерода с кислородом, поступающим к поверхности частицы за счет диффузии из основного потока с образованием оксида и диоксида углерода. Продукты сгорания диффундируют от поверхности частицы в окружающее ее пространство. При невысоких температурах ( 100) с лобовой стороны частицы будут протекать только гетерогенные реакции (реакции 1 и 2, рис. б); догорание же оксида углерода будет наблюдаться в кормовой части потока на границе циркуляционной зоны (реакция 3, рис. 2.14,6), а вторичные реакции C+C02 будут иметь место главным образом в тыльной части углеродной частицы (схема 2, рис. б), где кислород отсутствует, но имеются хорошие тепловые условия для обеспечения эндотермических реакций.
Важной отличительной особенностью горения коксового (углеродного) остатка частицы твердого топлива является его высокая пористость, что обеспечивает диффузию внутрь углеродной частицы активных по отношению к углероду газов (С02, 02, Н20). В ходе реагирования внутренняя поверхность частицы увеличивается за счет испарения влаги, выхода летучих веществ, изменения температуры и других факторов.
Чем больше проницаемость материала, интенсивнее диффузия газов внутрь его и чем медленнее протекает реакция, тем глубже проникание кислорода и других газов внутрь частицы и тем большая масса участвует в реакции. Процесс внутренней диффузии можно рассматривать как самостоятельный, не зависящий от характера диффузионных процессов в зоне горения.
Особенно значительна роль внутреннего реагирования при горении композиционных топлив — топливных гранул, капель топливных суспензий и др. С повышением температуры горения значение внутреннего реагирования ослабевает. При сжигании высокозольных твердых топлив даже при высоких температурах значение внутреннего реагирования существенно возрастает, так как зольная оболочка, образующаяся при выгорании такой частицы, становится дополнительным сопротивлением для диффузии газов к поверхности реагирования. Однако влияние этой оболочки на процесс сказывается только при горении крупных частиц топлива; при пылевидном сжигании даже при зольности топлива 30—35 % это влияние несущественно.
При горении частицы натурального твердого топлива стадии горения коксового (углеродного) остатка предшествует ряд факторов, существенно влияющих на процесс в целом, а именно: подогрев и подсушка частицы топлива; деструкция вещества топлива с выделением летучих; горение летучих и др. Важной особенностью горения этих частиц является четко выраженная стадийность с резким изменением характера закономерностей развития каждой стадии во времени. Экспериментальные исследования динамики выгорания частицы твердого топлива , выполненные практически на всех марках угля в широком диапазоне температур среды (от 573 до 1273 К), позволили создать модель горения частицы натурального топлива —угля, включающую 10, а для высоковлажных углей и водоугольных суспензий — 11 стадий процесса.
При вводе частицы в высокотемпературную окислительную среду она вначале проходит стадию прогрева 1 при определяющем влиянии внешнего теплообмена и массопереноса на изменение массы и температуры частицы. При выгорании частицы высоковлажного топлива или капли водоугольной суспензии вслед за стадией прогрева наблюдается стадия поверхностного испарения влаги, протекающая при постоянной температуре частицы. Собственно процесс горения частицы начинается со стадии 2 — стадии дальнейшего прогрева частицы и начала низкотемпературных экзотермических реакций внутри объема частицы, что приводит к достаточно резкому увеличению ее температуры при непрерывной скорости изменения температуры и потери массы.
Стадия 3 характерна уменьшением скорости роста температур в связи с началом эндотермических реакций деструкции угольного вещества с выходом летучих продуктов этой деструкции. Стадия завершается воспламенением летучих вокруг частицы, что приводит к интенсификации процессов деструкции внутри частицы. Эти процессы продолжаются во время 4 стадии — стадии горения летучих; 5—стадия параллельного протекания процессов горения летучих вокруг объема частицы и начала поверхностного гетерогенного горения углерода, о чем свидетельствует резкое возрастание температуры поверхности частицы; 6 — стадия активного поверхностного горения с догоранием вокруг поверхности еще выделяющихся летучих. Во время этой стадии достигается максимальная температура поверхности частицы.
Во время 1—5 стадий происходит изменение структуры реагирующей частицы с резким увеличением ее пористости и активации открывающейся поверхности. На стадии 7 наблюдается активное горение коксового (углеродного) остатка частицы с догоранием еще выделяющихся летучих на ее поверхности. Эта стадия характеризуется резким падением температуры на поверхности частицы. 8 стадия — это горение коксового остатка, как правило, самая продолжительная стадия, протекающая при плавном снижении температуры поверхности и развитии реакций внутри объема частицы. Процесс горения заканчивается стадией догорания коксового остатка (стадия 9), в основе которой лежит внутреннее реагирование углерода частицы с диффундирующими внутрь ее газами, и стадией 10 — стадией охлаждения зольного остатка частицы до температуры среды. Важно, что практически все стадии протекают при разных режимах горения от чисто диффузионных (стадии 1,2,4,7,8,9) до кинетических (стадии 3, 6).
В целом же весь процесс выгорания частицы натурального твердого топлива суммарно можно рассматривать как протекающий в промежуточном режиме ближе к диффузионному, а для инженерных расчетов — в чисто диффузионном режиме. При термической деструкции угольного вещества (стадии 2, 3, 4, 5) происходит выделение продуктов деструкции в виде газа, кислоты, воды и смолы. Относительная доля выделяющихся газа и жидкости зависит от скорости нагрева частицы: чем выше скорость нагрева, тем выход этих веществ больше. По мере движения к поверхности частицы вода и кислоты испаряются, а смола и газообразные углеводороды подвергаются вторичному разложению. Водяной пар, проходя через раскаленную углеродную поверхность, на стадиях 4 и 5 может вступать в реакцию с углеродом и интенсифицировать процесс.
В конце 3 стадии процесса происходит воспламенение частицы топлива, которое практически во всех случаях начинается с воспламенения выделившихся из нее горючих летучих, имеющих более низкую температуру воспламенения, чем коксовый (углеродный) ее остаток. В связи с этим роль летучих в процессе воспламенения во многом является решающей. Выход летучих является следствием деструкции угольного вещества; чем выше интенсивность их выхода, тем больше глубина деструкции, прямым следствием которой является активация образующейся новой реакционной поверхности твердого остатка за счет повышения пористости частицы. Образование летучих в объеме частицы приводит к повышению ее внутреннего давления и к разработке поверхности твердого остатка, что способствует существенной интенсификации процесса горения в целом, особенно на заключительной его стадии.
В то же время выделяющиеся летучие обволакивают частицу и при определенных условиях [на стадии 4 и 5 (частично)] препятствуют диффузии кислорода к поверхности частицы и тем самым в известной степени несколько тормозят основные гетерогенные реакции горения. Однако, это наблюдается только у относительно крупной частицы размером 1,0 мм и более. Чем выше размер частицы, тем относительно меньшая доля летучих выделяется до момента их воспламенения и тем большая их часть выгорает параллельно с гетерогенным реагированием на поверхности частицы.
При сжигании частиц топлива в потоке большое значение в процессе воспламенения играет время индукции Тинд, т. е. время, затрачиваемое на самопроизвольное повышение температуры в процессе химического реагирования горючего с окислителем, приводящего к воспламенению. Величина Тинд определяется как промежуток времени, в течение которого температура частицы повышается от начальной до температуры воспламенения. Чем выше температура среды, в которую введена частица топлива, тем меньше время индукции. Для оценки процесса воспламенения твердых топлив иногда пользуются параметром условная температура воспламенения— минимальная температура среды, при которой происходит воспламенение частицы при длительном ее пребывании в ней (т. е. при Тинд стремится к бесконечности). Эта температура воспламенения зависит не только от вида топлива, но и от тепловых условий взаимодействия частицы со средой. Так, для одиночной мелкой частицы эта температура меняется от 1170—1270 К для антрацита до 800—850 К для бурого угля. Для частиц тех же топлив, находящихся в контакте с другими такими же частицами (например, в слое), эта температура снижается почти в 2 раза, что свидетельствует о более благоприятных условиях воспламенения топлива при слоевом его сжигании.
При инженерных расчетах времени горения частицы твердого топлива стадии горения условно объединяют в четыре укрупненные расчетные стадии:
1) от момента ввода частицы в зону горения до момента воспламенения летучих (стадии /, // и III); время этой стадии рассчитывают как время выхода летучих Твл;
2) от момента воспламенения летучих до конца их видимого горения (стадии 4, 5); время этой стадии рассчитывают как время видимого горения летучих Тгл;
3) от момента прекращения видимого горения летучих до начала активного горения коксового остатка (стадия 4); время стадии рассчитывают как время прогрева коксового остатка до его воспламенения Твл; 4) от момента начала активного горения коксового остатка до завершения процесса (стадии 7, 8,9); время стадии рассчитывают как время горения коксового остатка Тгк).
Эти условные времена расчетных стадий горения частицы рассчитывают на основании экспериментальных данных, полученных при изучении изменения цветовой температуры частицы в процессе горения, а также визуального наблюдения за процессом с применением киносъемки. Расчетные зависимости позволяют определить влияние начального размера частицы d, мм; температуры среды Тт, К; концентрации кислорода 02, %; плотности частицы рчт, кг/м 3 , на время протекания расчетных стадий процесса.
Время расчетной стадии горения летучих (2—3) определяется только величиной поверхности частицы топлива, поскольку горение летучих протекает вокруг частицы и не зависит ни от температуры среды, ни от других параметров. Время протекания расчетной стадии горения коксового остатка Тгк линейно зависит от концентрации кислорода, пропорционально поверхности частицы d 2 .
Горение жидкого топлива. Жидкое топливо в топочных устройствах, как правило, сжигается в распыленном состоянии, в виде капель в потоке воздуха. Горение жидких топлив всегда происходит в паровой фазе, поэтому процессу горения капли всегда предшествует процесс испарения. В общем случае в высокотемпературной среде капля жидкого топлива окружена некоторой зоной, насыщенной его парами, на внешней поверхности которой вокруг капли устанавливается сферическая зона горения. Скорость химической реакции смеси паров жидкого топлива с окислителем достаточно велика, так что толщина зоны горения по отношению к диаметру зоны горения незначительна. Толщина паровой зоны вокруг капли топлива зависит от температуры в зоне горения и от параметров испарения топлива: чем выше температура горения и чем ниже температура кипения топлива и теплота его испарения, тем выше толщина паровой зоны.
В стационарном процессе скорость горения жидкого топлива в случае, если все оно выгорает в зоне вокруг капли, зависит от скорости его испарения. В пространстве между зоной горения и каплей находятся пары топлива и некоторая часть продиффундировавших туда продуктов сгорания, а вне зоны горения — окислитель и продукты сгорания (рис. 2.16). В зону горения из объема капли диффундируют пары топлива, а с внешней стороны — окислитель (кислород воздуха). В результате реакции с выделением теплоты образуются продукты сгорания, которые в основном отводятся в окружающее каплю пространство. Теплота, необходимая для испарения топлива, передается поверхности капли из зоны горения в основном излучением и в результате частичной диффузии внутрь паровой оболочки продуктов сгорания. При таких предпосылках время горения капли жидкого топлива в диффузионном режиме может быть рассчитано на основании теплового баланса ее испарения.
Область распространения факела можно условно разделить на следующие зоны: распыления топлива, его испарения и образования газовоздушной смеси, воспламенения и горения этой смеси. Как по сечению топливно-воздушной струи, так и по ее длине в процессе горения непрерывно изменяются температура и концентрация топлива и окислителя. При этом возможно образование локальных зон, в которых концентрация топлива будет выше теоретически необходимой. Не допустить образования таких зон — значит обеспечить высокую полноту выгорания жидкого топлива. Для производства тепловой энергии из нефтяных топлив применяют лишь мазут и печное бытовое топливо.
Горение газообразного топлива в потоке воздуха отличается от горения жидкого и твердого топлива тем, что оба реагирующих компонента (горючее и окислитель) находятся в одной газообразной фазе, поэтому возможны организация горения этого топлива как при полном (до молекулярного уровня) предварительном перемешивании реагирующих компонентов, так и без такого перемешивания, а также организация горения газовоздушной смеси, содержащей недостаточное для полного сгорания количество воздуха. Горение однородной газовой смеси происходит стационарно в некоторой зоне потока, в которую непрерывно поступает горючая смесь и из которой также непрерывно отводятся продукты сгорания.
В топочный объем газовоздушная смесь, как правило, вводится через сопло относительно малого сечения, в результате чего образуется турбулентная газовая струя. При входе в топочный объем струя газовоздушной смеси расширяется по направлению движения за счет эжектирования в нее газов с высокой температурой из окружающего струю пространства и одновременно частично разбавляется продуктами сгорания за счет поперечных турбулентных пульсаций (рис. 2.17). В соответствии с теорией развития неизотермических струй в результате взаимодействия струи с окружающим ее нагретым пространством происходит ее нагрев в турбулентном пограничном слое. В ядре струи, где газы движутся с постоянной скоростью, равной скорости начального участка струи, температура остается постоянной и равной температуре газовоздушной смеси на выходе из сопла. В результате нагрева смеси в периферической зоне струи она воспламеняется, образуя зону горения, расширяющуюся по мере удаления от устья сопла. В ядре струи смесь не горит.
При организации горения газовоздушной смеси с недостаточным количеством воздуха только часть горючего сгорает, реагируя с кислородом, содержащимся в смеси. Несгоревшая часть горючего вместе с продуктами сгорания взаимодействует с кислородом окружающей среды, образуя вторую зону горения, положение которой подчиняется законам диффузионного горения.
Таким образом, пространство, занимаемое горящим факелом, делится на три области: 1) область между горелкой и первым фронтом пламени, где смесь еще не горит; 2) область между двумя зонами горения, где находится несгоревшее в первой зоне горения горючее; 3) область вне диффузионной зоны горения, где находится смесь продуктов сгорания с окислителем. Как и в случае чисто диффузионного горения, для полного протекания реакции здесь также решающее значение имеет смесеобразование.
| | | следующая лекция ==> | |
| ОПРЕДЕЛЕНИЕ ТЕОРЕТИЧЕСКОЙ ТЕМПЕРАТУРЫ ГОРЕНИЯ | | | СУХИЕ ПРОДУКТЫ НЕПОЛНОГО СГОРАНИЯ |
Дата добавления: 2014-01-11 ; Просмотров: 2956 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
- http://studopedia.ru/3_71404_opredelenie-protsessov-goreniya.html
- http://www.syl.ru/article/367086/chto-takoe-gorenie-znachenie-slova-sut-himicheskogo-protsessa
- http://studopedia.su/10_8368_fiziko-himicheskie-osnovi-protsessa-goreniya.html