Молекулярно-кинетическая теория газов рассматривает идеальный газ:
а) молекулы не притягиваются и не отталкиваются;
б) молекулы взаимодействуют только при упругих столкновениях;
в) молекулы представляют собой материальные точки, т.е. обладают массой, но не имеют объёма.
В качестве критерия идеальности газов принято считать соотношение α/L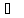
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в паскалях по имени французского учёного и математика
Блеза Паскаля (1623-1662). 1Па = 1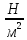
Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р) – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является термодинамическим параметром состояния.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
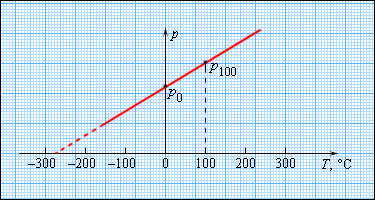
Термодинамическая температура Т всегда положительна. При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
Т = t + 273,15 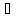
Ro= 8,314 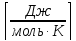
Удельный объем – отношение объема вещества к его массе 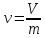
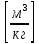
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
Уравнение состояния идеального газа Клапейрона – Менделеева:
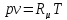
где р – давление, Па,

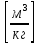
Rμ=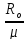
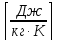
Например, для кислорода 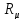
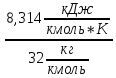

Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для любого процесса 1-2:, p1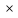
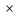
p2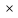

Разделив левую часть первого уравнения на левую часть второго уравнения, а правую часть первого уравнения на правую часть второго уравнения и сократив Rμ, получим:
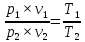
1.4. Смесь идеальных газов
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
Состав смеси задается долями объемными r, r1= 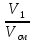

массовыми g g1= и мольными r1′ : r1′ =
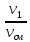
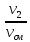
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
Молярная масса смеси: μсм= μ1r1+ μ2r2. μсм= 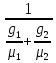
где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь между объемными и массовыми долями: g1= r1∙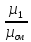
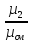
Что такое давление с точки зрения мкт
59. Давление газа с точки зрения молекулярно-кинетической теории
59. Давление газа с точки зрения молекулярно-кинетической теории
1. Молекулы взаимодействуют друг с другом посредством моле-кулярных сил. На далеких расстояниях — это силы притяжения, убывающие с увеличением расстояния, на близких — силы отталкивания, быстро возрастающие при сближении молекул. Расстояние между центрами сблизившихся молекул, на котором силы притяжения переходят в силы отталкивания, принимается за диаметр молекулы. В газах при нормальных условиях средние расстояния между молекулами еще велики по сравнению с их диаметрами. На таких расстояниях молекулярные силы очень слабы и не играют существенной роли. Молекулярные силы проявляются лишь на близких расстояниях порядка диаметров молекул. Под действием этих сил скорости сблизившихся молекул претерпевают значительные изменения как по величине, так и но направлению. Взаимодействия молекул на близких расстояниях называют столкновениями. Между двумя последовательными столкновениями молекула газа движется практически свободно, т. е. прямолинейно и равномерно. При каждом столкновении молекула газа почти мгновенно меняет направление своего движения, а затем движется с новой скоростью опять прямолинейно и равномерно, пока не произойдет следующее столкновение. Если газ в целом находится в покое (например, заключен в закрытом сосуде), то в результате столкновений устанавливается хаотическое движение, в котором все направления движения молекул равновероятны. Оно называется тепловым движением. Чем более разрежен газ, тем длиннее средний путь, проходимый молекулой между двумя последовательными столкно-вениями. Для достаточно разреженного газа, заключенного в сосуд, можно в первом приближении пренебречь размерами молекул и столкновениями их друг с другом. Надо учесть только столкновения молекул со стенками сосуда, в который газ заключен. В этом при-ближении молекулы газа могут рассматриваться как материальные точки, не взаимодействующие между собой и движущиеся прямолинейно и равномерно между каждыми двумя последовательными столк-новениями со стенками сосуда. Такая простейшая модель приводит к законам идеальных газов. Чтобы показать это, надо выяснить моле-кулярный смысл давления, температуры и внутренней энергии газа.
2. Давление газа на стенку сосуда есть результат ударов мапе-кул газа об эту стенку. При каждом ударе молекула газа действует на стенку с определенной (с макроскопической точки зрения бесконечно малой) силой. Обратно направленная сила, с которой действует на молекулу стенка сосуда, заставляет молекулу отражаться от стенки. Если бы в сосуде содержалось всего несколько молекул, го пх удары следовали бы друг за другом редко и беспорядочно, п нельзя было бы говорить ни о какой регулярной силе давления, действующей на стенку. Мы имели бы дело с отдельными практически мгновенными бесконечно малыми толчками, которым время от времени подвергалась бы стенка. Если же число молекул в сосуде очень велико, то будет велико и числе ударов их о стенку сосуда. Удары станут следовать непрерывно друг за другом. Одновременно о стенку сосуда будет ударяться громадное количество молекул. Бесконечно малые силы отдельных ударов складываются в конечную и почти постоянную силу, действующую на стенку. Эта сила, усредненная по времени, и есть давление газа, с которым имеет дело макроскопическая физика.
3. Вычислим давление газа на стенку сосуда. Пусть газ заключен в закрытый сосуд, и все молекулы одинаковы. Вообще говоря, они дви-жутся с различными скоростями, отличающимися друг от друга как по величине, так и по направлению. Разделим все молекулы на группы так, чтобы молекулы одной и той же группы в рассматриваемый момент времени имели приблизительно одинаковые по величине и направлению скорости. Скорость молекул i-й группы обозначим Vi, а число таких молекул в единице объема — /7,. Возьмем на стенке сосуда малую площадку о (рис. 43). Если молекулы движутся по направлению к площадке о, то они могут столкнуться с ней. Если же они движутся от площадки, то столкновений не будет. Предположим, что молекулы г-й группы движутся ио направлению к площадке а, и подсчитаем число г; молекул такой группы, ударяющихся об эту площадку за малое время dt. Построим на площадке а, как на основании, косой цилиндр с обра-зующими V >
Zi = atiiVix dt.
Дальнейший ход вычислений зависит от характера взаимодействия ударяющихся молекул со стенкой. Обычно при вычислениях считают, что стенка гладкая, а молекулы при ударе отражаются от нее зеркально, т. е. по законам удара идеально упругих шаров: абсолютная величина скорости при отражении не изменяется, угол падения равен углу отражения. Затем доказывается, что эти предположения не являются существенными. Однако в действительности стенка сосуда для ударяющейся молекулы не может быть идеальным зеркалом — ведь она сама состоит из молекул. Благодаря этому молекулы i-й группы после отражения будут иметь, вообще говоря, самые разнообразные по величине и направлению скорости, направленные от стенки, и распределятся по различным скоростным группам. Поэтому мы проведем дальнейшие вычисления, не вводя никаких специальных предположений относительно законов отражения молекул от стенки сосуда. Единственное предположение, которое будет и пользовано в вычислениях, состоит в том, что при отражении от стенки молекула в среднем не теряет и не приобретает кинетическую энергию. В дальнейшем будет показано, что это предположение означает, что температура газа должна быть равна температуре стенки. Для целей вычисления процесс взаимодействия молекулы со стенкой удобно мысленно разбить на два этапа. На первом этапе молекула замедляется и останавливается, как бы прилипая к стенке. Иа втором этапе молекула отталкивается стенкой, ускоряется и отскакивает от нее. Вычислим сначала силу F, которая действовала бы на площадку о со стороны газа, если бы весь процесс взаимодействия молекул газа со стенкой ограничивался только первым этапом, т. е. в предположении, что после ударов молекулы газа как бы прилипают к стенке. Молекулы i-ii группы, ударившиеся о площадку о за время dt, до удара обладали количеством движения г,р; == — atiiVixP > 0), т.е.
К силе F] следует прибавить силу F, которая действует на площадку о на втором этапе. Сила F, вполне аналогична силе отдачи, испытываемой орудием при выстреле. Роль снаряда играют молекулы, летящие от площадки о, т. е. молекулы, для которых vix а с неи и Давление газа Р.
Однако столкновения вносят качественные изменения в физическую интерпретацию давления Р. Пока не было столкновений, молекулы газа совершенно не взаимодействовали друг с другом. Величина Р имела только один смысл: она давала давление газа иа стенку сосуда. При наличии столкновений появляется силовое взаимодействие между макроскопическими частями газа. Роль стенки для любой макроскопической части газа может играть граничащая с ней другая макроскопическая часть того же газа. В этих условиях величина Р имеет также смысл внутреннего давления, посредством которого осуществляется силовое взаимодействие между примыкающими друг к другу макроскопическими частями газа. Именно такой смысл имеет давление Р в гидродинамике и аэродинамике.
5. Формулы (59.4) и (59.5) применимы как к нерелятпвистским,
так и к релятивистским движениям молекул. В случае нереляти-
вистских движений масса молекулы т может считаться постоянной.
§ eoj СКОРОСТИ ТЕПЛОВОГО ДВИЖЕНИЯ ГАЗОВЫХ МОЛЕКУЛ 193
Полагая в формулах (59.4) и (59.5) р = mv, получим для этого случая
При выводе этих формул молекулы рассматривались как бес-структурные материальные точки. Не принималось во внимание вращение молекул, а также внутримолекулярное движение. При столкновениях могут меняться скорости вращения молекул. Молекула может перейти в возбужденное состояние, или из возбужденного состояния вернуться в нормальное. Но все эти процессы не играют роли, когда речь идет о вычислении давления газа. Существенно только изменение поступательного количества движения молекулы при столкновениях ее со стенкой. Оно равно массе молекулы, умноженной на изменение скорости ее центра масс. Поэтому формулы (59.6) и (59.7) остаются в силе. Надо только понимать под v скорость поступательного движения молекулы (точнее, ее центра масс). Таким образом, формуле (59.7) можно придать вид
где (/inner) — среднее значение суммы кинетических энергий по-ступательного движения всех молекул газа. При столкновениях энергии вращательного и внутримолекулярного движений могут переходить в энергию поступательного движения и наоборот. Однако в установившемся состоянии среднее значение величины ЕтсТ остается неизменным.
Формула (59.8), как ясно из ее вывода, справедлива не только для однородного газа, но и для смеси различных газов. В этом случае под ЕПОСТ по-прежнему следует понимать сумму кинетических энергий поступательного движения молекул всех газов, содержащихся в сосуде. Из вывода ясно также, что для нашей модели газа, состоящей из невзаимодействующих молекул, справедлив закон Дальтона: давление смеси газов равно сумме парциальных давлений этих газов.
| Автор: Диков Александр | Дата: 2010-05-17 01:08:18 | Просмотров: 7636 |
Репетиторы, математика, русский язык, физика, сдать ЕГЭ, ЕГЭ 2012, тестирование ЕГЭ, ответы по ЕГЭ, репетитор, карта сайта,
Все права защищены и принадлежат авторам размещающих материалы на сайте. Данный сайт ни какой ответственности за размещенный материал не несет. Копирование материалов возможна только с указанием URL ссылки на исходный материал.
Давление газа с точки зрения молекулярно-кинетической теории. Молекулярно-кинетический смысл абсолютной температуры
Давление газа с точки зрения молекулярно-кинетической теории.
Давление газа на стенку сосуда есть результат ударов мапе-кул газа об эту стенку. При каждом ударе молекула газа действует на стенку с определенной (с макроскопической точки зрения бесконечно малой) силой. Обратно направленная сила, с которой действует на молекулу стенка сосуда, заставляет молекулу отражаться от стенки. Если бы в сосуде содержалось всего несколько молекул, го пх удары следовали бы друг за другом редко и беспорядочно, п нельзя было бы говорить ни о какой регулярной силе давления, действующей на стенку. Мы имели бы дело с отдельными практически мгновенными бесконечно малыми толчками, которым время от времени подвергалась бы стенка. Если же число молекул в сосуде очень велико, то будет велико и числе ударов их о стенку сосуда. Удары станут следовать непрерывно друг за другом. Одновременно о стенку сосуда будет ударяться громадное количество молекул. Бесконечно малые силы отдельных ударов складываются в конечную и почти постоянную силу, действующую на стенку. Эта сила, усредненная по времени, и есть давление газа, с которым имеет дело макроскопическая физика.
При своем движении молекулы газа ударяются о стенки сосуда, в котором находится газ, создавая тем самым давление газа на стенки. Если газ находится в равновесии, то все направляющие движения молекул равновероятны.
Пусть в единице объема содержится n0 молекул. При абсолютно упругом ударе молекулы об стенку ее импульс изменяетмся на 2m0v. Ясно, что за время t до стенки долетят и упруго отразятся от нее все молекулы, находящиеся внутри параллелепипеда с основанием S и высотой vt.
Таких молекул будет: n = (1/6) n0 S v t ; следовательно общее изменение импульса молекул, долетевших за время t до стенки и упруго-отразившихся от нее будет: 2m0 v n = (1/3) n0 m0 v (ст.2) S t ; Это изменение импульса равно импульсу силы, действующей со стороны стенки на молекулы, а следовательно, согласно третьему закону Нбютона со стороны молекул на стенки: (1/3) n0 m0 v (ст.2) S t = F t ; F = (1/3) m0 v (ст.2) n0 S ; P = (1/3) n0 m0 v (ст.2) — основное уравнение.
Термодинамическая температура с молекулярно-кинетической точки зрения — физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Связь между кинетической энергией, массой и скоростью выражаестя следующей формулой:
Таким образом частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
kB = 1.380 6505(24) × 10−23 Дж/K — постоянная Больцмана
T — термодинамическая температура, К
Абсолютная температура – есть величина, пропорциональная средней энергии поступательного движения молекул.
Молекулярно-кинетический смысл давления
Читайте также:
- Административный процесс можно рассматривать в широком управленческом смысле и в узком юрисдикционном смысле.
- Альбер Камю(1913 — 1960) сделал главной проблемой своей экзистенциональной философии проблему смысла жизни.
- В общем смысле под этикой управления понимается свод моральных принципов и ценностей, направляющих поведение индивида или группы индивидов.
- Вероятностный смысл математического ожидания
- Владение в экономическом и юридическом смысле
- Вопрос 3. Процесс группового давления.
- Геометрический смысл векторного произведения
- Геометрический смысл комплексного числа
- Геометрический смысл определенного интеграла
- Геометрический смысл производной
- Геометрический смысл смешанного произведения
- Лицензия на осуществление видов деятельности отличается от лицензии на право пользования участком недр, так как регулируются разными законами и имеют различный правовой смысл.
Опыт Штерна
Молекулярно-кинетическая теория
В основе молекулярно-кинетической теории лежат три положения:
1) Вещество состоит из микроскопических частиц (молекул), разделенных промежутками
2) Эти частицы (молекулы) находятся в непрерывном хаотическом движении
3) Частицы взаимодействуют друг с другом с силами, которые на больших расстояниях являются силами притяжения, а на маленьких, силами отталкивания
Впервые предположение о дискретном строении вещества на уровне догадок высказал Демокрит. Основы молекулярно-кинетической теории были заложении русским ученым Ломоносовым. Дальнейшее развитие МКТ получила в трудах Клаузиуса, Максвелла, Больцмана и Джоуля. МКТ подтверждают теплопроводность, броуновское движение, процесс диффузии.
Молекула – наименьшая устойчивапя обособленная частица вещества, обладающая его основными химическими свойствами. Размеры молекул колеблются от 10 –10 до 10 –7 м.
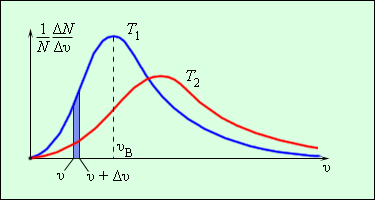
МКТ находит свое подтверждение в броуновском движении, диффузии. Определение скорости теплового движения впервые было осуществлено в опыте Штерна.
Установка немецкого физика О. Штерна состояла из двух коаксиальных цилиндров. По общей оси протянута платиновая проволока, покрытая слоем серебра. При пропускании тока по проволоке, атомы серебра испаряются. Испаряющиеся атомы разлетаются во все стороны. Во внутреннем цилиндре имеется щель, пролетая сквозь которую, атомы серебра оседают на внутренней поверхности внешнего цилиндра. При вращении установки. Атомы осаждаются не напротив щели, а смещаются на некоторое расстояние. Измеряя смещение можно вычислить скорость атомов серебра. При вращении серебряная полоска оказывается размытой, что говорит о том, что атомы имеют разную скорость.
С точки зрения молекулярно кинетической теории, давление газа – это есть результат ударов молекул газа о стенку.
Выделим площадку и рассмотрим процесс столкновений молекул с этой стенкой. Будем считать, что молекулы движутся с разными скоростями, в разных направлениях, но молекулы газа одинаковы.
Разделим процесс столкновения на два этапа:
1. Молекулы подлетают к стенке и, в процессе взаимодействия с молекулами стенки их скорость становится равной нулю.
2. Импульс молекулы увеличивается под действием силы отталкивания от нуля до конечного значения скорости, с которой молекулы отлетают от стенки.
Разделим все газа на группы, так что молекулы каждой имеют почти одну и ту же по величине и направлению скорость и рассмотрим молекулы какой-то i-той группы.
В процессе 1 за время dt к стенке подлетают молекул данной группы, при этом их импульс меняется на величину , где – число молекул данной группы в единицу объема газа.
В процессе 2 молекулы отлетают от стенки хаотично. Рассмотрим j группу молекул, двигающихся от стенки. За время dt их импульс изменился за счет действия сил отталкивания от стенки на величину
Средняя сила, действующая на молекулы газа, направлена перпендикулярно стенке вдоль оси Ox, поэтому , где в последней сумме учитываются молекулы, движущиеся как к стенке, так и от нее. Давление . В силу того, что все направления движения молекул равновероятны, , где , . Тогда . Эта формула справедлива как в релятивистском случае, так в нерелятивистском. В нерелятивистском случае можно формулу расписать как , где – средняя кинетическая энергия поступательного движения одной молекулы.
Замечание 1: При выводе этой формулы не учитывались столкновения между молекулами. Поскольку при столкновении происходит процесс перехода одной группы в другую, то при вычислении давления это будет не существенно, а существенен учет поступательного движения молекул.
Замечание 2: Если молекулы не тождественны и взаимодействуют друг с другом, то можно найти давление каждой группы молекул, а общее давление будет равно сумме давлений каждой группы …. Отсюда следут закон Дальтона.
Пример: Давление фотонного газа.
Если скорость частиц газа сравнима со скоростью света, то такой газ называется релятивистким в земных условиях.
Возьмем какую-то полость и будем поддерживать стенки этой полостипри какой-то постоянной температуре. Стенки будут испускать инфракрасное излучение, состоящее из фотонов. Такой газ, состоящий из хаотически движущихся во всех направлениях фотонов, называется фотонным газом. Давление фотонного газа можно посчитать, учитывая, что импульс фотона равен , тогда , где – объемная плотность потока энергии.
| | | следующая лекция ==> | |
| Термодинамические неравенства | | | Теорема о равномерном распределении кинетической энергии по степеням свободы |
Дата добавления: 2014-01-04 ; Просмотров: 1836 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Что такое давление с точки зрения мкт
Простейшей моделью, рассматриваемой молекулярно-кинетической теорией, является модель идеального газа . В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура).
В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
Используя модель идеального газа, вычислим давление газа на стенку сосуда . В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция скорости, параллельная стенке, остается неизменной (рис. 3.2.1).
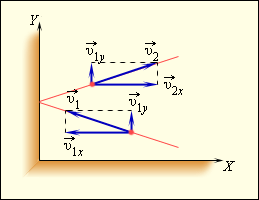 | |||||||||||||||||||||||||||
| Рисунок 3.2.1. Поэтому изменение импульса молекулы будет равно , где – масса молекулы. Выделим на стенке некоторую площадку (рис. 3.2.2). За время с этой площадкой столкнутся все молекулы, имеющие проекцию скорости , направленную в сторону стенки, и находящиеся в цилиндре с основанием площади и высотой .
|
- http://repetitor.biniko.com/blog-id114.htm
- http://mydocx.ru/1-14696.html
- http://studopedia.su/2_33038_molekulyarno-kineticheskiy-smisl-davleniya.html
- http://physics.ru/courses/op25part1/content/chapter3/section/paragraph2/theory.html
- http://studfiles.net/preview/436427/page:3/
- http://phscs.ru/physics9/ideal-gas

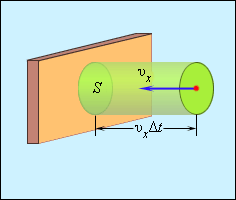
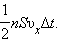 Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину , то полное изменение импульса всех молекул, столкнувшихся за время с площадкой , равно
Поскольку каждая молекула при столкновении со стенкой изменяет свой импульс на величину , то полное изменение импульса всех молекул, столкнувшихся за время с площадкой , равно 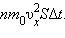 По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы , где – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке . Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку . Поэтому можно записать:
По законам механики это изменение импульса всех столкнувшихся со стенкой молекул происходит под действием импульса силы , где – некоторая средняя сила, действующая на молекулы со стороны стенки на площадке . Но по 3-му закону Ньютона такая же по модулю сила действует со стороны молекул на площадку . Поэтому можно записать: 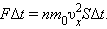
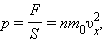
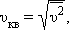 где
где 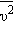 – среднее значение квадрата скорости.
– среднее значение квадрата скорости.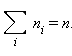 Каждая группа молекул вносит свой вклад
Каждая группа молекул вносит свой вклад 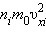 в давление газа. В результате соударений со стенкой молекул с различными значениями проекций скоростей возникает суммарное давление
в давление газа. В результате соударений со стенкой молекул с различными значениями проекций скоростей возникает суммарное давление 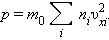
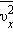 квадрата проекции
квадрата проекции 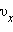 скорости молекул:
скорости молекул: 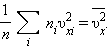
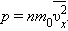
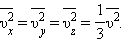
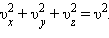
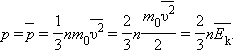
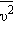 и средней кинетической энергией
и средней кинетической энергией 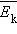 поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.
поступательного движения молекул. Его называют основным уравнением молекулярно-кинетической теории газов.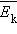 поступательного движения. Если предположить, что газ находится в сосуде неизменного объема , то
поступательного движения. Если предположить, что газ находится в сосуде неизменного объема , то 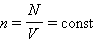 ( – число молекул в сосуде). В этом случае изменение давления пропорционально изменению
( – число молекул в сосуде). В этом случае изменение давления пропорционально изменению 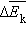 средней кинетической энергии.
средней кинетической энергии.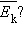 Опыт показывает, что такой величиной является температура .
Опыт показывает, что такой величиной является температура .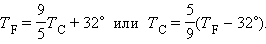

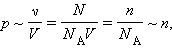
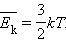
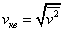 (5)
(5)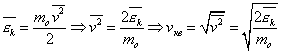
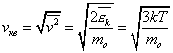
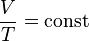 .
. .
.
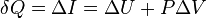 .
.