Начало детальному изучению болезни положил психиатр Алоис Альцгеймер. Наблюдая за своей подопечной с деменцией, он описывал патологию и пытался найти причину этому явлению. Сегодня мы всё ещё продолжаем поиски. Выдвинуто несколько гипотез, одна из которых – наследственность. Прижизненные и посмертные исследования больных показали взаимосвязь между мутацией генов и риском заболевания.
Учёные заподозрили связь между БА и синдромом Дауна. Люди с синдромом заболевают Альцгеймером намного чаще и раньше остальных. Вообще, БА – это проблема старшей возрастной группы, чаще всего она встречается у людей 40-65 лет. Но при синдроме Дауна недуг поражает в возрасте до 30 лет. Исследователи заподозрили, что причина может крыться в «поломке» 21 хромосомы. И нашли тому подтверждение. Но кроме 21 хромосомы обнаружилось, что болезнь возникает при мутации ещё и 1, 14 и 19 хромосом.
Мутация генов способна передаваться по наследству. Догадки были подкреплены наблюдениями за статистикой. Примерно у 10% больных в семейном анамнезе есть предок, болеющий БА. Сегодня считается, что в семье, где болеет один родитель, риск заболеть у ребёнка – 50%. Если болеют оба, это практически 100% вероятность появления деменции у наследника.
Но «поломка» генов означает только предрасположенность к слабоумию. Значит должны быть и другие факторы, которые увеличивают этот риск. К тому же наследственная деменция составляет только 10% от числа всех больных. Выяснить, что происходит с остальными 90% – главная задача психиатрии, неврологии и медицины в целом.
Психологические причины
Немецкая группа учёных установила связь между болезнью Альцгеймера и психотравмами. В ходе исследований оказалось, что у пациентов с посттравматическим стрессовым расстройством (ПТСР) и больных БА снижен уровень FMN2. Это белок, который помогает клеткам поддерживать свою структуру и функции. В результате психотравмирующих ситуаций количество FMN2 снижается, что вызывает расстройство когнитивных способностей.
Группа специалистов из Гёттингена провела лабораторные исследования по этой теории. У мышей со сниженным FMN2 с возрастом действительно усиливались симптомы ПТСР и болезни Альцгеймера. Такие наблюдения позволили выяснить ещё один фактор, который повышает риск деменции. Также тесты некоторых препаратов показали свою эффективность в улучшении памяти у старых животных. Но теория психологических травм – это только один из факторов, но никак не первопричина заболевания.

Одна из авторов на тему психосоматической теории – Лиз Бурбо – выдвинула своё предположение о причине заболевания. Лиз – философ и психолог. Она считает, что слабоумие – это попытка манипулировать окружающими и освободить себя от какой-либо ответственности. Гипотеза может показаться правдивой, если посмотреть на больных. Они часто раздражительны, плаксивы, не в состоянии сделать что-то сами. Но это, скорее, результат нарушений в мозге, а не их причина.
Бурбо написала книгу по психосоматике Альцгеймера. В ней утверждается, что БА появляется у тех, кто в молодости был очень активен, пытался всё запомнить. Такая интеллектуальная активность в совокупности с неоправданными надеждами и вызывает деменцию. Так считает Лиз и её последователи. Если изучить остальные гипотезы, теория Бурбо выглядит как догадки дилетанта.
Исследования доказывают, что активный мозг дольше остаётся здоровым, а люди не интеллектуального труда больше подвержены риску БА.
Но также доказано, что сильные психологические потрясения, депрессии и частые неврозы приводят к потере связей между нейронами. Из-за этого снижается логическое мышление и ощущение реальности.
Изучение причин, вызывающих деменции, начинается с молекулярного уровня. Это даёт надежду установить «точку отсчёта», первопричину недуга. Пока что учёные пришли к выводу, что БА – многофакторное заболевание. В одном случае оно может быть вызвано по одной причине, в другом – по другой. Из главных гипотез болезни Альцгеймера выделяют амилоидную, тау-гипотезу и холинергическую.
Холинергическая

Обнаружив такую закономерность, учёные создали ряд препаратов, которые поддерживают нужный уровень ацетилхолина. Симптомы у больных при такой терапии становятся менее выраженными, но болезнь это не останавливает. Значит, есть и другие причины заболевания.
Амилоидная
Эта гипотеза считается основной среди других предположений. Ещё Алоис Альцгеймер при вскрытии своей подопечной с БА обнаружил отложения белка в головном мозге. Изучение такого явления показало, что есть два вида протеина, который откладывается в тканях мозга: амилоид и тау-белок. Амилоид – комплекс белков и полисахаридов, он участвует в метаболизме на клеточном уровне. В норме это вещество делится на более мелкие части и расходуется организмом.
При нарушенном обмене веществ появляются слишком длинные фрагменты амилоида, которые не растворяются и откладываются в гиппокампе и других участках мозга.
Такие скопления называются бляшками. Из-за образования протеиновых бляшек в тканях мозга также накапливается кальций. Это нарушает связь между нейронами, и клетки, неспособные взаимодействовать, отмирают. Попытки исправить эту ситуацию пока не дают результата. Даже диагностировать накопление бляшек невозможно без вскрытия.
Тау-гипотеза
Другой тип белка, который откладывается в мозге – «тау». В здоровом организме он выполняет важную роль мембраны для живых клеток. Тау-белок тоже нерастворим, иначе он бы не смог выполнять свою барьерную функцию. У больных этот компонент собирается в «клубки», мешая клеткам обмениваться импульсом. Результат тот же – гибель нейронов и потеря синапсов. Что именно приводит к нарушению в белковом обмене остаётся неизвестным.
Факторы риска
Пытаясь обнаружить первопричину в этиологии болезни, учёным удалось составить список факторов, которые увеличивают риск БА. Условно их делят на корригируемые, некорригируемые и условно-корригируемые.
Некорригируемые

- Преклонный возраст. Молодые люди, дети и подростки не болеют приобретённым слабоумием. Чаще БА наступает после 65 лет, раньше этого возраста редко. А до 40 лет – практически никогда. С возрастом снижается гибкость психики и мозга в целом. Поэтому у людей с предрасположенностью и в возрасте 60 и более лет очень высок риск заболевания.
- Женский пол. Мужчины сталкиваются с этим видом деменции в 2-3 раза реже женщин. Связывают это с тем, что женщины живут дольше и чаще попадают в поле зрения врачей. Мужчины более склонны скрывать недуг.
- Черепно-мозговые травмы. Любые травмы головы могут сказаться слабоумием в преклонном возрасте. Но если у человек были такие случаи, это ещё не значит, что он обязательно столкнётся с потерей памяти.
- Глубокое психологическое потрясение. Как мы уже выяснили, травмы психики тоже могут менять структуру мозга. Давность психотравмы не имеет значения.
Сюда же входит низкая интеллектуальная активность на протяжении всей жизни. Значение имеет и наличие образования, и работа интеллекта в юные годы. Чтобы продлить «молодость» мозга, важно тренировать его: учить стихи, изучать новые технологии, кроссворды, хобби. Чтение не входит в способ профилактики.
Условно-корригируемые
В этой группе – те аспекты, которые можно исправить. В основном здесь заболевания, вызывающие кислородное голодание клеток. К ним относятся:
- повышенный уровень жиров в крови;
- болезни дыхательной системы;
- сахарный диабет;
- сердечно-сосудистые заболевания;
- повышенное давление.
Эти патологии создают «благоприятные» условия для слабоумия. Их лечение предотвратит факторы риска.
Корригируемые
Есть факторы, которые мы можем контролировать самостоятельно. Часто мы обращаем на них внимание только, когда болезнь уже подаёт первые признаки.
Чтобы продлить ясность ума рекомендуется интеллектуальная и физическая активность. Заниматься духовной составляющей и телом нужно с молодости, но к 40 годам это особенно необходимо. Тренировки ума и мышц насыщают кислородом, улучшают кровообращение, создают новые нейронные связи.
К факторам риска относится и ожирение. Оно вредит всем органам и системам человека. При лишнем весе хуже работает сердце, забиваются кровеносные сосуды, сложнее работает дыхательная система. Накопление жиров в крови напрямую грозит блокировкой нейронов. Также выявлена взаимосвязь с повышенным содержанием сахара в крови и БА. Те, кто меньше ест сладкого, дольше сохраняют работу мозга.
Вредные привычки, такие как курение, повышают «шансы» на старческую деменцию. Особенно быстро слабоумие возникает у зависимых от алкоголя и тяжёлых наркотиков. Вещества, помутняющие разум, делают это благодаря закупорке капилляров и сосудов. Результат – кислородное голодание и постепенная потеря нейронных связей. Продлить физическую и интеллектуальную молодость можно за счёт интересной и активной жизни.
Важно постоянно подпитывать свой интерес и жажду к знаниям, изучать языки и ноу-хау. Технологии особенно хорошо стимулируют передачу сигналов между нервными клетками. Полезно изучать работу телефонов, приложений, программ. Добавьте сюда качественное питание и занятия спортом – и риск деменции снизится даже у тех, кто предрасположен к ней.
Причины, симптомы и лечение болезни Альцгеймера
Помните, как в романе Дэниела Киза «Цветы для Элджернона» главный герой после обретения разума снова начинает его терять. Читатель наблюдает угасание интеллекта Чарли Гордона, снижение его умственного уровня. Забываются накопленные знания, стираются из памяти события прошлого, выполнение бытовых процедур становится сложным процессом, наступает апатия.
С подобными симптомами сталкиваются люди, страдающие болезнью Альцгеймера. Почему возникает и как проявляется эта болезнь? Можно ли ее предотвратить? Давайте в этом разберемся.
Болезнь Альцгеймера: таинственный враг
Это заболевание является наиболее распространенной формой потери памяти, или деменции. Обычно болезнь Альцгеймера диагностируют у людей старше 65-ти лет, однако она может появиться и в более раннем возрасте. Наиболее часто заболевание начинается с расстройства кратковременной памяти, то есть человек легко забывает полученную недавно информацию, и в то же время легко воспроизводит факты и данные, относящиеся к далекому прошлому. Затем и долговременная память тоже расстраивается, появляется ряд других симптомов.
Есть основания соотнести появление болезни в раннем возрасте с мутацией генов. Также генетики полагают, что в группу риска попадают те, чьи близкие родственники страдают болезнью Альцгеймера.
В ходе болезни в организме происходит ряд патологических процессов. Например, сосредоточение в мозговых тканях неправильно свернутых белков — бета-амилоида и тау-белка. Из малых пептидов образуются бляшки. Также появляются сенильные бляшки. Кроме того, происходит «потеря» нейронов и синаптических связей. Это приводит к атрофии определенных участков коры головного мозга. Проще говоря, происходит разрушение нервных клеток в большом количестве, появляется недостаток веществ, необходимых для передачи нервных импульсов. Болезнь развивается постепенно.
Болезнь Альцгеймера описывали еще античные врачи. Но окончательно сформулировать ее причины, течение и симптоматику смог немецкий психиатр Алоис Альцгеймер лишь в 1901 году. Через шесть лет он опубликовал подробное исследование течения этой болезни у одной из своих пациенток. С тех пор в медицинском мире это заболевание называют его именем.
К сожалению, в последнее время наблюдается все более широкое распространение и «помолодение» болезни Альцгеймера, которую диагностируют у лиц в возрасте 45–65 лет. Помимо тех, чьи родственники страдают этой болезнью, в группу риска попадают люди, жизнь которых не была связана с интеллектуальным трудом и интеллектуальной активностью, лица, страдающие сахарным диабетом и избыточной массой тела, имеющие хроническую гипоксию, атеросклероз магистральных артерий головы и некоторые другие заболевания.
Как начинается болезнь Альцгеймера: первые проявления
Первые симптомы возникают за несколько лет до постановки окончательного диагноза. Эта стадия заболевания называется предеменция . Что же указывает на начало болезни? Прежде всего — это расстройство краткосрочной памяти и затруднения с усвоением новой информации. Также тревожным сигналом может стать невозможность сосредоточиться, распланировать свою деятельность, появление проблем с абстрактным и логическим мышлением, забывание значений некоторых слов. Уже на стадии предеменции может возникнуть апатия, которая в дальнейшем сопровождает заболевание. Этот период специалисты нередко называют мягким когнитивным снижением.
Как протекает болезнь: симптоматика заболевания на разных стадиях
На смену предеменции приходит следующая стадия болезни Альцгеймера — ранняя деменция . Снижение памяти прогрессирует, начинает появляться агнозия — нарушение разных видов восприятия (тактильного, зрительного, слухового). Однако при этом сохраняется чувствительность сознания. Часто отмечается нарушение речи, восприятия, исполнительных и двигательных функций. Что касается событий далекого прошлого, очевидных давно воспринятых фактах, хорошо заученных двигательных повседневных функций, то все это в меньшей степени подвергается забвению по сравнению с новой информацией. Словарный запас на ранней стадии деменции сокращается, снижается скорость речи, может нарушиться координация движений, затрудняя выполнение повседневных бытовых действий.
Затем наступает умеренная деменция , при которой перечисленные выше симптомы усугубляются, все больше нарушается координация движений, утрачиваются навыки чтения и письма. Пациент может выполнять элементарные бытовые функции (одеваться, выполнять гигиенические процедуры и т.д.), но со временем ему и в этом потребуется помощь. Начинает нарушаться долговременная память, появляются поведенческие отклонения, которые обычно обостряются вечером: плаксивость, раздражительность, агрессия, может даже появиться тяга к бродяжничеству. Родственники и близкие при этом могут испытывать стресс, поэтому помещение пациентов, страдающих болезнью Альцгеймера, в специальные учреждения часто является решением проблемы.
Последней стадией болезни является тяжелая деменция . В этот период пациент уже полностью зависит от посторонней помощи, его речь состоит из отрывочных фраз, словарный запас сводится к минимуму. Больного обычно не покидает апатия, его мышечная масса истощается, и все необходимые действия он уже не может выполнять без посторонней помощи, вплоть до приема пищи. Неподвижность в большинстве случаев вызывает пневмонию и пролежневые язвы, что и становится причиной смерти.
Причины синдрома Альцгеймера
Указать однозначно причину заболевания невозможно. На сегодняшний день существует три гипотезы возникновения болезни Альцгеймера, причем каждая из них имеет право на существование и по-своему убедительна.
- Холинергическая гипотеза утверждает, что заболевание вызывает снижение синтеза нейромедиатора ацетилхолина, то есть биологически активного вещества, ответственного за нервно-мышечную передачу. Эта теория появилась первой, но сегодня ученые ставят ее под сомнение, так как использование медикаментов, восстанавливающих баланс ацетилхолина, не дает высоких результатов. Однако данная гипотеза послужила созданию ряда методов поддерживающей терапии при болезни Альцгеймера.
- Амилоидная гипотеза базируется на том, что основной причиной заболевания являются отложения бета-амилоидных пептидов — бимолекулярных конструкций белкового типа. В здоровом состоянии они защищают нервные клетки мозга. Срок их жизнедеятельности невелик, и после выполнения своих функций амилоиды уничтожаются белками-чистильщиками — протеазами, превращающими их в безопасные шлаки, от которых организм затем избавляется. Но если этот механизм нарушается, то защитники нервных клеток превращаются в их убийц. Более того, бета-амилоидные пептиды объединяются друг с другом и становятся недоступны для своих уничтожителей-протеаз. Сегодня эта теория активно разрабатывается учеными в мельчайших деталях и уже принесла ряд значительных результатов.
- Тау-гипотеза рассматривает последовательный ряд нарушений, который происходит в связи с отклонениями в структуре тау-белка — белка, ассоциированного с микротрубочками. Предполагается, что нити этого белка объединяются и внутри нервных клеток образуют клубки, что провоцирует дезинтеграцию микротрубочек и коллапс транспортной системы внутри нейрона. Это ведет к нарушению биохимической передачи между клетками, а затем — к их гибели.
Наследственность, как показали исследования, увеличивает вероятность обретения болезни Альцгеймера, но не является основной причиной болезни.
При первых признаках болезни Альцгеймера следует немедленно обратиться к врачу и кардинально пересмотреть свой образ жизни. Отсутствие двигательной активности, интеллектуальной деятельности, общения, недостаток витаминов, пагубные привычки (алкоголь, курение) могут усугубить болезнь и дать толчок к ее стремительному развитию.
Диагностика патологии
Осмотр больного врачом-неврологом, беседа с пациентом и с проживающими с ним родственниками очень важны при диагностике болезни Альцгеймера. Конкретизируют клиническую картину нейропсихологические скрининг-тесты. В ходе их выполнения пациент запоминает слова, читает, выполняет арифметические действия, копирует изображения.
Также при выявлении болезни используют аппаратуру SPECT- и PET-визуализации. Часто назначается анализ спинномозговой жидкости: он показывает содержание амилоидов и тау-белков.
Излечима ли болезнь Альцгеймера?
Учеными из Института биологии РАН совместно с исследователями из МГУ и Лондонского королевского колледжа установлено, что процесс превращения пептидов-защитников в пептидов-убийц может запускаться ионами цинка [1] . Есть основания полагать, что это позволит разработать препараты, блокирующие инициализируемую ионами цинка агрегацию бета-амилоидных пептидов.
Кроме того, существует ряд способов облегчить болезнь Альцгеймера, приостановить ее развитие, смягчить симптомы. Эффективность лечения зависит от своевременной диагностики — чем раньше будет обнаружена болезнь, тем результативнее действуют все принимаемые меры.
Поддерживающая терапия
На данном этапе развития медицины разработан ряд продуктивных поддерживающих терапевтических процедур для пациентов, страдающих болезнью Альцгеймера. При четком соблюдении всех указаний врача можно смягчить течение болезни и сохранить самостоятельность выполнения повседневных навыков и ясность памяти на долгие годы. В борьбе с болезнью Альцгеймера существует два основных направления.
- Медикаментозная терапия позволяет воздействовать на звенья патологического процесса. Поэтому при болезни Альцгеймера назначают препараты, блокирующие холинэстеразу и препятствующие образованию амилоида и бляшек. Это донепезил [2] , ривастигмин [3] и галантамин [4] . Причем ревастигмин назначают и в форме пластыря, который нужно наклеивать на кожу. Перечисленные выше препараты позволяют улучшить память и речь, помогают концентрировать аниманин и ускорить реакции.
Для улучшения мозгового кровообращения и защиты нейронов назначают церебролизин [5] и актовегин [6] . Для снятия возбуждения и борьбы с бессонницей применяют тиоридазин [7] . Для снятия психоэмоционального напряжения больным прописывают глицин [8] .
Однако следует помнить, что лекарства может назначить только врач с учетом симптоматики каждого пациента. - Психосоциальная терапия дополняет медикаментозное лечение. Она позволяет пациентам на ранних стадиях болезни Альцгеймера адаптироваться к заболеванию. Работа с воспоминаниями, общение, выполнение интеллектуальных задач стимулируют работу мозга и положительно влияют на психоэмоциональное состояние пациента. Подобная работа возможна как индивидуально с каждым пациентом, так и в группах.
Таким образом, универсального лекарства от болезни Альцгеймера не существует. Однако улучшить состояние больного и облегчить течение болезни возможно. Для этого важно как можно скорее поставить диагноз и грамотно подобрать курс лечения.
Белок болезни Альцгеймера путешествует из тела в мозг
Болезнь Альцгеймера — самая распространенная возрастная нейропатология, ведущая к нарушению работы мозга. По данным ВОЗ, во всем мире около 6−7 млн человек ежегодно пополняют ряды страдающих от этой болезни. Она была открыта в 1907 году, но до сих пор нет точного понимания причин ее развития и эффективных средств борьбы с ней.
Как сегодня считается, болезнь Альцгеймера формируется на фоне агрегации (скопления) в головном мозге белка бета-амилоида, который вызывает гибель нейронов и нарушение мозговых функций. Недавние исследования показали, что эта патология может иметь и инфекционную природу. Было обнаружено, что бета-амилоиды могут попадать в организм людей во время медицинских процедур (операций и инъекций).
Новое исследование ученых помогает глубже понять возможные механизмы развития болезни Альцгеймера. Для своего эксперимента ученые взяли лабораторных мышей двух видов. Одни мыши были генетически модифицированы так, чтобы их организм синтезировал повышенные уровни характерного для человека вида бета-амилоида. Другие мыши были обычными здоровыми животными. Ученые при помощи хирургической операции соединили вместе генетически мутантную мышь со здоровой, объединив их кровоток в одну единую систему кровообращения.
После 12 месяцев такого совместного пребывания мозговые ткани «здоровых» мышей проанализировали. Анализ показал, что бета-амилоид из организма мутантных мышей благополучно проник с кровотоком в мозг обычных, вызвав образование характерных для болезни Альцгеймера скоплений этого белка. Кроме этого, «заразившиеся» бета-амилоидом грызуны демонстрировали и другие признаки патологии: воспаление, нарушения функции обучения и памяти и гибель нейронов. Причем развитие этих процессов начинало фиксироваться уже после четырех месяцев с начала объединения кровотоков.
Ранее ученым уже было известно, что бета-амилоид и его белок-предшественник синтезируются не только в мозге, но и других органах. Это исследование, по словам ученых, впервые показывает, что потенциально патогенный белок может из тела с кровью переноситься в мозг и участвовать в формировании нейропатологии.
«Гематоэнцефалический барьер, защищающий мозг от попадания в него вредных веществ из кровотока, ослабевает, когда мы стареем. Это может позволить большему количеству бета-амилоида проникнуть в мозг, дополняя то, что вырабатывается самим мозгом, и ускорить развитие болезни», — пишут авторы работы.
Исследование опубликовано в журнале Molecular Psychiatry.
Ранее ученые выяснили, что мутации другого ключевого белка болезни Альцгеймера — TREM2 — могут быть и полезными, и вредными.
Тау-белок и болезнь Альцгеймера
Экология потребления. Здоровье: Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Хотя болезнь Альцгеймера активно исследуют на протяжении многих лет, механизмы ее возникновения остаются неясными.
Обычно появление основных симптомов болезни связывали с отложениями в головном мозге белка бета-амилоида – так называемыми амилоидными бляшками.
Авторы нового исследования полагают, что ключевую роль играют другие образования, которые обнаруживаются в мозге больных – нейрофибриллярные клубки, состоящие из тау-белка. Хотя пока среди ученых нет единства по поводу сравнительного вклада бета-амилоида и тау-белка в развитие болезни, полученные результаты, возможно, помогут разработке новых препаратов для ее лечения.
Скопления амилоидных бляшек при болезни Альцгеймера были открыты уже довольно давно. Они обнаруживались как при посмертном исследовании мозговой ткани, так и у живых больных – при помощи позитронно-эмиссионной томографии. Для этого в организм вводят радиоактивный изотоп, который образует соединение с интересующим веществом (в данном случае – с бета-амилоидом). Когда скопления целевого вещества оказываются “помечены”, их распределение в организме отслеживают по гамма-квантам, возникающим при позитронном распаде.
Но тут же возникала загадка: медикам было известно немало случаев, когда у пациентов, мозг которых был полон амилоидных бляшек, не было никаких признаков болезни Альцгеймера. Число таких людей в некоторых исследованиях достигало 30 %. Данный факт заставил ученых подозревать, что другая аномальная белковая структура – нейрофибриллярные клубки из тау-белка может быть фактором, важным для развития болезни.
Обычно тау-белок в организме участвует в образовании микротрубочек – важного элемента цитоплазматической структуры клеток. Но у пациентов с болезнью Альцгеймера, а также после черепно-мозговых травм обнаруживаются скопления тау-белка, к молекулам которого присоединено большое количество фосфатных групп. Из-за них белок переходит в нерастворимую форму, и его клубок остается прикрепленным к нейронам головного мозга.
Влияние нейрофибриллярных клубков на здоровье до конца не изучено. До недавнего времени единственным методом исследования, доступным в данном случае, было измерение уровня тау-белка в ткани головного мозга после смерти больного или же у живого пациента в спинномозговой жидкости. Позитронно-эмиссионная томография не могла помочь, так как не располагала радиоизотопами, которые подходили бы для того, чтобы пометить тау-белок в организме.
Теперь эта проблема решена и соответствующие препараты найдены.
Поэтому невролог Бо Ансес (Beau M. Ances) и его коллеги из Университета Вашингтона в Сент-Луисе смогли впервые провести исследование распределения нейрофибриллярных клубков в головном мозге у живых пациентов. Одновременно они использовали и радиопрепарат для отображения бета-амилоида. Таким образом, ученые получили картину одновременного распределения в мозге двух связанных с болезнью Альцгеймера белков.
В исследовании участвовали десять пациентов с легкой степенью болезни Альцгеймера и 36 здоровых. Как показали ученые, чем больше у человека отложений тау-белка в височной доле мозга, тем сильнее у него проявляются нарушения памяти и внимания, характерные для болезни Альцгеймера.
Аналогичного соотношения для бета-амилоида не обнаружилось. Исследователи пришли к выводу, что позитронно-эмиссионную томографию, направленную на обнаружение амилоида, можно использовать для выявления самых ранних стадий болезни Альцгеймера. Тогда как тот же метод, но с использованием веществ, нацеленных на тау-белок, будет эффективен при выявлении перехода от ранних, несимптоматических стадий к легкой степени болезни Альцгеймера.
Бо Ансес подозревает, что решающим в развитии болезни становится совместное влияние на нервную ткань скоплений амилоида и тау-белка. Пока в мозге накапливаются только амилоидные бляшки, он еще в состоянии частично компенсировать их воздействие, но появление нейрофибриллярных клубков становится ключевым фактором, и симптомы болезни начинают нарастать.
Одновременно ученые проверили содержание тау-белка в спинномозговой жидкости участников исследования и обнаружили корреляцию его уровня с количеством тау-белка в височной доли головного мозга. Следовательно, анализ спинномозговой жидкости может служить методом диагностики.
Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета
Если предположение исследователей верно, то амилоидный белок Aβ приобретает очень драматичный ореол: будучи предназначен для защиты нервных клеток от инфекции, при определённых условиях он сам становится хуже любой заразы.
Болезнь Альцгеймера — основную форму старческого слабоумия — связывают с небольшим белком Aβ (β-амилоидом), нерастворимые отложения которого в нервной ткани оказывают разрушительный эффект на высшую нервную деятельность. β-Амилоид образуется вследствие ферментативного расщепления гликопротеина APP, в норме всегда присутствующего в мембранах нейронов и других клеток. Нормальная физиологическая роль ни этого белка, ни его метаболита Aβ до недавнего времени была неизвестна. Исследователи из Массачусетского госпиталя нашли возможную функцию белка Aβ в норме. Обнаружено, что синтетические аналоги Aβ и препараты височной доли мозговой ткани альцгеймеровских больных обладают мощной антимикробной активностью, а животные с нарушенным синтезом Aβ страдают сниженным иммунитетом. Всё это позволяет предположить, что белок Aβ — часть системы врождённого иммунитета в нервной системе человека.
Рисунок 1. Августа Д., пациентка Алоиса Альцгеймера (в честь которого БА получила своё название), 1901 г.
Болезнь Альцгеймера (БА) считается бичом развитых стран, поскольку с увеличением продолжительности жизни вероятность развития этого вида старческой деменции возрастает многократно. Хотя механизм развития заболевания в общих чертах установлен, эффективного лечения, способного противостоять деградации нервной ткани и вследствие этого деградации самой личности больного, пока не существует. Амилоидная гипотеза, объясняющая причины возникновения БА, говорит, что первым этапом развития заболевания является повышенная продукция амилоидного белка Aβ (или β-амилоида), в определённых условиях (прежде всего, в высокой концентрации) претерпевающего конформационную перестройку: в его структуре начинают преобладать β-тяжи (кстати, отсюда и пошло название). «Перерождённый» Aβ, подобно прионам, образует нитевидные амилоидные агрегаты — нерастворимые жёсткие фибриллы больших размеров, обладающие токсическим действием и в прямом смысле разрушающие мозг. Кроме того, амилоидная форма Aβ конвертирует «нормальный» растворимый белок в токсичную конформацию.
Кстати, амилоидная форма Aβ становится токсичной ещё до полимеризации в фибриллы: токсический эффект появляется на стадии сферических агрегатов, построенных уже из «вредных» белковых молекул с повышенным содержанием β-структур [1]. Между прочим, недавно обнаружена прямая связь концентрации белкá Aβ в спинномозговой жидкости с циркадным ритмом и недосыпанием, которое может быть одним из факторов развития болезни Альцгеймера [2].
β-Амилоид образуется в результате протеолитического расщепления предшественника — мембранного гликопротеида APP (также обозначают ПБА — предшественник β-амилоида). В процессе участвуют два фермента — β- и γ-секретазы, — которые «выщепляют» β-амилоид (белок длиной 40 или 42 аминокислотных остатка) из состава предшественника и секретируют его во внеклеточную область. До недавнего времени нормальная физиологическая роль β-амилоида была неизвестна, и его можно было воспринимать как горький молекулярный курьёз, часто приводящий собственный организм к такому тяжёлому последствию, как болезнь Альцгеймера.
Американские исследователи из Массачусетского госпиталя, похоже, наконец-то установили нормальную функцию Aβ: скорее всего, он имеет отношение к врождённому иммунитету [3]. «Многие годы считалось, что β-амилоид — не более чем молекулярный мусор, весьма не безвредный, впрочем. Наши результаты говорят, что этот белок — нормальный компонент системы врождённого иммунитета мозга, — говорит Рудольф Танзи (Rudolph Tanzi), один из авторов работы. — В частности, факторы, „включающие“ врождённый иммунитет — не только инфекция, но и травма или инсульт, — способствуют развитию болезни Альцгеймера и отложению Aβ в мозгу» [4].
Рисунок 2. Интеллектуальная активность, в том числе увлечение игрой в шахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана
Этому открытию предшествовало наблюдение, что Aβ во многом напоминает антимикробные пептиды (АМП) [5], являющиеся основой врождённого иммунитета большинства многоклеточных организмов, — в частности, пептид LL-37 человека, относящийся к группе кателицидинов. Кроме них, у человека есть ещё две группы АМП, участвующих в формировании врождённого антибактериального иммунитета, — дефензины и гистатины. От антител (лежащих в основе приобретённого, или специфического, иммунитета) их отличает то, что они могут действовать в нервной ткани и в мозгу, куда антитела «не добираются», и защищают человека от, например, менингита и нейрокандидоза. Ещё одна мишень действия этих пептидов — это вирусы и даже раковые клетки.
Схожесть некоторых физико-химических и биологических свойств β-амилоида и пептида LL-37 подтолкнула учёных изучить антимикробную активность Aβ, которой никто ранее не занимался. Результаты превзошли ожидания: синтетические аналоги Aβ40 и Aβ42 ингибировали развитие восьми из 15 исследованных микроорганизмов с активностью, равной или даже превышающей активность LL-37. Среди микроорганизмов, ингибируемых амилоидом, — грибок Candida albicans, кишечная палочка E. coli, три разновидности стафилококка, внутриклеточная паразитическая бактерия листерия и другие.
Чтобы удостовериться в том, что токсичность для бактерий не является следствием реактивов белковой химии, которые могли остаться после очистки белкóв, в следующем эксперименте изучили способность препарата ткани височной доли мозга (а именно там сильнее всего депонируется амилоид) ингибировать рост грибка Candida; в качестве контроля использовали препараты ткани не болевших пациентов того же возраста, а также образцы из других участков мозга, в которых не наблюдается существенных отложений Aβ. (Поскольку исследование проводилось в крупной больнице, недостатка в материале для исследования — мозговой ткани умерших пациентов — не было.) Эксперимент полностью подтвердил гипотезу, и, более того, антитела к β-амилоиду возвращали грибок «к жизни», подтверждая, что это именно белок Aβ ингибировал рост микроорганизмов.
Кроме того, оказалось, что трансгенные мыши с инактивированным геном одной из секретаз, генерирующих белок Aβ, сильнее подвержены влиянию различных патогенов; то же самое можно сказать и про людей, в ходе клинических испытаний получавших препарат, снижающий уровень Aβ42. Кстати, уменьшение концентрации хорошо изученного АМП LL-37 тоже увеличивает заболеваемость, но и чрезмерно высокая его доза не хороша, потому что приводит к отложению бляшек, подобных атеросклеротическим. Склонность к образованию фибрилл, подобных амилоидным, есть и у других АМП: хорошо известный антимикробный белок лактоферрин образует нерастворимые агрегаты при желатинозной дистрофии роговицы.
Изучение действия β-амилоада на бактерии показало, что он связывается с мембранами микроорганизмов, несмотря на то, что, по сравнению с подавляющим большинством АМП, имеет отрицательный, а не положительный заряд, — то есть, одного знака с мембранами бактерий. Возможно, эта на первый взгляд невыгодная организация необходима для преодоления специальных защитных систем бактерий, нейтрализующих катионные (положительно заряженные) пептиды. Ещё одним тяжело объяснимым качеством Aβ является его токсичность по отношению к собственным клеткам, что и приводит в ряде случаев к серьёзным расстройствам. Одно из возможных объяснений этому — что β-амилоид является также «оружием» против раковых клеток своего организма, но, даже если это и так, никаких подробностей процесса пока не известно, так же как и не известно толком, что вызывает повышение его продукции при БА.
Рисунок 3. Чарлтон Хестон и Рональд Рейган на встрече в Белом Доме, 1981 год. Оба к концу жизни заболели болезнью Альцгеймера.
«Необходимо выяснить, что же запускает врождённый иммунитет, к которому принадлежит альцгеймеровский пептид, в пожилом возрасте, и какие гены управляют этими процессами, — говорит Роберт Муар (Robert Moir), другой руководитель исследования. — Если удастся это установить, мы сможем разработать варианты предотвращения этой ненужной активации или даже научиться управлять ей» [4].
Небольшая модификация обычного белка влияет на развитие болезни Альцгеймера
В основе болезни Альцгеймера могут лежать изменения лишь в одной аминокислоте небольшого белка Aβ42. К такому выводу пришли ученые из МГУ имени М.В. Ломоносова, Института молекулярной биологии имени В. А. Энгельгардта и Института биофизики клетки, о своих результатах они сообщили на страницах журнала Scientific Reports.
Болезнь Альцгеймера – комплексное нейродегенеративное заболевание, причины которого в большинстве случаев остаются непонятными. Многочисленные исследования показывают, что при болезни Альцгеймера в клетках мозга происходит целый ряд серьезных системных нарушений. В ходе развития заболевания в нейронах появляются токсичные формы небольшого белка бета-амилоида, образующие скопления – амилоидные бляшки. Также в клетках больного формируются нейрофибриллярные клубки, содержащие тау-белок с повышенным уровнем фосфорилирования (присоединения остатков фосфорной кислоты). В результате нарушается нервная проводимость, а нейроны погибают. Этим объясняются симптомы заболевания, главный из которых – расстройство кратковременной памяти.
Биологи изучили белок из семейства бета-амилоидов – Aβ42 (буквы – сокращение от «амилоид бета», а 42 – количество аминокислотных остатков – «звеньев» в его цепи). Этот небольшой белок присутствует в нервной ткани здоровых людей, где он участвует в нервной проводимости и регулирует обмен холестерина. Aβ42 может подвергаться ряду химических модификаций, которые могут изменять его свойства. Внимание российских ученых привлекла форма isoAβ42 с изомеризированным остатком аспарагиновой кислоты в положении 7 (изомерами называют химические вещества с тем же количеством атомов разных элементов, но имеющих иную пространственную конфигурацию). Ранее эта же группа ученых показала, что isoAβ42 может выступать в качестве «затравки» для Aβ42, что приводит к образованию амилоидных бляшек.
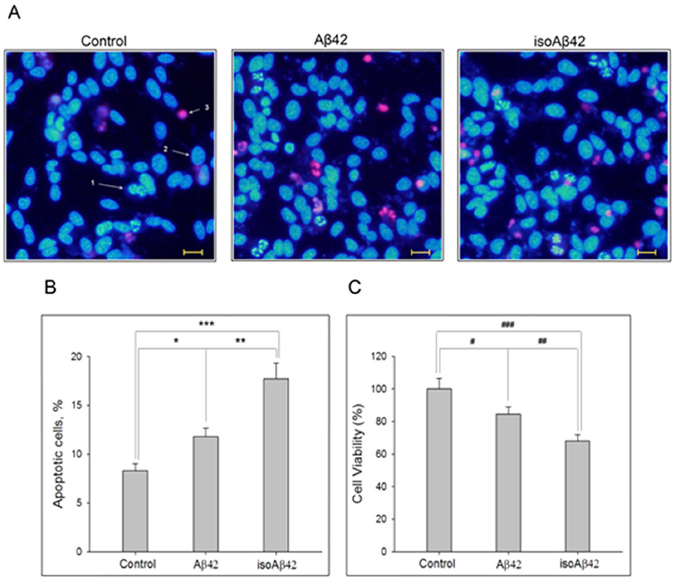
Ученые из Института молекулярной биологии им. Энгельгардта РАН решили проверить, каким образом эта модификация бета-амилоида влияет на метаболические процессы в клетках. Для этого использовался химически синтезированный isoAβ42. Интактный (то есть нетронутый) белок Aβ42 (без изомеризованного остатка аспарагиновой кислоты) и isoAβ42 добавили к культуре клеток нейробластомы человека SH-SY5Y. Эту клеточную линию ученые получили из опухоли четырехлетней девочки, но уже несколько десятков лет выращивается в лаборатории для изучения нейродегенеративных заболеваний. Третья группа клеток была контрольной, и белков к ней не добавляли.
Через сутки после введения белков часть клеток стала гибнуть путем апоптоза (аналог клеточного «самоубийства»). При этом под действием isoAβ42 клеток погибало в два раза больше, чем под действием Aβ42. Изучив изменения в клеточной культуре, биологи установили, что isoAβ42 также снижает уровень тау-белка в клетках. Кроме того, оказалось, что isoAβ42 резко повышает фосфорилирование тау-белка, тубулинов и матрина-3. Именно чрезмерное фосфорилирование этих белков – характерный признак нервной ткани, пораженной болезнью Альцгеймера. Тау-белок помогает поддерживать стабильность микротрубочек. Микротрубочки играют роль «скелета» клетки, определяя ее механическую устойчивость и форму, а также участвуют в транспорте частиц внутри клетки. Тау-белок с повышенным уровнем фосфорилирования больше не может связываться с микротрубочками, что вызывает нарушения в функционировании клетки.
Таким образом, российские ученые впервые показали, что токсический эффект isoAβ на клеточных культурах нейробластомы человека связан с его способностью вызывать фосфорилирование тау-белка и некоторых других белков в гораздо большей степени, чем обычный Aβ42. Повреждение нейронов белком isoAβ42 похоже на то, которое наблюдается в нейронах пациентов с болезнью Альцгеймера, что свидетельствует о критической роли isoAβ42 в развитии этой патологии.
Белок в рационе — профилактика болезни Альцгеймера
Добавляя в свой рацион содержащие белок продукты, вы можете снизить риск развития болезни Альцгеймера. Такие выводы сделали австралийские ученые из университета Эдит Коуэн, проследив, как влияет потребление протеина на образование амилоидных бляшек в головном мозге человека, что, как известно, считается предвестником развития дегенеративного заболевания. Каким же образом им удалось выяснить эту зависимость?
Прежде чем прийти к какому-либо заключению, исследователи с зеленого континента привлекли 541 добровольца в пожилом возрасте, не жаловавшихся на очевидные проблемы с ухудшением памяти. С помощью специальных биомаркеров у испытуемых был измерен уровень белка амилоида в головном мозге. Затем участников эксперимента разделили на три группы, в первой из которых добровольцы потребляли наибольшее количество белка в день – 118 грамм в день, со средним уровнем потребления и самым низким – 54 грамма в день. По истечении определенного времени повторное обследование участников продемонстрировало 12-кратный риск высокого содержания бета амилоида у участников со скудным белковым рационом по сравнению с теми, кто съедал в два раза больше белков ежедневно. Следует отметить, что само по себе наличие амилоида в организме человека – это естественно, а проблема начинает зарождаться тогда, когда его количество превышает допустимую норму. И тогда в головном мозге будущей жертвы болезни Альцгеймера образуются так называемые амилоидные бляшки, нарушая нормальное функционирование головного мозга.
На сегодняшний день авторы исследования не могут сказать причину такой зависимости, однако вполне вероятно, что происходит это из-за снижения артериального давления благодаря поступающему с пищей белком, как показывают предыдущие исследования. Тем не менее, требуется дополнительное изучение взаимосвязи между включением в рацион белковой пищи и снижением риска развития болезни Альцгеймера. Наряду с этим австралийские ученые планируют рассмотреть и другие факторы в этой взаимозависимости – гендерный и генетический.
Между тем, не лишне будет упомянуть другие исследования о пользе белковой пищи для нашего организма. Так, больше десяти лет назад ученые выяснили, что протеин способен утолять голод, помогая при этом регулировать массу тела. Другое исследование выяснило, что белковый рацион способствует ускоренному восстановлению организма после травмы.
И напоследок стоит напомнить, какие продукты считаются основными источниками белка. Если говорить о протеине в пище животного происхождения, то это говядина, свинина, баранина, рыба, птица, яйца, а растительного происхождения – бобовые, цельные злаки, орехи и семечки, что особенно актуально для вегетарианствующих.
Биохимия болезни Альцгеймера
Рубрика: Медицина и фармацевтика
Научный журнал «Студенческий форум» выпуск №8(29)
Биохимия болезни Альцгеймера
Болезнь Альцгеймера (болезнь альцгеймеровского типа) является наиболее распространенной формой первичных дегенеративных деменций позднего возраста.
Таблица 1.
Структура заболеваемости
Возраст, лет
Процент заболевших
К проявлениям данного заболевания относится:
• Больные не могут вспомнить нужное слово и заменяют его другим, не вполне подходящим по смыслу
• Больной не ориентируется на местности, не узнает знакомых, не может определить время по часам
• Больной путается во времени
• Больные теряют способность к самообслуживанию и нуждаются в уходе
Объяснение возможных причин развития Болезни Альцгеймера отражено в трёх гипотезах:
1. Холинергическая гипотеза
2. Амилоидная гипотеза
Первой мы рассмотрим холинергическую теорию.
Наблюдается корреляция между выраженностью деменции и центральным холинергическим дефицитом — холинергической деафферентацией коры.
Степень холинергического дефицита в корковых отделах связана с уменьшением количества нейронов в базальных отделах головного мозга, где располагаются нейроны, которые продуцируют ацетилхолин.
Помимо ацетилхолинергической системы, некоторые изменения наблюдаются со стороны других нейротрансмиттерных систем, например, сейчас интенсивно изучаются глутаматергические расстройства.
Поддержка этой гипотезы ослабла, так как лекарственные средства, направленные на корректировку дефицита ацетилхолина, имеют слабую эффективность.
Далее остановимся на амилоидной теории.
Более 20 лет основной гипотезой в области исследования болезни Альцгеймера оставалась амилоидная гипотеза.
Аβ образуется из белка АРР (англ. Amyloid precursor protein) путем воздействия двух ферментов β- и γ-секретаз.
Считается, что к избыточному накоплению амилоида приводят ошибки фолдинга. Фолдинг – это процесс самопроизвольного скручивания полипептидной цепи в уникальную нативную пространственную структуру.
Новое исследование, которые было проведено в Калифорнийском университете в Сан-Диего, показывает, что бета-амилоид разрушает один из белков-антиоксидантов и предлагает способ защиты этого белка от повреждающего воздействия амилоида.
Установлено, что бета-амилоид и антиоксидантный фермент каталаза взаимодействуют. Их взаимодействие повреждает каталазу так, что она не становится неспособна выполнять свою физиологическую функцию – разложение перекиси водорода на кислород и воду.
При покрытии амилоида низкомолекулярным соединением, которое предотвращает его взаимодействие с другими белками, активность каталазы восстановилась, и уровень перекиси водорода вернулся к нормальным показателям.
Покрытие, использованное для исследования взаимодействия между амилоидом и каталазой, является кандидатом на роль лекарственного препарата. Это один из классов молекул, разработанных в лаборатории профессора Янга.
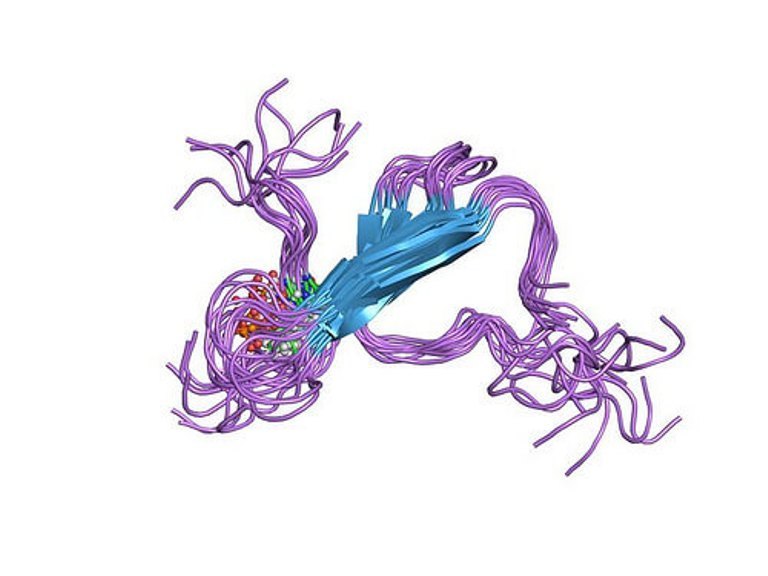
Тау-белок – это белок ассоциированный с микротрубочками, функиця которого состоит в стабилизации структур микротрубочек клетки. Синтез его происходит преимущественно в нейронах. При некоторых патологических процессах этот белок может вступать в процессы агрегации. При образовании таких агрегатов нарушается функция нейронов.
Рисунок 1. Структура тау-белка в здоровой и пораженном нейроне
В 17 хромосоме человека содержится ген тау-белка, который содержит 16 экзонов. Из этого следует, что альтернативный сплайсинг способствует образованию изоформ этого белка.
После синтеза молекула белка входит в посттрансляционный процессинг. Фосфорилирование (осуществляемое ферментом киназы гликогенсинтазы 3) в данном процессе благоприятствует взаимодействию тау-белка с тубулином и стабилизации микротрубочек.
Взаимодействия тау-белка и Аβ:
Результаты нового исследования, которые были опубликованы в журнале Neurobiology of Aging, предполагают вероятность того, что патологические формы двух белков, тау-белка и бета-амилоида, которые являются признаками патологии мозга при болезни Альцгеймера – бляшки и нейрофибриллярные клубки – могут действовать совместно, при этом повреждая митохондрии и, следовательно, снижая выживаемость нейронов.
Клетка с поврежденными митохондриями не может продуцировать необходимое количество энергии для поддержания своей жизнедеятельности, не способна поддержать нужный уровень кальция и, как следствие, вырабатывает повышенное количество повреждающих ее молекул-окислителей.
Самые сильные изменения в митохондриях наблюдались, когда бета-амилоид и процессированный тау находились в клетке вместе. В присутствии усеченного тау и бета-амилоида они слипались в частях нейронов и не могли попасть в синапсы, как это должно происходить без патологии.
На основании этих данных можно сделать следующие выводы:
1. Несмотря на огромную работу, проделанную учеными в данном направлении, механизм биохимических процессов болезни Альцгеймера по-прежнему неясен, однако наиболее вероятная теория связана со взаимодействием патологических форм тау-белка и Аβ.
2. Не установлена взаимосвязь между нейродегенеративными изменениями Аβ и гиперфосфорилированными тау-белком, если она имеется.
- http://www.kp.ru/guide/bolezn-al-tsgeimera.html
- http://chrdk.ru/news/belok-bolezni-altcgeimera-puteshestvuet-iz-tela-v-mozg
- http://econet.ru/articles/116699-tau-belok-i-bolezn-altsgeymera
- http://biomolecula.ru/articles/vozmozhno-b-amiloid-bolezni-altsgeimera-chast-vrozhdionnogo-immuniteta
- http://indicator.ru/news/2018/03/23/belok-av42-bolezn-alcgejmera/
- http://memini.ru/discussions/31134
- http://nauchforum.ru/journal/stud/29/34902