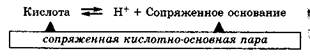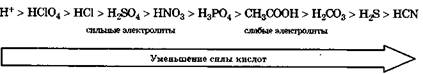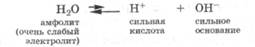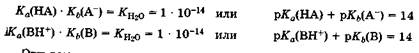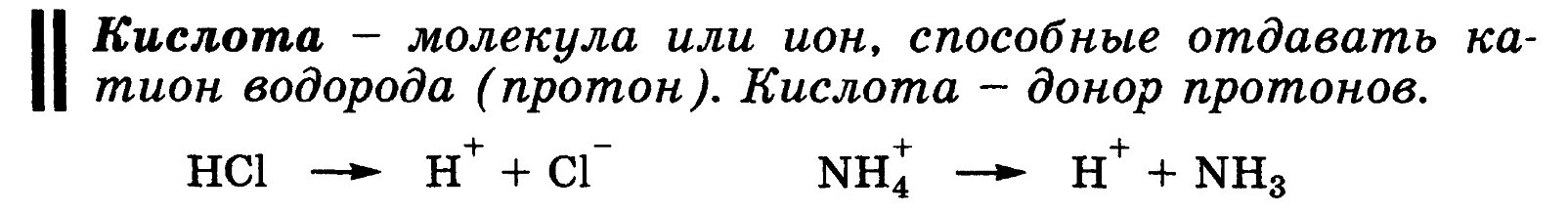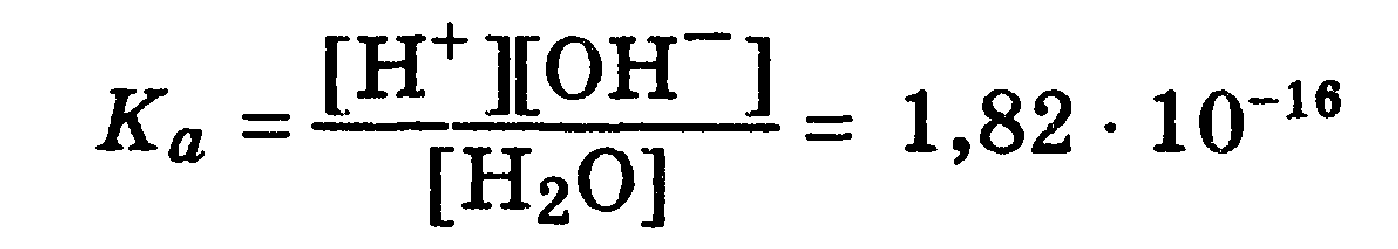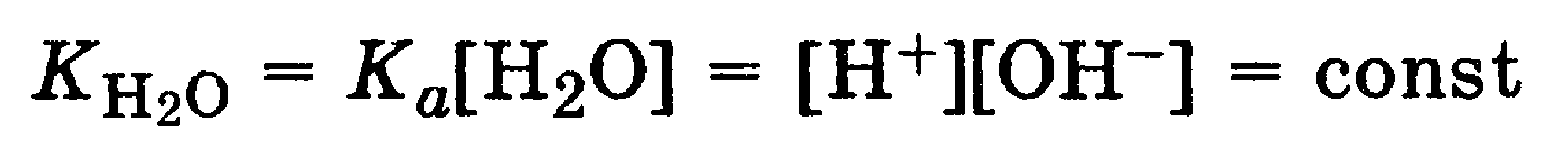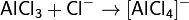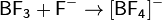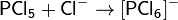Понятия «кислота» и «основание» применяют по отношению к двум группам соединений, обладающих совокупностью диаметрально противоположных свойств. В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот и оснований. Согласно этой теории понятиям кислота и основание отвечают следующие определения.
 |
Кислота — молекула или ион, способные отдавать катион водорода (протон). Кислота — донор протонов.
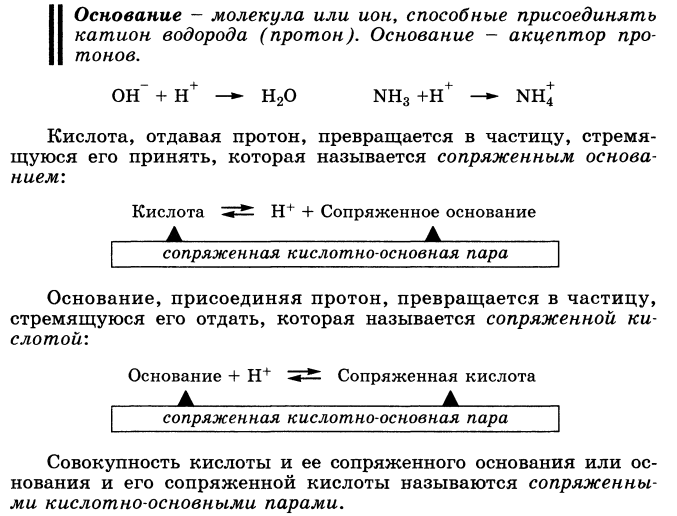
Основание — молекула или ион, способные присоединять катион водорода (протон). Основание — акцептор протонов.
Кислота, отдавая протон, превращается в частицу, стремящуюся его принять, которая называется сопряженным основанием:
Основание, присоединяя протон, превращается в частицу, стремящуюся его отдать, которая называется сопряженной кислотой:
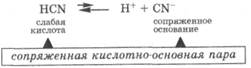
Совокупность кислоты и ее сопряженного основания или основания и его сопряженной кислоты называются сопряженными кислотно-основными парами.
Сила кислоты определяется ее способностью отдавать протон, т. е. сильная кислота — активный донор протона. Сила кислот в водных растворах уменьшается в ряду:
 |
Сила основания определяется его способностью присоединять протон, т. е. сильное основание — активный акцептор протона. Сила оснований в водных растворах, т. е. их сродство к протону, уменьшается в ряду:
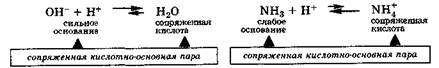
Сильные кислоты, легко отдавая протон, превращаются в сопряженные основания, которые плохо присоединяют протон. Поэтому диссоциация этих кислот протекает практически необратимо:
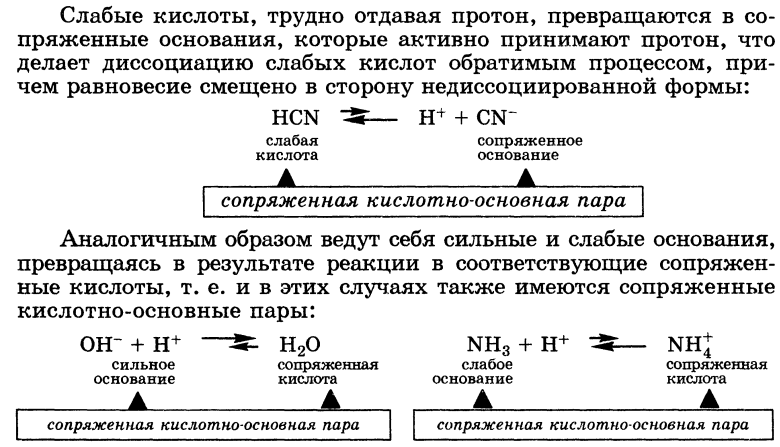
Слабые кислоты, трудно отдавая протон, превращаются в сопряженные основания, которые активно принимают протон, что делает диссоциацию слабых кислот обратимым процессом, причем равновесие смещено в сторону недиссоциированной формы:
Аналогичным образом ведут себя сильные и слабые основания, превращаясь в результате реакции в соответствующие сопряженные кислоты, т. е. и в этих случаях также имеются сопряженные кислотно-основные пары:
Некоторые вещества способны выступать в одних реакциях в роли донора протона, отдавая его соединениям, у которых сродство к протону выше, а в других — в роли акцептора протона, отнимая его у соединений с меньшим сродством к протону. Такие вещества называются амфолитами.
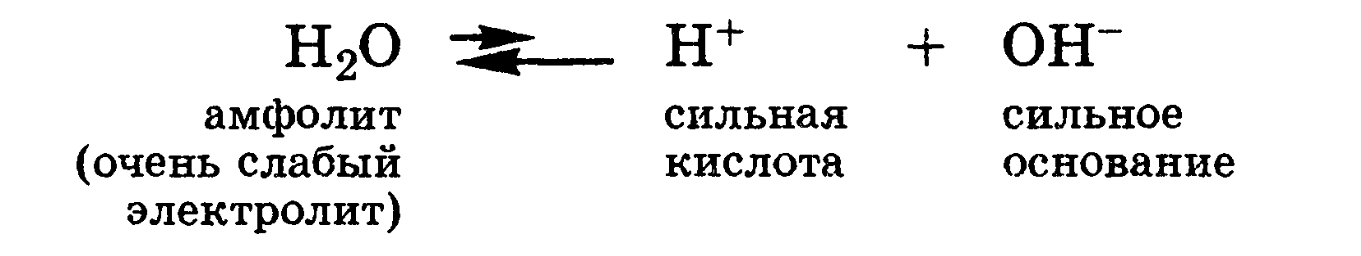
Амфолиты — молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать в реакции, характерные как для кислот, так и для оснований. Амфолит проявляет свойства кислоты или основания в зависимости от того, с какими веществами он взаимодействует. Типичным амфолитом является вода, так как в результате ее электролитической диссоциации образуются одновременно сильная кислота и сильное основание:
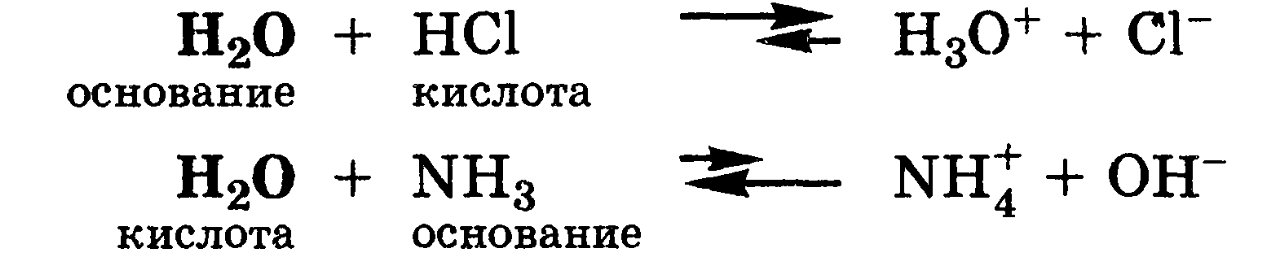
Кроме того, вода взаимодействует и с кислотами, выступая основанием, и с основаниями, проявляя свойства кислоты:
 |
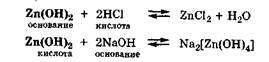 |
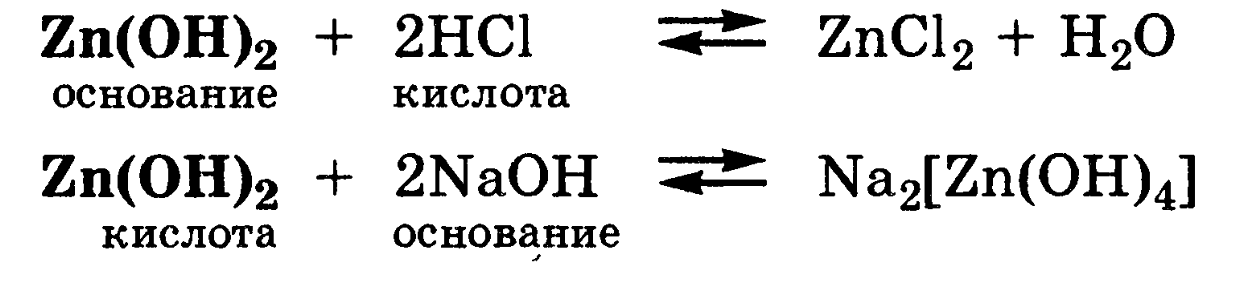
Амфолитами являются гидроксиды некоторых металлов (Zn, Al, Pb, Sn, Cr):
Амфолитами являются гидроанионы многоосновных кислот, например НС03-, НР042-и Н2РО4-.
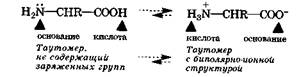
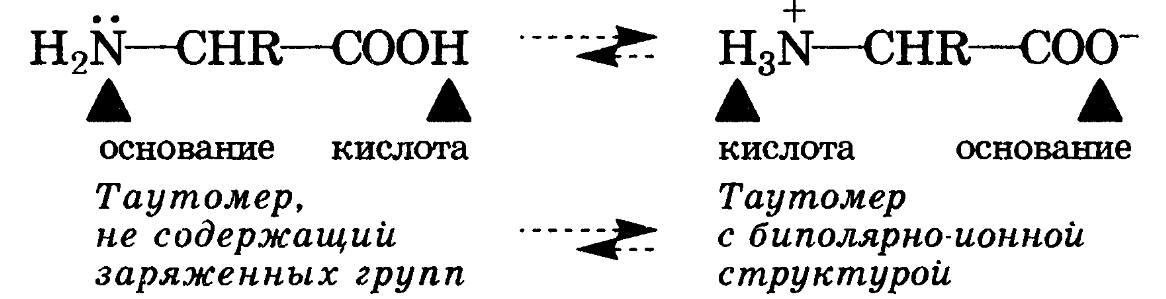
Амфолитами являются также соединения, молекулы которых содержат две различные кислотно-основные группы, например важные в биологическом отношении а-аминокислоты. Молекула а-аминокислоты в результате переноса протона от карбоксильной группы на аминогруппу превращается из таутомера*, не содержащего заряженные группы, в таутомер, имеющий биполярно-ионную (цвиттерионную) структуру. Таким образом, для а-аминокислот характерна прототропная таутомерия (разд. 21.2.1).
В кристаллическом состоянии и в водных растворах это равновесие для а-аминокислот практически полностью смещено в сторону таутомера с биполярной структурой. Так, для глицина в водном растворе содержание таутомера с биполярно-ионной структурой в 223 000 раз больше, чем другого таутомера.
Вследствие этой особенности строения молекулы а-аминокислот проявляют кислотные свойства за счет аммонийной группы ( NH3+), а основные — за счет ионизованной карбоксильной группы (—СОО- ), выступая амфолитами:
Как и все амфолиты, а-аминокислоты являются слабыми электролитами.
Согласно протолитической теории кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основанию называется протолизом и объясняется тем, что эти два вещества имеют разное сродство к протону. В кислотно-основном взаимодействии всегда участвуют две сопряженные кислотно-основные пары, и переход протона всегда происходит в сторону образования более слабых кислот, включая сопряженные. Если склонность к взаимодействию с протоном у реагентов соизмерима, то наблюдается протолитическое равновесие.
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон (Н + ) между основаниями взаимодействующих сопряженных кислотно-основных пар (НА, А- и ВН + , В). Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты:
Схематично протолитическое равновесие можно представить следующей схемой:
Переход протона всегда происходит от сильной кислоты каниону слабой кислоты, что сопровождается вытеснением слабой кислоты из ее соли под действием более сильной кислоты.
Протолитическое равновесие наблюдается при ионизации слабых электролитов в воде (разд. 7.2). Так, ионизация слабой кислоты в водных растворах является следствием конкуренции за протон между анионом слабой кислоты и водой, выступающей основанием, т. е. акцептором протона. Этот процесс является обратимым и характеризуется константой равновесия Ка:
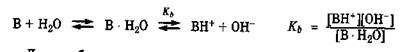 |
При взаимодействии слабого основания с водой последняя, выступая донором протона, способствует ионизации этого основания, носящей равновесный характер:
для слаоых электролитовсила кислот и оснований характеризуется величинами констант кислотности Каи основности Кbссоответственно (разд. 7.2). Если эти константы характеризуют протолитическое взаимодействие воды с кислотой или основанием одной сопряженной пары НА, А или ВН + , В, то произведение констант кислотности Ка и основности Kb, компонентов данной пары всегда равно ионному произведению воды Кн2о = 1 * 10 -14 (при 22 °С):
Эти выражения позволяют заменить в случае водных растворов константу основности Кь или показатель основности рКь слабого основания на константу кислотности Каили на показатель кислотности рКасопряженной кислоты этого основания. На практике для характеристики протолитических свойств соединения обычно используют величину рКа. Так, силу аммиака в воде как основания (pKb, = 4,76) можно охарактеризовать показателем кислотности иона аммония NH4+, т. е. сопряженной кислоты: рKа(NH4+) = 14 — 4,76 — 9,24. Поэтому в случае водных растворов нет необходимости в специальной таблице констант или показателя! основности, достаточно единой шкалы кислотности, представленной в табл. 8.1, где свойства оснований характеризуются констгантой Каили показателем кислотности рКаих сопряженных кислот. Самой сильной кислотой в водных растворах является ка-тион водорода Н + (точнее НзО + ), а самым сильным основанием -анион ОН-. Величина рКаколичественно характеризует силу слабьпх электролитов в водных растворах.
Слабая кислота тем слабее, чем больше значение ее рКа. Слабое основание тем слабее, чем меньше значение рКа его сопряженной кислоты.
Значение рКаравно значению рН водного раствора, в котоpoм данный слабый электролит ионизован на 50 %: поскольку в атом случае [А — ] = [НА], то Ка= [Н + ] и рКа= рН. Так, для уксусной кислоты в ее водном растворе с рН = рKа(СН3СООН) = = 4,76 имеет место равенство [СН3СОО-] = [СН3СООН], а для вод-Hoгo раствора аммиака равенство [NH4] = [NH3 ■ Н2О] будет наблюдаться в растворе с рН = рKа(NH4+) = 9,24.
Кроме того, значение рКапозволяет определить значение рН’ водных растворов, где данная слабая кислота НА находится преимущественно (99 % и более) в виде аниона (А») — это будет в растворах с рН > рКа + 2; или в виде молекул (НА) — в растворах с рН
studopedia.org — Студопедия.Орг — 2014-2019 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.003 с) .
Причина диссоциации электролитов — их взаимодействие с водой. Вода образует при диссоциации катион водорода и анион гидроксила. Катион водорода — протон — имеет малый радиус
(»10 -15 м) и в воде гидратирован — его обычное координационное число равно четырем. Формула гидрата протона — Н9О4 + , но для простоты ее записывают как Н3О + . В растворах протоны переходят от одних соединений к другим.
HNO2 + H2O H3O + + NO2 —
кислота 1 основание 2 кислота 2 основание 1
Протолиз — процесс передачи протона.
Протолиты— кислоты и основания, отдающие и принимающие протоны.
Протолитическое равновесие — кислотно-основное равновесие — ионно-молекулярное равновесие, устанавливающееся после передачи протона. К протолитическим процессам относятся процессы диссоциации, ионные реакции в растворах, реакции гидролиза.
Кислота — молекула или ион, способная отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
H2CO3 + H2O H3O + + HCO3 — Kк = 4´10 -7 .
NH4 + + 2H2O NH3´H2O + H3O + Kк = 6´10 -10 .
[Al(H2O)6] 3+ + H2O[Al(H2O)5OH] 2+ + H3O + Kк = 9´10 -6 .
Основание— молекула или ион, способная принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания Ко.
NH3´H2O (H2O)NH4 + + OH — Ко = 1,8´10 -5 .
C5H5N + H2OC5H5NH + + OH — Ко = 1,8´10 -5 .
Амфолиты — протолиты, способные к отдаче и к присоединению протона.
HCO3 — + H2O H3O + + CO3 2- HCO3 — — кислота
HCO3 — + H2O H2CO3 + OH — HCO3 — — основание
Для воды имеем: H2O+ H2OH3O + + OH —
Константы Kк и Ко для сопряженных кислот и оснований связаны между собой.
HA + H2O H3O + + A — Kк =
A — + H2O HA + OH — Ко =
Отсюда Kк´Ко = ´= [H3O + ]´[OH — ] = К(Н2О)
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 9116 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Протолитическая теория кислот и оснований
(Теория Бренстеда и Лоури)
По протолитической, или протонной теории кислота – это соединение, частица которого может отдать протон (Н + ) другой частице – основанию. Согласно этой теории кислоты и основания — это вещества, теряющие и приобретающие протоны и называемые протолитами. Передача протона от кислоты к основанию называется протолизом. Кислота–донор протонов,а основание–акцептор Н + .
В результате отдачи протона сама кислота превращается в сопряженное ей основание. Основание – акцептор Н + — превращается в сопряженную ему кислоту.
В следующей реакции протолитического равновесия:
НА + В ⇄А — + НВ + (14)
НА – кислота, А — — сопряженное ей основание; В – основание, НВ + — сопряженная ему кислота.
Таким образом, в равновесной протолитической реакции присутствуют две сопряженные пары «кислота / основание»: НА /А — и НВ + / В.
Кислоты и основания, или протолиты, могут быть нейтральными (молекулы), катионными или анионными:
Анионные Молекулярные Катионные
протолиты протолиты протолиты
Протонодонорная способность вещества — это его кислотность; протоноакцепторная способность — это основность. Эти свойства определяются сродством к протону, т.е. величиной энтальпии реакции присоединения протона.
При кислотно-основном взаимодействии роль основания играет тот партнер, у которого протонное сродство выше.
Из термохимических уравнений:
NH3(г) + H + (г)
H2O(г) + H + (г)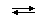
OH — (г) + H + (г)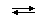
F — (г) + H + (г)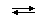
1) NH3 — более сильный акцептор протона и более сильное основание, чем H2O, а NH4 + , наоборот, более слабый донор протона и более слабая кислота, чем H3O + ;
2) OH — — более сильное основание, чем F — , а H2O — более слабая кислота, чем HF.
Количественной характеристикой состояния протолитического равновесия обратимой реакции между кислотой HA и основанием (растворителем) HL
HA(s) + HL 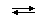
является величина Kк— константа кислотности:
Чем больше значение Kк, тем более сильной кислотой является протолит HA в данном растворителе HL.
Количественной характеристикой состояния протолитического равновесия в реакции между основанием B и кислотой (растворителем) HL
В + HL 
является величина Kо — константа оснόвности:
Kо = [HB + ] . [L — ] / [B] = Const = f(T). (16)
Чем больше значение Kо, тем более сильным основанием является протолит B в данном растворителе HL.
Пример 2.1.
где HCl — кислота, а Н2О – основание.
Протолитическая теория кислот и оснований. Понятие кислоты и основания. Амфолиты.
Протолитическая теория — кислотные или основные свойства частиц обусловлены их спосоностью отдавать или присоединять протон водорода (1923 г. — Йоханес Брёнстед, Томас Лаури).
Первой теоретической концепцией кислот и оснований была теория Аррениуса, в основе которой лежит электролитическая диссоциация веществ в растворах. Согласно Аррениусу, кислоты — это вещества, образующие при диссоциации в водном растворе ионы Н + , а основания — ионы ОН — . Достоинства теории: простые математические соотношения для расчета рН водных растворов. Недостатки: 1) нельзя представить существование катиона Н + в растворе, как этого требует теория; 2) не учитывается влияние растворителя (несмотря на многочисленные экспериментальные подтверждения участия растворителя в реакциях кислот и оснований); 3) все расчеты оказываются неверными при переходе к неводным растворителям.
Теория Льюиса. По Льюису кислоты — вещества, принимающие пару электронов, основания — вещества, отдающие ее. При этом образуются ковалентные связи. В класс кислот попадают молекулы, образованные атомами с незаполненной восьмиэлектронной оболочкой (BF3, SO3), катионы-комплексообразователи (Fe 3+ , Со 2+ и т. п.), галогениды с ненасыщенными связями (TiCl4 ), молекулы с поляризованными двойными связями (СО2, SO2). В класс оснований — молекулы — содержащие свободные электронные пары (NH3, Н2О), анионы, органические соединения с двойными и тройными связями, ароматические соединения. Этот подход широко используется в органической химии («кислоты и основания Льюиса»). Однако с точки зрения аналитической химии теория оказалась слишком общей.
Теория Льюиса не имеет количественного критерия оценки силы кислот и оснований, который мог бы служить основой для аналитических расчетов кислотно-основных равновесий (например, для оценки рН).
Развитием теории Льюиса стала концепция жестких и мягких кислот Пирсона, по которой при взаимодействии кислоты-акцептора пары электронов с основанием-донором пары электронов не обязательно получается ковалентная связь, и могут возникать ионная и координационная связи. В круг кислотно-основных реакций включается таким образом комплексообразованне.
По Брёнстеду, кислота — донор протона, а основание — акцептор его. По Льюису, кислота — вещество, которое может использовать неподеленную электронную пару электронов атома другие молекулы для образования устойчивой электронной группировки одного из своих атомов, основание — вещество, обладающее неподеленной парой электронов, которая может быть использована для образования устойчивой электронной группировки др. атома.
Наиболее общей теорией кислот и оснований является теория Усановича, по которой кислотами считают вещества, отдающие катионы или принимающие анионы (или электроны), основаниями — вещества, отдающие анионы (или электроды) и принимающие катионы. Как видно, кислоты и основания Усановича включают кислоты и основания Льюиса, окислители и восстановители.
Раствор амфолита.Это растворы так называемых «кислых солей» (NaHCO3, NaH2PO4 и т. п.), солей катионокислот (NH4COOH, ZnOH (Н2O)3, аминокислот (молекулы их содержат кислотную иосновную группы, например, аминоуксусная кислота NH2CH2COOH ). В таких растворах сосуществуют частицы ипринимающие, и отдающие протоны. Обозначив амфолит НА — (хотя амфолиты могут быть как заряженными, так и незаряженными), напишем равновесия в растворе
14. Кислотно-основное равновесие. Типы протолитических реакций.
Согласно ионной теории кислоты – соединения, которые при электролитической диссоциации в водном растворе образуют ионы водорода Н+:
НАn Н + + Аn −
Основания – соединения, которые при электролитической диссоциации в водном растворе образуют ионы гидроксила ОН − :
KtОН Kt + + ОН −
Рассматривая кислотно-основные равновесия в водных растворах в дальнейшем, будем считать их приближающимися к идеальным растворам, т.е. активностью ионов пренебрегаем (а → С).
Тогда в соответствии с законом действующих масс:
Типы протолитической реакции:
1) Реакция нейтрализации. Кислота и щелочь в растворе обмениваются ионами и нейтрализуют друг друга.
NaOH + HCl → NaCl + H2O
2) Реакция гидролиза.
15. Кислотные и основные свойства растворителей. Влияние природы растворителя на силу кислот и оснований. Константа кислотности и основности. Нивелирующее и дифференцирующее действие растворителей.
С точки зрения кислотно-основных свойств растворители можно разделить на три группы:
1. Апротонные растворители, не обладающие ни кислотными, ни основными свойствами — например, углеводороды и их галогенопроизводные: бензол, гексан, хлороформ.
2. Протофильные растворители, обладающие только основными свойствами: кетоны (ацетон), простые эфиры (диоксан, диэтиловый эфир), третичные амины (пиридин).
3. Амфипротные растворители, обладающие как кислотными, так и основными свойствами: вода, спирты, карбоновые кислоты, первичные и вторичные амины.
Диссоциация слабых кислот. CH3COOH ↔ CH3COO-+ H+
Ka — константа равновесия, называемая константой кислотности
Диссоциация слабых оснований. NH4OH ↔ NH4++ OH-
Kb-константа равновесия, называемая константой основности
Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах.
Важная роль растворителя в кислотно-основных реакциях ярко проявляется в нивелирующем и дифференцирующем эффектах.
В области высоких (Ка > 1) и очень низких (Ка 14 ) значений констант кислотности величина рН практически не зависит от рКа(константа ионизации). Аналогичные явления наблюдаются и для водных растворов оснований, а также для растворов кислот и оснований в любом другом амфипротном растворителе. Подобная независимость кислотно-основных свойств от констант кислотности (основности) называется нивелирующий эффектом растворителя.
При переходе от более к менее основному растворителю происходит обратное явление: сильные кислоты могут стать слабыми. Например, в воде НС1 и НСlO4 — сильные кислоты. В ледяной уксусной кислоте они становятся слабыми и, следовательно, различающимися по своим кислотно-основным свойствам. Этот эффект называется дифференцирующим эффектом растворителя. Дифференцирующий эффект проявляется и для оснований — при переходе от более к менее кислотному растворителю (например, от воды — к пиридину).
Как видно, в кислотно-основных равновесиях растворитель играет не меньшую роль, чем природа кислот и оснований. С точки зрения равновесия из многочисленных свойств растворителей имеет значение донорно-акцепторное сродство к протону и диэлектрическая проницаемость.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Амфолит с точки зрения протолитической теории
В настоящее время трактовка кислотно-основных свойств соединений производится с позиций трёх основных теорий: теория Аррениуса, Бренстеда-Лоури, Льюиса.
Согласно теории Аррениуса:
- Кислоты — это электролиты при диссоциации которых в качестве катионов образуются только H+
- Гидроксиды — это электролиты при диссоциации которых в качестве аниона образуются только ионы OH-.
Теория кислот и оснований Аррениуса не имеет всеобщего характера и не может объяснить как свойства веществ в неводных растворителях, так и свойства веществ, не подвергающихся диссоциации (NH3, CaO, CO2).
Более общий характер имеет созданная в 1923 году протолитическая теория кислот и оснований Бренстеда-Лоури (теория сопряжённых пар). Согласно этой теории:
- Кислоты — это молекулы или ионы, способные отдавать протон, то есть доноры протонов.
- Основания — это молекулы или ионы, способные присоединять протон, то есть акцепторы протонов.
Согласно протолитической теории, кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основания называется протолизом.
Подобный подход позволяет оценивать кислотно-основные свойства ионов. Например, карбонат-ион может присоединить протон и, следовательно, является основанием, а гидрокарбонат-ион может отдать протон, и значит, является кислотой: (CO3-)основание + (H+) ⇆ (HCO3-)кислота
Кислоты Бренстеда-Лоури делят на 3 типа:
- Нейтральные кислоты: HCl, H3PO4, HNO3, HClO
- Катионные кислоты: NH4+, H3O+
- Анионные кислоты: H2PO4-, HCO3-, HSO4-
На такие же три группы делятся основания:
- Нейтральные основания: NH3, H2O
- Анионные основания: OH-, F-
- Катионные основания: (NH2-NH3)+
Согласно протолитической теории, отдавая протон, кислота превращается в частицу, которая называется сопряжённым основанием. Соответственно, основание, присоединяя протон, превращается в сопряжённую кислоту.
Кислота и сопряжённое ей основание (или основание с сопряжённой кислотой) образуют сопряжённую кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряжённое с ней основание и наоборот.
Молекулы воды (H2O), аммиака (NH3 жидк.), анионы многоосновных кислот могут быть как донорами, так и акцепторами протонов, т.е. являются веществами-амфолитами.
Изоэлектрическая точка (ИЭТ): характеристика состояния р-ра амфотерного электролита (амфолита), способного присоединять или отщеплять протоны, превращаясь либо в положительно, либо в отрицательно заряженные ионы, при котором суммарный электрический заряд амфолита равен нулю. В ИЭТ амфолит не перемещается в электрическом поле. Соответствует рН раствора, при котором одинаковы концентрации положительно и отрицательно заряженных форм (для аминокислот) или числа ионизированных кислотных и основных групп (для макромолекул белков и др. полиамфолитов). Значение рН в ИЭТ (обозначают рI, или рНI) определяется величинами констант диссоциации кислотной и основной ф-ций: pI = 0,5(рК1+рK2).
Гидролизом солей называют взаимодействие солей и воды с образованием слабых электролитов. В итоге гидролиза обычно происходит изменение реакции среды. Гидролиз является обратимым процессом, протекает в крайне незначительной степени, поэтому в схемах реакций ставят знак обратимости. Принято выделять следующие типы гидролиза солей:
- Гидролиз по аниону (сильное основание и слабая кислота);
- Гидролиз по катиону (слабое основание и сильная кислота);
- Гидролиз по катиону и по аниону (слабое основание и слабая кислота);
- Не гидролизуются (сильное основание и сильная кислота).
Способность солей вступать в реакции гидролиза характеризуется степенью гидролиза. Степенью гидролиза hг называют отношение концентрации гидролизованной части соли Сг к её общей концентрации С0: hг = Сг/С0.
Факторы, влияющие на степень гидролиза:
- Температура;
- Концентрация продуктов гидролиза;
- Концентрация соли;
- Разбавление;
- Добавки посторонних веществ.
Протолитическая теория кислот и оснований
При рассмотрении класса оснований обнаруживается недостаточность широко распространенного мнения, что этот класс составляют только гидроксиды металлов и гидроксид аммония. По гидроксид аммония — вещество несуществующее, и основанием следует считать сам аммиак, а также близкие к нему но свойствам амины. Сложнее обстоит дело с солями, которые составляют отдельный класс веществ, но и они могут проявлять свойства как оснований, так и кислот. Очевидно, что наблюдаемая кислотность и основность разных веществ не вмещается в рамки сложившейся в XIX в. классификации химических соединений. На протяжении первых трех десятилетий XX в. были выдвинуты новые теории кислот и оснований, не ограниченные традиционными классами веществ. Выше была затронута электронная теория кислот и оснований. Но она кажется несколько отвлеченной, потому что в вопросе о кислотах и основаниях трудно не учитывать особую роль ионов водорода. Это привело к появлению протолитической теории, авторами которой стали ученые, работавшие независимо друг от друга, Т. М. Лоури (1928, Англия) и Й. Н. Брёнстед (1929, Дания).
В протолитической теории рассматриваются кислоты и основания в протонных растворителях. Это такие растворители, которые сами могут как отдавать, так и связывать протон. Важнейшим растворителем такого типа является вода. Из других веществ можно назвать спирты, аммиак, некоторые органические кислоты. Кислоты и основания определяются по роли частиц в передаче протона.
Кислота — это частица, реагирующая как донор протона.
Кроме обычных молекулярных кислот, это понятие охватывает любые ионы, способные отдавать протон. Одним из простейших ионов такого типа является аммоний NHJ. Аммоний входит в состав солей, и поэтому соли аммония и некоторые другие соли могут рассматриваться в качестве кислот.
Основание — это частица, реагирующая как акцептор протона.
Очевидно, что гидроксиды металлов являются основаниями потому, что имеющийся в них гидроксид-ион связывает протон, превращаясь в молекулу воды. Но данное определение значительно шире, так как в солях все анионы слабых кислот могут связывать протоны, превращаясь в молекулы кислот. Следовательно, основаниями являются не только гидроксиды металлов, но и соли. Известно также много молекулярных веществ, главным образом органических, способных присоединять протон.
Протонирование — присоединение протона к молекуле или иону.
Депротонирование — потеря протона молекулой или ионом.
Кроме кислот и оснований, в протолитической теории рассматриваются амфолиты, т.е. такие частицы, которые могут реагировать как отдавая протон, так и связывая его (табл. 14.3). Амфолитами являются некоторые гидроксиды металлов, кислые и основные соли, аминокислоты, белки. Например, легко представить себе, что анион НС03 в гидрокарбонате натрия, связывая протон, превращается в угольную кислоту, а отдавая протон — в карбонат-ион:
У разных амфолитов могут преобладать как кислотные, так и основные свойства. Выше было отмечено, что гидрокарбонат натрия создает в растворе слабую щелочную среду. У этого вещества преобладают основные свойства.
Разновидности кислот, оснований и амфолитов согласно протолитической теории
25 Основные положения теории кислот и оснований Бренстеда- Лоури: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара. Амфолиты.
Сила кислоты определяется ее способностью отдавать протон, т.е сильная кислота — активный донор протона. Сила основания определяется его способностью принимать протон, т.е сильное основание — активный акцептор протона.
Для удобства оценки характера водной среды используют водородный показатель pH. Это количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода. pH=-lg[H+] Иногда используют гидроксильный показатель pOH. В нейтральной среде водородный показатель =7, в кислой он меньше 7 а в щелочной – больше. Для определения кислотности среды используют индикаторный или ионометрический метод.
Некоторые вещества в одних реакциях способны вступать в роли донора протона, а в других — в роли акцептора протона. Такие вещества называют амфолитами.
Типичным амфолитом является вода:
Вода взаимодействует и с кислотами, выступая в роли основания, и с основаниями, выступая в роли кислот:
Амфолитами являются также гидроксиды некоторых металлов и гидроанионы некоторых многоосновных кислот:
Амфолитами также являются соединения, молекулы которых две различные кислотно-основные группы:
26. Ионное произведение воды. Водородный показатель среды растворов. Математическое выражение рН, его значение в кислой, щелочной, нейтральной средах. Биологическая роль водородного показателя.
В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. Вода является очень слабым электролитом. Ее диссоциация выглядит так: 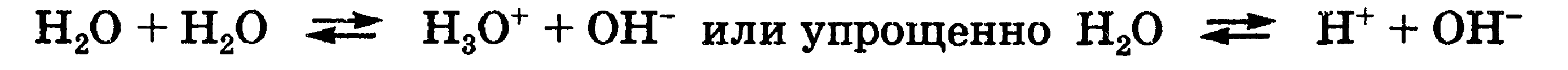
Отсюда:

27.Основные положения теории кислот и оснований Льюиса. Понятие о жестких и мягких кислотах и основаниях (теория жмко).
Кислота Льюиса – любое хим.соединение , молекула ,ион , являющийся акцептором электронной пары и таким образом способное принимать пару электронов соединения донора (основания Льюиса ) на незаполненную орбиталь с образованием соединения аддукта .
Основание Льюиса – основанием считается любая частица (атом , молекула или анион ) способная отдавать электронную пару для образования ковалентной связи . Т.е по Льюису кислота является акцептором пары электронов , а основание -донором .
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания.
Кислота Льюиса— молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны приниматьэлектронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag + , Fe 3+ ), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода,спирты, галогены.
Примеры химических реакций между кислотами и основаниями Льюиса:
Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Молекулярная орбиталь, на которую переходит электронная пара, у жёстких кислот имеет низкую энергию. Соответственно, жёсткие основания — это доноры с аналогичными свойствами (с большим отрицательным зарядом, большой электроотрицательностью и низкой поляризуемостью). Их орбиталь, с которой отдаётся электронная пара, также имеет низкую энергию.
Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания — это основания Льюиса с теми же свойствами. Как у мягких кислот, так и у мягких оснований энергия орбиталей, участвующих в реакции высока. Поскольку такие свойства как заряд, электроотрицательность и поляризуемость изменяются плавно, существует ряд кислот и оснований Льюиса, которые занимают промежуточное положение между жёсткими и мягкими.
Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера.
28. Ионизация слабых кислот и оснований. Константа кислотности и основности. Связь между константой кислотности и константой основности в сопряженной протолитической паре. Амфолиты. Изоэлектрическая точка.
Амфолит с точки зрения протолитической теории
Теории кислот и оснований — совокупность фундаментальных физико химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований двух классов веществ, реагирующих между собой. Задача теории предсказание продуктов… … Википедия
Амфотерность — (от др. греч. (ἀμφότεροι «двойственный», «обоюдный») способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства. Понятие амфотерность как характеристика двойственного поведения вещества… … Википедия
Расстановка ударений: АМФОЛИ`ТЫ
АМФОЛТЫ (греч. amphoteros — и тот и другой и lytos — растворимый), или амфотерные электролиты, — вещества, молекулы к-рых содержат кислотные и основные группы; в зависимости от условий проявляют кислотные или основные свойства. К А. относятся такие биологически важные вещества, как аминокислоты (см.), пептиды (см.), белки (см.), нуклеопротеиды (см.) и др.
Согласно протолитической теории кислот и оснований (см. Электролиты) кислотные свойства этих веществ обусловлены содержанием в их молекулах кислотных групп, напр. — СООН, — NH + 3, являющихся донорами протонов, а основные свойства — содержанием основных групп, напр. — СОО — , — NH2, являющихся акцепторами протонов.
В водных растворах А. могут находиться в различных формах: в виде не диссоциированных молекул, положительно заряженных ионов (катионов), отрицательно заряженных ионов (анионов) и биполярных ионов (называемых также цвиттерионами, амфотерными ионами или амфиионами). Все эти формы находятся в динамическом равновесии друг с другом. Так, напр., в растворе аминокислота глицин находится в форме катионов + H3NCH2COOH, анионов H2NCH2COO — , молекул H2NCH2COOH или биполярных ионов + H3NCH2GOO — .
Исследование ряда свойств растворов А. (диэлектрической проницаемости, спектров комбинационного рассеяния и др.) показало, что в водных растворах аминокислот, пептидов и белков электронейтральными частицами преимущественно являются не сами молекулы, а биполярные ионы. Так как в состав последних входят кислотные и основные группы, то они проявляют амфотерные свойства, т. е. диссоциируют в растворах и как кислоты:
[ + H3NCH2COO — — H2NCH2COO — +H + ](1),
и как основания:
[ + H3NCH2COO — +H2О H3NCH2COOH+OH — ](2).
Константы диссоциации, соответствующие равновесиям (1) и (2), называют амфиионными (амфотерноионными) константами диссоциации и обозначают через Ка и Кb соответственно. В кислой среде А. в растворе находятся в виде катионов.
+ H3NCH2COO — +H + + H3NCH2COOH (при электрофорезе перемещаются к катоду), в сильно щелочной среде — в виде анионов:
+ H3NCH2COO — +OH — HOH3NCH2COO — (при электрофорезе перемещаются к аноду). Значение рН среды, в к-рой А. находится в форме биполярных ионов или недиссоциированных молекул, т, е. электронейтральных частиц, не перемещающихся в электрическом поле, называют изоэлектрической точкой А. и обозначают символом pi (см. Изоэлектрическая точка).
Для А. с преобладающими кислотными свойствами изоэлектрическая точка меньше 7, а для А., у к-рых более выражены основные свойства, — больше 7.
См. также Активная реакция среды, Водородный показатель, Кислоты и основания.
Библиогр.: Ашмарин И. П. и др Химия белка, ч. 1, с. 153, Л., 1968, библиогр.; Белки, под ред. Г. Нейрата и К. Бейли. пер. с англ., т. 2, с. 431, М., 1956, библиогр.; Гауровиц Ф. Химия и функции белков, пер. с англ., с. 109, М 1965 библиогр.
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
- http://studopedia.ru/2_49839_protoliticheskaya-teoriya-kislot-i-osnovaniya.html
- http://helpiks.org/7-18361.html
- http://cyberpedia.su/9x81a5.html
- http://vk.com/page-101519962_51256249
- http://studme.org/274787/matematika_himiya_fizik/protoliticheskaya_teoriya_kislot_osnovaniy
- http://studfiles.net/preview/5874028/page:8/
- http://dic.academic.ru/dic.nsf/ruwiki/1606807
- http://www.sohmet.ru/medicina/item/f00/s00/e0000458/index.shtml